紫杉醇腹腔热灌注治疗晚期卵巢癌临床观察
2017-12-23孙亚楠陈素琴
李 楠,孙亚楠,杨 亮,陈素琴
(1.河北医科大学第二医院妇科,河北 石家庄 050000;2. 中国人民解放军白求恩国际和平医院妇产科,河北 石家庄 050082;3.河北医科大学第二医院神经外科,河北 石家庄 050000)
·论著·
紫杉醇腹腔热灌注治疗晚期卵巢癌临床观察
李 楠1,孙亚楠2,杨 亮3,陈素琴1
(1.河北医科大学第二医院妇科,河北 石家庄 050000;2. 中国人民解放军白求恩国际和平医院妇产科,河北 石家庄 050082;3.河北医科大学第二医院神经外科,河北 石家庄 050000)
目的探讨肿瘤细胞减灭术(cytoreductive surgery,CRS)后紫杉醇腹腔热灌注治疗晚期卵巢癌的临床效果。方法选取晚期卵巢癌患者46例,随机分观察组和对照组各23例,观察组CRS后给予紫杉醇腹腔热灌注治疗+奥沙利铂、多西他赛静脉化疗,对照组CRS后给予奥沙利铂、多西他赛静脉化疗。比较2组治疗过程中出现的并发症与不良反应、疗效、肿瘤控制、腹腔积液控制、生活质量、无进展生存期(progression-free survival,PFS)等指标。结果2组肿瘤控制情况和有效率差异无统计学意义(P>0.05);观察组腹腔积液控制情况和KPS评分情况优于对照组,无进展生存期长于对照组(P<0.05);2组不良反应发生率差异无统计学家意义(P>0.05)。结论晚期卵巢癌患者CRS术后实施紫杉醇腹腔热灌注治疗,可提高患者的腹腔积液控制、KPS评分、PFS,且不明显增加并发症与不良反应发生率。
卵巢肿瘤;化学疗法,肿瘤,局部灌注;紫杉醇
10.3969/j.issn.1007-3205.2017.12.012
女性生殖系统存在三大恶性肿瘤,卵巢癌位于其中,其发病隐匿,且尚未研究出早期有效的筛查手段。在妇科恶性肿瘤疾患中,卵巢癌的临床病死率居于首位[1]。大部分卵巢癌患者初次诊断时已发展至晚期,且多累及腹膜,常合并腹腔积液或梗阻症状[2]。虽然近些年,对于晚期卵巢癌,已经开始并广泛应用一种较为有效的标准治疗方案,即肿瘤细胞减灭术(cytoreductive surgery,CRS)术后联合铂类+紫杉醇类药物的静脉化疗,卵巢癌的存活率已经有所提高,但大多数患者会复发,且多以腹膜转移方式复发,其预后仍然很差[3]。现今,在肿瘤治疗方面,除了已有的化疗、放疗、手术以及生物疗法这四类疗法外,出现了第五类疗法,即热灌注疗法,目前被广泛用于恶性肿瘤腹膜种植转移及恶性腹腔积液的预防和治疗中[4],此疗法在卵巢癌治疗方面的有效性受到普通关注。本研究通过前瞻性队列分析,观察晚期卵巢癌CRS后实施紫杉醇腹腔热灌注疗法的有效性以及安全性。现报告如下。
1 资 料 与 方 法
1.1一般资料 选取2011年1月—2015年3月河北医科大学第二医院妇科收治的晚期卵巢癌患者46例。纳入标准:①年龄≤75岁;②均接受了CRS,经术后病理学证实为FIGOⅢ期或Ⅳ期卵巢癌;③卡氏功能状态(Karnofsky performance status,KPS)评分≥70分,预计生存期≥6个月;④血常规、肝肾功能与心肺功能未发现明显异常;⑤不存在其他化疗禁忌证。将46例患者随机分为观察组和对照组各23例。观察组年龄39~72岁,平均(55.13±10.56)岁;浆液性腺癌16例,黏液性腺癌4例,混合性癌2例,子宫内膜样腺癌1例。对照组年龄38~73岁,平均(53.26±9.49)岁;浆液性腺癌19例,黏液性腺癌2例,混合性癌1例,透明细胞癌1例。2组一般情况差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准,所有患者或授权家属均签署知情同意书。
1.2方法 观察组CRS后实施紫杉醇腹腔热灌注结合奥沙利铂、多西他赛方案静脉化疗;对照组CRS后实施奥沙利铂、多西他赛静脉化疗。
1.2.1腹腔热灌注疗法 观察组术中快速冰冻病理证实为卵巢癌,待CRS后即将关腹时,将4根硅胶管留置于腹腔并固定,供热灌注治疗所需。热灌注治疗时间为术后第1、3、5天,应用的热灌注治疗仪型号为BR-TRG-Ⅱ。操作步骤:治疗前,检测患者血尿常规、肝肾功能以及心电图等,密切注意体温状况,治疗前30 min肌内注射25 mg异丙嗪、50 mg哌替啶、20 mg苯海拉明以及10 mg地塞米松防过敏处理。对治疗时仪器进行调整,温度43 ℃,时间1 h,准备2.5~4.0 L生理盐水(具体用量基于患者体质量、身高等指标加以明确),待一切准备充分,将温度升高到40 ℃,连通管路,通过调整管路,使其确保通畅,接着治疗开始,经由管路将紫杉醇注入腹腔(用量为135 mg/m2,在3个时间段即术后第1、3、5天分3次给予),在治疗进行时,检测患者心电指标,对血压、心率状况进行观察。热灌注治疗结束后酌情适时拔除腹腔硅胶管。
1.2.2静脉化疗 术后经石蜡病理分析,证实患者均为晚期卵巢癌,术后2组均采用奥沙利铂、多西他赛化疗方案规范静脉治疗(奥沙利铂130 mg/m2、多西他赛75 mg/m2),用药前对患者实施抗过敏预处理,整个疗程8个周期。
1.3观察指标 比较2组治疗过程中出现的并发症与不良反应、疗效、肿瘤控制、腹腔积液控制、生活质量、PFS等指标。将实体瘤治疗评价划分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)、进展(progressive disease,PD)。肿瘤控制标准:CR,肿瘤彻底消退,且至少保持4周;PR,病灶缩小≥50%,且保持4周;SD,病灶缩小<50%,或者病灶增大<25%,未见新病灶;PD,病灶增大≥25%,或者有新病灶出现。有效率为完全缓解和部分缓解之和。腹腔积液控制标准:CR,腹腔积液消失,症状缓解且维持4周;PR:腹腔积液减少<50%,且持续4周;SD,腹腔积液减少≥50%,或者增多<25%,持续4周;PD,腹腔积液增多≥25%,症状加重。无进展生存期(progression-free survival,PFS)为从治疗开始到疾病进展或死亡的时间。
1.4统计学方法 应用SPSS 19.0统计学软件分析数据。计量资料比较采用独立样本的t检验;计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.12组临床疗效比较 2组肿瘤控制情况和有效率差异均无统计学意义(P>0.05);观察组腹腔积液控制情况和KPS评分优于对照组,有效率高于对照组,差异有统计学意义(P<0.05)。见表1~3。
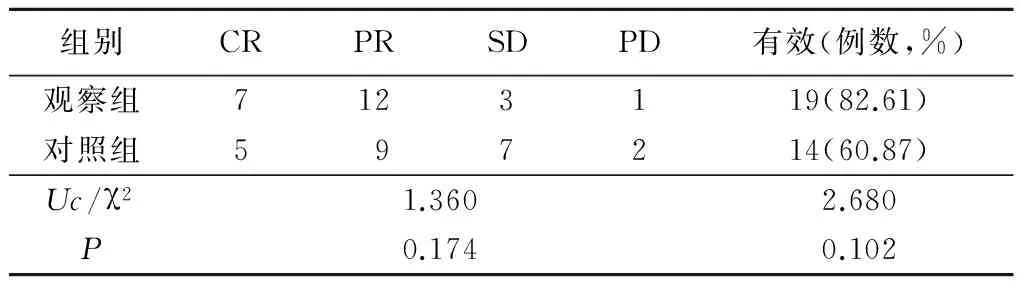
表1 2组肿瘤控制情况比较 Table 1 Comparison of the tumor control in the two groups (n=23,例数)
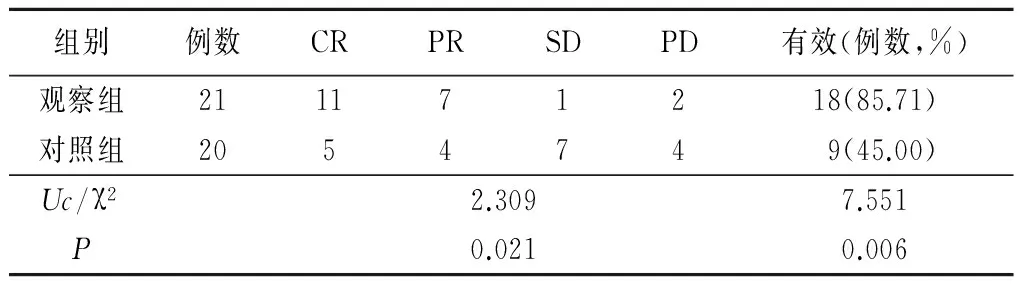
表2 2组腹腔积液控制情况比较Table 2 Comparison of the peritoneal effusionin the two groups (例数)

表3 2组KPS评分比较Table 3 Comparison of the KPS scores in the two groups (n=23,例数,%)
2.2PFS 观察组PFS为(27.6±9.4)个月,对照组PFS为(20.7±6.4)个月,观察组PFS长于对照组,差异有统计学意义(t=2.909,P=0.006)。
2.3不良反应 观察组消化道瘘1例(4.35%)、骨髓抑制5例(21.74%)、肝功能损伤3例(13.04%),不良反应发生率为39.13%(9/23);对照组骨髓抑制6例(26.09%)、肝功能损伤4例(17.39%),不良反应发生率为43.48%(10/23),2组不良反应发生率差异无统计学家意义(χ2=0.089,P=0.765)。
3 讨 论
卵巢癌病死率为妇科恶性肿瘤之首。据统计美国2017年预计新发卵巢癌病例22 440例,预计死亡病例14 080例[1]。多数卵巢癌患者诊断时已为晚期,且同时合并腹膜受累或远处转移(FIGOⅢ~Ⅳ期),总的5年生存率不超过30%[3]。晚期卵巢癌标准治疗方案包括最大化减瘤即CRS及随后进行以铂类联合紫杉醇类药物为基础的静脉化疗,60%~80%患者将达到临床缓解,但晚期卵巢癌的长期生存率仍很低,中位生存期约为29个月,大多数患者出现复发且大部分发生在腹膜[5]。对于卵巢癌而言,其较为显著的生物学特征包括腹腔种植转移,即便满意的CRS术后依然有大量游离癌细胞或微小病灶存在于腹腔内,它们既不能被切除也不能通过静脉化疗有效治疗,多数患者最终腹腔复发。因此,如何提高卵巢癌的疗效仍是当前的重要研究课题。
由于卵巢癌多局限于腹膜腔,所以腹腔化疗有很强的理论基础。腹腔内给药可使残存微小病灶缺乏血管的肿瘤组织以及游离的恶性肿瘤细胞暴露于高浓度的细胞毒性药物中,同时血液-腹膜屏障限制了这些高剂量药物进入血浆从而降低全身毒性风险。腹腔化疗在治疗卵巢癌方面具有临床优势,可延长中位PFS和中位总生存时间,降低死亡风险,对于卵巢癌尤其存在腹膜转移癌的患者推荐应用顺铂以及紫杉醇腹腔联合静脉化疗作为其一线化疗方案。然而,在常温腹腔化疗方面,药物效能依然未能充分释放。
热灌注疗法的理论基础为:在温度耐受水平方面,正常组织与肿瘤组织存在区别。在温度处于40~43 ℃时,大部分癌细胞活性开始丧失,但就正常组织细胞而言,45.5~47 ℃是其致死临界温度。治疗原理为:基于在温度敏感性上机体正常细胞与肿瘤细胞之间存在区别,以及两类细胞在诸多生物特征(包括血流量、含水量等)方面的差异,根据肿瘤热疗原理,借助体外循环灌注热疗设备的加热功能,使治疗液温度升高至治疗温度,再经由动力循环泵导至体腔,同时在治疗进行中维持规定治疗温度[5]。
腹腔热灌注治疗具有多种优点。首先,热具有直接的细胞毒性作用,43 ℃可直接杀伤肿瘤细胞而不损伤正常细胞。同时还可以增强化疗药物的作用并促进其渗透到肿瘤组织内,热灌注时,化疗药物能够穿透直径<5 mm的肿瘤结节[6],若常温腹腔化疗,药物则只能够穿透直径<3 mm的肿瘤结节,因而热灌注可以对广泛种植的癌细胞进行热清扫。其次,考虑到癌细胞耐热性差,术后可应用热疗联合化疗方案热杀灭G0期癌细胞(对化疗不具敏感性)。此外,肿瘤切除后立即给予腹腔化疗也有助于减少术后常见的肿瘤细胞诱捕作用(即手术切除过程中肿瘤细胞播散种植导致肿瘤在切除部位和腹膜表面复发)。一些前瞻性的证据和大量的回顾性研究显示腹腔热灌注疗法在胃肠恶性肿瘤腹膜转移癌的治疗中具有显著的效果。CRS和腹腔热灌注治疗现今是腹膜假性黏液瘤和恶性腹膜间皮瘤的标准治疗方案[7-8],且被认为是限制结直肠癌腹膜转移瘤腹膜扩散的有效治疗方法[9],它还有利于限制胃癌腹膜扩散,是唯一有可能延长这些疾病患者生存的治疗方式,否则预后极差[10]。而卵巢癌也具有腹腔及腹膜种植转移的生物学特征。这些为腹腔热灌注在卵巢癌治疗中的应用进一步提供了支持。
腹腔热灌注常用药物有顺铂、紫杉醇、丝裂霉素、奥沙利铂、阿霉素和卡铂,其他药物如吉西他滨和伊立替康也可使用。国内外研究多以顺铂腹腔热灌注,但不良反应较多。作为一类抗细胞内微管新型药物,紫杉醇能够特异性结合于小管β位上,导致微管蛋白出现明显的聚合反应,同时能够对微管蛋白自身解聚功能进行明显抑制,由此在有丝分裂环节难以产生纺锤体组织结构,最终对肿瘤细胞繁殖与分裂等过程进行阻碍。对比顺铂,紫杉醇的腹膜吸收显著降低,通过体外实验已经明确紫杉醇抗肿瘤作用增加,同时全身毒性反应明显降低[11]。CRS术后行腹腔热灌注可增加腹腔内紫杉醇含量,使其高于峰值血浆浓度1 000倍以上,持续腹腔中作用,并作用于腹膜从而减少腹腔积液的生成。而有效控制恶性腹腔积液在晚期卵巢癌治疗中有着重要地位,能够缓解因腹腔积液短时间大量增多带给患者的巨大心理压力与生理痛苦,同时在一定程度上对抽排腹腔积液造成的大量蛋白流失、电解质紊乱、腹腔积液再次汇聚等现象加以抑制。本研究结果显示,2组肿瘤控制指标差异无统计学意义,出现此结果的原因可能与本研究的样本量小有关。观察组腹腔积液改善和KPS评分指标方面优于对照组,患者生活质量有所提升,且没有明显增加并发症与不良反应发生率。
不同研究中用于卵巢癌腹腔热灌注治疗的药物种类很多,治疗方案、腹腔热灌注方法和患者的选择亦有不同,汇总和比较非常困难。这些研究报告显示中位PFS为11.8~41.2个月,中位总生存期为30.0~77.8个月,5年生存率为15%~63%[12-13]。本研究结果显示,观察组中位PFS显著长于对照组。
总之,晚期卵巢癌患者CRS后腹腔热灌注治疗是一种全新的治疗模式,目前越来越多的证据支持使用该治疗方法,但灌注药物种类、温度、容量、时间点的选择等在国际上尚未达到共识,NCCN、FIGO、ESMO指南均有提及应用此法治疗卵巢癌但尚没有列入正式推荐,其远期疗效也仍需进一步观察。
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2017[J]. CA Cancer J Clin,2017,67(1):7-30.
[2] Mendivil AA,Rettenmaier MA,Abaid LN,et al. Consolidation hyperthermic intraperitoneal chemotherapy for the treatment of advanced stage ovarian carcinoma: a 3 year experience[J]. Cancer Chemother Pharmacol,2017,80(2):405-410.
[3] Coccolini F,Campanati L,Catena F,et al. Hyperthermic intraperitoneal chemotherapy with cisplatin and paclitaxel in advanced ovarian cancer: a multicenter prospective observational study[J]. J Gynecol Oncol,2015,26(1):54-61.
[4] 陈勇.卡铂联合5-氟尿嘧啶腹腔热灌注治疗恶性腹腔积液临床研究[J].河北医科大学学报,2013,34(3):270-272.
[5] Bakrin N,Classe JM,Pomel C,et al. Hyperthermic intraperitoneal chemotherapy(HIPEC) in ovarian cancer[J]. J Visc Surg,2014,151(5):347-353.
[6] Polom K,Roviello G,Generali D,et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for treatment of ovarian cancer[J]. Int J Hyperthermia,2016,32(3):298-310.
[7] Fallis SA,Moran BJ. Management of pseudomyxoma peritonei[J]. J BUON,2015,20(Suppl 1):S47-55.
[8] Cao S,Jin S,Cao J,et al. Advances in malignant peritoneal mesothelioma[J]. Int J Colorectal Dis,2015,30(1):1-10.
[9] Hall B,Padussis J,Foster JM. Cytoreduction and Hyperthermic Intraperitoneal Chemotherapy in the Management of Colorectal Peritoneal Metastasis[J]. Surg Clin North Am,2017,97(3):671-682.
[10] Braam HJ,Schellens JH,Boot H,et al. Selection of chemotherapy for hyperthermic intraperitoneal use in gastric cancer[J]. Crit Rev Oncol Hematol,2015,95(3):282-296.
[11] Cascales-Campos P,Lpez-Lpez V,Gil J,et al. Hyperthermic intraperitoneal chemotherapy with paclitaxel or cisplatin in patients with stage Ⅲ-C/Ⅳ ovarian cancer. Is there any difference?[J]. Surg Oncol,2016,25(3):164-170.
[12] Bhatt A,Glehen O. The role of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy(HIPEC) in ovarian cancer: a review[J]. Indian J Surg Oncol,2016,7(2):188-197.
[13] Bakrin N,Bereder JM,Decullier E,et al. Peritoneal carcinomatosis treated with cytoreductive surgery and Hyperthermic Intraperitoneal Chemotherapy(HIPEC) for advanced ovarian carcinoma: a French multicentre retrospective cohort study of 566 patients[J]. Eur J Surg Oncol,2013,39(12):1435-1443.
Clinicalobservationofhyperthermicintraperitonealchemotherapywithpaclitaxelinpatientswithadvancedovariancancer
LI Nan1, SUN Ya-nan2, YANG Liang3, CHEN Su-qin1
(1.DepartmentofGynecology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 2.DepartmentofObstetricsandGynecology,theBethuneInternationalPeaceHospitalofPLA,Shijiazhuang050082,China; 3.DepartmentofNeurosurgery,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
ObjectiveTo evaluate the effect of hyperthermic intraperitoneal chemotherapy with paclitaxel after cytoreductive surgery(CRS) in patients with advanced ovarian cancer.MethodsA total of 46 cases of advanced(stage Ⅲ-Ⅳ) ovarian cancer patients were included in our study, 23 cases in study group and 23 cases in control group randomly. The study group was treated by hyperthermic intraperitoneal chemotherapy with paclitaxel and venous chemotherapy with oxaliplatin and docetaxel regimen after CRS. While the control group was treated by venous chemotherapy with oxaliplatin and docetaxel regimen after CRS only.Clinical treatment results for toxicity and adverse reactions, curative effects, remission rate of tumor, controlled rate of ascites, quality of life, and progression-free survival(PFS) were compared and analyzed after treatment.ResultsThe differences of the total remission rate of tumor and curative effects between two groups were not statistically significant(P>0.05). The controlled rate of ascites and KPS score in the study group were all better than patients in the control group(P<0.05). The PFS is also beteer than that of the control group(P<0.05).The differences in the rate of toxicity and adverse reactions between the study group and the control group were not statistically significant(P>0.05).ConclusionApplying the hyperthermic intraperitoneal chemotherapy with paclitaxel to treat advanced ovarian cancer after CRS can improve the controlled rate of ascites, KPS score, PFS and with little toxicity and adverse reactions.
ovarian neoplasms; chemotherapy, cancer, regional perfusion; paclitaxel
2017-09-12;
2017-10-11
河北省科技计划项目(152777220)
李楠(1981-),女,河北石家庄人,河北医科大学第二医院主治医师,医学博士研究生,从事妇科疾病诊治研究。
R737.31
A
1007-3205(2017)12-1409-04
赵丽洁)
