基于性构相依核心化学思想的元素化学的教学与思考
——以“硫的含氧化合物”的教学内容为例
2017-12-22
(1.上饶师范学院 化学与环境科学学院,江西 上饶 334001;2.上饶幼儿师范高等专科学校,江西 上饶 334001)
基于性构相依核心化学思想的元素化学的教学与思考
——以“硫的含氧化合物”的教学内容为例
张文广1, 彭春玉2
(1.上饶师范学院 化学与环境科学学院,江西 上饶 334001;2.上饶幼儿师范高等专科学校,江西 上饶 334001)
以硫的含氧化合物的教学内容为例,阐述了元素化学教学中,以性构相依的核心化学思想统领教学过程的课堂教学实践活动:通过详细分析物质的分子结构和成键特征,深刻揭示物质性质表现的内在原因;通过全面阐释物质性质与用途、性质与制备方法、性质与存在方式之间严密的逻辑关系,顺利实现元素化学完整知识体系的传授和多维教学目标的达成。
性构相依;学科思想;硫的含氧化合物;教学设计
作为大学化学专业核心基础课程之一的无机化学,其内容体系包括化学基础理论和元素化学两大部分。基础理论是关于化学(含各主干学科无机化学、有机化学、分析化学、物理化学等)共同或通用的学科理论,是“大化学”概念下的普遍原理,其重要性不言而喻;元素化学内容庞杂、材料琐碎,化学反应方程式及描述性的反应现象纷繁,教材风格单调,知识呈现呆板,这种现象严重影响了学生的学习积极性,使课堂教学受到了很大的挑战,也正因为如此,近年来国内外的一些无机化学教材内容和主讲教师有淡化、弱化、压缩元素化学教学的倾向。
元素化学应该是无机化学内容体系的主脉,这至少可以从两个方面来理解:从无机化学经典定义的内涵看,作为化学的重要主干学科,无机化学是以元素周期律和化学原理为基础,分族、分区地研究元素及其单质、化合物的组成、结构、性质、用途、制备的学科;从无机化学的发展趋势看,随着科学的不断发展,无机化学与其他学科日益紧密的交叉、渗透产生了很多新兴学科,如材料科学、信息科学、能源科学、环境科学、生命科学、空间科学等等,无机化学的这种交叉、渗透,主要的体现和反映就在元素化学领域。正因为元素化学是无机化学内容体系的主脉,笔者认为,在无机化学课程中,元素化学的教学只能强化,不应弱化,更不能虚化和边缘化。
如何高效地进行元素化学的教学?笔者的体会是:以性构相依的核心化学思想统领课堂教学,可以取得良好的教学效果。通过详细分析物质的分子结构和成键特征,从而深刻揭示物质性质表现的内在原因;通过严密阐释物质性质与用途、性质与制备方法、性质与存在方式之间的逻辑关系,从而顺利实现元素化学完整知识体系的传授和多维教学目标的达成。更重要的是,以性构相依的核心化学思想来统领元素化学的课堂教学,通过教师的循循善诱和启发讲解,能激发学生的求知欲望,使学生好于探究、乐于学习,为达成教学目的提供源源不断的精神动力。
下面以“硫的含氧化合物”的教学内容为课堂教学设计的实例,展示元素化学的教学实践。
1 关于硫的含氧化合物的一些基本实验事实
硫元素能形成一系列的氧化物,其中最常见和最重要的是SO2和SO3。硫又能形成种类繁多的含氧酸,其中较重要的是亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2S2O7)、硫代硫酸(H2S2O3)、过二硫酸(H2S2O8)、连四硫酸(H2S4O6)及其形成的盐[1-2]。
实验表明:SO2的分子构型为V型(折线型、角型),键角119.5°,S、O原子间具有双键的性质(键长143 pm,比单键键长155 pm小[1-2]),见图1a。

图1 SO2的分子结构
气态的SO3主要以单分子的形式存在,其分子构型为平面三角型,键角120°,S、O原子间也有双键的性质;纯净的SO3在常温下是易挥发的固体,固态时的SO3主要以两种形式存在:一种是由SO4四面体构成的无限长链石棉型分子(SO3)n,其中所有的S原子和三分之一的O原子在链上成键,三分之二的O原子与S原子在链外成键,链内和链外的S、O键长不等;另一种是类似椅式环己烷构型的三聚体分子(SO3)3,其中三个O原子和所有的三个S原子在环内成键,六个O原子与S原子在环外成键,环内和环外的S、O键长也不等。
在硫形成的各种含氧酸中,H2SO4最重要。它是化学工业和化学实验室中很常见的化工原料和化学试剂,其分子构型为四面体,分子内主要有两类不同键长的S、O键,见图2a。

a 实验参数 b 理论分析
低价态的硫含氧酸都不稳定,很易分解,形成盐后稳定性增强,但都具有还原性,易被氧化,其中的硫代硫酸根离子还有较强的配位能力,很容易形成配合物;高价态的硫含氧酸及其盐都表现出较强的氧化性,有的甚至比高锰酸钾的氧化性还强(如过二硫酸盐)。
物质的结构决定物质的性质,物质的性质反映物质的结构。如何用化学键理论或分子结构知识来阐释上述实验事实?课堂上可引导学生对这些问题作出深入的分析。
2 共价键理论对硫的含氧化合物分子结构的分析
可用现代价键理论(Valence Bond Method,VB法),并结合轨道杂化(Orbital Hybridization)的思想及分子轨道理论(Molecular Orbital Theory,MO法)的处理方法对硫的含氧化合物的分子结构进行阐释。这里以SO2和H2SO4为例,讨论如下。
2.1 对SO2分子结构的分析
SO2分子中原子间的键合关系是:1个S原子为中心(由于S的电负性小于O,原子核对价电子的束缚力S小于O,故S原子“允许”更多的原子来共享其价电子,所以S是中心原子),2个O为配体原子。S的价层电子结构是3s23p4,S共有6个价电子。根据原子间共价键的成键规则,中心原子S与2个配位原子O要分别形成1个键,分子内总共有2个键。由于每个配位原子O的价电子层各有2个未成对的电子,这需要中心原子S的4个价电子与其成键,所以S的价层还有1对未成键的孤电子对。
根据原子轨道杂化类型的判断规则[3],原子间键合时杂化轨道是用来填充键电子对和孤电子对的,由于中心原子S成键后的键电子对和孤电子对总数为3,故它所需要的杂化轨道数也为3;又由于轨道杂化前后其总数是不变的,故中心原子S需要提供3个价层轨道来进行杂化,所以它的轨道杂化类型必定是sp2。按照判断分子结构的逻辑规则,中心原子S在SO2分子中的成键情况,见图3。
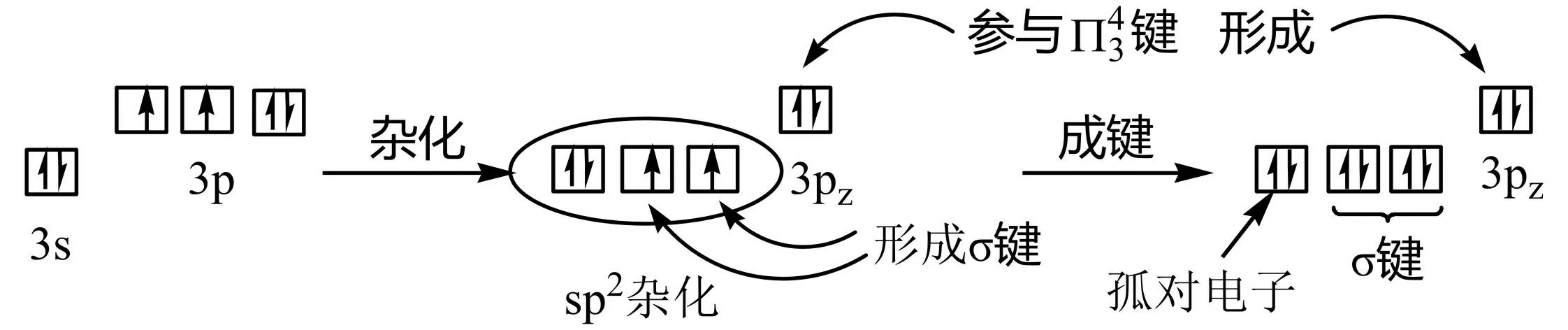
图3 SO2分子中心原子的轨道杂化和成键方式
在图3中,S的3个杂化轨道相互间按平面三角形取向,孤对电子占据着1个杂化轨道;2个填有未成对电子的杂化轨道,分别与2个配体原子O中填有未成对电子的1个2p轨道以“头碰头” 重叠的方式形成键(称为sp2-p键),所以分子的几何构型或空间取向为“V”型。此外,中心原子S的价电子层还有1个3p轨道,它未参与杂化,而且含有1对电子,由于它与2个配体原子O上含有未成对电子的另一个2p轨道,共同垂直于分子所在的平面,3个p轨道相互平行,所以能够以“肩并肩”的方式重迭形成3中心、4电子的大键,表示为见图1b(实线表示键,虚线表示大键)。
在SO2分子中,S原子杂化轨道中没成键的孤电子对,它只受到1个所属原子即硫原子核的吸引,所以能量较高,故而它与成键电子对之间的斥力,比成键电子对与成键电子对之间的斥力更大,所以原子间的夹角即分子的键角不是理想的120°而是119.5°。

2.2 对H2SO4分子结构的分析
H2SO4分子中原子间的键合关系为:1个S原子为中心,2个O原子(非羟基氧)和2个OH原子团(羟基)为配体。类似于上面的分析,中心原子S的轨道杂化方式是sp3,杂化轨道中不存在孤对电子。其成键情况见图4。
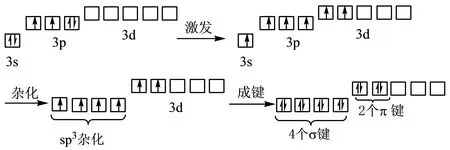
图4 H2SO4分子中心原子S的轨道杂化和成键方式
在图4中,中心原子S的4个填有未成对电子的sp3杂化轨道,分别与4个键联O原子中填有未成对电子的1个2p轨道以“头碰头” 重叠的方式形成4个键(称为sp3-p键),从而确定了分子的四面体构型。中心原子S的价层还有五个未杂化的3d轨道,其中两个轨道各填有一个未成对电子,这两个轨道与两个非羟基配体O原子上填有未成对电子的2p轨道,相互平行,可以“肩并肩”的方式重叠形成键(称为p-d键),见图2b。
根据上述分析可知,H2SO4分子中S与OH结合的键是单键(键长为155或152 pm),S与O(非羟基氧)结合的键是双键(键长为142或143 pm),其中同类型键中键长略有差异,可能是由于原子所处的位置对称性状态不完全相同,因而原子间的作用力不完全相同所致;从图2a还可以看出,H2SO4分子内各键角虽然都与正四面体的109.5o接近,但毕竟还是略有差异。
3 硫含氧化合物的结构对其性质用途及存在制备等决定性影响的阐释
物质的结构决定物质的性质,物质的性质又决定物质的用途、制备和存在方式,这种“性构相依”的辩证关系是化学的重要学科思想。根据这一思想和上述对硫含氧化合物分子结构的分析,可以很好地阐释它们的各种性质和存在、制备、用途等化学事实,举例如下:
(1)SO2分子中的正负电荷重心并未重合,所以它是极性分子。由于取向力、色散力、诱导力等分子间力都较大,故SO2气体极易被液化,而且液态SO2是很多物质的良好溶剂。由于SO2分子中S的氧化数为+4,处在中间态,故SO2既有氧化性,又有还原性;作还原剂时可被氧气催化氧化成三氧化硫,故SO2主要用来制备硫酸;作氧化剂时可杀灭细菌和漂白纸张,故SO2可用作防腐剂和漂白剂。
(2)硫形成的各种低价态含氧酸,如H2SO3(S的氧化数为+4)、H2S2O3(S的平均氧化数为+2)、H2S4O6(S的平均氧化数为+2.5),由于S的氧化数较低,导致S原子作用于成键电子的有效核电荷较低,故S原子核对S、O键中共用电子对的吸引力即S、O键较弱,所以低价态的硫含氧酸都不稳定,极易分解,它们只能以盐的形式存在。
(3)H2SO4分子中的S已达到了最高价态+6,有较强的得电子倾向,故H2SO4有较强的氧化性,热的浓硫酸是非常强的氧化剂,可氧化许多金属和非金属单质:
Cu + 2H2SO4(浓) = CuSO4+2SO2+2H2O
C + 2H2SO4(浓) = CO2+ 2SO2+ 2 H2O

(5)Na2S2O3中S的平均氧化数为+2,有较强的失电子倾向,故Na2S2O3有较强的还原性,遇弱的氧化剂I2可被氧化成连四硫酸盐Na2S4O6(S的平均氧化数为+2.5);遇强的氧化剂Cl2可被氧化成硫酸盐Na2SO4(S的氧化数为+6):
2Na2S2O3+ I2= Na2S4O6+2NaI
Na2S2O3+ 4Cl2+5H2O =2H2SO4+ 2NaCl+6HCl
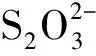
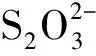
Na2S2O3的水合物晶体Na2S2O3·5H2O俗称海波或大苏打,是一种重要的化学试剂,常用作化工生产中的还原剂、绵织物漂白后的脱氯剂(利用其对氯气或次氯酸钠的还原性)、照相行业中的定影剂(配位剂),还用于电镀、鞣革行业中的污水处理(利用其对重金属离子的配位性)。
(6)亚硫酸钠Na2SO3溶液很容易被氧气氧化成Na2SO4;而S和O是同族元素,有相似的原子结构和成键特征,所以受类比思维的启发,很容易理解Na2SO3在一定条件下也很易被硫单质硫化成与Na2SO4结构相似的Na2S2O3:

由于水溶液中SO2与H2S和NaOH作用可分别生成S和Na2SO3,SO2与Na2S和Na2CO3作用也可分别生成S和Na2SO3,所以按照演绎思维的推理,也很容易理解Na2S2O3的另两种制备方法[1-2]:
4SO2+2H2S + 6NaOH =3Na2S2O3+5H2O
4SO2+2Na2S + Na2CO3=3Na2S2O3+ CO2
4 感悟与思考
元素化学是传授化学键理论和物质结构知识的重要载体,也是对学生进行矛盾普遍联系、对立统一等辩证唯物主义思想教育的重要素材。加强元素化学的教学,是无机化学课程内容、知识体系的客观要求,也是开拓无机化学新的发展方向的必然要求。在元素化学的教学中,以性构相依的学科思想统领教学过程,无比重视物质结构和分子成键特征的分析推理,是解决无机化学课程体系原理部分与元素部分相互脱节的重要途径,也是理论指导实践、学以致用的重要体现。
以性构相依的学科思想统领元素化学的教学过程,关键是教师要有扎实的教学基本功和丰富的化学学术素养;要善于凝炼教学内容,把握知识间严密的逻辑关系;要充分考虑学生的认知规律,为学生精心设计出“心求通而未得,口欲言而不能”(宋代理学家朱熹语)的教学问题和教学情境;要特别注重启发式的教学思想和教学方法,做到有讲有练,讲练结合,层层推进,拾级而上;点拨讲解要做到循循善诱,步步深入,让学生感到“其言皆若出于吾之口,其意皆若出于吾之心”(朱熹语)而愿于、乐于孜孜求索。
性构相依的辩证思想具有丰富的哲学内涵,它是化学学科核心意义上的学科思想[5]。以性构相依的核心化学思想来统领元素化学的课堂教学,既能使学生加深理解元素化学的知识,又可使学生巩固掌握学过的分子结构知识,并得到科学思想的熏陶和思维方法的训练;而且,它还能激发学生的求知欲望,使学生乐于学习、好于学习,使课堂教学氛围得到最大的优化,从而取得良好的教学效果。
[1] 北京师范大学,华中师范大学,南京师范大学.无机化学[M].3版.北京:高等教育出版社,1993:460-470.
[2] 武汉大学,吉林大学.无机化学[M].3版.北京:高等教育出版社,1994:608-621.
[3] 张文广,王祖浩.原子轨道杂化方式的判断与分子结构的合理推定[J].化学世界,2008(3):189-192.
[4] 张文广,彭春玉.价键法融合分子轨道理论及轨道杂化概念对O3分子结构和性质的阐释[J].化学世界,2017(8):509-511.
[5] 张文广.性构相依思想的阐释及其教学实践探索[D].上海:华东师范大学,2008.
Teaching and Thinking for Elements Chemistry Based on Subject Thought about Correlating Properties with Structure
ZHANG Wenguang1,PENG Chunyu2
(1.School of Chemistry and Environmental Sciences ,Shangrao Normal University,Shangrao Jiangxi 334001; 2. Shangrao Preschool Education College,Shangrao Jiangxi 334001)
Taking teaching of oxo-compounds of sulphur for example,this paper discussed how to teach elements chemistry based on subject thought about correlating properties with structure:revealing profoundly internal cause of matter properties by analysis of molecular structure and bonding feature in detail;realizing successfully propagation of integrated knowledge systems in elements chemistry and accomplish of polydemensions teaching aims by fully clarifying strict logic relations between properties and uses,and preparation,and occurrence.
correlating properties with structure;subject thought;oxo-compounds of sulphur;teaching design
2017-01-04
张文广(1963-)男,江西上饶人,教授,博士,主要从事无机化学及专业英语的教学和研究工作。E-mail:zwg0793@163.com
G642.0
A
1004-2237(2017)06-0065-05
10.3969/j.issn.1004-2237.2017.06.015
