过表达FaSAMDC基因提高黑麦草属植物的抗旱性和耐热性
2017-12-22曾庆飞韦鑫蔡一鸣舒健虹吴佳海王小利
曾庆飞,韦鑫,蔡一鸣,舒健虹,吴佳海,王小利
(贵州省农业科学院草业研究所,贵州 贵阳 550006)
过表达FaSAMDC基因提高黑麦草属植物的抗旱性和耐热性
曾庆飞,韦鑫,蔡一鸣,舒健虹,吴佳海,王小利*
(贵州省农业科学院草业研究所,贵州 贵阳 550006)
主要探讨了在黑麦草属植物中导入高羊茅S-腺苷甲硫氨酸脱羧酶基因(FaSAMDC)对转基因植株抗旱耐热性的提高效果,为培育黑麦草抗旱耐热新品种提供种质新材料。选择黑麦草成熟种子为外植体,采用贵州省草业研究所分子生物学实验室构建的过表达载体以及黑麦草胚性愈伤组织高频植株再生和农杆菌介导的遗传转化体系,将克隆自高羊茅的FaSAMDC基因转入贵州地区主栽品种多花黑麦草特高和多年生黑麦草四季的基因组内,经抗性筛选、PCR检测和Southern杂交分析验证,获得45株特高与44株四季的转基因植株,转化频率分别为2.93%和2.28%。抗旱耐热试验表明,在30 ℃高温和中度干旱胁迫条件下,特高转基因株系的根冠比比对照组培苗高出7.08%,叶片相对含水量(RWC)比对照高出13.12%,RWC降低幅度比对照少5.49个百分点;四季转基因株系的根冠比比对照组培苗高出6.54%,RWC比对照高出12.54%,RWC降低幅度比对照少6.50个百分点,差异均达到显著水平(P<0.05),证明转入FaSAMDC基因的黑麦草阳性株系的抗旱耐热能力得到了明显提高。形态与生长特征观测结果显示,与非转基因组培苗相比,转基因株系的叶长、株高、主茎节数减小,叶宽、单株分蘖数增加,叶色变深,植株形状趋向于叶片丛生的紧凑型,推测导入的FaSAMDC基因参与了基因表达、细胞分裂等生理功能的调节。
黑麦草;根癌农杆菌;遗传转化;FaSAMDC基因;抗旱耐热性
在世界各国种植的优良牧草中,禾本科牧草约占43%的比重,其中黑麦草(Lolium)由于具有生长迅速、茎叶柔嫩光滑、绿色期长、耐牧性强、营养价值高且株型外观优美等优点,已成为世界温带地区建立人工草地和补播天然草场的重要冷季型禾草,在草地草坪建植及饲草供给中占有很重要的地位[1]。但是另一方面,黑麦草对于35 ℃以上的高温、干旱、-15 ℃以下的严寒以及土壤盐碱均表现出较弱的耐受性,从而使其进一步的广泛栽培和利用受到限制[2]。针对黑麦草存在的不足,对现有品种进行抗逆性改良,定向培育抗旱、耐热、耐瘠薄的系列黑麦草优良品种,对于改善区域农业生产结构、促进“三元结构农业”和节粮型畜牧业的发展将起着重要作用。
进行黑麦草耐逆性改良,现代转基因技术是一条有效的重要途径。在国外,利用转基因技术改良黑麦草抗逆性的研究起步较早,选择分生组织和颖果作为外植体,已建立了多年生黑麦草细胞悬浮系和原生质体培养体系,并获得了转基因组培苗[3-4];另外通过碳化硅纤维介导法和基因枪法都获得了转基因植株[5-6],只是未见转基因新品种的选育报道。在国内,刘萍等[7]应用农杆菌介导法将克隆自辽宁碱蓬(Suaedaliaotungensis)的甜菜碱醛脱氢酶基因(BADH)转移进多年生黑麦草,获得了具有较强耐盐能力的转基因株系Gsc-LP5;王奇丽等[8]利用农杆菌介导的遗传转化方法,将报告基因GUS和抗除草剂基因BAR成功转入多年生黑麦草,共计获得52株T0代表现为Basra抗性的植株。而对于一年生黑麦草遗传转化的研究报道相对较少。
在植物的生长发育过程中,S-腺苷甲硫氨酸脱羧酶基因(SAMDC)是一个与抗逆相关的重要功能基因。研究表明,当植物体内多胺生物合成流量增加时,植株能产生对生物及非生物胁迫的耐受性[9]。而在多胺生物合成途径中,S-腺苷甲硫氨酸脱羧酶(SAMDC)能以S-腺苷甲硫氨酸(SAM)为底物催化形成脱羧S-腺苷甲硫氨酸(dcSAM),为精氨和亚精氨的合成提供氨丙基,从而成为了亚精胺和精胺合成的关键酶。SAMDC能对多种外界条件的胁迫作出反应,会受高盐、高热、干旱、寒冷及水分胁迫的诱导[10]。已有试验证明,转入康乃馨SAMDC的转基因植株能获得对非生物胁迫的广谱抗性[11];SAMDC调节合成的精胺积累有助于植物在经受干旱后的快速复苏[12];SAMDC在转基因番茄中的组成型表达能同时提高植株对生物及非生物胁迫的耐受性[13],但还未见在黑麦草中超量表达SAMDC基因的研究报道。本研究利用贵州省草业研究所分子生物学实验室构建的过表达载体以及黑麦草组培再生体系和农杆菌介导的遗传转化体系,将克隆自高羊茅的SAMDC基因导入多花黑麦草特高和多年生黑麦草四季的基因组内,经抗性筛选、PCR检测、Southern杂交和抗旱耐热性鉴定,获得了一批耐逆性增强的转基因植株。
1 材料与方法
1.1 材料
黑麦草外植体选用在贵州地区种植较为普遍的品种的成熟种子,一年生黑麦草特高于2014年购于贵阳霖卉园林绿化有限公司,多年生黑麦草四季由贵州省草业研究所保存。2013至2014年构建的过表达载体是由经贵州省草业研究所分子生物学实验室改造过的植物表达载体pCAMBIA 1300与克隆自高羊茅黔草1号的SAMDC基因(FaSAMDC)所形成的重组质粒pCAMBIA 1300-FaSAMDC。该载体具有潮霉素(hygromycin,Hyg)和卡那霉素(kanamycin,Kan)抗性,在FaSAMDC片段的两侧各具有一个CaMV 35S启动子,主要表达框架如图1所示。通过冻融法将重组质粒导入根癌农杆菌(Agrobacteriumtumefaciens)菌株EHA105和GV3101中,经PCR和酶切验证获得阳性克隆[14]。
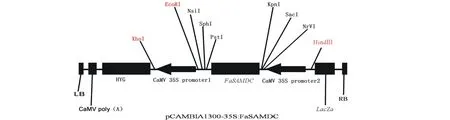
图1 构建的过表达载体结构图Fig.1 Schematicic diagram of constructed recombinant plasmid LB:左边界 Left border;CaMV poly(A):来自花椰菜花叶病毒35S启动子的多聚腺苷酸尾 Polyadenylation from 35S promoter of cauliflower mosaic virus;HYG:抗潮霉素序列 Hygromycin resistant sequence;XhoI:限制性内切酶XhoI识别序列 Sequence recognized by restriction enzyme XhoI;CaMV 35S promoter 1:来自花椰菜花叶病毒的35S启动子1 35S promoter 1 from cauliflower mosaic virus;EcoRI:限制性内切酶EcoRI识别序列 Sequence recognized by restriction enzyme EcoRI;NsiI:限制性内切酶NsiI识别序列 Sequence recognized by restriction enzyme NsiI;SphI:限制性内切酶SphI识别序列 Sequence recognized by restriction enzyme SphI;PstI:限制性内切酶PstI识别序列 Sequence recognized by restriction enzyme PstI;FaSAMDC:插入的高羊茅腺苷甲硫氨酸脱羧酶基因 Inserted S-adenosylmethionine decarboxylase gene from Festuca arundinacea;KpnI:限制性内切酶KpnI识别序列 Sequence recognized by restriction enzyme KpnI;SacI:限制性内切酶SacI识别序列 Sequence recognized by restriction enzyme SacI;NrVI:限制性内切酶NrVI识别序列 Sequence recognized by restriction enzyme NrVI;CaMV 35S promoter 2:来自花椰菜花叶病毒的35S启动子2 35S promoter 2 from cauliflower mosaic virus;HindⅢ:限制性内切酶HindⅢ识别序列 Sequence recognized by restriction enzyme HindⅢ;LacZa:β-半乳糖苷酶a基因 Gene A of beta-galactosidase;RB:右边界 Right border.
愈伤组织诱导培养基:特高的愈伤组织诱导采用CC+7 mg/L 2,4-D+0.5 mg/L 6-BA,四季采用CC+5 mg/L 2,4-D+0.5 mg/L 6-BA;愈伤组织继代培养基:MS+0.5 mg/L 2,4-D+0.5 mg/L 6-BA+1.25 mg/L CuSO4+1.0 g/L CH; 农杆菌培养基采用YEB培养基:10 g/L胰蛋白胨+1 g/L酵母抽提物+5 g/L蔗糖+0.5 g/L MgSO4·7H2O,pH 7.0;农杆菌悬浮培养基:AA+1.0 mg/L 2,4-D+100 μmol/L乙酰丁香酮,pH 5.2;预培养基:MS+10 g/L葡萄糖+3 mg/L 2,4-D+2 mg/L KT+100 μmol/L乙酰丁香酮+0.1 mol/L甘露醇+5 mg/L AgNO3+8 g/L琼脂粉;液体预培养基:MS+30 g/L麦芽糖+10 g/L葡萄糖+3 mg/L 2,4-D+2 mg/L KT+100 μmol/L乙酰丁香酮+0.1 mol/L甘露醇+5 mg/L AgNO3;共培养基:MS+5 mg/L 2,4-D+0.05 mg/L 6-BA+100 μmol/L乙酰丁香酮+0.1 mol/L甘露醇+5 mg/L AgNO3+8 g/L琼脂粉;选择培养基:MS+10 g/L葡萄糖+3 mg/L 2,4-D+2 mg/L KT+150 mg/L特美汀+40 mg/L潮霉素+8 g/L琼脂粉;分化筛选培养基:特高转化苗采用 MS+2 mg/L 6-BA+0.5 mg/L NAA+0.1 mg/L TDZ+40 mg/L潮霉素+8 g/L琼脂粉,四季转化苗采用 MS+6 mg/L 6-BA+0.3 mg/L NAA+5 mg/L KT+40 mg/L潮霉素+8 g/L琼脂粉;生根培养基:1/2MS+0.5 mg/L NAA+0.5 mg/L IAA+8 g/L琼脂粉。
1.2 根癌农杆菌介导转化黑麦草
遗传转化试验于2015年进行。2个品种均以剥去颖壳后切除1/3胚乳端的种子作为外植体,分别接种于愈伤组织诱导培养基上,在(26±1) ℃黑暗条件下培养40 d形成愈伤组织,接着转移至继代培养基上,每次培养25 d,通过2次继代培养后获得胚性愈伤组织,然后按下列步骤进行遗传转化。
1.2.1受体愈伤组织预培养 将继代培养形成的愈伤组织转接至预培养基上,(25±1) ℃无光照条件下预培养3 d后在液体预培养基中振荡预培养2 d,以促进愈伤组织的活化并使之处于感受状态。
1.2.2农杆菌感染与共培养 在YEB平板上挑取活化的已导入过表达载体pCAMBIA 1300-FaSAMDC的根癌农杆菌EHA105的单菌落,接种于含Hyg和Kan各50 mg/L的YEB液体培养基中,28 ℃、180 r/min培养至OD600为1.0,5000 r/min离心10 min收集菌体,用农杆菌悬浮培养基重悬成OD600为0.7的悬浮液。将预培养的胚性愈伤组织浸入悬浮液30 min,用无菌滤纸吸干菌液,转接至共培养基上,(25±1) ℃黑暗条件下培养3 d。
1.2.3抗性愈伤组织筛选 共培养后的愈伤组织先用0.1 mol/L甘露醇无菌液振荡清洗,再用含200 mg/L特美汀的无菌水洗涤3~5次,吸干水分后转移到Hyg浓度为40 mg/L的选择培养基上,(25±1) ℃暗培养4周。将长出的抗性愈伤组织转接至新的含相同浓度Hyg的选择培养基上,连续进行2轮继代筛选,每20 d转接一次。
1.2.4抗性植株再生 将3轮筛选后的抗性愈伤组织分别转移至特高与四季各自的筛选分化培养基上,在(25±1) ℃、光照时间12 h/d、光强2000 lx的培养室中进行分化培养。当分化形成的不定芽长至2 cm左右时转入生根培养基中,待幼根长出且再生苗株高达到6~8 cm时,在15~25 ℃室温条件下揭开瓶盖炼苗2~3 d后,将再生苗从瓶内小心取出,清水洗净琼脂,移栽至盛有营养土(腐殖土∶蛭石∶砂壤土=1∶1∶1)的花钵中。
1.3 抗性植株的PCR检测
转化苗的PCR检测、Southern blot 分析和抗旱耐热鉴定试验于2016年开展进行。
采用常用的CTAB法提取转化植株及对照非转化组培苗的叶片总DNA,根据潮霉素B基因的片段序列设计一对特异引物,正向引物F1:TTCTGCGGGCGATTTGTG,反向引物R1:AGCGTCTCCGACC TGATG。以提取的基因组DNA为模板,每个反应体系总体积20 μL,采用Touch down PCR方法进行扩增:94 ℃预变性3 min;94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸1 min,10个循环,每个循环退火温度减1 ℃;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,25个循环。扩增产物用1.2%凝胶电泳检测。
1.4 转基因植株的Southern杂交分析
在特高和四季的T0转基因植株中分别随机选择4株转化苗和1株非转化对照组培苗,CTAB法大量提取基因组DNA。经分光光度法检测合格后各取30 μg基因组DNA,用EcoR I酶切完全后在0.8%琼脂糖凝胶中4 ℃条件下电泳(100 V,5 min,接着70 V约5 h),再转移到HybondTM-N+尼龙膜上。以潮霉素抗性标记基因HYG片段(877 bp)作为探针,探针标记、分子杂交和信号检测采用“DIG-High Prime DNA Labeling and Detection Starter Kit”试剂盒(上海浩洋生物科技有限公司)说明书中的操作步骤进行。
1.5 转基因植株的抗旱耐热性鉴定
采用根冠比测定法[15]以及苗期叶片相对含水量测定法[16],以组培产生的非转基因苗为对照,对阳性株系的抗旱耐热性进行鉴定。
根冠比测定:随机选取特高转基因株系、四季转基因株系以及特高与四季非转基因组培苗各3株,移栽于花钵中后转入30 ℃人工气候室内培养。正常浇水12 d后接着作连续断水12 d的中度干旱胁迫处理。将连同根系的整个植株带土取出,冲净后用吸水纸吸取根表面的水分,将地上、地下部分分离,于105 ℃杀青30 min,在恒温85 ℃下烘干12 h至恒重后采用万分之一电子天平称重。
根冠比(R/S)=地下根系干重(root)/地上部干重(shoot)
叶片相对含水量(RWC)的测定:在盆栽苗中选择苗高、生长状况一致的特高和四季转基因苗以及组培产生的非转基因的特高和四季苗各6株,转入30 ℃人工气候室内培养。正常浇水12 d后各选3株测定其叶片相对含水量,计算平均值;剩下3株作连续断水12 d的中度干旱胁迫处理后再分别测定叶片相对含水量,计算各株系叶片相对含水量变化值的平均值。
RWC数值测定采用鲜重法:剪取整株黑麦草叶片,称出鲜重(Wf);再将叶样浸入蒸馏水中24 h,取出后用吸水纸擦干样品表面水分,称出饱和重(Wt);最后将叶样放入已升温至105 ℃的烘箱中杀青15 min,然后于80 ℃下烘至恒重,采用万分之一电子天平称出干重(Wd)。
叶片相对含水量 RWC=(Wf-Wd)/(Wt-Wd)×100%
1.6 转基因植株形态与生长观察
将组培形成的非转化对照植株和转基因株系首先移植于花钵中,2周后移栽至温室大棚内,25 ℃条件下控温生长。60 d后每组各选择5个植株,观察记录它们的生长、分蘖、叶色、株型等形态特征,分别测定各类株系的株高、叶片长度、叶片宽度、节数与单株分蘖数,计算各测定项目的平均值。
1.7 数据处理
对各试验处理的数据,采用Excel统计分析软件、SPSS数据处理软件分别进行统计分析和显著性测验。
2 结果与分析
2.1 转基因植株的获得
利用优化建立的多花黑麦草特高和多年生黑麦草四季的高频组培再生体系,分别以2个品种的成熟种子为外植体,将外植体经过前处理后分别接种于各自的愈伤组织诱导培养基,40 d后选择生长状态良好、致密均一的愈伤组织转接至统一的继代培养基中,通过2次共50 d的继代培养后,挑选颜色鲜黄、生长旺盛且结构密实的Ⅱ型胚性愈伤组织(图2A)进行3 d的预培养和2 d的振荡培养,接着与已导入过表达载体pCAMBIA 1300-FaSAMDC的根癌农杆菌EHA105共培养(图2B),经Hyg筛选6周后将抗性愈伤组织转移至筛选分化培养基上,待形成不定芽后(图2C)转入生根培养基中(图2D),3周后移栽至盛有营养土的花钵中(图2E、F),最终获得131棵抗性植株。
2.2 转基因植株的PCR检测
选取移栽成活的131棵抗性植株,提取叶片总DNA,以EHA105-p1300菌作阳性对照,非转化的特高和四季苗的叶片总DNA为阴性对照,用设计的引物对扩增抗潮霉素B基因的部分片段。PCR产物经1.2%琼脂糖凝胶电泳检测发现,其中有45株特高转基因抗性植株和44株四季转基因株系扩增出了与预期长度相吻合的877 bp的目的片段,非转化对照植株均未出现相应扩增带(图3),表明FaSAMDC基因已经整合进入到2个品种的黑麦草基因组中。特高和四季的转化频率分别为2.93%和2.28%(表1)。
2.3 转基因株系的Southern blot分析
在经PCR检测呈阳性的转基因植株中,为进一步确证外源的FaSAMDC基因已整合到黑麦草基因组中,分别随机选择4株特高转化苗(编号FT1~FT4)和4株四季转化苗(编号FS1~FS4),提取叶片总DNA,并以非转化的特高和四季苗的叶片总DNA为对照,经EcoR I酶切后用含抗潮霉素B基因部分片段的探针进行Southern杂交,结果见图4和图5。杂交结果显示,多花黑麦草特高的4个35S:SAMDC转化子(FT1~FT4)均出现了明显的单一杂交条带,对照没有杂交带,推测4个35S:SAMDC转化子均为单拷贝HYG阳性植株;而多年生黑麦草四季的4个35S:SAMDC转化子中(FS1~FS4),FS1和FS4两个转化子的杂交条带较为明显,FS2与FS3的条带较弱,对照也没有条带;其中FS1、FS3和FS4为单一条带,推测它们为单拷贝的HYG阳性植株,而FS2号出现了微弱的2个条带,推测其可能为双拷贝的HYG阳性株系。
2.4 转基因阳性株系的抗旱耐热能力鉴定
2.4.1根冠比测定结果 当转基因阳性株系与非转化的组培对照苗在设定的高温干旱胁迫环境中生长24 d以后,分别分离地上部与地下部,烘干称重,测定每一植株的根冠比,并计算每一材料根冠比3个重复的平均值,结果见表2。从表中看出,2个品种的转基因阳性株系经高温干旱胁迫后其根冠比值均高于相应的对照株系,其中特高转基因株系比对照苗高出7.08%,四季转基因株系比对照高出6.54%,差异均达到显著水平(P<0.05)。

图2 农杆菌介导的黑麦草遗传转化及植株再生Fig.2 Agrobacterium-mediated transformation of ryegrass and regeneration of the transformed plantlets A:诱导出的特高胚性愈伤组织;B:特高胚性愈伤组织与根癌农杆菌的共培养;C:四季抗性愈伤组织不定芽的分化;D:生根培养基中特高和四季抗性植株生根;E:特高和四季抗性植株移栽至花钵并成活;F:特高和四季抗性植株在人工气候室内生长。 A: Induced embryogenic callus of Tetragold; B: Co-culture of embryogenic callus of Tetragold and Agrobacterium tumefaciens; C: Differentiation of adventitious buds from resistant callus of Four seasons; D: Hygromycin-resistant plants of Tetragold and Four seasons growing in rooting medium; E: Hygromycin-resistant plants of Tetragold and Four seasons potted in soil successfully; F: Hygromycin-resistant plants of Tetragold and Four seasons growing in climatic laboratory.

图3 转基因黑麦草抗性植株潮霉素B基因的PCR检测Fig.3 PCR analysis of B gene of hygromycin in putative transgenic plants of ryegrass M:DNA分子量;+:EHA105-p1300菌(阳性对照);-:非转化植株(阴性对照);1~9:特高和四季转基因抗性植株。 M: DNA marker; +: Strain EHA105-p1300 as positive control; -: Non-transformed plant as negative control; 1-9: Transgenic hygromycin-resistant plants of Tetragold and Four seasons.

表1 农杆菌介导2个黑麦草品种的转化频率Table 1 Transgenic frequency of two ryegrass cultivars by Agrobacterium tumefaciens

图4 特高转基因植株潮霉素B基因的Southern杂交分析Fig.4 Southern analysis of B gene of hygromycin in putative transgenic plants of Tetragold
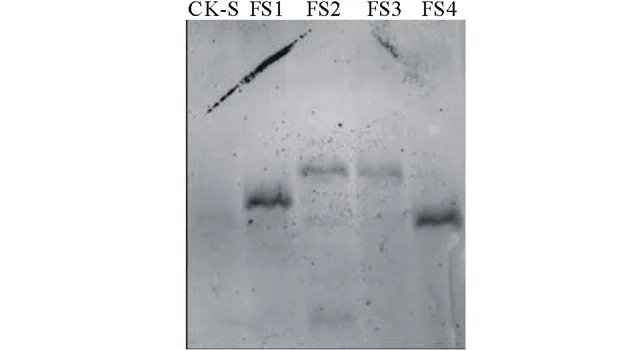
图5 四季转基因植株潮霉素B基因的Southern杂交分析Fig.5 Southern analysis of B gene of hygromycin in putative transgenic plants of Four seasons
CK-T:特高非转化植株(阴性对照);FT1~FT4:特高转基因植株。CK-T: Non-transformed Tetragold plant as negative control; FT1-FT4: Transgenic hygromycin-resistant plants of Tetragold.
CK-S:四季非转化植株(阴性对照);FS1~FS4:四季转基因植株。CK-S: Non-transformed Four seasons plant as negative control; FS1-FS4: Transgenic hygromycin-resistant plants of Four seasons.

表2 特高、四季转基因株系与对照苗根冠比测定Table 2 The root to shoot ratios of transgenic lines of Tetragold and Four seasons and control seedlings
较CK高:Increase rate compared with CK.同行不同大写字母表示转基因株系与对照苗之间差异达极显著水平(P<0.01),不同小写字母表示差异显著(P<0.05)。下同。Different capital letters after data in the same row indicate the significant difference between transgenic lines and control seedlings atP<0.01 level, different lowercase letters indicate significant differences atP<0.05 level. The same below.
2.4.2叶片相对含水量(RWC)测定 经设置的30 ℃高温以及正常浇水和中度干旱胁迫处理后,先后对转基因株系与非转基因组培对照苗3个重复的叶片相对含水量进行了测定,计算平均值(表3)。结果显示,在高温及正常浇水条件下,特高转基因株系的叶片相对含水量比对照高出7.63%,四季转基因株系比对照高出6.04%,2个品种转基因株系与对照组培苗的RWC差异均达显著水平(P<0.05);而在高温和连续断水12 d的中度干旱胁迫处理以后,特高转基因株系的叶片相对含水量比对照要高出13.12%,四季转基因株系比对照高出12.54%,RWC差异都达到极显著水平(P<0.01);同时,在经受中度干旱胁迫后,特高与四季2个品种转基因株系的RWC降低幅度分别比对照少5.49和6.50个百分点,说明所获得的转基因株系比对照组培苗具有更强的抗旱耐热能力。

表3 特高、四季转基因株系与对照苗叶片相对含水量测定Table 3 The leaf relative water content of transgenic lines of Tetragold and Four seasons and control seedlings %
较CK高或低:Increase or decrease rate compared with CK.
2.5 转基因阳性株系的形态与生长特征
对转基因阳性株系与同批次的非转基因组培苗在移栽60 d后苗期的形态特征考察结果见表4。观测结果显示,与对照相比,特高和四季转基因株系的株高与节数均有所降低,叶片宽度增加而长度略有减小,单株分蘖数增加,叶色变深,株型更趋向于叶片丛生的紧凑型。说明2个品种转基因株系的形态与生长特征与非转基因对照组培苗存在着差异,FaSAMDC基因的过量表达对转基因植株的垂直生长具有一定的抑制作用,但能增加株系的单株分蘖数,且叶色、株型的变化更有利于植株抵抗干热的环境条件。

表4 转基因植株与非转化对照植株的形态与生长特征Table 4 Morphological and growth characteristics of transgenic lines of Tetragold and Four seasons and control plants
3 讨论
国内外关于黑麦草遗传转化的研究始于20世纪80年代,前期采用的遗传转化方法主要是硅碳纤维转导法、原生质体直接转导DNA法和基因枪法等,并获得了少量的转基因多花黑麦草植株[17-18]。不过这些方法普遍存在着受基因型限制较大、转化频率较低、外源基因易于多拷贝插入、存在基因沉默与共抑制现象、后代株系呈非孟德尔遗传、再生植株不育等系列问题,后来建立起来的根癌农杆菌介导的遗传转化方法在一定程度上克服了这些缺点[19],并已逐渐成为作物遗传转化的主要途径之一[20]。然而,农杆菌介导的遗传转化是以愈伤组织再生体系作为受体系统的,黑麦草作为禾本科牧草对愈伤诱导和转化再生都不敏感,被称为组织培养顽固种类[21]。为获得较高的遗传转化效率,在转化实验开展前,课题组专门针对多花黑麦草特高和多年生黑麦草四季2个贵州地区的黑麦草主栽品种,先后进行了种子外植体的预处理、愈伤组织诱导及继代培养基组分、抗生素的临界浓度、愈伤组织分化培养基组分、预培养与共培养基组分、菌液浓度、浸染方式、农杆菌菌株与胚性愈伤组织的共培养时间、抑菌处理等内容的系统对比试验,优化建立了2个黑麦草品种农杆菌介导的遗传转化体系,保证了本研究中FaSAMDC基因转化实验的顺利进行。
在农杆菌介导的遗传转化过程中,由于绝大多数单子叶植物都不能积累足够的酚类物质,难以激活农杆菌的侵染能力,从而不能成为农杆菌的天然寄主[22]。乙酰丁香酮作为一种酚类化合物具有潜在的诱导农杆菌vir基因的作用,已被证明是一种能够提高单子叶植物和部分双子叶植物农杆菌转化效率的有效诱导物[23]。甘露醇作为一种中性单糖,也是一种农杆菌vir区基因的诱导剂,同时还可作为渗透调节物质调节细胞内外的渗透压而有助于遗传转化。另外,在单子叶植物的遗传转化过程中,农杆菌浸染后极易造成愈伤组织的褐化坏死,而硝酸银作为一种强还原剂,能够降低愈伤组织的氧化率、弱化甘露醇的高渗透作用并抑制农杆菌的过度生长,在不影响T-DNA转移和整合的同时,还能促进愈伤组织不定芽的分化,从而显著提高遗传转化效率[24]。因此,本研究在预培养及共培养基中分别添加了100 μmol/L乙酰丁香酮、30 g/L甘露醇和5 mg/L的硝酸银,并获得了较为理想的转化效果,转化效率分别达到2.93%和2.28%。总基因组单酶切的Southern杂交结果显示,在随机挑选的多花黑麦草特高的4个35S:SAMDC转化子中,FaSAMDC基因都是以单拷贝形式进入黑麦草基因组中的,而在随机选取的多年生黑麦草四季的4个转化子中,其中1个株系的FaSAMDC基因则以双拷贝数整合进入到了染色体中。在转基因株系中,外源基因无论以单拷贝或双拷贝形式存在都能正常表达[25],因此可以预见,转入FaSAMDC基因的黑麦草其抗逆性都会得到不同程度的增强。
试验转入FaSAMDC基因的目的是为了获得适合在贵州地区广泛种植的抗旱耐热性增强的黑麦草种质新材料。为了检测所获材料的抗旱耐热能力,本研究对2个品种的转基因株系分别进行了经高温干旱胁迫处理后根冠比和叶片相对含水量的对比测定。根冠比是衡量作物地上部分与地下部分生长发育协调程度的重要指标,高温干旱条件下,根冠比较高的植株具有更强的供应地上部生长所需养分的能力,有利于作物抵御高温干旱并保持较好的生长状况。在一定范围内,根冠比越大,抗旱耐热能力越强[26]。由于根冠比的测定会耗费整个植株,因而本研究只在每个品种的阳性转化株系中随机选择3个株系用于测定。测定结果显示,2个品种转基因株系的根冠比与非转基因组培苗的差异均达到显著水平。说明SAMDC基因的过量表达,一方面能通过增加植株体内亚精胺、精胺和内源腐胺的合成含量而提高植物的抗逆性[27],同时也还会通过增加植株的根冠比值来提高其对高温干旱的耐受性。叶片相对含水量是反映植物水分状况以及保水能力的另一个重要指标,它能够密切反映出水分状况与蒸腾作用之间的平衡关系以及植物对高热干旱环境胁迫的抵御能力[16]。相对含水量较高的叶片具有较高的渗透调节功能和较强的抗旱耐热性,叶片相对含水量与植物的抗旱耐热能力呈正相关关系[28];经过高热和水分胁迫处理后,叶片相对含水量的降低幅度愈小,植株的抗旱耐热能力愈强[29]。本研究获得的2个品种的转基因株系,无论是在高温及正常水分条件下,还是在高温及水分胁迫处理后,其叶片相对含水量都要显著高于对照组培苗,而且经中度干旱胁迫后,叶片相对含水量的降幅也明显低于对照。这进一步证实,转入FaSAMDC基因的黑麦草种质新材料,其抗旱耐热能力确信得到了有效的提高。
SAMDC基因的超量表达,不仅能提高植株的抗旱耐热性能,同时还能增强对于盐及其他渗透胁迫的适应能力,并具有控制基因表达、细胞分裂等多种生理功能[30],因此在一定程度上可以改变植株的形态与生长特征。本研究中转入了FaSAMDC基因的黑麦草株系,与非转基因对照苗相比,叶长株高略有减小,叶片宽度与单株分蘖数有所增加,叶色变深,植株形状更趋向于叶片丛生的紧凑型。这种形态与生长特征的变化,应该是外源SAMDC基因多种耐逆性机制共同作用的结果,而且可能更有利于提高植株对非生物胁迫的广谱抗性。
4 结论
在前期优化建立的多花黑麦草特高和多年生黑麦草四季2个品种高效组培再生及农杆菌介导的遗传转化体系的基础上,以2个黑麦草贵州主栽品种的成熟种子为外植体,通过胚性愈伤组织的诱导培养与根癌农杆菌EHA105介导的遗传转化,克隆自高羊茅与抗逆功能相关的S-腺苷甲硫氨酸脱羧酶基因(FaSAMDC)被导入多花黑麦草特高和多年生黑麦草四季的基因组内。经抗性筛选、PCR检测和Southern blot分析,确证获得45株特高和44株四季转基因阳性株系,转化频率分别达到2.93%和2.28%。在30 ℃高温和中度干旱胁迫条件下,2个品种转基因植株的根冠比与非转基因组培对照苗的差异达到显著水平(P<0.05),叶片相对含水量则呈现出极显著差异(P<0.01);经高温干旱胁迫后,特高与四季转基因株系叶片相对含水量的降低幅度比对照植株分别少出5.49%和6.50%,证明转入FaSAMDC基因阳性株系的抗旱耐热能力在出发材料的基础上得到了明显提高。与非转基因对照植株相比,转基因株系的叶长、叶宽、叶片颜色、主茎节数、株高、单株分蘖数及植株形状均有所变化,推测导入的FaSAMDC基因参与了植株体内基因表达、细胞分裂等生理功能的调节。性状改良试验达到了通过遗传转化获得抗旱耐热性增强的黑麦草种质新材料的研究目的。
References:
[1] Healy M G, Ryan P C, Fenton O,etal. Bioaccumulation of metals in ryegrass (LoliumperenneL.) following the application of lime stabilised, thermally dried and anaerobically digested sewage sludge. Ecotoxicology and Environmental Safety, 2016, 130: 303-309.
[2] Xie H W, Xu Q G, Li Y. Research progress of genetic breeding of high temperature resistance stress and drought resistance ofLoliumperenne. Crop Research, 2011, 25(1): 89-94.
[3] Dalton S J. Plant regeneration grom cell suspension protoplasts ofFestucaarundinaceaSchreb.(tall fescue) andLoliumperenneL. (perennial ryegrass). Journal of Plant Physiology, 1988, 132: 170-175.
[4] Wang Z Y, Nagel J, Potrykus L,etal. Plant from suspension cell-derived protoplasts inLoliumspecies. Plant Science, 1993, 94: 179-193.
[5] Dalton S J, Beitany A J E, Timms E,etal. Transgenic plants ofLoliummultiflorum,Loliumperenne,FestucaarundinaceaandAgrostisstoloniferaby silicon carbede fibre-mediated transformation of cell suspension cultures. Plant Science, l998, 132: 31-43.
[6] Spangenberg G, Wang Z Y, Wu X L. Transgenic perennial ryegrass (LoliumperenneL.) plants from microprojectile bombardment of embryogenic suspension cells. Plant Science, 1995, 108: 209-217.
[7] Liu P, Zhang Z X, Su Q,etal. TransgenicLoliumperenneL.applyingAgrobacterium-mediated gene transfer. Acta Scientiarum Naturalium Universitatis Sunyatseni (Natural Science Edition), 2005, 44(3): 126-128.
刘萍, 张振霞, 苏乔, 等. 应用农杆菌介导法的多年生黑麦草遗传转化研究. 中山大学学报(自然科学版), 2005, 44(3): 126-128.
[8] Wang Q L, He J G, Chen Y L,etal. Establishment of anAgrobacterium-mediated transformation system forLoliumperenneL. Journal of Agricultural Science and Technology, 2009, 11(2): 119-123.
王奇丽, 何近刚, 陈彦龙, 等. 农杆菌介导多年生黑麦草转化体系的建立. 中国农业科技导报, 2009, 11(2): 119-123.
[9] Bhavna W, Manchikatla V R. Effect of increased polyamine bioxynthesis on stress responses in transgenic tobacco by introduction of human S-adenosybnethionine gene. Plant Science, 2003, 164(5): 727-734.
[10] Hao Y J, Zhang Z, Kitashiba H,etal. Molecular clotting and functional characterization of two apple S-adenosylmethionine decarboxylase genes and their different expression in fruit development, cell growth and stress responses. Gene, 2005, 350(1): 41-50.
[11] Wi S J, Kim W T, Park K Y. Overexpression of carnation S-adenosylmethionine decarboxylase gene generates a broad-spectrum tolerance to abiotic stresses in transgenic tobacco plants. Plant Cell Reports, 2006, 25(10): 1111-1121.
[12] Peremarti A, Bassie L, Christou P,etal. Spermine facilitates recovery from drought but does not confer drought tolerance in transgenic rice plants expressingDaturastramoniumS-adenosylmethionine decarboxylase. Plant Molecular Biology, 2009, 70(3): 253-264.
[13] Hazarika P, Rajam M V. Biotic and abiotic stress tolerance in transgenic tomatoes by constitutive expression of S-adenosylmethionine decarboxylase gene. Physiology and Molecular Biology of Plants, 2011, 17(2): 115-128.
[14] Zeng Q F, Yang C Y, Li X D,etal. Cloning ofSAMDCgene fromFestucaarundinaceaQiancao No.1 and construction of its plant expression vector. Pratacultural Science, 2015, 32(8): 1237-1242.
曾庆飞, 杨春燕, 李小冬, 等. 高羊茅黔草1号SAMDC基因的克隆及植物表达载体的构建. 草业科学, 2015, 32(8): 1237-1242.
[15] Hu H G, Liu J X. Morphological mechanisms of drought resistance ofZoysiaWilld. Acta Agrestia Sinica, 2008, 16(1): 94-96.
胡化广, 刘建秀. 结缕草属植物抗旱形态机理(简报). 草地学报, 2008, 16(1): 94-96.
[16] Zheng M N, Li X L, Wan L Q,etal. Physiological responses to drought stress of warm-season forage grasses. Chinese Agricultural Science Bulletin, 2009, 25(9): 114-119.
郑敏娜, 李向林, 万里强, 等. 四种暖季型禾草对水分胁迫的生理响应. 中国农学通报, 2009, 25(9): 114-119.
[17] Bettany A J, Dalton S J, Timms E,etal.Agrobacteriumtumefaciens-mediated transformation ofFestucaarundinacea(Schreb.) andLoliummultiflorum(Lam.). Plant Cell Reports, 2003, 21(5): 437-444.
[18] Altpeter F. Perennial ryegrass (LoliumperenneL.). Methods in Molecular Biology, 2006, 344: 55-64.
[19] Bajaj S, Ran Y, Phillips J,etal. A high throughputAgrobacteriumtumefaciens-mediated transformation method for functional genomics of perennial ryegrass (LoliumperenneL.). Plant Cell Reports, 2006, 25(7): 651-659.
[20] Chen C H, Chuan X J, Wang H,etal. Factors affecting gegetic transformation efficiency for stylo (Stylosanthesguianensis) withAgrobacteriumtumefaciens. Acta Prataculturae Sinica, 2016, 25(6): 102-108.
陈彩虹, 钏秀娟, 王荟, 等. 农杆菌侵染条件对柱花草遗传转化效率的影响. 草业学报, 2016, 25(6): 102-108.
[21] Yi Z L, Chen Z Y, Jiang J X,etal. Establishment of a transformation system and acquisition of transgenic plants forLoliumperenne. Acta Prataculturae Sinica, 2006, 15(4): 99-103.
易自力, 陈智勇, 蒋建雄, 等. 多年生黑麦草遗传转化体系的建立及其转化植株的获得. 草业学报, 2006, 15(4): 99-103.
[22] Hu K, Yan X F, Li D,etal. Genetic improvement of perennial ryegrass with low lignin content by silencing genes ofCCRandCAD. Acta Prataculturae Sinica, 2013, 22(5): 72-83.
胡可, 严雪锋, 栗丹, 等. 沉默CCR和CAD基因培育低木质素含量转基因多年生黑麦草. 草业学报, 2013, 22(5): 72-83.
[23] Hu F R. Optimization ofAgrobacterium-mediated transformation of tall fescue (FestucaarundinaceaSchreb.). Molecular Plant Breeding, 2005, 3(3): 375-380.
胡繁荣. 农杆菌介导的高羊茅遗传转化体系的优化. 分子植物育种, 2005, 3(3): 375-380.
[24] Qiao D J, Mao P, Ma X R,etal. The effects of mannitol and AgNO3for perennial ryegrass transformation mediated byAgrobacteriumtumefaciens. Acta Prataculturae Sinica, 2011, 20(1): 102-110.
乔定君, 毛萍, 马欣荣, 等. 甘露醇及AgNO3对根癌农杆菌介导的多年生黑麦草遗传转化的影响. 草业学报, 2011, 20(1): 102-110.
[25] Zhao J S, Zhi D Y, Xue Z Y,etal. Research onFestucaarundinaceatransformation mediated byAgrobacteriumtumefaciens. Acta Genetica Sinica, 2005, 32(6): 579-585.
赵军胜, 支大英, 薛哲勇, 等. 根癌农杆菌介导的高羊茅遗传转化研究. 遗传学报, 2005, 32(6): 579-585.
[26] Li W R, Zhang S Q, Ding S Y,etal. Root morphological variation and water use in alfalfa under drought stress. Acta Ecologica Sinica, 2010, 30(19): 5140-5150.
[27] Wang X L, Liu X X, Wang S Y,etal. Cloning and differential expression analysis of S-adenosylmethionine decarboxylase geneFaSAMDCin tall rescue. Acta Prataculturae Sinica, 2011, 20(4): 169-179.
王小利, 刘晓霞, 王舒颖, 等. 高羊茅腺苷甲硫氨酸脱羧酶基因FaSAMDC的克隆与差异表达分析. 草业学报, 2011, 20(4): 169-179.
[28] Peng L M, Cao L, Han L,etal. Drought resistance analysis of regegerated plants from calli ofLoliumperennecarried by the Shenzhou No.7 spaceship. Acta Prataculturae Sinica, 2015, 24(1): 64-71.
彭丽梅, 曹丽, 韩蕾, 等. 多年生黑麦草愈伤组织航天搭载后再生株系的抗旱性研究. 草业学报, 2015, 24(1): 64-71.
[29] Guo H, Zhu F R, Hu H B. Analysis on drought resistant of 5 landscape plants. Southwest China Journal of Agricultural Sciences, 2014, 27(5): 2151-2155.
郭晖, 朱凤荣, 胡海波. 5种园林植物抗旱性分析. 西南农业学报, 2014, 27(5): 2151-2155.
[30] Zhang J J, Ding S L, Zou Y J,etal. Research advance on S-adenosylmethionine decarboxylase in plants. Chinese Journal of Cell Biology, 2008, 30: 622-628.
张佳景, 丁淑丽, 邹宜静, 等. 植物腺苷甲硫氨酸脱羧酶研究进展. 细胞生物学杂志, 2008, 30: 622-628.
EnhancingdroughtandheattoleranceinLoliumspp.throughoverexpressionoftheFaSAMDCgene
ZENG Qing-Fei, WEI Xin, CAI Yi-Ming, SHU Jian-Hong, WU Jia-Hai, WANG Xiao-Li*
GuizhouInstituteofPrataculture,GuizhouAcademyofAgriculturalSciences,Guiyang550006,China
To obtain new ryegrass germplasm with enhanced drought and heat tolerance a genetic transformation experiment using plants from the genusLoliumwas conducted. By using mature seeds of ryegrass as explants and adoption of the overexpression vector,tissue culture and regeneration system of ryegrass, and genetic transformation mediated byAgrobacteriumtumefaciens, the S-adenosylmethionine decarboxylase gene cloned fromFestucaarundinacea(FaSAMDC) was introduced into the genome of ‘Tetragold’ annual ryegrass and ‘Four Seasons’ perennial ryegrass. Eighty-nine transgenic plants (45 Tetragold and 44 Four Seasons) were regenerated from independent resistant calli, which were confirmed by antibiotic resistance screening, PCR assay and southern hybridization analysis; the transgenic frequency was 2.93% and 2.28%, respectively. Drought and heat resistant tests under high temperature (30 ℃) and moderate drought stress showed that in Tetragold, the root to shoot ratio was 7.1% higher, leaf relative water content (RWC) 13.1% higher and the RWC descent scope 5.5% lower than the controls; for transgenic Four Seasons plants the root to shoot ratio was 6.5% higher, RWC 12.5% higher and the RWC descent scope 6.5% lower than the control; differences between transgenic plants and controls were all statistically significant (P<0.05), indicating that drought and heat resistance in transgenic plants was significantly improved. Observations of morphological and growth characteristics showed that, compared with non-transgenic plants, leaf length, plant height and main stalk pitch number of transgenic plants were lower but leaf width and tiller number per plant were higher. Leaves of transgenic plants were darker in colour and plants tended to become compact with tufted leaves suggesting that the insertedFaSAMDCgene was involved in the regulation of physiological function, such as gene expression and cell division. The transgenic material developed in the study could be used as foundation for the cultivation of new ryegrass varieties with enhanced drought and heat resistance.
ryegrass;Agrobacteriumtumefaciens; genetic transformation;FaSAMDCgene; drought and heat tolerance
10.11686/cyxb2017208http//cyxb.lzu.edu.cn
曾庆飞, 韦鑫, 蔡一鸣, 舒健虹, 吴佳海, 王小利. 过表达FaSAMDC基因提高黑麦草属植物的抗旱性和耐热性. 草业学报, 2017, 26(12): 117-127.
ZENG Qing-Fei, WEI Xin, CAI Yi-Ming, SHU Jian-Hong, WU Jia-Hai, WANG Xiao-Li. Enhancing drought and heat tolerance inLoliumspp. through overexpression of theFaSAMDCgene. Acta Prataculturae Sinica, 2017, 26(12): 117-127.
2017-05-02;改回日期:2017-07-03
贵州省农业科技攻关项目(黔科合NY[2013]3060号),贵州省农业科学院博士科研启动基金(2013-06),黔农科院自主创新科研专项[(2014)010号],贵州省高层次创新型人才培养项目(黔科合人才[2016]4024)和贵州省科技创新人才团队建设项目(黔科合平台人才[2016]5617)资助。
曾庆飞(1969-),男,贵州德江人,副研究员,博士。E-mail:zengqingfei2008@163.com*通信作者Corresponding author. E-mail:wangxiaolizhenyuan@126.com
