基于石墨烯纳米材料的水质Cr(Ⅵ) 电化学传感器
2017-12-22李玥琪胡敬芳邹小平高国伟
李玥琪,胡敬芳,邹小平,高国伟,
(1北京信息科技大学自动化学院,北京 100192;2北京信息科技大学传感器重点实验室,北京 100101)
基于石墨烯纳米材料的水质Cr(Ⅵ) 电化学传感器
李玥琪1,胡敬芳2,邹小平2,高国伟1,2
(1北京信息科技大学自动化学院,北京 100192;2北京信息科技大学传感器重点实验室,北京 100101)
针对我国水质重金属六价铬(Cr(Ⅵ))污染问题突出,提出了一种基于石墨烯纳米材料的水质 Cr(Ⅵ)电化学传感器。采用电化学方法还原氧化石墨烯,构建石墨烯纳米材料修饰金电极(rGO/Au)。采用扫描电子显微镜(SEM)和透射电子显微镜(TEM)技术表征了rGO/Au的表面形貌和结构;采用方波伏安法、循环伏安法和线性扫描伏安法等电化学方法研究了Cr(Ⅵ)在rGO/Au表面的直接电催化还原行为,优化了氧化石墨烯的电化学还原电位和还原时间,以及支持电解质pH、浓度和检测电位等实验参数;采用计时电流法,在无须预富集的条件下,考察了Cr(Ⅵ)浓度与rGO/Au响应电流之间的线性关系。实验结果表明,石墨烯纳米材料对Cr(Ⅵ)有明显的电催化还原活性,计时电流响应值与 Cr(Ⅵ)浓度呈良好的线性关系,线性范围为 5~2000 μg·L-1,最低检测限为 0.5 μA·L-1(S/N≥3)。所制备的 rGO/Au 具有对常见其他重金属干扰离子(Cr(Ⅲ)、Ni(Ⅱ)、Cu(Ⅱ)、Mg(Ⅱ)和 Mn(Ⅱ))较好的抗干扰性能,11次连续测定后,响应值相对初始值下降幅度小于10%,表明该修饰电极具有较好的稳定性。本研究提出的电化学传感器具有检测方法简单、快速、环保以及可重复使用的优点,能够应用于水质重金属Cr(Ⅵ)的快速测定。
石墨烯;纳米材料;重金属Cr(Ⅵ);电催化还原;电化学;传感器
引 言
铬在现代工业的电镀、冶金、制革、染色、颜料等行业中被广泛应用。工厂废水、废气排放中所含的铬对环境造成了污染,是环境监测的必测项目之一[1]。铬常见的化合物价态有三价铬 Cr(Ⅲ)和六价铬 Cr(Ⅵ),Cr(Ⅵ)的毒性比 Cr(Ⅲ)高 100~1000倍,Cr(Ⅵ)易被人体吸收,在体内蓄积,抑制酶活性,干扰蛋白质、核糖核酸的合成,导致癌症[2]。因此水中Cr(Ⅵ)的检测对环境保护和人类健康具有十分重要的意义。世界卫生组织(WHO)规定水中Cr(Ⅵ)的限量标准为 50 μg·L-1[3]。中国国家标准 GB 3838—2002限定地表水质Ⅰ~Ⅴ类Cr(Ⅵ)的浓度标准为 10~100 μg·L-1[4]。因此,水质重金属 Cr(Ⅵ)检测具有重要意义。
水环境重金属Cr(Ⅵ)现有的检测方法包括原子吸收光谱测试法[5]、色谱分析法[6]、荧光分析法[7]、紫外-可见分光光度法[8]和质谱分析法[9]等,这些方法需要大量复杂的处理手段、检测时间长、仪器大型昂贵且在检测过程中容易造成二次污染。相比较而言,电化学检测方法[10]具有灵敏度高、表征信息丰富、体积微型化、成本低、操作简单以及易于实现自动化等优点,已经被广泛应用于检测与分析各种重金属离子,如铜 Cu(Ⅱ)[11]、铅 Pb(Ⅱ)[12]和镉Cd(Ⅱ)[12]等。早期电化学检测 Cr(Ⅵ)大部分采用汞电极,在络合剂的作用下对Cr(Ⅵ)进行检测与分析。尽管汞电极灵敏度高,重现性好,但由于其具有毒性,被很多国家地区限制甚至禁止使用。不同的电极材料,如金[13]、铋[14]、碳糊[15]、丝印碳电极[16]、玻碳电极[17]等,被开发应用于Cr(Ⅵ)的检测,但这些电极材料检测时通常需要预富集过程,导致检测周期长。化学修饰电极作为一种新兴技术进入到广大研究工作者的视线,通过共价键合、吸附、聚合等手段有目的地将具有特殊功能性的物质引入电极表面,使电极具备新的特定功能。这一技术应用于六价铬的检测有许多成功例子,如金膜修饰碳复合电极[18]、银纳米颗粒覆盖金纳米多孔膜修饰电极[19]等。
石墨烯是一种由碳原子通过 sp2杂化而形成的具有二维蜂窝网状结构的新型碳纳米材料。其拥有超大比表面积、超高载流子迁移率、优良的化学稳定性以及和其他纳米材料或生物材料兼容性好等优异的物理性能,使它成为电化学、电催化和生物传感器等领域的研究热点。目前有研究小组曾尝试将石墨烯纳米材料用于Cr(Ⅵ)检测,如石墨烯聚苯胺复合材料修饰电极[20]和石墨烯/金纳米复合材料修饰电极[21]均取得了较满意的效果。然而研究石墨烯单一纳米材料对 Cr(Ⅵ)的电化学检测还鲜见报道。
石墨烯纳米的合成制备方法主要有机械剥离法[22]、外延生长法[23]、化学气相沉积法[24]和化学合成法[25]等,这些方法需要复杂的工艺过程、昂贵的成本,并且生产出的石墨烯难以控制形貌、稳定性差、不适合宏量制备。电化学还原氧化石墨/氧化石墨烯(graphite oxide/graphene oxide)是利用氧化石墨烯(GO)在水溶液中带负电荷,在电场作用下,向工作电极移动,并在一定的电位条件下,还原沉积到工作电极上,只需在常温条件下,无须添加有毒还原剂,借助简单的电化学设施就可以实现[26]。所以,电化学还原GO是一种简单、成本较低、绿色快速且能大批量制备的石墨烯制备方法。
因此,本文提出了一种基于石墨烯纳米材料的水质Cr(Ⅵ)电化学传感器,采用电化学还原GO的方法,构建石墨烯纳米材料修饰金电极(rGO/Au)研究 Cr(Ⅵ)在 rGO/Au表面的电化学行为,在无须预富集条件下,采用计时电流法测定水质Cr(Ⅵ)浓度。
1 实验部分
1.1 Cr(Ⅵ)电化学检测原理
实验中水质重金属Cr(Ⅵ)电化学检测原理是:采用计时电流法控制电压为一固定值(-0.8~-1.4 V),此时Cr(Ⅵ)在修饰电极表面发生电化学还原反应,反应方程式[17]如下

通过记录5个不同标准浓度(c)样品相应的还原电流响应值(i),得到i与c之间的线性关系,并绘制i-c标准曲线,记录未知浓度样品的电流响应值,根据i-c标准曲线计算得到待测样品中Cr(Ⅵ)的浓度值。
1.2 实验仪器和试剂
氧化石墨烯粉末(graphene oxide powder,99.9%)购于阿拉丁公司。高氯酸锂(LiClO4)、铁氰化钾(K3[Fe(CN)6])、重铬酸钾(K2CrO4)均购于国药集团化学试剂有限公司,使用前均未进一步纯化;氢氧化钠(NaOH)、氯化钾(KCl)、浓盐酸(HCl,37%)、浓硫酸(H2SO4,95%)、硝酸铬(Cr(NO3)3)、七水合硫酸镁(MgSO4·7H2O)、硫酸锰(MnSO4)、六水合硫酸镍(NiSO4·6H2O)、九水合硫酸铜(CuSO4·9H2O)均购于西陇化工股份有限公司。pHS-3C型数字化pH计(上海洛奇特电子设备有限公司)。所有的电化学实验均利用CHI630E电化学分析仪(上海辰华仪器公司)完成。工作电极为还原氧化石墨烯修饰的金电极,参比电极和辅助电极分别为 Ag/AgCl(3 mol·L-1KCl)电极和铂电极。超声波清洗器购自深圳市洁盟清洗设备有限公司。Cr(Ⅵ)标准溶液(3000 μg·L-1)用 K2CrO4配制,支持电解质为 HCl,用时按需稀释。所用试剂均为分析纯或优质纯,实验用水为去离子水。
1.3 修饰电极的制备
将金电极在附有 Al2O3粉末的麂皮上抛光,轨迹呈“8”字形,抛光后依次分别在丙酮、乙醇、去离子水中超声 5 min,再用超纯水冲洗,吹干电极后,将电极置于0.1 mol·L-1H2SO4的电解质溶液,循环伏安法设置在0~0.6 V之间扫描12圈用以活化电极表面。
在3.0 mg·ml-1的氧化石墨烯水溶液中加入0.1 mol·L-1高氯酸锂作为支持电解质,利用恒电位-1.2 V沉积,沉积时间为25 min。将沉积好的rGO/Au于去离子水中提拉3~5次,以除去吸附的GO和高氯酸锂,置于去离子水中保存,即制得石墨烯修饰电极。
1.4 电化学测定Cr(Ⅵ)
以修饰电极为工作电极,Ag/AgCl(3 mol·L-1KCl)和铂电极分别为参比电极和对电极,将Cr(Ⅵ)标准溶液按照 5、10、20、50、100、500、1000、1500、2000 μg·L-1浓度稀释,制成不同浓度样品。采用计时电流法,设置还原电位为0.35 V,还原时间为300 s,分别测定不同浓度样品溶液,记录i-t曲线,测量250~300 s之间响应电流均值。所有实验均在室温下进行。
2 结果与讨论
2.1 石墨烯纳米材料的SEM、TEM和XPS表征
对新制备的 rGO/Au的表面形貌进行表征,SEM图是拍摄完整的修饰电极表面,用于拍摄TEM图和 XPS谱图的是从修饰电极表面剥落后的沉积的石墨烯样品。从图 1(a)可以看出在电极表面形成了致密均匀的膜,表面起伏不大,有极少的缺陷空洞;图1(b)显示堆叠的石墨烯片层;图1(c)中可以清楚地看到近乎透明的石墨烯薄层的边缘,其中的小黑点可能是石墨烯片层褶皱叠加而形成的;图1(d)左下角是石墨烯薄层边缘有轻微卷曲。

图1 rGO/Au修饰电极的SEM和TEM图Fig.1 SEM and TEM images of rGO/Au modified electrode
从氧化石墨烯粉末GO的C1s XPS谱图(图2)可以看出存在多种碳原子成键方式,其中,峰1(284.6 eV)、2(285 eV)、3(287 eV)、4(289.3 eV)分别对应碳碳单键和双键环氧基和烷氧基(C—O)、羰基羧基(—COOH)这4种官能团。经过电沉积后C—C的峰强增加,而羰基的峰强度明显减弱,这与文献[27]中还原电位约为-1.3 V时易被还原,O—H和C—O—C不易被还原的实验现象一致,说明电沉积法能够去除部分含氧官能团,使得含氧峰减弱,GO得到部分还原。
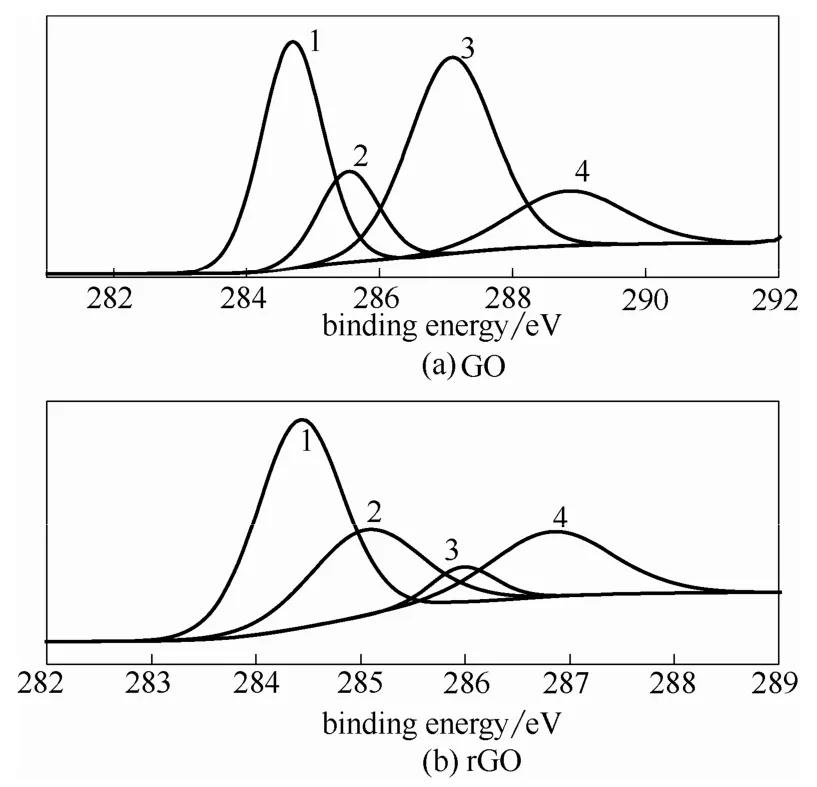
图2 GO和rGO的C1s XPS谱图Fig.2 XPS spectra of GO and rGO
2.2 制备条件对石墨烯纳米材料的影响
图3是金电极在稳定的GO溶液中循环伏安曲线,从图中可看到在-0.65 V处出现了非常明显的还原峰,说明GO在-0.65 V处被还原成石墨烯。
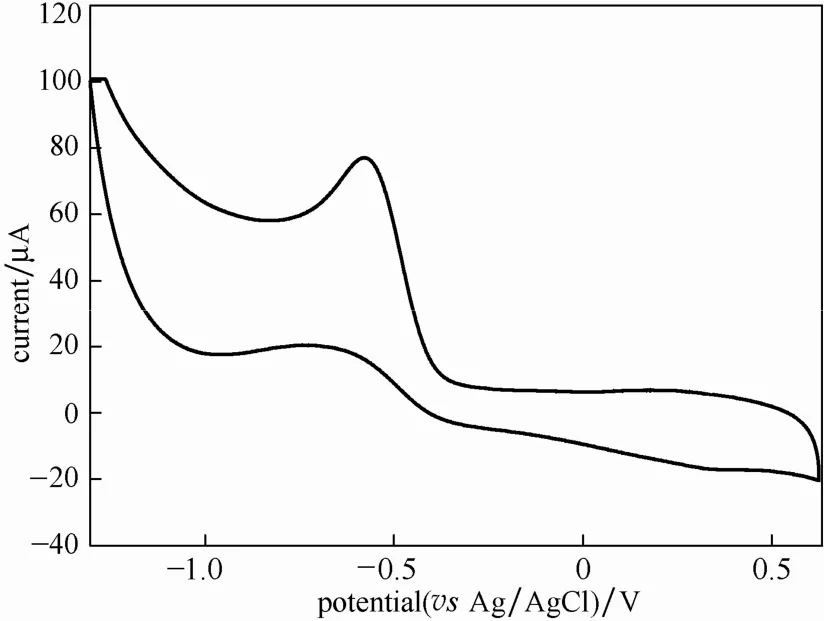
图3 氧化石墨烯溶液的循环伏安曲线Fig.3 Cycling voltammetry in graphene oxide suspension
文献[27]认为恒电位还原 GO时,将电位设置为比还原峰电位更负的值,这样可以增强还原程度,减少反应时间。因此,还原电位分别设置为-0.8、-1.2和-1.4 V。图4是在不同还原电位下得到的修饰电极在浓度为1 mmol·L-1铁氰化钾溶液中循环伏安(CV)响应曲线的还原峰值和氧化峰值的对比,结果表明,还原电位为-1.2 V得到的修饰电极在浓度为1 mmol·L-1铁氰化钾溶液中的CV氧化峰和还原峰电流值均最大,表明-1.2 V条件下得到的石墨烯纳米材料具有更好的电化学活性。因此,-1.2 V被选择作为制备石墨烯纳米材料的GO还原电位。
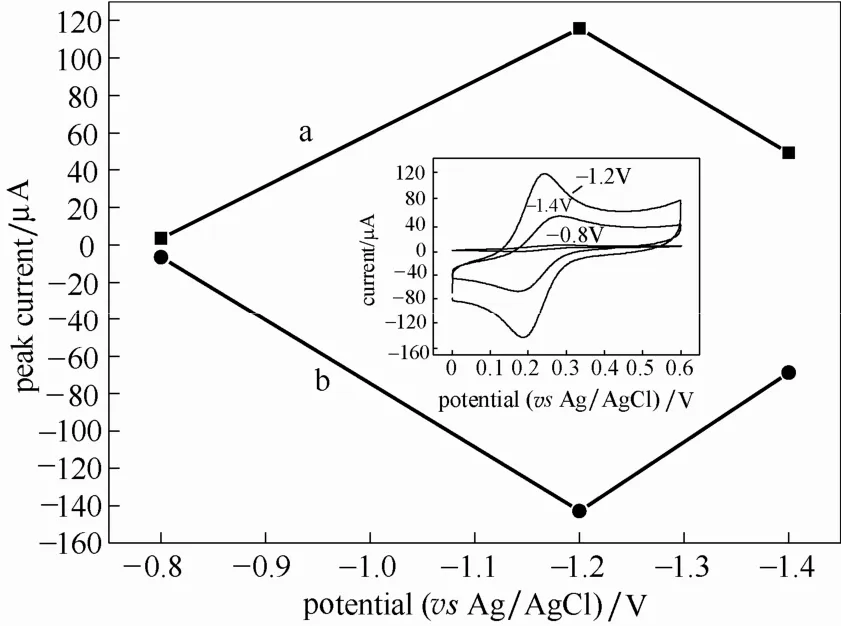
图4 还原电位的影响(内插图为不同还原电位制得的rGO/Au在1 mmol·L-1 K3[Fe(CN)6]溶液中的循环伏安曲线)Fig.4 Effect of reduction potential (inset:cycling voltammetry of rGO/Au obtained in different reduction potential in K3[Fe(CN)6]solution)
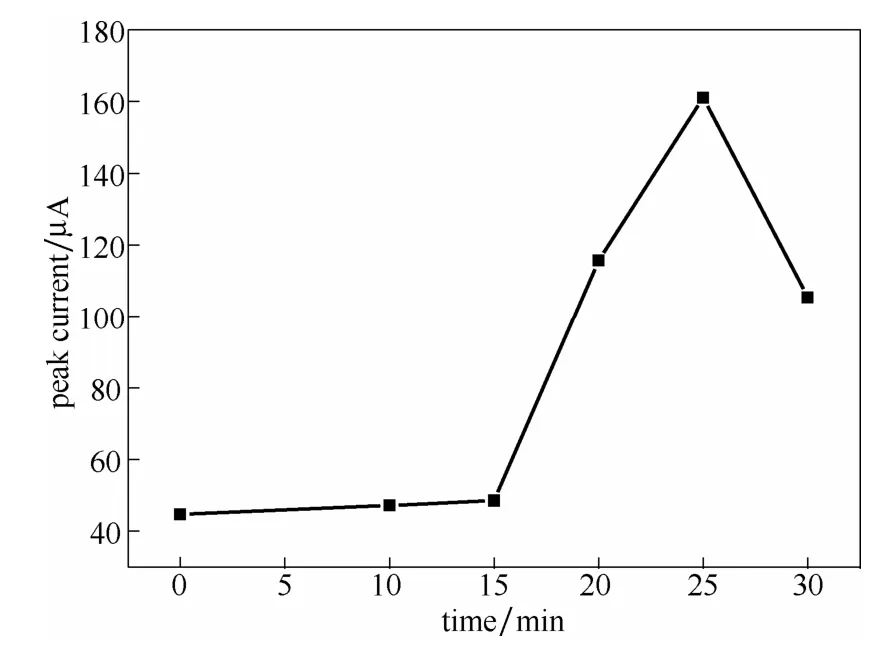
图5 电化学还原GO时间的影响Fig.5 Effect of GO electroreduction time
GO还原时间是制备石墨烯纳米材料另一个重要参数。采用 CV法研究了不同还原时间下得到rGO/Au的电极特性。图5为以浓度1 mmol·L-1铁氰化钾溶液作为表征溶液,记录不同还原时间下rGO/Au的CV曲线的还原峰电流值。从图中可以看出,在0~25 min内随着时间的增长,[Fe(CN)6]3-还原峰电流值不断增加,然而当时间达到 30 min时,修饰电极的[Fe(CN)6]3-还原峰电流值下降。分析原因认为,随着GO还原时间的延长,沉积在电极表面的石墨烯纳米材料就不断增加,石墨烯层与层之间靠强烈的π-π键相互作用堆叠起来[28],可有效增加电极表面的比表面积和电子传输率,电极活性增强,电流响应增大,而当修饰膜高于一定厚度时,电极表面修饰膜会阻碍电子扩散,电极活性降低,电流响应减小[29]。因此,25 min被选择作为GO还原时间。
2.3 修饰电极有效面积的测定
对沉积的还原产物进行了BET测试,石墨烯纳米材料的比表面积为142.42 m2·g-1。尽管比表面积较理论值而言相对较小,但是修饰电极确实增加了电极的有效面积。根据Randles-Sevcik方程采用循环伏安法测定石墨烯修饰电极的有效面积
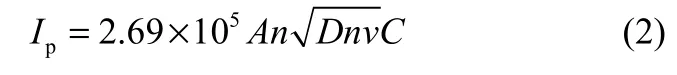
式中,n为氧化还原对的半反应中存在的电子数,[Fe(CN)6]3-/4-,n=1;v是电压扫描速率,50 mV·s-1;A是工作电极的有效面积,cm2;D是[Fe(CN)6]3-/4-的扩散系数,D=6.057×10-6cm2·s-1(298 K);C为[Fe(CN)6]3-/4-的浓度;Ip为[Fe(CN)6]3-/4-的氧化还原反应峰电流值。石墨烯修饰电极和裸电极在 K3[Fe(CN)6]溶液中扫描的循环伏安曲线的还原峰电流值分别为 18.98 μA和 6.30 μA。经计算得,修饰电极表面积和裸电极的有效面积分别是4.06 cm2和1.35 cm2。
2.4 Cr(Ⅵ)在修饰电极上的电化学行为
图6所示为裸金电极(a)和修饰电极rGO/Au(b)在含有 2000 μg·L-1Cr(Ⅵ)的电解质溶液中的方波伏安曲线。从图中可以看出,裸金电极呈现一条平缓无峰的曲线,而rGO/Au在0.3 V左右出现了明显的还原峰。分析原因认为,电化学还原法制得的石墨烯能保存边缘和缺陷部位的部分含氧官能团[27],如羧基(—COOH)、羟基(—OH)和环氧基(C—O),这些官能团为 Cr(Ⅵ)提供了大量的吸附位点[20],增强了修饰电极对Cr(Ⅵ)的吸附能力,同时石墨烯纳米材料本身具有大的比表面积,高的载流子迁移速率可有效增加电极表面有效面积和电催化活性,提高Cr(Ⅵ)在电极表面的直接电催化还原能力。由图7可以看出,随着Cr(Ⅵ)浓度的增加,CV曲线的Cr(Ⅵ)还原峰值不断增大,表明rGO/Au对Cr(Ⅵ)检测的可能性。
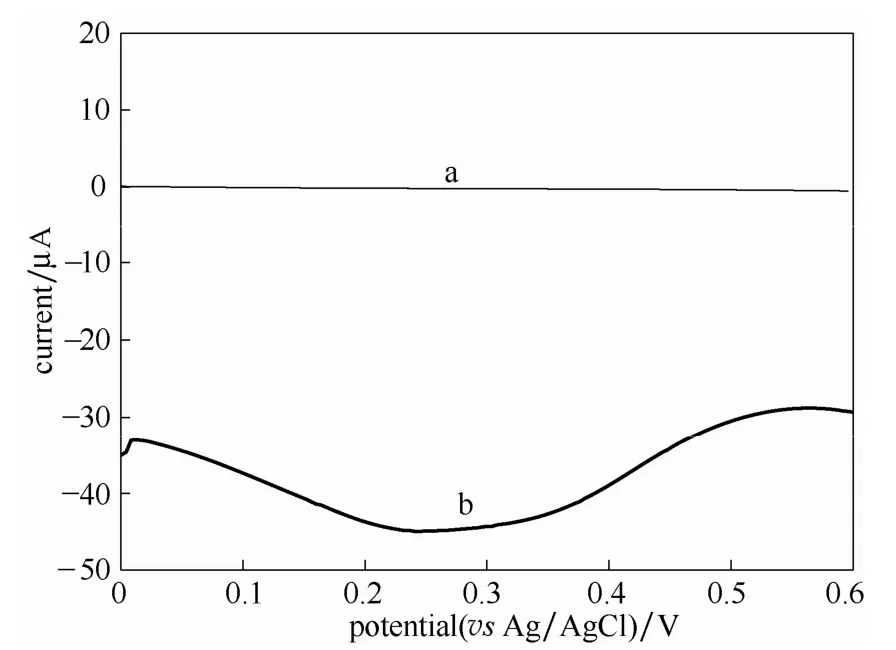
图6 Au and rGO/Au 在 2000 μg·L-1 Cr(Ⅵ)待测溶液中的方波伏安曲线Fig.6 Square wave voltammetry of Au(a) and rGO/Au(b)electrodes in electrolyte containing 2000 μg·L-1 Cr(Ⅵ)
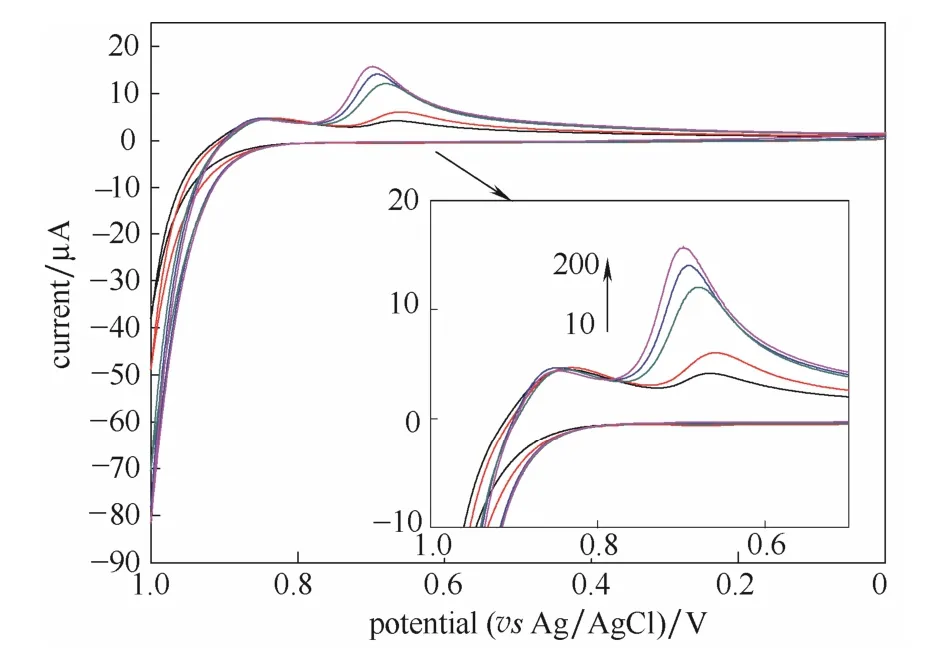
图7 Cr(Ⅵ)在浓度范围 10~200 μg·L-1时的循环伏安曲线(内插图为Cr(Ⅵ)还原峰局部放大)Fig.7 Cycling voltammetry of increasing concentration of Cr(Ⅵ) range from 10 to 200 μg·L-1 (inset is magnification of Cr(Ⅵ) reduction peak)
2.5 优化Cr(Ⅵ)检测实验条件
2.5.1 支持电解质浓度和 pH的影响 牛津大学Compton等[29]对不同支持电解质对Cr(Ⅵ)检测结果的影响做了对比实验,发现HCl作为支持电解质,检测效果佳,同时地表水中富含氯离子(Cl-),更接近真实水样环境,然而有研究人员发现当 Cl-浓度大于一定值时可能对 Cr(Ⅵ)有一定的干扰作用[30],因此,实验选择HCl为支持电解质,并针对Cl-浓度的干扰作用,对HCl浓度进行了优化。分别配制浓度为 0.001、0.01、0.1、0.5、1 mol·L-1的 HCl,依次加入等量Cr(Ⅵ)溶液,得到5种含有同样浓度的 100 μg·L-1Cr(Ⅵ)和不同浓度的 HCl混合测试溶液。修饰电极对 5种测试溶液进行线性扫描伏安(LSV)扫描,LSV曲线对Cr(Ⅵ)的还原峰值与空白溶液(不含Cr(Ⅵ)的HCl溶液)对应峰位电流值之差(ΔI)如表1所示,发现当HCl浓度在0.001~0.5 mol·L-1范围内时,ΔI随着HCl浓度的增加而增加,当HCl浓度增加到1 mol·L-1时,ΔI略有减小,这是因为随着 HCl浓度的增加,测试溶液中 H+浓度不断增加有利于Cr(Ⅵ)的还原[18],而当HCl浓度继续增加到 1 mol·L-1时,Cl-浓度对 Cr(Ⅵ)的电催化还原产生干扰,电流响应减小。所以选择 0.5 mol·L-1为支持电解质HCl的最优浓度。

表1 支持电解质浓度对反应的影响Table 1 Effect of electrolyte concentration on reduction reaction
由于 H+浓度是影响 Cr(Ⅵ)在水溶液中存在形式的重要因素[29],因此对测试溶液的pH进行了进一步考察。分别配制含有 100 μg·L-1Cr(Ⅵ)、0.5 mol·L-1Cl-且 pH 分别为 0.32(0.5 mol·L-1HCl的pH)、2、4、6、7、9、10这7种测试溶液,其他实验条件均与上相同,实验结果如图8所示,减去背景信号的还原峰电流差值(ΔI)在pH为0.32时达到最优,即0.5 mol·L-1HCl为测试最优pH。
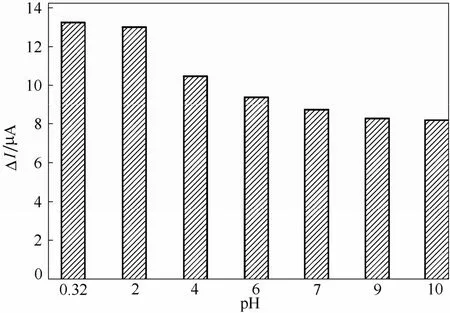
图8 支持电解质pH对ΔI的影响Fig.8 Effect of electrolyte pH on ΔI
2.5.2 检测电位的影响 实验表明,在选定的实验条件下,该修饰电极在0.3~0.4 V电位之间对Cr(Ⅵ)均出现较灵敏的电流响应,且重现性均较好,因而分别在 0.3、0.35、0.4 V 电位下做了 10~2000 μg·L-1的Cr(Ⅵ)的标准曲线,结果表明,在0.35 V时标准曲线的线性度和相关性最好,且在相同浓度时,i-t曲线电流值最大,因此选择0.35 V为最优的Cr(Ⅵ)检测电位。
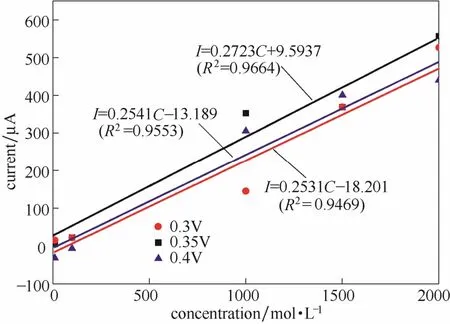
图9 不同检测电位下的标准曲线Fig.9 Corresponding standard addition curves in different working potential
2.6 电化学测定Cr(Ⅵ)
在无须预富集过程条件下,采用计时电流法对不同浓度进行电化学测定,考察该传感器对Cr(Ⅵ)测定的校准曲线、线性范围和最低检测下限。从图10可以看出,随着浓度的不断增大,还原电流值在不断地增加。在5~2000 μg·L-1浓度范围内,响应电流与Cr(Ⅵ)浓度呈良好的线性关系,线性回归方程为I=-2.0206+0.2796C,(I代表响应电流,C代表Cr(Ⅵ)浓度)相关系数为R2=0.9773,最低检测下限为 0.5 μg·L-1(S/N≥3),表明该传感器能够实现Cr(Ⅵ)的电化学测定。
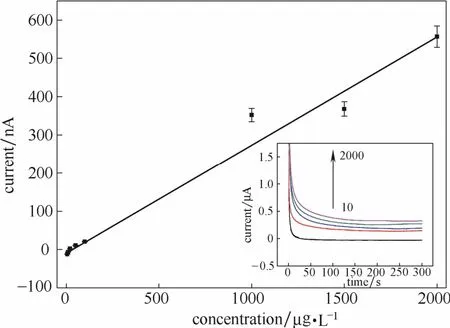
图10 还原峰电流与对应浓度的标准曲线(内插图为rGO/Au修饰电极连续测定不同浓度Cr(Ⅵ)的i-t曲线)Fig.10 Corresponding standard addition curve of Cr(Ⅵ)concentration and responding reduction peak current (inset is i-t curves obtained in different concentration on rGO/Au modified electrode)
2.7 抗干扰性和稳定性
水体中常有不同的共存离子,对Cr(Ⅵ)的还原有不同程度的影响。特别是三价铬,在一般水体中浓度是Cr(Ⅵ)的100多倍,同时还是Cr(Ⅵ)的还原产物,易对Cr(Ⅵ)产生干扰。在计时电流法检测过程中,分别加入不同浓度的干扰离子,以响应电流值与不含干扰离子的响应电流值的偏差来估计干扰程度。Cr(Ⅲ)、Mn(Ⅱ)的实验用量参考国家地表水环境质量标准(GB 3838—2002),Ni(Ⅱ)、Cu(Ⅱ)、Mg(Ⅱ) 的实验用量参考文献[29]中的实际水样中共存离子的值。上述离子造成的偏差均小于15%(图11),其中,100 μg·L-1Cr(Ⅵ)样品中加入浓度 100倍的三价铬,测量结果偏差约 7%,表明该传感器具有较好的抗干扰性能。
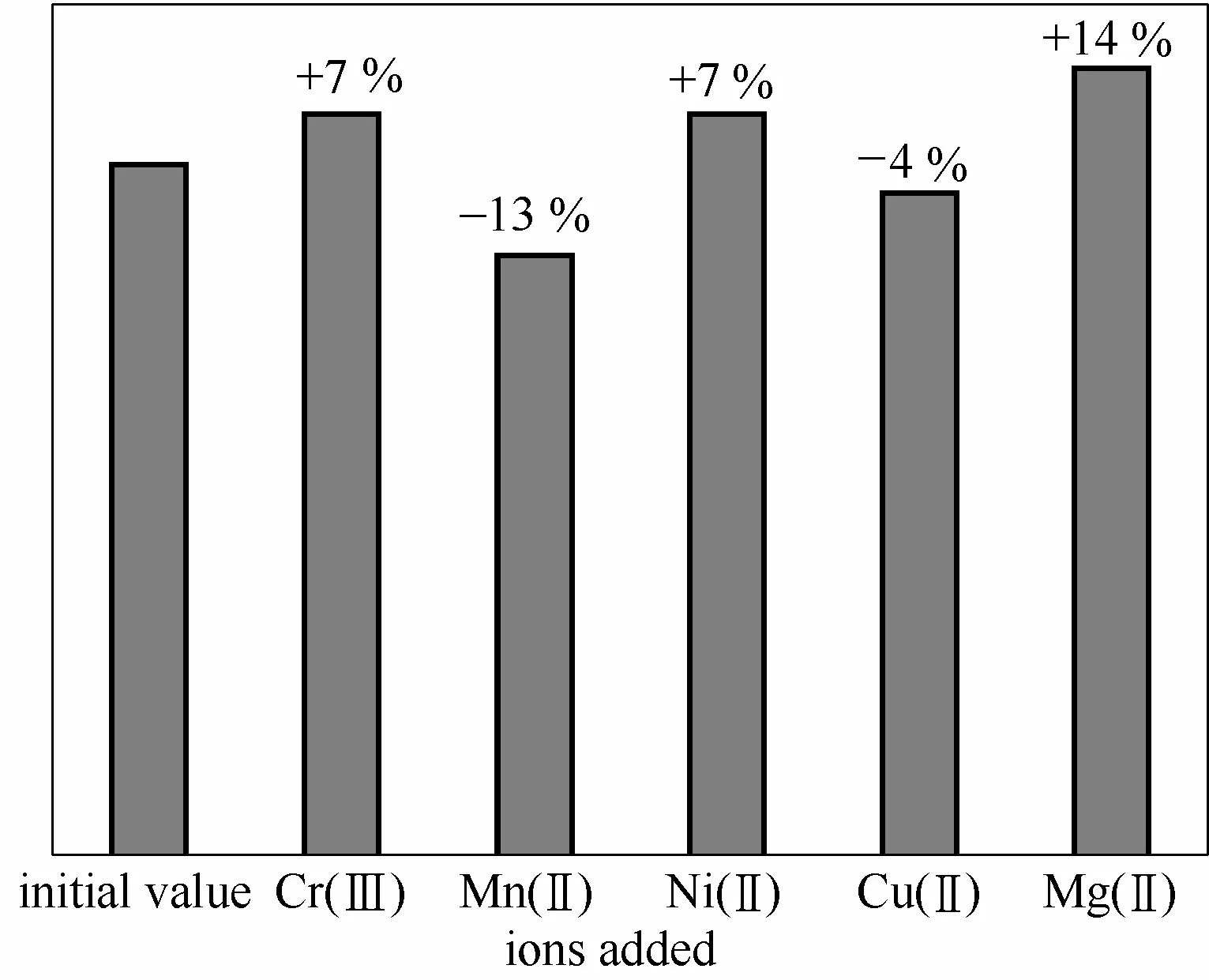
图11 抗干扰性的分析Fig.11 Analysis of anti-inference
对于电化学传感器的实际应用,其稳定性是一个重要的考察指标。图12是将修饰电极用于Cr(Ⅵ)(100 μg·L-1)的12次连续测量结果,数据表明在连续11次测量后,修饰电极电流响应降低幅度小于10%,说明此电极有较好的稳定性。
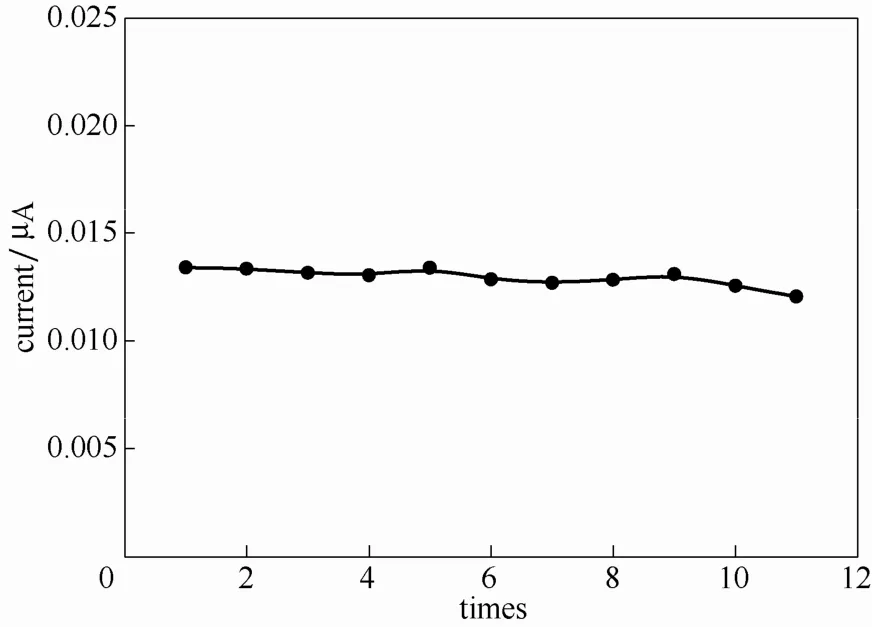
图12 稳定性的测定Fig.12 Measurement of stability
3 结 论
本文提出了一种电化学制备石墨烯纳米材料修饰电极,并将其成功应用于水质重金属Cr(Ⅵ)检测,构建了一种新型的基于石墨烯纳米材料的水质重金属Cr(Ⅵ)电化学传感器。实验发现,石墨烯纳米材料对Cr(Ⅵ)具有良好的电催化还原活性,能够增强电流响应,提高传感器灵敏度,改善了传感器的分析性能。结果表明,该传感器线性范围较宽(5~2000 μg·L-1),检测下限较低(0.5 μg·L-1),抗干扰性和稳定性较好。该传感器具有制备简单、检测快速、检测过程可控且环保等优点,有望应用于未来实际便携式检测应用。
[1]JIN W,ZHANG Z,WU G,et al.Integrated lignin-mediated adsorption-release process and electrochemical reduction for the removal of trace Cr( Ⅵ )[J].RSC Advances,2014,4(53):27843-27849.
[2]COSTA M.Potential hazards of hexavalent chromate in our drinking water.[J].Toxicology & Applied Pharmacology,2003,188(1):1-5.
[3]ORGANIZATION W H.Guidelines for drinking-water quality.Vol1,Recommendations:addendum[J].Guidelines for Drinking-water Quality,2006,38(3):104-108.
[4]康新平,刘洪海,陈坚.液体样品中铬的价态和微量分析方法的研究进展[J].理化检验(化学分册),1999,35(3):139-142.KANG X P,LIU H H,CHEN J.On the valency and progress of analytical method of chromium in water solution[J].PTCA(PART B:Chemical Analysis),1999,35(3):139-142.
[5]KREUZ B.Separation and determination of Cr(Ⅲ) and Cr(Ⅵ) with cation-exchange chromatography and atomic absorption spectroscopy.An experiment for quantitative methods of analysis[J].Journal of Chemical Education,2005,82(3):435-438.
[6]WILLIAMS T,JONES P,EBDON L.Simultaneous determination of Cr(Ⅲ) and Cr(Ⅵ) at ultratrace levels using ion chromatography with chemiluminescence detection[J].Journal of Chromatography A,1989,482(2):361-366.
[7]WANG L,XIA T,LIU J,et al.Preparation and application of a novel core/shell organic nanoparticle as a fluorescence probe in the selective determination of Cr(Ⅵ)[J].Spectrochimica Acta Part A Molecular &Biomolecular Spectroscopy,2005,62(1/2/3):565-569.
[8]LEVITSKAIA T G,O’HAR M J,SINKOV S I,et al.Direct spectrophotometric analysis of Cr(Ⅵ) using a liquid waveguide capillary cell[J].Applied Spectroscopy,2008,62(1):107.
[9]AND S M B,BRODBELT J S,MARCHAND A P,et al.Evaluation of binding selectivities of caged crown ligands toward heavy metals by electrospray ionization/quadrupole ion trap mass spectrometry[J].Analytical Chemistry,2000,72(11):2433-2445.
[10]BARD A J,FAULKNER L R.Electrochemical Methods:Fundamentals and Applications[M].Wiley,1980.
[11]WANG J,BIAN C,TONG J,et al.Microsensor chip integrated with gold nanoparticles-modified ultramicroelectrode array for improved electroanalytical measurement of copper ions[J].Electroanalysis,2013,25(7):1713-1721.
[12]LI J,ZHANG J,WEI H,et al.Combining chemical reduction with an electrochemical technique for the simultaneous detection of Cr(Ⅵ),Pb(Ⅱ) and Cd(Ⅱ)[J].Analyst,2009,134(2):273-277.
[13]JIN W,WU G,CHEN A.Sensitive and selective electrochemical detection of chromium (Ⅵ) based on gold nanoparticle-decorated titania nanotube arrays[J].Analyst,2014,139(1):235-241.
[14]LIN L,LAWRENCE N S,THONGNGAMDEE S,et al.Catalytic adsorptive stripping determination of trace chromium (Ⅵ) at the bismuth film electrode[J].Talanta,2005,65(1):144-148.
[15]SVANCARA I,FORET P,VYTRAS K.A study on the determination of chromium as chromate at a carbon paste electrode modified with surfactants[J].Talanta,2004,64(4):844.
[16]MISCORIA S A,JACQ C,MAEDER T,et al.Screen-printed electrodes for electroanalytical sensing,of chromium Ⅵ in strong acid media[J].Sensors & Actuators B Chemical,2014,195(5):294-302.
[17]CARRINGTON N A,YONG L,XUE Z L.Electrochemical deposition of sol-gel films for enhanced chromium (Ⅵ) determination in aqueous solutions[J].Analytica Chimica Acta,2006,572(1):17-24.
[18]KACHOOSANGI R T,COMPTON R G.Voltammetric determination of chromium (Ⅵ) using a gold film modified carbon composite electrode[J].Sensors & Actuators B Chemical,2013,178(178):555-562.
[19]HE X,ZHENG Q L,PING Y,et al.Electrochemical synthesis of silver nanoparticles-coated gold nanoporous film electrode and its application to amperometric detection for trace Cr(Ⅵ)[J].Science China:Chemistry,2011,54(6):1004-1010.
[20]YANG Y,DIAO M,GAO M,et al.Facile preparation of graphene/polyaniline composite and its application for electrocatalysis hexavalent chromium reduction[J].Electrochimica Acta,2014,132(19):496-503.
[21]SANTHOSH C,SARANYA M,RAMACHANDRAN R,et al.Graphene/gold nanocomposites-based thin films as an enhanced sensing platform for voltammetric detection of Cr(Ⅵ) ions[J].Journal of Nanotechnology,2014,DOI:org/10.1155/2014/304526.
[22]NOVOSELOV K S,JIANG D,SCHEDIN F,et al.Two-dimensional atomic crystals[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(30):10451-10453.
[23]CHARRIER A,COATI A,ARGUNOVA T,et al.Solid-state decomposition of silicon carbide for growing ultra-thin heteroepitaxial graphite films[J].Journal of Applied Physics,2002,92(5):2479.
[24]LI X,CAI W,AN J,et al.Large-area synthesis of high-quality and uniform graphene films on copper foils[J].Science,2009,324(5932):1312.
[25]EIGLER S,ENZELBERGERHEIM M,GRIMM S,et al.Wet chemical synthesis of graphene[J].Advanced Materials,2013,25(26):3583-3587.
[26]DENG S,LEI J,CHENG L,et al.Amplified electrochemiluminescence of quantum dots by electrochemically reduced graphene oxide for nanobiosensing of acetylcholine[J].Biosensors & Bioelectronics,2011,26(11):4552-4558.
[27]GUO H L,WANG X F,QIAN Q Y,et al.A green approach to the synthesis of graphene nanosheets.[J].ACS Nano,2009,3(9):2653-2659.
[28]CHEN K,CHEN L,CHEN Y,et al.Three-dimensional porous graphene-based composite materials:electrochemical synthesis and application[J].Journal of Materials Chemistry,2012,22(39):20968-20976.
[29]WELCH C M,NEKRASSOVA O,COMPTON R G.Reduction of hexavalent chromium at solid electrodes in acidic media:reaction mechanism and analytical applications[J].Talanta,2005,65(1):74-80.
[30]HALLAM P M,KAMPOUTIS D K,KADARA R O,et al.Graphite screen printed electrodes for the electrochemical sensing of chromium(Ⅵ)[J].Analyst,2010,135(8):1947.
date:2017-05-09.
Prof.HU Jingfang,jfhu@bistu.edu.cn
supported by the National Natural Science Foundation of China (9011610902) and the Science and Technology Project of Beijing Educational Committee (KM201611232021).
Graphene nanomaterial based electrochemical sensor for Cr(Ⅵ)detection in water
LI Yueqi1,HU Jingfang2,ZOU Xiaoping2,GAO Guowei1,2
(1Detectation Technology & Autodevicement,Beijing Information Science & Technology University,Beijing100192,China;2Key Laboratory of Sensor,Beijing Information Science & Technology University,Beijing100101,China)
The heavy metal ion pollution of hexavalent chromium (Cr(Ⅵ)) in water is serious in China.An electrochemical sensor for hexavalent chromium (Cr(Ⅵ)) detection is proposed based on graphene nanomaterial.The graphene nanomaterial modified gold electrode (rGO/Au) was prepared by using the method of electrochemical reduction of graphene oxide (GO).The surface morphology and structure of rGO/Au were characterized by scanning electron microscope (SEM) and transmission electron microscope (TEM) technologies.The direct electrocatalytic reduction of Cr(Ⅵ) on the surface of rGO/Au was studied by using electrochemical methods such as square wave voltammetry (SWV),cyclic voltammetry (CV) and linear sweep voltammetry (LSV),etc.The preparation conditions were optimized which include GO reduction potential and reduction time,as well as the detection parameters,such as detection potential,pH and concentration of electrolyte.Without preconcentration step,the linear relationship between Cr(Ⅵ) concentrations and current responses on the rGO/Au was investigated by using amperometry method.The experimental results showed that graphene nanomaterial has electrocatalytic activity for Cr(Ⅵ) reduction.A good linear relationship between Cr(Ⅵ) concentrations and current responses was obtained from 5 to 2000 μg·L-1,with a low detection limit of 0.5 μg·L-1(S/N≥3).The modified electrode was resistant to some common metal interference ions,such as Cr(Ⅲ),Ni(Ⅱ),Cu(Ⅱ),Mg(Ⅱ) and Mn(Ⅱ).And the response current decreased less than 10% compared to the initial value after 11 successive measures,which showed a relative good stability.The advantages of the proposed electrochemical sensor are simple,fast,friendly environmental and reusable,which made it possible to apply the sensor for rapid detection of Cr(Ⅵ) in water.
graphene; nanomaterial;heavy metal ion Cr(Ⅵ); electrocatalytic reduction; electrochemistry; sensor
TP 212.2
A
0438—1157(2017)12—4816—08
10.11949/j.issn.0438-1157.20170587
2017-05-09收到初稿,2017-08-21收到修改稿。
联系人:胡敬芳。
李玥琪(1990—),女,硕士研究生。
国家自然科学基金项目(9011610902);北京市教育委员会科技专项基金项目(KM201611232021)。
