驯化后的聚糖菌对和内源反硝化速率的影响
2017-12-22贾淑媛王淑莹赵骥李夕耀张琼彭永臻
贾淑媛,王淑莹,赵骥,李夕耀,张琼,彭永臻
(北京工业大学,国家工程实验室,北京市水质科学与水环境恢复工程重点实验室,北京 100124)
贾淑媛,王淑莹,赵骥,李夕耀,张琼,彭永臻
(北京工业大学,国家工程实验室,北京市水质科学与水环境恢复工程重点实验室,北京 100124)
在序批式(sequencing batch reactor,SBR)反应器中,通过分段厌氧-好氧(厌氧后排水)运行方式,在以葡萄糖为碳源、P/C比小于2/100的条件下,成功实现了聚糖菌(glycogen accumulating organisms,GAOs)的驯化富集,厌氧段磷酸盐的释放量(phosphorus release amounts,PRA)稳定在1.0 mg·L-1以内,胞内糖原(glycogen,gly)含量是初始阶段的1.2倍。驯化后的GAOs分别以为电子受体经厌氧-缺氧运行方式,可进行内源反硝化反应过程。GAOs在内源反硝化过程中依次利用胞内的聚β-羟基戊酸酯(poly-β-hydroxyvalerate,PHV)、聚β-羟基丁酸酯(poly-β-hydroxyvalerate,PHB)和gly作为内碳源。在22℃时,反硝化聚糖菌(denitrifying glycogen accumulating organisms,DGAOs)以为电子受体平均比内源反硝化速率分别为0.067 g N·(g VSS)-1·d-1、0.023 g N·(g VSS)-1·d-1,常温短程内源反硝化速率约是全程内源反硝化速率的3倍。
聚糖菌;厌氧;需氧;曝气;富集;内源反硝化
引 言
富营养化已经成为我国面临的重要环境问题之一,水体中氮磷污染易引起富营养化。强化生物除磷(enhanced biological phosphate removal,EBPR)工艺是目前行之有效的生物除磷工艺[1],被广泛接受和认可。该工艺厌氧-好氧交替运行以富集聚磷菌(phosphorus accumulating organisms,PAOs)[2]。在厌氧阶段,PAOs吸收水中的可挥发性脂肪酸(volatile fatty acids,VFAs)以聚β-羟基烷酸(poly-β-hydroxyalkanoates,PHA)的形式贮存于细胞内。细胞内聚磷(polyphosphates,Poly-P)水解和糖原酵解为该过程提供能量和还原力,水解的磷酸盐释放,导致水体中磷含量升高。在好氧阶段,PAOs氧化分解细胞内的PHA,过量地吸收正磷酸盐,完成糖原合成和细胞生长,通过排放剩余污泥完成系统除磷。同时,部分PAOs能在缺氧条件下以硝酸盐氮为电子受体,分解胞内 PHA吸收正磷酸盐,这类菌被称为反硝化聚磷菌(denitrifying phosphorus accumulating organisms,DPAOs)。研究表明DPAOs和PAOs非常相似,甚至可能是同一微生物类型[3]。
但有文献曾报道,即使在有利于EBPR系统运行的条件下,除磷效果恶化的现象也时有发生[4-7]。近年来研究表明,在EBPR系统中除PAOs外还有一类微生物——聚糖菌(glycogen accumulating organisms,GAOs)[8]。厌氧时 GAOs吸收 VFAs合成PHA但不释磷;好氧时分解PHA合成gly而不积聚磷,对除磷没有贡献。Liu等[5]实验发现,通过控制进水中的磷浓度与基质浓度之比(P/C)可以富集培养GAOs。类似DPAOs,在缺氧环境下也存在反硝化聚糖菌(denitrifying glycogen accumulating organisms,DGAOs)以硝酸盐氮为电子受体,分解胞内储藏的PHA,以达到脱氮的目的[9-11]。但目前对于驯化后的 GAOs内源反硝化过程的研究未见报道。
本文首先通过控制进水P/C比[5],在分段厌氧-好氧的运行方式下,以葡萄糖为碳源,培养聚糖菌为优势菌种;然后分别以亚硝酸盐氮和硝酸盐氮作为电子受体,利用驯化后的GAOs进行内碳源反硝化脱氮,使系统成功启动并稳定运行;最后确定了不同电子受体条件下内碳源反硝化速率和内碳源利用量。
1 试验材料和方法
1.1 试验装置和运行方式
试验在序批式反应器(SBR)中进行。母反应器(编号为0#)为富集GAOs使用,批次试验反应器(编号分别为 1#、2#)为不同电子受体 DGAOs内源反硝化使用,反应器由圆柱形有机玻璃制成。
0#SBR反应器有效容积为10 L,排水比为0.4。在反应器壁的垂直方向设置取样、进水和出水口。采用蠕动泵进水、重力排水。厌氧阶段采用IKA机械搅拌器搅拌使活性污泥处于悬浮状态;好氧阶段采用空气压缩机将空气鼓入反应器中。反应器在富集培养阶段采用分段厌氧-好氧运行方式,每天连续运行3个周期,每个周期480 min。通过时间控制器自动控制,具体运行方式如图1所示。此运行方式的特点在于在厌氧阶段结束后,将厌氧阶段富含磷的上清液排出系统,之后再加入不含 COD的试验用水进行好氧曝气,筛选和驯化 GAOs。该方式可以限制系统中PAOs的生长,为培养驯化GAOs创造理想的环境,提高GAOs在活性污泥体系中的数量和活性。
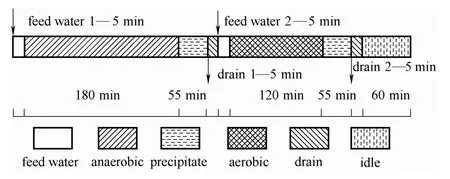
图1 厌氧-好氧SBR反应器运行方式Fig.1 Anaerobic-aerobic SBR operation mode
1#、2#SBR反应器有效容积均为3 L,排水比为1/3,厌氧-缺氧方式运行,每天运行1个周期。各反应器具体运行时间见表 1。该运行方式的特点在于在厌氧阶段结束后,将厌氧阶段含外碳源的上清液排出系统,再加入不含 COD但含有亚硝态氮或硝态氮的溶液,以保证在缺氧过程中利用厌氧阶段贮存的内碳源对不同电子受体进行反硝化过程。之后向 1#、2#反应器中分别加入溶液和溶液。
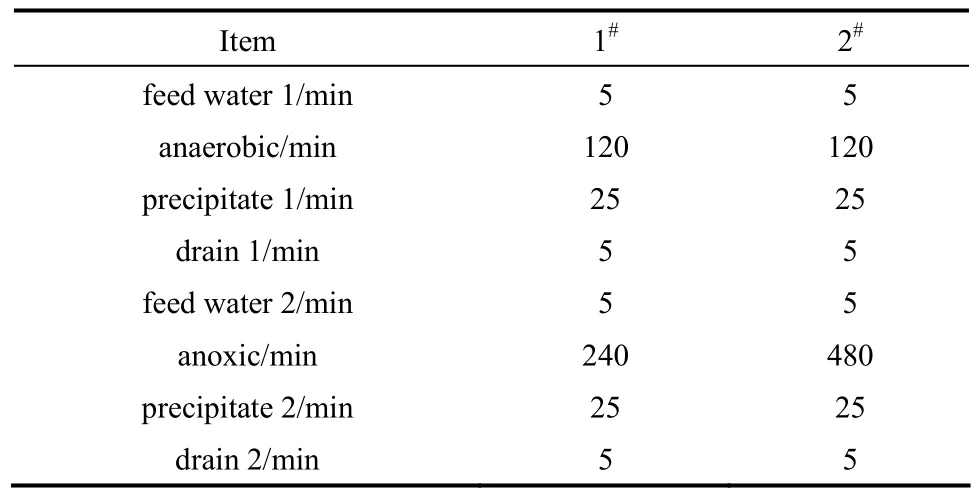
表1 厌氧-缺氧SBR反应器运行时间Table 1 Anaerobic-anoxic SBR operating time
1.2 试验用水和接种污泥
本试验均采用人工配水,葡萄糖作碳源,加入少量磷元素以达到磷限制条件。为满足微生物生长过程的需要,加入少量的微量元素营养液。在富集GAOs过程中,模拟废水成分和微量元素营养液的组成[12]如表 2;在 DGAOs内源反硝化启动和稳定运行过程中,模拟废水成分和微量元素营养液的组成在表2的基础上,缺氧时向1#、2#反应器中分别加入溶液和溶液,使两个反应器中缺氧混合初始的浓度约为 20.0 mg·L-1。
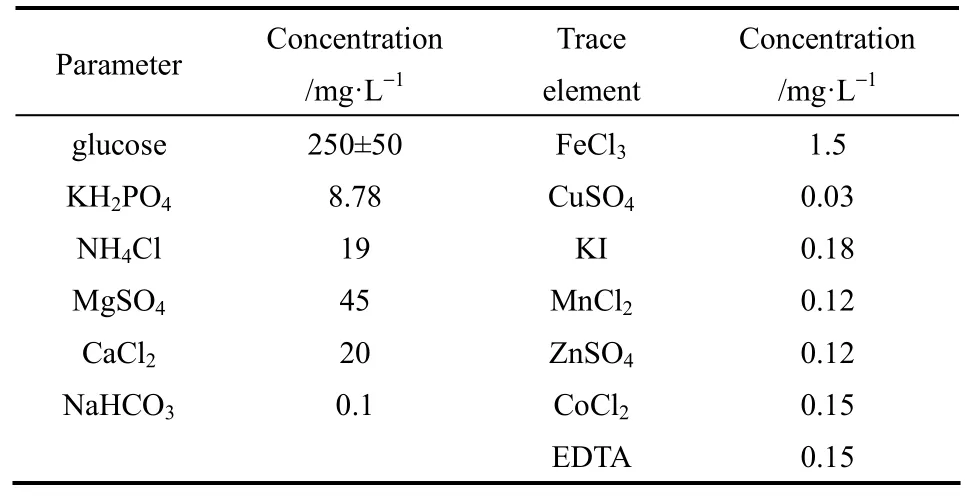
表2 模拟废水成分及微量元素组成Table 2 Content of simulated wastewater
接种污泥取自北京市某高校生活污水处理中型试验SBR,具有正常的脱氮除磷能力。
1.3 检测指标和分析方法
水样采用0.45μm滤纸过滤,COD采用兰州连华5B-1型COD快速测定仪测定;由Lachat Quikchem 8500型流动注射仪(Lachat Instrument,Milwaukee,Wiscosin)测定;MLVSS采用标准方法[13]测定;PHA采用气相色谱法[14]测定;gly采用蒽酮法[15]测定;pH、DO采用WTW Multi 3420 pH/DO仪在线监测。
1.4 厌氧段PRA的计算方法
厌氧段磷酸盐的释放量[16](phosphorus release amount,PRA)是指厌氧段结束时与进水混合时系统中磷酸盐浓度的差值,计算方法为
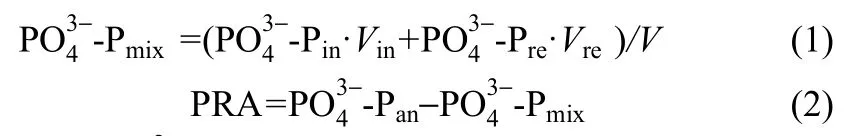
2 试验结果与讨论
2.1 GAOs的富集培养
2.1.1 磷限制条件下有机物吸收与释磷特性 为观测接种污泥除磷性能及体系中PAOs和GAOs相对数量关系,在富集GAOs之前,0#反应器先采用传统强化生物除磷的运行方式,即在厌氧结束后不排出富含磷的上清液,直接进行好氧曝气。在培养的第10个周期,0#反应器中活性污泥PRA明显增多。连续运行 15个周期后趋于稳定,由初始的 12.1 mg·L-1提高至 17.2 mg·L-1,该现象表明接种的活性污泥在厌氧-好氧交替运行的环境中已具备厌氧释磷、好氧吸磷的能力。从第16个周期起,0#反应器严格按照图1的运行方式培养驯化污泥以选择和富集GAOs。控制在2.0 mg·L-1左右,约为1.0 mg·L-1。厌氧结束后,将富含磷的上清液排出系统,之后再加入不含磷和 COD的模拟废水,曝气进行好氧阶段。如图2所示,在厌氧阶段伴随着有机物的迅速减少,且减少量变化幅度不大,平均为36 mg·L-1,PRA也逐渐减少,连续运行至第60个周期,PRA稳定在1.0 mg·L-1,与持平。说明有机物快速吸收所需能量已不再来自Poly-P的水解,而是来自于gly。因为在磷限制条件下,PAOs在好氧时不能在胞内充分积累Poly-P,厌氧时因能量不足影响 PAOs吸收 VFAs和合成PHA。在本系统中,厌氧阶段通过胞内糖原酵解产生的能量和还原力,有机物仍被不断吸收,并以PHA的形式储存在细胞内。这说明PAOs数量逐渐减少,GAOs数量逐渐增多,成为活性污泥的优势菌种。
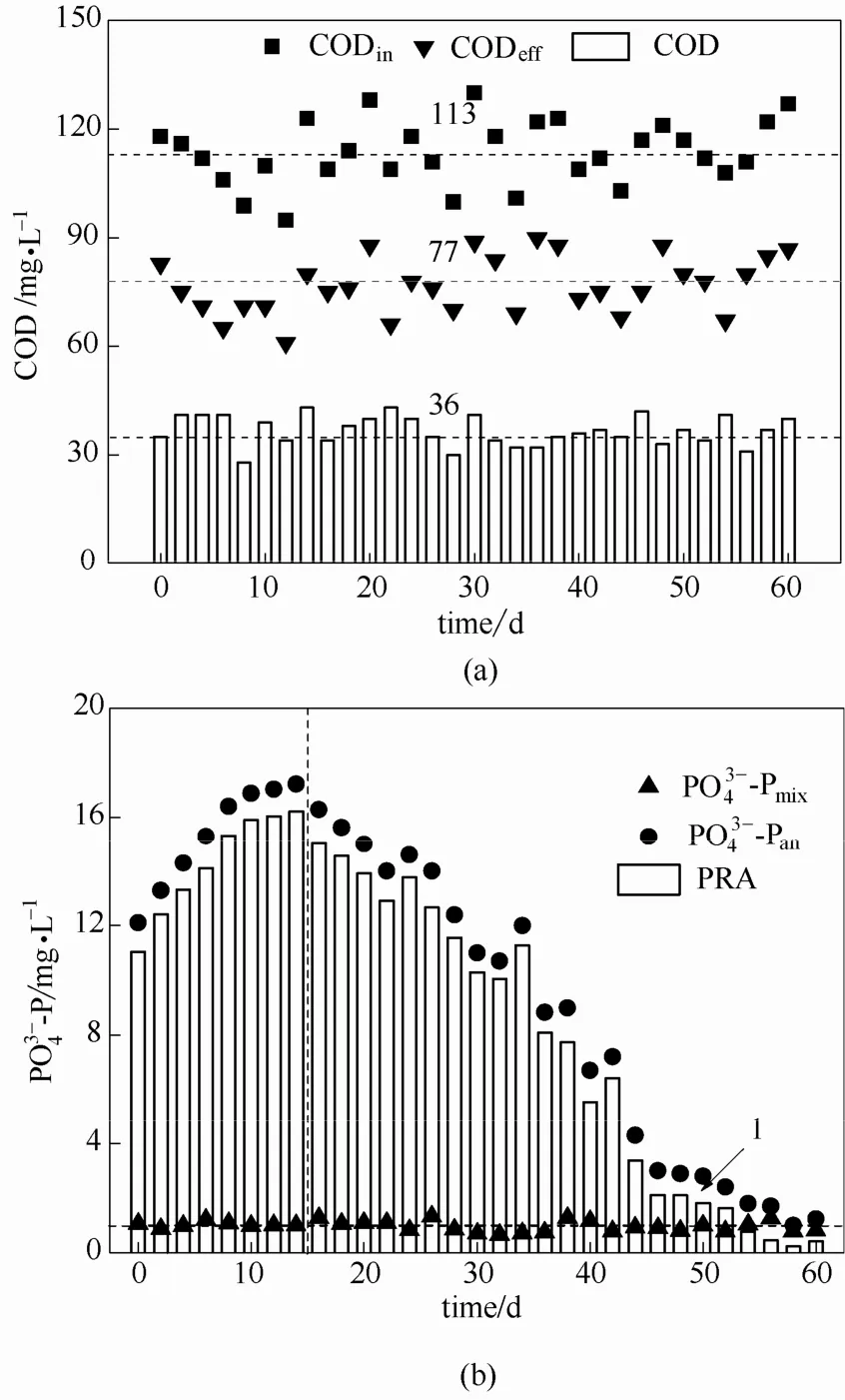
图2 厌氧阶段有机物吸收量(a)和释磷量(b)Fig.2 Organic substances absorption (a) and phosphate release(b) in anaerobic phase
2.1.2 不同运行阶段系统除磷和底物储存特性 在0#反应器按照强化生物除磷方式运行至第 15个周期,活性污泥PRA已基本达到稳定状态。在一个完整周期内各物质浓度变化如图3(a)所示。在厌氧初始阶段,系统中的浓度均为零,因此厌氧段通过反硝化去除的 COD量为零。厌氧过程中COD的去除量均是由PAOs和GAOs储存为内碳源的量。进水COD浓度为247.0 mg·L-1,厌氧混合后系统内COD值约为123.0 mg·L-1,前30 min COD浓度迅速减少,厌氧结束时COD含量为80.0 mg·L-1,厌氧阶段 COD 实际的吸收量为 43.0 mg·L-1;为 2.0 mg·L-1,为1.0 mg·L-1,前30 min磷迅速释放,150 min时磷的释放量达到最高为 17.2 mg·L-1,PRA 为 16.2 mg·L-1;此阶段单位COD的释磷量为376.7 mg P·(g COD)-1。伴随着COD浓度的降低,污泥中PHA含量由初始117.0 mg COD·(g VSS)-1逐渐增多,厌氧180 min时PHA含量为152.0 mg COD·(g VSS)-1,其中PHB含量约为PHV的1.5倍;gly含量降低,由初始 155.0 mg COD·(g VSS)-1降至 120.0 mg COD·(g VSS)-1,减少量为 35 mg COD·(g VSS)-1;好氧阶段磷被过量吸收,在整个周期结束时,磷浓度仅为 0.6 mg·L-1,磷净吸收量约为 0.4 mg·L-1。由此可见,接种污泥本身含有 PAOs,具有正常的释磷和吸磷功能,且厌氧释磷与好氧吸磷的效果良好。
反应进行至第60个周期,GAOs富集基本完成,在一个完整周期内各物质浓度变化如图3(b)所示。进水COD浓度为255.0 mg·L-1,厌氧混合后系统内COD值约为127.0 mg·L-1,前30 min COD迅速下降,厌氧末COD含量为87.0 mg·L-1,厌氧阶段COD实际的吸收量为 40.0 mg·L-1;为 1.8 mg·L-1,约为 0.8 mg·L-1,为 1.2 mg·L-1,PRA 为 0.4 mg·L-1,此阶段单位 COD 的释磷量为10.5 mg P·(g COD)-1,与富集GAOs前相比大幅度下降,此时EBPR功能已被破坏,GAOs对COD去除的贡献远多于 PAOs。在厌氧阶段随着COD浓度的降低,污泥中PHA含量由初始114.0 mg COD·(g VSS)-1逐渐增多,厌氧180 min时PHA含量为169.0 mg COD·(g VSS)-1,其中PHV含量约为PHB的1.7倍,这与GAOs以葡萄糖为基质进行代谢过程的途径有关[17-20];gly含量降低,由初始185.0 mg COD·(g VSS)-1降至 140.0 mg COD·(g VSS)-1,减少量为45 mg COD·(g VSS)-1,但gly含量是GAOs富集初始阶段的1.2倍,这也反映出系统内 GAOs已逐渐成为优势菌种,GAOs富集基本完成。
2.2 不同电子受体DGAOs内源反硝化的启动与稳定运行
2.2.1 DGAOs内源反硝化缺氧阶段的长期运行 0#反应器GAOs富集完成后,将活性污泥平均分至1#、2#SBR反应器中,每个反应器的 MLSS约为 3500 mg·L-1。均采用厌氧-缺氧方式运行,每天1个周期。
1#、2#反应器在缺氧时分别以为电子受体,图4是反应器在内源反硝化启动和稳定运行期间,缺氧进出水中浓度以及去除率的变化。在启动阶段,将浓度控制在10.0 mg·L-1左右。第1~10天为启动阶段,1#反应器进水浓度约为11.0 mg·L-1,反应4 h后出水浓度约为3.0 mg·L-1,去除约平均去除率约为72.7%。2#反应器进水浓度约为10.0 mg·L-1,反应8 h后出水浓度约为1.5 mg·L-1,浓度降为0 mg·L-1,去除约平均去除率约为85.0%。
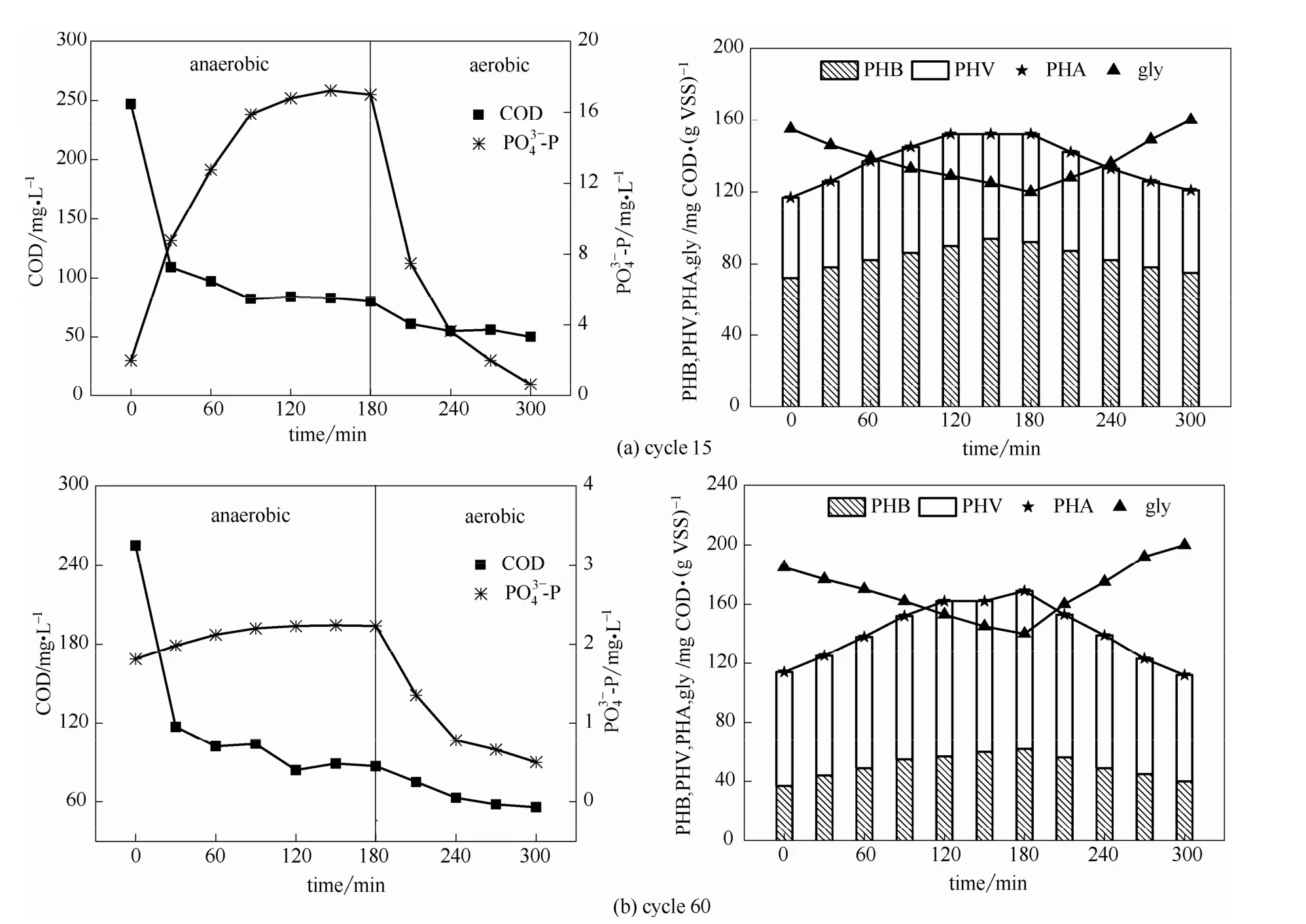
图3 第15、60个周期COD和-P及内碳源浓度变化Fig.3 Concentration of COD & -P and intracellular storage polymers in cycle 15 and cycle 60
从第21天开始,1#反应器进水浓度稳定在 20.0 mg·L-1左右,出水浓度从 5.0 mg·L-1逐渐降低到 1.0 mg·L-1,在 60 d 后平均去除率稳定在95.0%左右。2#反应器进水浓度约为 20.0 mg·L-1,浓度为 0~1.0 mg·L-1,出水浓度为 1.0~2.0 mg·L-1,平均去除量为18.5 mg·L-1,平均去除率约为 92.5%。由于污泥系统内反硝化菌的数量和反硝化能力的局限性,当反硝化菌的还原能力达到极限时,反硝化速率达到稳定状态[23]。因此,在1#、2#反应器内分别以为电子受体的DGAOs内源反硝化过程趋于稳定。
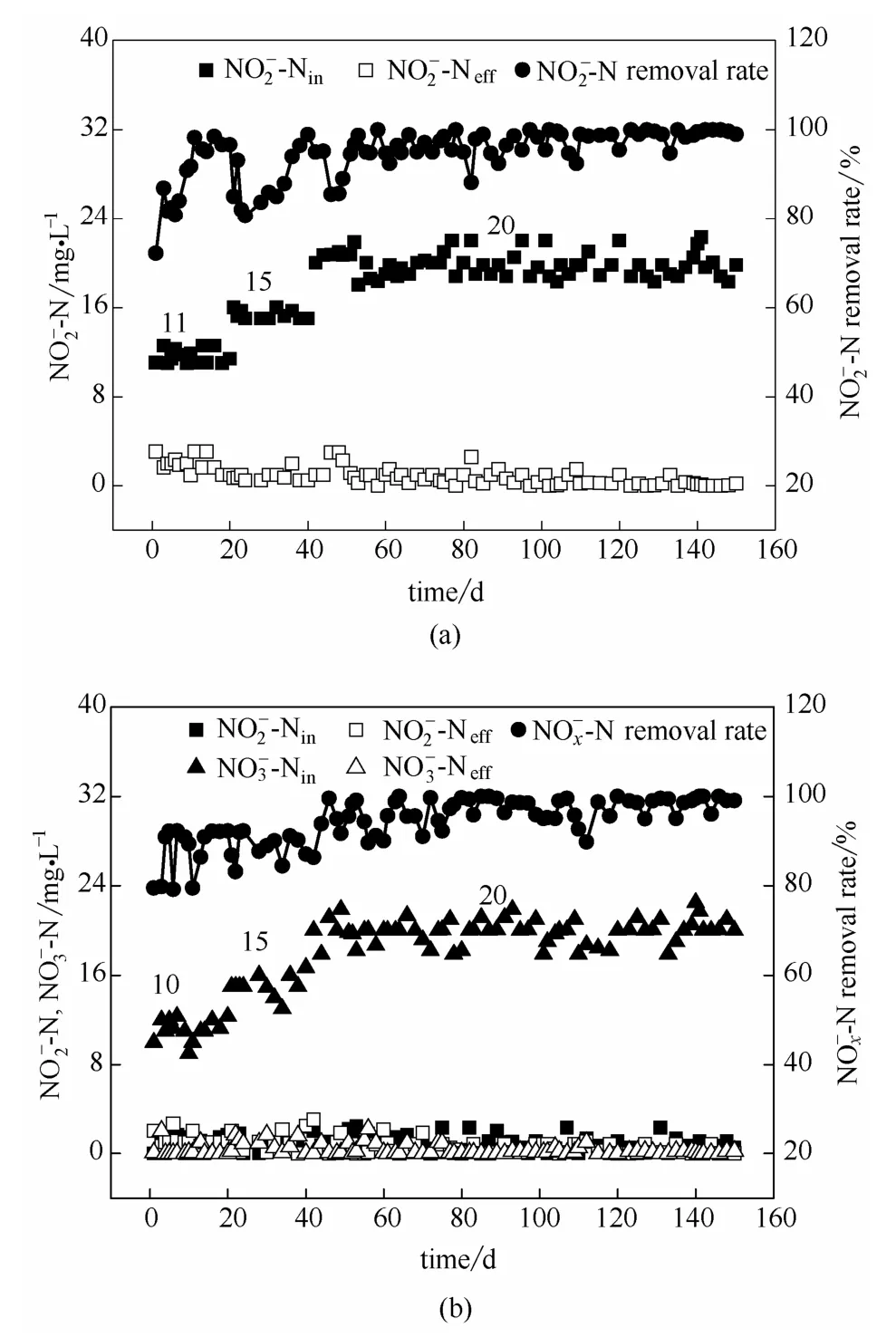
图4 以(a)、(b)为电子受体DGAOs缺氧段进出水和浓度及去除率Fig.4 Concentration of & and removal rate in anoxic phase of DGAOs used of (a) & (b)as electron acceptors
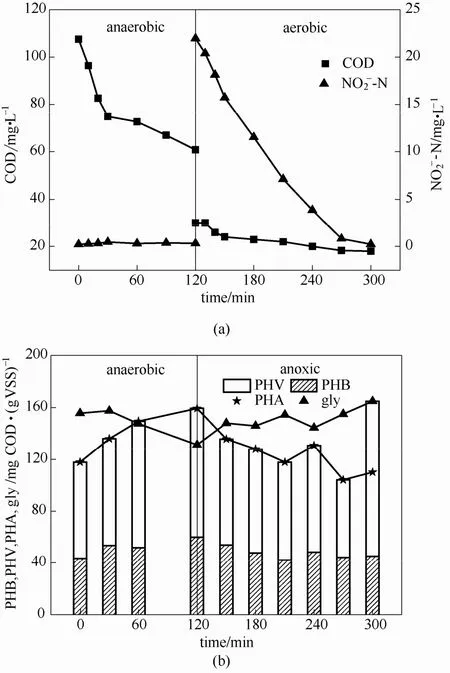
图5 以为电子受体DGAOs内源反硝化过程典型周期各物质变化Fig.5 Concentration of COD & (a) and intracellular storage polymers (b) in a typical SBR cycle of DGAOs made using of as electron acceptor
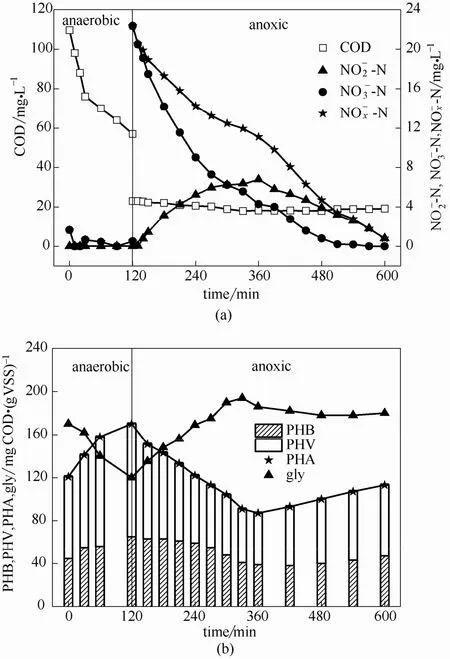
图6 以为电子受体DGAOs内源反硝化过程典型周期各物质变化Fig.6 Concentration of COD & (a) and intracellular storage polymers (b) in a typical SBR cycle of DGAOs made using of as electron acceptor
22℃时,DGAOs平均内源反硝化速率为0.023 g N·(g VSS)-1·d-1,是短程内源反硝化速率的 1/3,且低于常规外源反硝化速率[26-29]。细胞内 PHV、PHB的含量均逐渐减少,PHV、PHB减少量分别约为 39.0 mg COD·(g VSS)-1、18.0 mg COD·(g VSS)-1,DGAOs优先且主要利用 PHV进行内源反硝化反应;糖原含量增加了60.0 mg COD·(g VSS)-1,为下一周期 DGAOs吸收并储存外碳源提供能量和还原力。
3 结 论
(1)本文采用分段厌氧-好氧(厌氧后排水)运行方式,在SBR反应器中以葡萄糖为唯一碳源,限制进水磷浓度在2 mg·L-1以内且P/C比小于2/100,成功抑制PAOs的生长。接种含有PAOs、具有释磷和吸磷效果的活性污泥,其厌氧段单位 COD释磷量为376.7 mg P·(g COD)-1,PHB是PHV含量的1.5倍,gly减少量为35.0 mg COD·(g VSS)-1,COD快速吸收所需能量来自Poly-P的水解。经过60 d的培养,厌氧段单位 COD 释磷量降为 10.5 mg P·(g COD)-1,PHV是PHB含量的1.7倍,gly减少量为45.0 mg COD·(g VSS)-1且gly含量是驯化前的1.2倍,COD快速吸收所需能量来自糖原酵解。此时完成GAOs的选择和富集。
(3)厌氧阶段,DGAOs利用糖原酵解提供的能量和还原力,吸收葡萄糖,合成PHV和PHB储存在胞内,为反硝化过程提供电子供体和能量。在缺氧阶段,DGAOs先后利用PHV、PHB和gly为电子供体和内碳源进行反硝化过程,消耗的 PHV含量约为PHB含量的2.2倍。
[1]FUHS G W,CHEN M.Microbiological basis of phosphate removal in the activated sludge process for the treatment of wastewater[J].Microbial Ecology,1975,2(2):119-138.
[2]SEVIOUR R J,MINO T,ONUKI M.The microbiology of biological phosphorus removal in activated sludge systems[J].Microbiology Reviews,2003,27(1):99-127.
[3]AHN J,SCHROEDER S,BEER M,et al.Ecology of the microbial community removing phosphate from wastewater under continuously aerobic conditions in a sequencing batch reactor[J].Applied and Environmental Microbiology,2007,73(7):2257-2270.
[4]FILIPE C D M,DAIGGER G T,GRADY C P L.pH as a key factor in the competition between glycogen-accumulating organisms and phosphorus-accumulating organisms[J].Water Environment Research,2001,73(2):223-232.
[5]LIU W T,NAKAMURA K,MATSUO T,et al.Internal energy-based competition between polyphosphate- and glycogen-accumulating bacteria in biological phosphorus removal reactors—effect of P/C feeding ratio[J].Water Research,1997,31(6):1430-1438.
[6]SAUNDERS A M,OEHMEN A,BLACKALL L L,et al.The effect of GAOs (glycogen accumulating organisms) on anaerobic carbon requirements in full-scale Australian EBPR (enhanced biological phosphorus removal) plants[J].Water Science and Technology,2003,47(11):37-43.
[7]SATOH H.Deterioration of enhanced biological phosphate removal by the domination of microorganisms without poly-P accumulating[J].Water Science and Technology,1994,30(6):203-211.
[8]MINO T,LIU W,KURISU F,et al.Modeling gloycogen storage and denitrification capability of microorganisms in enhanced biological phosphate removal process[J].Water Science and Technology,1995,31(2):25-34.
[9]ZENG R J,YUAN Z G,KELLER J.Enrichment of denitrifying glycogen-accumulating organisms in anaerobic/anoxic activated sludge system[J].Biotechnology and Bioengineering,2003,81(4):397-404.
[10]MIAO L,WANG S Y,LI B K,et al.Advanced nitrogen removalvianitrite using stored polymers in a modified sequencing batch reactor treating landfill leachate[J].Bioresource Technology,2015,192:354-360.
[11]JI J T,PENG Y Z,WANG B,et al.Achievement of high nitrite accumulationviaendogenous partial denitrification (EPD)[J].Bioresource Technology,2017,224:140-146.
[12]李安安,李勇智,祝贵兵,等.活性污泥体系中聚糖菌的富集与鉴定[J].环境工程学报,2009,3(5):927-931.LI A A,LI Y Z,ZHU G B,et al.Enrichment and identification of glycogen accumulating organism in activated sludge system[J].Chinese Journal of Environmental Engineering,2009,3(5):927-931.
[13]魏复盛.水和废水监测分析方法指南[M].北京:中国环境科学出版社,1994.WEI F S.Guidelines for Monitoring and Analyzing Water and Wastewater[M].Beijing:China Environmental Science Press,1994.
[14]OEHMEN A,KELLER-LEHMANN B,ZENG R J,et al.Optimisation of poly-beta-hydroxyalkanoate analysis using gas chromatography for enhanced biological phosphorus removal systems[J].Journal of Chromatography A,2005,1070 (1/2):131-136.
[15]OEHMEN A,ZENG R J,YUAN Z G,et al.Anaerobic metabolism of propionate by polyphosphate-accumulating organisms in enhanced biological phosphorus removal systems[J].Biotechnology and Bioengineering,2005,91(1):43-53.
[16]WANG X X,WANG S Y,XUE T L,et al.Treating low carbon/nitrogen (C/N) wastewater in simultaneous nitrificationendogenous denitrification and phosphorous removal (SNDPR)systems by strengthening anaerobic intracellular carbon storage[J].Water Research,2015,77:191-200.
[17]CECH J S,HARTMAN P.Competition between polyphosphate and polysaccharide accumulating bacteria in enhanced biological phosphate removal systems[J].Water Research,1993,27(7):1219-1225.
[18]SATCH H,MINO T,MATSUO T.Deterioration of enhanced biological phosphorus removal by the domination of microorganisms without polyphosphate accumulation[J].Water Science and Technology,1994,30(6):203-211.
[19]MINO T,SATOH H.Metabolisms of different bacterial populations in enhanced biological phosphate removal process[J].Water Science& Technology,1994,29(7):67-70.
[20]BEGUM S A,BATISTA J R.Microbial selection on enhanced biological phosphorus removal systems fed exclusively with glucose[J].World Journal of Microbiology and Biotechnology,2012,28(5):2181-2193.
[21]马勇,彭永臻,王淑莹.不同外碳源对污泥反硝化特性的影响[J].北京工业大学学报,2009,35(6):820-824.MA Y,PENG Y Z,WANG S Y.Sludge denitrification characteristics with different external carbon source[J].Journal of Beijing University of Technology,2009,35(6):820-824.
[22]HALLIN S,LINDBERG C F,PELL M.Microbial adaptation,process performance and a suggested control strategy in a pre-denitrifying system with ethanol dosage[J].Water Science & Technology,1996,34(1/2):91-99.
[23]郑平.新型生物脱氮理论与技术[M].北京:科学出版社,2004.ZHENG P.New Biological Denitrification Theory and Technology[M].Beijing:Science Press,2004.
[24]MINO T,LIU W T,KURISU F,et al.Modeling gloycogen storaged denitrification capability of microorganisms in enhanced biological phosphate removal process[J].Water Science and Technology,1995,31(2):25-34.
[25]葛士建,李夕耀,彭永臻,等.改良 UCT分段进水深度脱氮除磷工艺反硝化动力学性能[J].北京工业大学学报,2011,37(3):433-439.GE S J,LI X Y,PENG Y Z,et al.The modified UCT subsection water depth dephosphorization process denitrification kinetics performance[J].Journal of Beijing University of Technology,2011,37(3):433-439.
[26]HENZE M,HARREMOE S P.Chemical biological nutrient removal:the HYPRO concept[C]//Proceedings of the 4th Gothenburg Symposium Chemical Water and Wastewater Treatment.Madrid:Springer Verlag,1990:145-149.
[27]HENZE M.Nitrate versus oxygen utilization rates in wastewater and activated sludge systems[J].Water Science and Technology,1986,18(6):115-122.
[28]HENZE M.The influence of raw wastewater biomass on activated sludge oxygen respiration rates and denitrification rates[J].Water Science and Technology,1989,21(6/7):603-607.
[29]HENZE M.Capabilities of biological nitrogen removal processes from wastewater[J].Water Science and Technology,1991,23(4/5/6):669-679.
date:2017-06-08.
Prof.WANG Shuying,wsy@bjut.edu.cn
supported by National Natural Science Foundation of China(51578014) and the Funding Projects of Beijing Municipal Commission of Education.
Effect of endogenous denitrification rate of domesticated GAOs onand
JIA Shuyuan,WANG Shuying,ZHAO Ji,LI Xiyao,ZHANG Qiong,PENG Yongzhen
(National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology,Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering,Beijing University of Technology,Beijing100124,China)
Glycogen accumulating organisms (GAOs) has been enriched in the anaerobic-aerobic sequencing batch reactor (AO-SBR) (drained after anaerobic) with glucose as the carbon source and the P/C ratio less than 2/100.PRA was less than 1.0 mg·L-1.The content of gly was 1.2 times the initial stage of GAOs enrichment.The domesticated GAOs cultured in anaerobic-anoxic operation could proceed endogenous denitrification reaction withandas endogenous carbon source.GAOs used intracellular poly-β-hydroxyvalerate (PHV),poly-β-hydroxyvalerate (PHB) and glycogen (gly) in turns as carbon source in endogenous denitrification process.The average endogenous denitrification rate of DGAOs usingandas electron acceptors were 0.067 g N·(g VSS)-1·d-1and 0.023 g N·(g VSS)-1·d-1at 22℃,respectively.Short-range endogenous denitrification rate was about three times as much as endogenous denitrification rate at normal temperature.
glycogen accumulating organisms (GAOs); anaerobic; aerobic; aeration; enrichment; endogenous denitrification
X 703.1
A
0438—1157(2017)12—4731—08
10.11949/j.issn.0438-1157.20170734
2017-06-08收到初稿,2017-09-07收到修改稿。
联系人:王淑莹。
贾淑媛(1993—),女,硕士研究生。
国家自然科学基金项目(51578014);北京市教委资助项目。
