福寿螺组织细胞原代培养及染色体核型分析
2017-12-22李绪杰张福周邹湘辉杨东娟查广才
李绪杰,张福周,邹湘辉,杨东娟,查广才
(韩山师范学院食品工程与与生物科技学院,广东 潮州 521041)
福寿螺组织细胞原代培养及染色体核型分析
李绪杰,张福周,邹湘辉,杨东娟,查广才
(韩山师范学院食品工程与与生物科技学院,广东 潮州 521041)
无菌分离取得福寿螺肌肉、外套膜、肾脏及脑组织,分别采用胰酶消化法和研磨法进行组织细胞分离,选取DMEM、F12和改良1640培养基分别进行细胞原代培养,光镜下观察细胞的生长状态,MTT法测定细胞活性。细胞培养一定时间后进行染色体制备及染色体核型分析。结果表明,福寿螺组织细胞在不同的培养基培养下活力具有明显差异,用含水解乳蛋白的DMEM培养基培养的福寿螺外套膜和斧足组织细胞活力较好;用M199培养基培养的福寿螺斧外套膜和脑组织细胞活力较好。核型分析结果表明福寿螺染色体为二倍体(2n = 28,NF = 56),核型为2B型,核型不对称系数为66.4%。
福寿螺;原代培养;染色体;核型分析
福寿螺在世界范围内造成了严重的农业与生态危害,已被世界自然保护联盟列入全球100种恶性外来入侵物种之一[1]。国家环保总局也将福寿螺列入首批(16种)入侵我国的 “危害最大的外来物种”之一[2]。目前,在脊椎动物的细胞建系上已有数百个品种[3],在无脊椎动物研究上,国内外学者在贝类细胞培养方面进行了探索,但迄今为止仅建立了淡水双脐螺胚胎(Biomphalaria glabrata embryonic,BGE)细胞系[4-6],水生无脊椎动物由于细胞形态、结构、功能以及营养需求等方面的特殊性,细胞培养多停留在原代培养和有限传代水平上[7]。有关淡水螺类的细胞培养报道目前只有姜德勋等[8]采用改良M199培养基对福寿螺部分组织进行培养。染色体是遗传物质的载体,是基因的携带者,其数目和形态特征的变化常常会导致生物形态结构、生理和生化等许多遗传特性的改变。核型分析是对体细胞或配子的染色体特征进行定性和定量表述的一种基本方法,主要包括染色体数目、染色体形态、染色体的“解剖学”特征和染色体的分子特征[9-12]。染色体核型代表一个物种或个体在染色体水平上的表型[13]。有关福寿螺染色体核型研究报道至今只有文献[14]。
本研究采用不同培养基分别培养福寿螺组织细胞,进行福寿螺组织细胞体外培养建系;在细胞培养基础上,改进染色体制作实验程序,缩短实验周期,进行染色体核型分析。本研究从细胞水平上了解福寿螺的遗传机制及其在入侵地占据生态优势机制,对福寿螺的预防控制具有重要意义,同时从细胞水平上研究福寿螺是否可作为敏感的环境指示生物,为湿地生态环境安全监测提供参考与借鉴。
1 材料与方法
1.1 试验材料
供试福寿螺(3.56 g±0.42 g)采集于潮州市下津村农家池塘,试验主要试剂包括75%乙醇,Hanks液,链霉素、青霉素,0.25%胰蛋白酶液,改良1640、M199及DMEM培养基,胎牛血清,MTT,DMSO等。
试验主要仪器设备有台式冷冻离心机、二氧化碳恒温培养箱、酶标仪、超净工作台、组织研磨器、倒置显微镜等。
1.2 试验方法
1.2.1 研磨法处理组织 (1)取材:将整只福寿螺浸泡在75%乙醇溶液中30~60 s,用无菌棉签擦净福寿螺螺体及组织表面黏液,切取所需组织,把组织块置于无菌培养皿中,用Hanks液漂洗2~3次,去除污物,置于青霉素(1.0×105IU /L) 和链霉素(1.0×105IU /L)的无菌水中30~60 min,分别转入一定量基础培养基中漂洗3次。(2)研磨:按组织大小加入10倍体积的基础培养基,用经灭菌的组织研磨器把组织磨碎。(3)分离:研磨液通过孔径0.074 mm不锈钢筛滤掉残余的组织块。800 r/min离心消化液3 min,吸出上清,分别加入适量1号DMEM(无血清含5 g/L水解乳蛋白)、M199(15%胎牛血清)、改良1640(15%胎牛血清)及2号DMEM(15%胎牛血清)培养液。(4)计数:用血球计数板计数,如细胞悬液细胞密度过大,须分别补加培养液调整,然后分装入培养瓶中。
1.2.2 胰酶消化法处理组织 (1)取材:与1.2.1取材方法相同。(2)剪切:用眼科剪把组织剪碎,加入组织块体积30倍的胰蛋白酶液,然后一并倒入培养皿中,盖上皿盖,使组织块均匀分布于皿底。(3)消化:37℃恒温消化,每隔5 min摇动1次。(4)分离:在消化过程中见消化液混浊时,用吸管吸出少许消化液在镜下观察组织,若已分散成细胞团或单个细胞时终止消化,随即通过孔径0.074 mm不锈钢筛,滤掉尚未充分消化的组织块。低速800 r/min离心消化液3 min,吸出上清,加入适量1号DMEM(无血清含5 g/L水解乳蛋白)、M199(15%胎牛血清)、改良1640(15%胎牛血清)及2号DMEM(15%胎牛血清)培养液。(5)计数:与1.2.1计数方法相同。
1.2.3 原代培养 将细胞置于5% CO2恒温培养箱中37℃培养,每天观察细胞的形态,每2 d更换1次培养基。待细胞贴满瓶壁70%~80%时进行酶解消化,传代培养或制成细胞悬液待用。
1.2.4 MTT法检测细胞活力 将上述获得的相同密度的细胞悬液直接接种于96孔板中,每孔接种100 μL。培养3 d。每孔加入5 g/L MTT 20 μL,27℃孵育4 h,轻轻吸弃上清培养液,每孔再加入DMSO 150 μL,充分震荡使结晶完全溶解,30 min后以DMSO为空白调零,测定570 nm波长处各孔的光吸收值(OD570)。
1.2.5 染色体制备及观察 细胞预处理:收集生长旺盛的细胞,吹打散,加入秋水仙素使终浓度达到1 μg/mL进行预处理;经预处理6~8 h后,以800 r/min离心7 min,去上清;低渗:加入 0.075 mol/L KCl溶液1 mL,轻轻吹打,细胞重悬后补加0.075 mol/L KCl溶液7 mL,室温下低渗20 min;预固定:加入3~4滴Carnoy,800 r/min离心7 min,去上清;固定:沿管壁慢慢加入3 mL固定液,2 min后用吸管轻轻的吹打分散细胞,固定10 min后,800 r/min离心去上清;此步骤重复2次;去上清后剩0.2~0.5 mL固定液,用吸管吹打使其成为细胞悬液;滴片:吸取细胞悬液滴于冰冷的载玻片上(经80%乙醇浸泡,0~4℃冷藏),吹散,酒精灯外焰过火5 s左右;染色观察:风机吹干,置于装有Giemsa染液的染色缸内,染色20 min,水洗后吹干,显微镜观察并拍照。
1.2.6 染色体核型分析 测量:标本先行拍照放大后目测照片上每条染色体长度,按长短顺序初步编号,写在每条染色体短臂的一端,同时确定主缢痕的位置,用游标卡尺逐条测量短臂和长臂长度。根据测量的数据,计算染色体的相对长度、臂比及着丝粒指数。福寿螺染色体用相对长度表示,比绝对长度更具有可比性、更稳定,按照Levan[15]的公式计算:相对长度=(每个染色体的长度/全部染色体长度)×100;臂比值=长臂长度/短臂长度;着丝粒指数=(短臂长度/该染色体长度)×100。染色体臂数的计算按Matthhey[16]的建议中部和亚中部着丝粒染色体的臂数记为2,亚端部和端部着丝粒染色体的臂数记为1。染色体排列:按染色体由长到短同源染色体重新编号,由左向右顺序贴在纸上。着丝点排列在同一水平线上,短臂在上,长臂在下。绘制核型模式图及核型分析表:核型模式图用Excel绘制,长臂在下,短臂在上,横坐标为染色体序号,纵坐标为染色体的相对长度。
2 结果与分析
2.1 原代培养细胞形态特征
在相同培养条件下,对研磨法、胰酶消化法处理的福寿螺组织细胞进行原代培养,培养7 d后观察细胞形态,结果(图1)表明,外套膜组织细胞呈椭圆形或多边形;脑组织细胞多呈圆形,细胞体透亮。研磨法处理的外套膜组织相对于酶解法处理的细胞长势较慢,细胞折光性较弱。酶解法处理的脑组织细胞细胞形态完整,细胞能贴壁单层生长,分生能力相对强于研磨法处理的脑组织细胞。

图1 福寿螺原代细胞形态
2.2 MTT法检测不同培养基培养的细胞活力
采用酶解法培养福寿螺原代细胞,对各组织细胞分别加入不同的培养基培养10 d后转移到96孔板中进行MTT活力检测,结果(图2)显示,用1号DMEM含水解乳蛋白培养基培养的福寿螺外套膜和斧足组织细胞活力较好;用M199培养基培养的福寿螺外套膜和脑组织细胞活力较好。
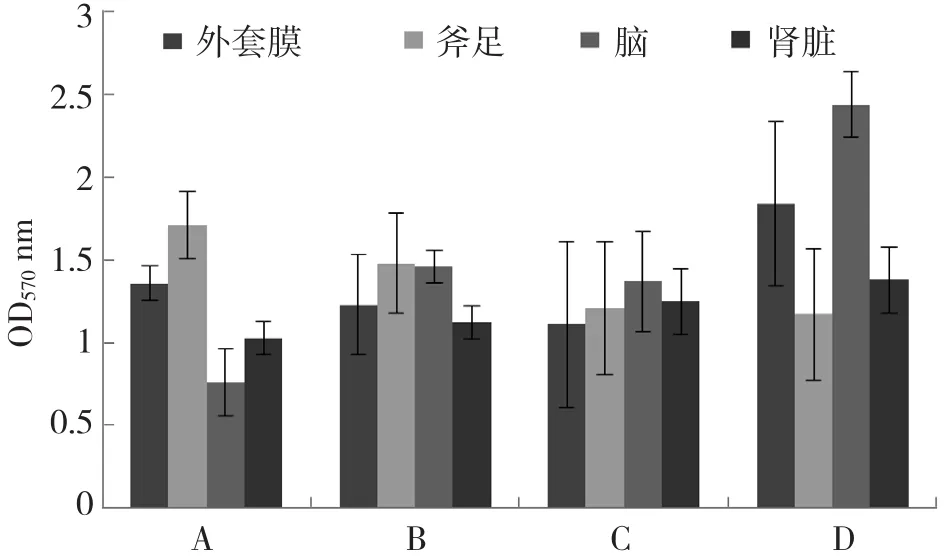
图2 不同培养基培养的细胞活力
2.3 福寿螺染色体及核型分析
选择形态清晰、分散性良好的6个(雌雄各半)染色体图像,放大后对数码照片上的染色体分别进行测量、计算每条染色体的相对长度、臂比指数、着丝粒指数,然后取平均值,结果(图3)显示,福寿螺的染色体2n=28,为二倍体,未见性染色体。福寿螺核型公式为:2n=18 sm+10 m,NF=56;依据相对长度和臂比指数数据,福寿螺染色体为中部或近中部着丝点染色体。福寿螺着丝粒指数变化范围为25.0~46.1;臂比值范围在1.2~3.0之间(表1)。根据Stebbins[17]的核型分类标准及Aarno[18]的核型不对称系数计算方法,福寿螺的核型为2B型,核型不对称系数为66.4%,对称程度较高。

图3 福寿螺染色体核型分析结果
3 讨论
3.1 组织细胞原代培养
自1907年Harrison创立动物组织和细胞的体外培养方法以来,脊椎动物细胞培养技术已经相当成熟,全世界已建立的细胞系株至少有数千种[3],水生无脊椎动物由于细胞形态、结构、功能以及营养需求等方面的特殊性,很少有相关细胞系建立的报道[7]。在原代细胞培养过程中,防止微生物污染难度较大,细菌、真菌及立克次氏体污染是最常见的污染,且培养的大部分细胞通常在体外存活时间较短[19]。随着无脊椎动物中的模式动物、经济动物、生物矿化理论、细胞免疫学、病毒学等方面的研究不断深入,越来越多种类的无脊椎动物的细胞培养将会成为必然[20]。
目前,关于淡水螺类组织细胞体外培养的研究较少。本研究进行福寿螺细胞原代培养的研究,旨在探讨建立福寿螺组织细胞体外长期培养方法,建立福寿螺组织细胞系,为有机体代谢研究、环境监测等创造平台。为确定合适的组织细胞分离处理方法,本研究在相同培养条件下培养7 d后观察研磨法、胰酶消化法培养的细胞形态。酶解法和研磨法处理福寿螺组织细胞都会对细胞造成一定损害,试验结果表明,采用酶解法处理的组织细胞的生长状态相对于研磨法来说较好。在组织细胞分离培养方法选择上,姜德勋等[8]采用切取组织块直接培养,对细胞的损伤度最小,但由于细胞从组织块迁出速度慢,使得细胞培养周期加长。采用酶解法可以短时间内获取大量单个细胞,缩短原代细胞培养的周期。在选择合适培养基培养不同组织细胞实验中,我们发现用含水解乳蛋白的DMEM培养基培养的福寿螺外套膜和斧足组织细胞活力较好;用M199培养基培养的福寿螺斧外套膜和脑组织细胞活力较好。福寿螺机体组织因代谢情况不一样,营养需求也表现不一,因此不同组织细胞在不同培养基中活力具有差异。
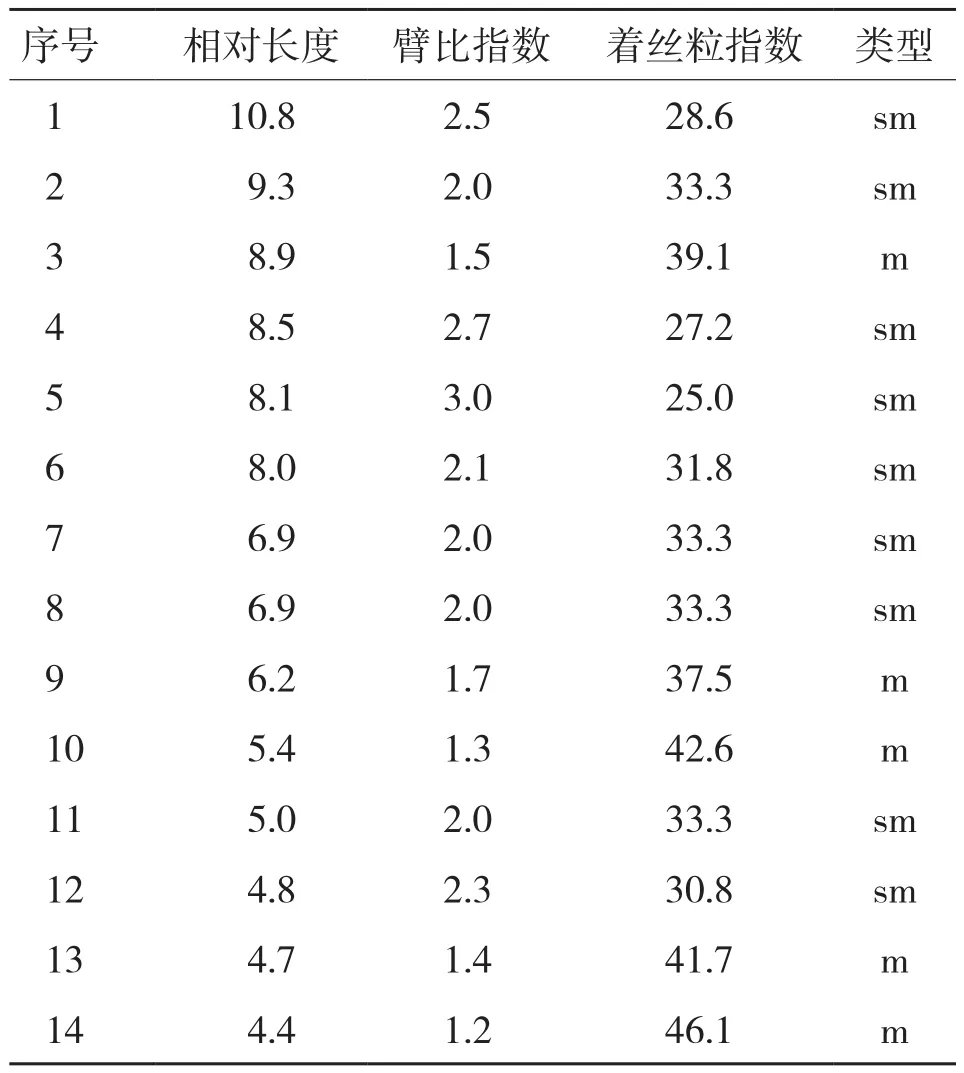
表1 福寿螺染色体核型分析数据
培养基中使用动物血清既有优点也有风险[21]。国外研究学者采用改良的无添加胎牛血清的L-15培养基及辅助缓冲液培养无脊椎动物锯缘青蟹(Scylla serrata)肝胰腺细胞,成功证明了L-15培养基促进无脊椎动物组织如肝胰腺的生长和细胞存活的效率[22]。本研究比较了在细胞原代培养过程中添加水解乳蛋白和血清的DMEM培养基的效果差异,在后续的其他软体动物组织细胞建系实验过程中可以尝试使用改良的培养基而不添加血清的方法。
3.2 染色体核型分析及意义
核型分析能明确识别各个染色体的特征,有助于基因定位和定体的研究,是遗传学的一项基本技术[23]。叶冰莹等[14]研究的大瓶螺核型采用体内腹腔注射HCG,但随着个体的生长发育,细胞进一步分化,处于分裂状态的细胞不多,较难找到分裂相[19]。研究者通过细胞培养手段,可以在较短时间内获得大量中期分裂相,从而便于进行染色体计数和观察[24]。
根据染色体核型分析试验数据分析可得,福寿螺的染色体2n=28,为二倍体,未见性染色体,与叶冰莹等[14]的研究结果一致。福寿螺核型公式为:2n=18 sm+10 m,NF=56;染色体为中部或近中部着丝点染色体,核型为2B型,核型对称程度较高。本试验结果在染色体核型公式、着丝粒指数、臂比值上与前人的研究结果具有一定的差异性。这可能是由于福寿螺染色体核型发生了微弱的进化,尽管软体动物和大多数非哺乳类脊椎动物与大多数胎盘类哺乳动物相比,它们在形态和核型上的进化速度要慢得多[25]。
本研究采用不同培养基培养福寿螺不同组织细胞以获得原代培养细胞,通过MTT法测定各组织细胞的活力,确定了福寿螺组织细胞合适的培养基,可为螺类及其他软体动物组织细胞体外建系提供参考。通过细胞原代培养,在较短时间内获得大量中期分裂相,从而便于进行染色体计数和观察,进一步对福寿螺染色体核型进行制备和分析。染色体核型分析研究将有利于推动福寿螺遗传机制、入侵占地生态优势机制的研究,同时对福寿螺防治具有积极意义。
[1] 郭靖,章家恩. 福寿螺入侵机制的研究进展[J]. 生态学杂志,2014,33(3):806-807.
[2] 刘雨芳,李菲,李玉峰,等. 福寿螺在湖南的分布现状、危害与扩散风险预警[J]. 水生生物学报,2011,35(6):1067-1071.
[3] Lynn D E. Development of insect cell lines:virus susceptibility and applicability to prawn cell culture[J]. Methods Cell Sci,1999,21(4):173-181.
[4] Maramorosch K. Invertebrate histocyte culture:Research applications[C]. A Subsidiary of Harcourt Brace Jovanovich,Publishers,1976(3):372-373.
[5] Rinkevich B. Cell cultures from marine invertebrates:obstacles,new approaches and recent improvements[J]. J Biotechno,1999,70:133-153.
[6] Rinkevich B. Marine invertebrate cell culture:new millennium trends[J]. Mar Biotechnol,2005,7(5):429-434.
[7] 王华. 栉孔扇贝(Chlamys farreri)心肌组织细胞培养的初步研究[D]. 湛江:广东海洋大学,2009.
[8] 姜德勋,许璞,沈爱国,等. 福寿螺足组织和外套膜组织细胞培养的初步研究[J]. 淡水渔业,2008,38(2):54 -59.
[9] 李懋学,张赞平. 作物染色体及其研究技术[M]. 北京:中国农业出版社,1995:1-60.
[10] 李懋学. 植物染色体研究技术[M]. 哈尔滨:东北林业大学出版社,1991.
[11] 任文娟. 菜用大黄染色体观察及核型分析[D].新乡:河南科技学院,2013.
[12] 吴瑞霞. 马蓝的形态组织观察与细胞核型分析[D]. 福州:福建农林大学,2010.
[13] 王小丽. 五种南海海水鱼的染色体核型分析和显带[D]. 广州:暨南大学,2007.
[14] 叶冰莹,齐秋贞,邱文仁. 大瓶螺(Ampullaria gigas Spix)的核型分析[J]. 福建师范大学学报(自然科学版),1995,11(1):95-99.
[15] Levan A,Fedga K,Sandbreg A A. Nomenclature for centromeric poition on chromosomes[J].Hereditas,2010,52(2):201-220.
[16] Matthey R. The chromosome formulae of eutherian mammals[M]. New York:Academic Press,1973:531-616.
[17] Setbbins G L. Chromosomal evolution in highter plants. London[M]. Edward Aronld,1971:88.
[18] Arano H. Cytological studies in subfamily Carduoideae(Compositae)of Japan IX[J].Botanical Magazine Tokyo,1963,76(895):32-39.
[19] 钟秀颖. 几种贝类组织细胞培养的研究[J]. 生命科学仪器,2009,7(5):22-24.
[20] 周婵,朱勇,徐水. 无脊椎动物细胞原代培养方法[J]. 动物营养学报,2011,23(2):203-209.
[21] Nims R W,Harbell J W. Best practices for the use and evaluation of animal serum as a component of cell culture medium[J]. In Vitro Cell Dev Biol Anim. 2017 Jul 21. doi:10. 1007/s11626-017-0184-8.
[22] Sashikumar A,Desai P V. Development of primary cell culture from Scylla serrata:Primary cell cultures from Scylla serrata[J].Cytotechnology,2008,56(3):161-169.
[23] 周翼虎. 药的染色体制片技术优化与核型分析[D]. 呼和浩特:内蒙古大学,2014.
[24] 王爱民,阎冰,苏琼,等. 培养马氏珠母贝外套膜上皮细胞分泌物的分析[J]. 农业生物技术学报,2003,11(3):285-290.
[25] Chambers S M. Rates of evolutionary change in chromosome numbers in snails and vertebrates[J]. Evolution,1987,41(1):166-175.
Primary histocyte culture and chromosome karyotype analysis of Pomacea canaliculata
LI Xu-jie,ZHANG Fu-zhou,ZOU Xiang-hui,YANG Dong-juan,ZHA Guang-cai
(School of Food Engineering and Biotechnology,Hanshan Normal University,Chaozhou 521041,China)
Pomacea canaliculata’s muscle,mantle,kidney and brain tissues were aseptic separated by trypsin digestion and grinding method. Cells were primary cultured with DMEM,F12 and modified 1640 medium.The growing status was observed under light microscope. The cell viability was determined by MTT method. After a certain time,chromosome preparation and chromosome karyotype analysis were conducted. Results showed that there was significant difference in histocytes viability among different culture medium. The better viability of mantle and muscle histocytes was cultured with DMEM medium containing hydrolyzed milk protein. The better viability of mantle and brain histocytes was cultured with M199 medium. In karyotype analysis,results showed that P. canaliculata was diploid (2n = 28,NF = 56). The nuclear type was 2B and the nuclear asymmetry coefficient was 66.4%
Pomacea canaliculata;primary culture;chromosome;karyotype analysis
S917.4
A
1004-874X(2017)08-0127-06
李绪杰,张福周,邹湘辉,等. 福寿螺组织细胞原代培养及染色体核型分析[J].广东农业科学,2017,44(8):127-132.
2017-06-17
中国科学院环境化学与生态毒理学国家重点实验室开放基金(KF2016-28);广东省大学生科技创新培育专项(pdjh2017b0330);广东省教育厅科技创新项目(2013KJCX 0126);潮州市科技引导计划项目(2014SF02)
李绪杰(1996-),男,在读本科生,E-mail:854151550@qq.com
邹湘辉(1976-),男,博士,教授,E-mail:zxh11043@126.com
(责任编辑 崔建勋)
