饮酒通过内质网应激促进小鼠乳腺癌恶性进展
2017-12-22朱佩刘亚坤姜玉汪思应
朱佩,刘亚坤,姜玉,汪思应
(安徽医科大学基础医学院病理生理学实验室,合肥 230032)
研究报告
饮酒通过内质网应激促进小鼠乳腺癌恶性进展
朱佩,刘亚坤,姜玉,汪思应*
(安徽医科大学基础医学院病理生理学实验室,合肥 230032)
目的通过动物实验及体外实验探索饮酒是否促进乳腺癌恶性进展,且这一作用是否与其诱导的慢性应激有关。方法利用小鼠乳腺癌移植瘤模型,体内观察2%乙醇慢性处理的小鼠乳腺癌E0771细胞对体内细胞生长转移的影响;利用体外细胞学实验观察0.2%乙醇慢性诱导对小鼠乳腺癌细胞E0771增殖、迁移及非锚定生长能力的影响;同时用分子生物学方法探索细胞内ROS水平及慢性内质网应激蛋白如p-eIF2a、Bip、XBP1-s等蛋白表达水平是否发生改变。结果与对照组相比,饮酒组小鼠体内肿瘤生长速度加快,转移增加;体外酒精处理可以显著促进乳腺癌细胞增殖、迁移等恶性生物学行为,酒精慢性处理可以诱导ROS、内质网应激活化蛋白p-eIF2a、Bip、XBP1-s表达上升。结论饮酒可能通过诱导乳腺癌细胞内质网应激促进其恶性进展。
酒精;乳腺癌;内质网应激;小鼠
乳腺癌是全球女性最常见的恶性肿瘤之一,其发病率高[1,2],在全球范围内的发生率和死亡率也呈逐年上升趋势[3],目前对其治疗仍缺乏有效手段。肿瘤的发生发展是一个动态的过程[4],如肿瘤细胞的分化、增殖和转移[5],三者相互影响,并与周围基质息息相关[6]。除遗传因素外,环境因素是调控肿瘤的另一重要因素[7,8],大量研究表明:慢性应激、重金属污染、慢性炎症、过度饮酒等均与肿瘤发展密切相关。酒精早在很多年前即被国际癌症研究机构(International Agency for Research on Cancer,IARC)列为人类的I类致癌物[9],已被证实是影响癌症发展的多种危险因素之一[10-12]。
内质网应激 (endoplasmic reticulum stress,ERS)是机体应激时发生在细胞水平的最早期的反应[13],它和多种细胞进程有关,对维持细胞正常生理功能有重要作用[14]。内质网应激能促使内质网对蓄积在网腔内的错误折叠或未折叠蛋白的加工处理,从而更好维持细胞的正常功能并使之存活。但是,发生持续过度的内质网应激容易引起细胞凋亡[15,16]。据文献报道,内质网应激与多种疾病密切相关,包括神经系统退行性疾病、糖尿病、肿瘤等[17-19]。目前,肿瘤仍是人类面临的一大难题,在分子水平研究肿瘤与内质网应激之间的关系仍是当今热点。环境因素,癌基因的激活以及药物的干扰都能够引发内质网应激。大量研究表明,酒精与乳腺癌的发生息息相关。但关于饮酒是如何促进乳腺癌发展和转移及其恶性转化的机制仍然不清楚。本课题旨在通过低浓度的乙醇(0.2%)对乳腺癌细胞株E0771进行慢性诱导,建立诱导后的稳定细胞株然后检测其恶性生物学行为的改变。同时,我们构建了小鼠乳腺癌移植瘤及饮酒模型,体内观察饮酒(2%)对小鼠乳腺癌生长转移的影响。通过体内与体外实验来共同探究细胞发生恶性转化是否与ERS相关。
1 材料与方法
1.1 材料
1.1.1 实验动物
6周龄SPF级雌性小鼠10只,体重18~22 g,购自湖南斯莱克景达实验动物有限公司【SCXK(湘)2011-0003】,实验于安徽医科大学动物房完成【SYXK(晥) 2011-007】。
1.1.2 试剂与仪器
小鼠乳腺癌细胞株E0771获赠自中科院上海细胞生物学研究所;DMEM(标准)培养基、胎牛血清、胰酶(Gibco,美国);MTT细胞增殖及细胞毒性试剂盒(KeyGen Biotech,中国);100 U/mL青霉素和100 μg/ mL链霉素(Hyclone,美国);细胞周期检测试剂盒/细胞活性氧检测试剂盒(Beyotime,中国);过硫酸铵AP、丙烯酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷Tris、十二烷基磺酸钠SDS(上海生工生物公司,中国);蛋白酶抑制剂(Roche,中国);抗β-actin单抗(#60008-1-Ig,Proteintech),抗Bip (#ab59364,Abcam)、抗XBP1-s (#25997-1-AP,Proteintech),抗p-eIF2a (#3398,Cell signaling)。二抗:HRP偶联的山羊抗鼠、HRP偶联的山羊抗兔 (Biosharp,中国)、PVDF膜 (Millipore,美国)、Western blot高灵敏度化学发光检测试剂盒(北京康为世纪生物科技有限公司,中国);Transwell小室(BD,美国);琼脂糖粉剂 (Biowest,美国)等,本研究中所用化学品均为分析纯。
1.2 方法
1.2.1 细胞培养与分组
E0771细胞接种于60 mm小皿,DMEM (含10%胎牛血清 + 1%青霉素-链霉素)培养,置于一定温度下,37℃ 5% CO2的恒温培养箱中培养。细胞为上皮样贴壁生长,每2~3 d换液或传代一次。取生长对数期细胞,随机分组(对照组、诱导组),每皿接种按1×105个细胞,待细胞贴壁后,向诱导组细胞中加入0.2%无水乙醇进行处理,传代,重复,持续至第21天。7、14 d的细胞给予冻存保种,取诱导到第21天的细胞进行生物学行为实验。
1.2.2 慢性酒精应激动物模型的建立
将10只6周龄大小的裸鼠随机分成2组,每组5只,分别记为实验组与对照组。将实验组小鼠的饮水中加2%无水乙醇,对照组正常饮水。接种经慢性诱导的E0771乳腺癌细胞以后,观察小鼠体内的肿瘤生长情况。分别在实验组和对照组裸鼠的左侧腋下皮下注射0.1 mL / 1×106细胞悬液。接种后每天观察裸鼠的生长情况,待裸鼠长出肿瘤后,每隔3 d测量肿瘤的体积,并且绘制肿瘤的生长曲线。肿瘤的体积计算公式:Tumor volume (mm3)=1/2 ab2(a=肿瘤最长径,b=肿瘤最短径),接种后第22天时处死裸鼠,取出裸鼠肿瘤组织,拍照称重。并解剖内脏,观察有无其他内脏转移。
1.2.3 细胞增殖检测-MTT实验
取对数期生长细胞 (对照组、诱导组) 以1×104/孔接种于96孔板中培养0、24、48、72 h后,每孔加5 mg/mL MTT溶液0.05 mL,37℃孵育。4 h后,吸弃上清,再按0.15 mL/孔加二甲基亚砜 (DMSO),孵育10 min。选择490 nm波长,检测吸光度A值。实验至少重复3次,对结果统计后分析。
1.2.4 检测细胞迁移能力-迁移实验
分组实验细胞,消化后用无血清培养基重悬后,按2×104/孔接种于带有8 μm微孔膜的Transwell小室的24孔板的上室,下室提前加入含10% FBS的DMEM培养液。常规培养6 h后收板,吸弃上清、PBS冲洗。4%多聚甲醛固定,再用0.2%结晶紫染色30 min,清洗脱色后棉签轻拭上室未迁移细胞,待晾干于倒置显微镜下随机观察每孔5个视野的细胞,并照相、统计分析,实验重复3次。
1.2.5 检测细胞非锚定生长能力-软琼脂集落形成实验
首先制备下层胶,将提前制备好的含1.5%的琼脂糖下层胶体与2× DMEM培养基按照1∶1等比例混合,在12孔板中每孔加入700 μL,室温待凝,然后消化计数离心细胞,重悬细胞制成单细胞悬液,再制备含0.75%的琼脂糖上层胶,上层胶也与2× DMEM培养基按照1∶1等比例混合,再加入细胞悬液,确保每孔加入500 μL的上层胶,每孔加入2000个细胞。室温待凝固后,再加入普通DMEM培养基1 mL保持琼脂湿润。然后放于孵箱中,常规培养2~3周左右。置于显微镜下观察,待软琼脂中出现白色集落时收板,用显微镜观察克隆形态,计数克隆数,在不同视野拍照保存。实验至少重复3次。
1.2.6 检测细胞应激反应能力-ROS生成实验
取实验组E0771细胞,常规消化收集细胞于15 mL离心管中(连同上清一起收集),15 000 r/min离心4 min,弃上清,PBS洗细胞2次。用无血清培养液DMEM按1000∶1配DCFH-DA (终浓度为10 μmol/L),每个样本加入1 mL DCFH-DA工作液,37℃,孵育30~50 min,每5 min上下颠倒混匀一次,离心收集细胞,PBS洗3次,弃尽上清,用500 μL PBS重悬细胞,流式细胞仪分析检测细胞。实验重复3次。
1.2.7 蛋白印迹法 (western blot) 检测ERS相关蛋白的表达
收集对数生长期E0771细胞沉淀,用RIPA裂解液(含蛋白酶抑制剂)裂解细胞提取总蛋白。后用BCA法测定蛋白质浓度,以每孔40 μg上样,根据目的蛋白大小配制SDS-PAGE凝胶(10%分离胶,5%浓缩胶),进行电泳(浓缩胶80 V,分离胶120 V)分离目的蛋白,完成后通过电转(200 mA,2 h)将蛋白转移到PVDF膜上。然后室温下,用TBST溶液(含5%脱脂奶粉)封闭2 h后,对应加入稀释过的一抗中(按说明书稀释1000~2000倍),4℃摇床孵育(过夜)。次日TBST洗膜10 min × 4次,常温在二抗(含5%脱脂奶粉的TBST溶液稀释过5000倍的辣根过氧化物酶)中孵育1 h后,再次洗膜10 min×3次。利用增强的化学发光试剂盒进行ECL检测目的蛋白,实验至少重复3次。
1.3 统计学处理

2 结果
2.1 慢性饮酒促进了乳腺癌细胞在裸鼠体内的生长转移
为了研究慢性饮酒对乳腺癌细胞在裸鼠体内的生长和转移的影响,我们将实验组小鼠的饮水中加2%乙醇,对照组正常饮水。结果从生长曲线看出,慢性饮酒组裸鼠肿瘤的体积明显大于空白对照组肿瘤的体积(图1A)。慢性饮酒组,裸鼠的肿瘤大小和肿瘤的重量较之对照组明显升高(图1B)。解剖内脏,结果发现,慢性饮酒组小鼠的肺脏转移情况也明显高于对照组(图1C)。这一结果表明,慢性饮酒不仅促进了乳腺癌细胞在裸鼠体内的生长,还促进了乳腺癌细胞在裸鼠体内的转移。实验组与对照组进行比较,差异有显著性 (P<0.05),实验重复3次。
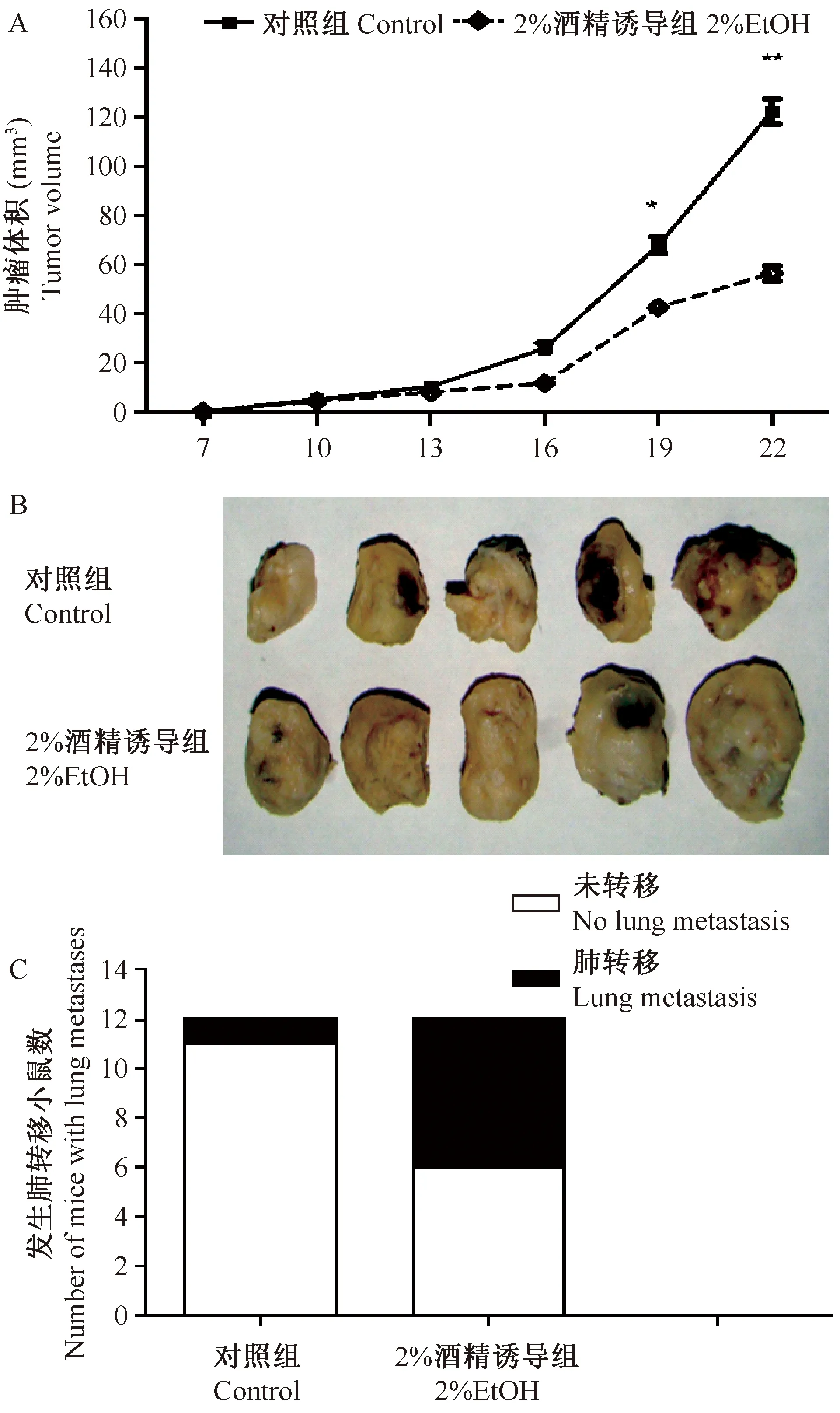
注:与对照组比较:*P<0.05,**P<0.01。图1 酒精慢性刺激对E0771乳腺癌细胞小鼠体内生长转移的影响Note.Compared with the control group,*P<0.05,**P<0.01.Fig.1 Effects of chronic ethanol consumption on the progression of breast cancer in nude mice
2.2 慢性酒精应激促进了E0771乳腺癌细胞的增殖能力
乳腺癌细胞E0771用0.2%乙醇慢性诱导21 d后,将细胞重新消化计数铺板做MTT增殖实验,如图2所示,随着时间的推移,实验组E0771乳腺癌细胞的体外增殖能力是增强的。实验组与对照组差异有显著性(P<0.05),实验重复3次。

图2 慢性酒精应激促进了乳腺癌细胞的增殖能力Fig.2 Chronic ethanol exposure promotes the proliferation ability of breast cancer cells
2.3 慢性酒精应激促进了E0771乳腺癌细胞的迁移和侵袭的能力
乳腺癌细胞E0771用0.2%乙醇慢性诱导21 d后,结果发现,实验组迁移和侵袭的速度比之对照组都明显升高(图3A),乳腺癌细胞迁移和侵袭数量明显增多(图3B)。差异有显著性(P<0.05),实验重复3次。
2.4 慢性酒精应激促进了E0771乳腺癌细胞的集落形成能力
乳腺癌细胞E0771用0.2%乙醇慢性诱导21 d后结果如图4所示,与对照组相比,实验组E0771乳腺癌细胞软琼脂集落形成能力明显增高。其集落形成的大小和数目都高于对照组。实验组与对照组相比,差异有显著性 (P<0.05),实验重复3次。
2.5 慢性酒精应激促进了E0771乳腺癌细胞对应激的反应
我们将实验组乳腺癌细胞E0771用0.2%乙醇慢性诱导21 d后,分别检测了对照组与实验组细胞的ROS水平。如图5A所示,与对照组相比,实验组E0771细胞的ROS水平明显高于对照组。Western实验表明,与对照组相比,酒精诱导组E0771乳腺癌细胞的内质网应激标记蛋白的表达上升(图5B)。
3 讨论
目前,在全球范围内,乳腺癌严重威胁世界女性的健康。研究认为,乳腺癌是遗传因素和环境因素共同作用的结果,环境因素在其中发挥关键作用。酒精,一种已被证实的环境致癌物质,其致病性主要来自长期饮酒。由于大量饮酒所造成的酒精急性中毒,可以使人丧命。少量饮酒所造成的慢性中毒对人体也极其有害,因此,饮酒的风险长期存在。有文献报道,慢性酒精应激可以通过激活p38γ信号通路促进乳腺癌细胞的侵袭以及可以通过激活肿瘤血管生成来促进肿瘤细胞的增长导致肿瘤恶化[20,21]。

图4 慢性酒精应激促进了乳腺癌细胞的集落形成能力Fig.4 Chronic ethanol exposure promotes the ability of soft agar colony formation of breast cancer cells
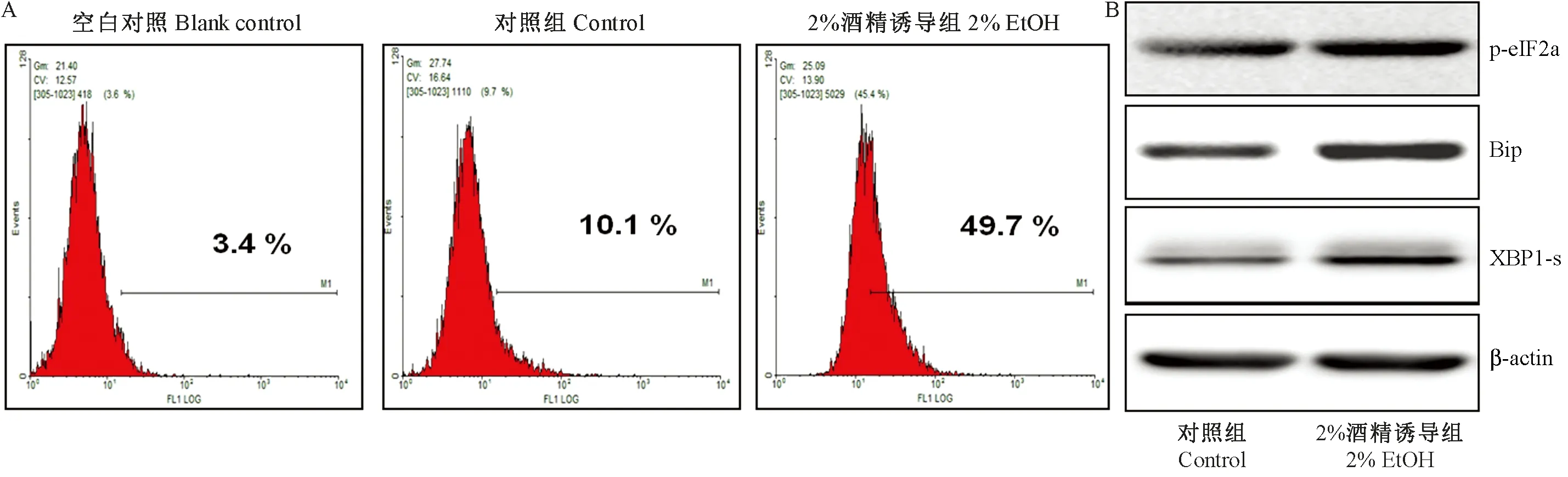
图5 酒精慢性应激促进了小鼠E0771乳腺癌细胞的应激反应Fig.5 Chronic ethanol exposure promotes the stress response of breast cancer cells
肿瘤的的恶性转化甚至90%以上癌症的相关死因都是由于癌细胞侵袭到周围的其他组织,向全身传播,并转移至远处器官形成继发性肿瘤[22]。所以,了解影响肿瘤恶性转化的分子机制十分必要。目前的研究表明,饮酒会大大增加患恶性肿瘤的风险,而酒精影响肿瘤发生的机制可能与其体内中间代谢产物乙醛生成、氧化应激、DNA碱基修饰或者DNA损伤等因素相关。体内体外的影响环节也不尽相同。在体内,酒精可以引起内分泌的改变,如雌激素、胰岛素等。在体外,饮酒可以引起肿瘤细胞的ROS应激,导致一系列肿瘤转录因子的活化,从而促进肿瘤细胞恶性生物学行为。内质网应激是机体应激时发生在细胞水平的最早期的反应,与机体的多种疾病密切相关,如神经退行性疾病、代谢类疾病、炎症反应和肿瘤[23,24]。内质网是广泛存在于真核细胞中的一种重要细胞器,也是钙离子的储存库,和多种细胞进程有关[25]。它主要调节细胞内蛋白质合成后的折叠与加工,细胞对应激的反应以及细胞内钙离子的水平。钙离子稳态改变和蛋白质错误折叠或者折叠过多以及环境因素,癌基因的激活以及药物的干扰都能够引发内质网应激,从而开启未折叠蛋白反应 (unfolded protein response,UPR)[26-28],UPR是体内的一种自我保护机制。适当的UPR能够保护细胞免受凋亡,而过度的UPR则会引发一系列级联反应,最终使细胞发生凋亡[29]。目前在分子机制上研究内质网应激与肿瘤的恶性转化是当今的热点之一。
大量文献报道酒精慢性诱导肿瘤细胞会促进肿瘤细胞的恶性生物学行为[30,31],这其中也包括酒精慢性刺激对乳腺癌细胞的恶性生物学的影响。本课题组旨在通过低浓度酒精刺激,建立诱导后的稳定乳腺癌细胞株E0771模型,以探究其恶性生物学行为的改变,同时,我们构建了小鼠乳腺癌移植瘤及饮酒模型,体内观察饮酒对小鼠乳腺癌生长转移的影响。并对体内与体外实验共同研究其机制是否与内质网应激相关。我们通过一系列的生物学行为实验、Western实验以及体内实验,证明饮酒可以通过内质网应激促进小鼠乳腺癌恶性生物学进展。
饮酒可以通过慢性应激促进小鼠乳腺癌恶性进展,这一发现有助于更好解释酒精与乳腺癌细胞生长、转移之间的相互关系。并且,4-PBA (4-苯基丁酸)是内质网应激的抑制剂,可以在一定程度上抵抗酒精引起的慢性应激。于是,我们将通过用4-PBA 预处理乙醇诱导的E0771乳腺癌细胞,并进行相关的行为学和动物学实验验证4-PBA对乙醇诱导的慢性应激的逆转作用。
以上这些新观点可能为乳腺癌的临床防治提供新思路,我们还试图寻找其他的一些酒精慢性应激乳腺癌的信号通路,去评估饮酒人群的肿瘤恶性进展的风险。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2016 [J].CA Cancer J Clin,2016,66 (1): 7-30.
[2] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012 [J].CA Cancer J Clin,2015,65 (2): 87-108.
[3] Mariotto AB,Etzioni R,Hurlbert M,et al.Estimation of the number of women living with metastatic breast cancer in the United States [J].Cancer Epidemiol Biomarkers Prev,2017,26(16):809-815.
[4] Hanahan D,Weinberg RA.Hallmarks of cancer: the next generation [J].Cell,2011,144 (5): 646-674.
[5] Luo G,Hu N,Xia X,et al.RPN11 deubiquitinase promotes proliferation and migration of breast cancer cells [J].Mol Med Rep,2017,16 (1):331-338
[6] Hu Z,Fang H,Wang X,et al.[Corrigendum] Overexpression of SHP2 tyrosine phosphatase promotes the tumorigenesis of breast carcinoma [J].Oncol Rep,2017,37 (4): 2522-2522.
[7] Sun JL,Chen DL,Hu ZQ,et al.Arsenite promotes intestinal tumor cell proliferation and invasion by stimulating epithelial-to-mesenchymal transition [J].Cancer Biol Ther,2014,15(10): 1312-1319.
[8] Derksen TM,Bours MJ.Lifestyle-related factors in the self-management of chemotherapy-induced peripheral neuropathy in colorectal cancer: a systematic review [J].2017,2017: 7916031.
[9] Boeing H.Alcohol and risk of cancer of the upper gastrointestinal tract: first analysis of the EPIC data [J].IARC Sci Publ,2002,156: 151-154.
[10] Mercer KE,Hennings L,Sharma N,et al.Alcohol consumption promotes diethylnitrosamine-induced hepatocarcinogenesis in male mice through activation of the Wnt/beta-catenin signaling pathway [J].Cancer Prev Res (Phila),2014,7 (7): 675-685.
[11] Kohn-Gaone J,Gogoi-Tiwari J,Ramm GA,et al.The role of liver progenitor cells during liver regeneration,fibrogenesis,and carcinogenesis [J].Am J Physiol Gastrointest Liver Physiol,2016,310 (3): G143-154.
[12] Wang Y,Xu M,Ke ZJ,et al.Cellular and molecular mechanisms underlying alcohol-induced aggressiveness of breast cancer [J].Pharmacol Res,2017,115: 299-308.
[13] Lindholm D,Korhonen L,Eriksson O,et al.Recent insights into the role of unfolded protein response in ER stress in health and disease [J].Front Cell Dev Biol,2017,5: 48-64.
[14] Xu Q,Chen C,Lin A,et al.Endoplasmic reticulum stress-mediated membrane expression of CRT/ERp57 induces immunogenic apoptosis in drug-resistant endometrial cancer cells [J].Oncotarget,2017,8(35):58754-58764.
[15] Gong J,Wang XZ,Wang T,et al.Molecular signal networks and regulating mechanisms of the unfolded protein response [J].J Zhejiang Univ Sci B,2017,18 (1): 1-14.
[16] Song S,Tan J,Miao Y,et al.Crosstalk of autophagy and apoptosis: involvement of the dual role of autophagy under stress [J].J Cell Physiol,2017.232(11): 2977-2984
[17] Inceoglu B,Bettaieb A,Trindade da Silva CA,et al.Endoplasmic reticulum stress in the peripheral nervous system is a significant driver of neuropathic pain [J].Proc Natl Acad Sci U S A,2015,112 (29): 9082-9087.
[18] Duivenvoorden WCM,Hopmans SN,Austin RC,et al.Endoplasmic reticulum protein ERp46 in prostate adenocarcinoma [J].Oncol Lett,2017,13 (5): 3624-3630.
[19] Su D,Ma J,Yang J,et al.Monosialotetrahexosy-1 ganglioside attenuates diabetes-associated cerebral ischemia/reperfusion injury through suppression of the endoplasmic reticulum stress-induced apoptosis [J].J Clin Neurosci,2017,41: 54-59.
[20] Lu Y,Ni F,Xu M,et al.Alcohol promotes mammary tumor growth through activation of VEGF-dependent tumor angiogenesis [J].Oncol Lett,2014,8 (2): 673-678.
[21] Xu M,Ren Z,Wang X,et al.ErbB2 and p38gamma MAPK mediate alcohol-induced increase in breast cancer stem cells and metastasis [J].Mol Cancer,2016,15 (1): 52-66.
[22] Gupta GP,Massague J.Cancer metastasis: building a framework [J].Cell,2006,127 (4): 679-695.
[23] Chevet E,Hetz C,Samali A.Endoplasmic reticulum stress-activated cell reprogramming in oncogenesis [J].Cancer Discov,2015,5 (6): 586-597.
[24] Sprenkle NT,Sims SG,Sanchez CL,et al.Endoplasmic reticulum stress and inflammation in the central nervous system [J].Mol Neurodegener,2017,12 (1): 42-60.
[25] Pitts MW,Hoffmann PR.Endoplasmic reticulum-resident selenoproteins as regulators of calcium signaling and homeostasis [J].Cell Calcium,2017.In Press,Corrected Proof
[26] de Freitas Junior JC,Silva Bdu R,de Souza WF,et al.Inhibition of N-linked glycosylation by tunicamycin induces E-cadherin-mediated cell-cell adhesion and inhibits cell proliferation in undifferentiated human colon cancer cells [J].Cancer Chemother Pharmacol,2011,68 (1): 227-238.
[27] Tanimura A,Yujiri T,Tanaka Y,et al.Activation of the unfolded protein response in primary acute myeloid leukemia cells [J].Int J Hematol,2011,94 (3): 300-302.
[28] Martins AS,Alves I,Helguero L,et al.The unfolded protein response in homeostasis and modulation of mammalian immune cells[J].Int Rev Immunol,2016,35 (6): 457-476.
[29] Mahadevan NR,Rodvold J,Sepulveda H,et al.Transmission of endoplasmic reticulum stress and pro-inflammation from tumor cells to myeloid cells [J].Proc Natl Acad Sci U S A,2011,108 (16): 6561-6566.
[30] Yu K,Yang J,Wang F,et al.Ethanol supports macrophage recruitment and reinforces invasion and migration of Lewis lung carcinoma [J].Alcohol Clin Exp Res,2014,38 (10): 2597-2606.
[31] Wang S,Xu M,Li F,et al.Ethanol promotes mammary tumor growth and angiogenesis: the involvement of chemoattractant factor MCP-1 [J].Breast Cancer Res Treat,2012,133 (3): 1037-1048.
Ethanolpromotestheprogressionofbreastcancerinmicebyactivatingendoplasmicreticulumstress
ZHU Pei,LIU Ya-kun,JIANG Yu,WANG Si-ying*
(Department of Pathophysiology,Basic Medical College,Anhui Medical University,Hefei 230032,China)
ObjectiveEpidemiological studies have suggested that alcohol drinking is closely associated with diverse tumor development,but fewer laboratory studies or mechanism analysis is made.Our study aims to explore the effect of alcohol on the tumorigenicity and metastasis of breast cancer in nude miceinvivoand on the malignant behaviorinvitro,and whether it is related to endoplasmic reticulum stress (ERS).MethodsWe first established the nude mouse model of breast cancer with chronic alcohol consumption (2%) and to detect the effects of ethanol on tumor growth and metastasis.We also observed the changes of malignant biological behavior of EO771 cells in cell culture induced by chronic alcohol treatment (0.2%) using MTT,Transwell and soft agar tests,and detect the expression of ROS and ERS marker,i.e.p-eIF2a,Bip,and XBP1-s.ResultsTheinvivoexperiment showed that alcohol drinking enhanced the growth and metastases of breast cancer in nude mice.Theinvitrotest showed that chronic exposure to ethanol also promoted the cell proliferation and migration ability,increased the ROS expression,activated ERS pathway,and enhanced the expression of p-eIF2a,Bip and XBP1-s.ConclusionsAlcohol drinking may promote the malignant behavior of breast cancer cells through endoplasmic reticulum stress.
Ethanol; Breast cancer; Endoplasmic reticulum stress; Mice
WANG Si-ying.E-mail: sywang@ahmu.edu.cn
国家自然科学基金(No.30973424,No.81272258)。
朱佩(1990-),女,硕士研究生,专业:病理学与病理生理学。Email: 615884940@qq.com
汪思应(1963-),男,博士生导师,研究方向:肿瘤分子生物学。E-mail: sywang@ahmu.edu.cn
Q95-33
A
1005-4847(2017) 06-0605-07
10.3969/j.issn.1005-4847.2017.06.004
2017-03-03
