长爪沙鼠体外受精与早期胚胎体外培养体系的初步建立
2017-12-22郭红刚李莉周生来卢领群李坤杜江涛石巧娟金秀清李长龙萨晓婴应华忠褚晓峰
郭红刚,李莉,周生来,卢领群,李坤,杜江涛,石巧娟,金秀清,李长龙,萨晓婴,应华忠,褚晓峰*
(1.浙江省医学科学院,浙江省实验动物与安全性研究重点实验室, 杭州 310013; 2.杭州市疾病预防控制中心,杭州 3100212; 3.中国医科大学实验动物部, 沈阳 110001; 4.首都医科大学基础医学院, 北京 100069)
研究报告
长爪沙鼠体外受精与早期胚胎体外培养体系的初步建立
郭红刚1,李莉2,周生来3,卢领群1,李坤1,杜江涛1,石巧娟1,金秀清1,李长龙4,萨晓婴1,应华忠1,褚晓峰1*
(1.浙江省医学科学院,浙江省实验动物与安全性研究重点实验室, 杭州 310013; 2.杭州市疾病预防控制中心,杭州 3100212; 3.中国医科大学实验动物部, 沈阳 110001; 4.首都医科大学基础医学院, 北京 100069)
目的探讨自配的获能液和受精液用于长爪沙鼠体外受精的可行性,为长爪沙鼠的胚胎保种提供参考。方法用自配的获能液和受精液对长爪沙鼠进行体外受精,并用改良后的KSOM培养液对长爪沙鼠的2细胞胚胎进行体外培养试验。结果长爪沙鼠体外受精率在60%以上,沙鼠2细胞胚胎能够在体外进一步发育。结论初步建立了长爪沙鼠体外受精和胚胎发育体系,但需要进一步优化。
长爪沙鼠;体外受精;体外培养
长爪沙鼠 (Mongolian gerbil,Merionesunguiculatus)是研究神经学、寄生虫学、病毒学、细菌学、内分泌学、遗传学、血液学、脂类、糖代谢、肿瘤学、药理学、放射生物学、生殖和毒理学的良好模型动物,具有很高的科研价值和应用前景,有望成为一个有中国特色的实验动物新品系[1-5]。采用传统的保种方法,消耗大量人力物力资源,而且自然灾害、意外微生物污染都可能使这些宝贵品系毁于一旦,特殊的表型在繁育过程中也可能由于遗传漂变而丧失,因此对其胚胎进行冷冻保存是未来沙鼠资源保种的主要方式,这就需要有大量的胚胎,体外受精正是获得大量胚胎的有效途径。因为长爪沙鼠精子与胚胎体外培养的特殊性,相关研究一直进展缓慢,迄今为止,仍未找到适合于长爪沙鼠精子体外获能、体外受精和胚胎体外发育的培养液。
我们采用计算机辅助分析系统(computer-assisted sperm analysis,CASA)对长爪沙鼠精子在自配的获能液中不同时间精子运动参数进行测量,最终确定获能时间大致在4~5 h,随后的体外受精结果也支持这一结论,在改良后的KSOM培养液中,部分胚胎可以发育到桑葚胚。我们初步建立了长爪沙鼠体外受精和体外发培养体系,为长爪沙鼠的冷冻保种提供了有力的支持,但该体系需要进一步完善。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雌性长爪沙鼠,2~3月龄,雄性长爪沙鼠5月龄,由浙江省实验动物中心提供【SCXK(浙)2008-0033】,实验在浙江省实验动物中心进行【SYXK(浙)2008-0113】,并按实验动物使用的3R原则给予人道的关怀。动物饲养设施光照周期为7:00-19:00光照,19:00-7:00黑暗。长爪沙鼠饲喂辐照料,饮用超滤水,笼器具、垫料等均经121℃高压灭菌,饲养环境温度20~25℃,湿度40%~60%。
1.1.2 主要试剂和药品
体外获能液(实验室自配),组成成分为:NaCl、 KCl、 NaHCO3、葡萄糖、丙酮酸钠、 牛磺酸、 肾上腺素、 BSA、 MgCl2·6H2O、 NaH2PO4·2H2O、 CaCl2·2H2O、 酚红(0.5%)、 青霉素G、 硫酸链霉素及DL-乳酸钠溶液,pH值为(7.35±0.10),渗透压为(315±5)mOsm/kg。
体外受精液(实验室自配),组成成分除BSA加倍外,其余同体外获能液。M2培养基(M7167,Sigma),石蜡油(lotD357A,SAGE),孕马血清(PMSG,宁波),绒促性腺素 (HCG,宁波)。
1.1.3 仪器
CO2培养箱(Thermo),计算机辅助精液分析系统(CASA,Microptic,Barcelona,Spain),解剖显微镜(Leica,S8APO),洗卵管(自制),35 mm培养皿 (Corning,USA),100 mm培养皿(Corning,USA)。
1.2 方法
1.2.1 液滴平衡
取获能液和受精液在35 mm 培养皿中分别作获能液滴(300 μL/d)和受精液滴 (200 μL/d),用矿物油覆盖液滴,在使用前30 min平衡。
1.2.2 精子的获取、培养及长爪沙鼠精子获能时间确定
早上8:00,取4月龄有繁育能力的雄鼠,颈椎脱臼处死,腹部75%酒精消毒,打开腹腔,取附睾尾,用眼科剪将附睾尾周围的脂肪剥离,在灭菌滤纸上去除血迹和脂肪,用拇指和食指轻轻挤压附睾尾,同时用1 mL注射器针头刺破附睾尾,待破口处涌出乳白色的精子团后用1 mL注射器针头挑出约30 μL精子团,置于预先平衡好的液滴中,在5% CO2、饱和湿度100%、37℃培养箱中培养0、2.5、4.5、5.5 h。
我们采用计算机辅助精子质量分析系统对长爪沙鼠精子在自配的获能液中不同时间精子运动参数进行测量(参数设定见图1),精子运动参数包括直线运动速度VSL(straight-line velocity,μm/s)是观察时间内精子从运动起点到运动终点的直线距离对观察时间的比;曲线速度VCL(curvilinear-velocity,μm/s)是精子在观察时间内所经过的实际运动轨迹距离总和对观察时间的比;平均运动路径速度VAP (average path velocity,μm/s)是精子在观察时间内的平均轨迹距离总和对观察时间的比;直线性LIN(linearity,LIN=VSL/VCL,)表征精子实际所走路径的曲折程度,值越大表示路径越直,值越小表示越弯,并且取值范围在0-1之间;前向性STR(straightness,STR=VSL/VAP),表征精子向前运动的程度,值越大表示精子前向能力越好,值越小表示精子可能在原地打转,取值范围在0-1之间;侧摆幅度ALH (lateral amplitude,μm):精子在运动过程中实际运动轨迹相对其平均移动轨迹的偏移幅度;鞭打频率BCF(beat cross frequency)精子曲线运动轨迹越过其平均路径轨迹的次数对观察时间的平均,各参数的几何意义如图1中CELL TRACK REFERENCE所示。照相速度60帧/秒,数据为6帧连续照片的平均值。
1.2.3 卵子的超排与获取
第0天下午5点取雌鼠,腹腔注射PMSG,剂量为每只40 IU,第4天下午8点取雌鼠,腹腔注射HCG,剂量为每只40 IU,HCG注射后16 h,将雌鼠用颈椎脱臼法处死,75%乙醇消毒腹部,打开腹腔,取出输卵管置于液滴培育皿的矿物油内,于显微镜下划破输卵管膨大部,收集卵丘团于液滴内。
1.2.4 体外受精
取8 μL精子加入受精皿内,37℃培养箱中受精8~9 h。
1.2.5 受精结果检查
受精培养8~9 h后将卵子移出,置于受精液中洗3遍,移入预先平衡的发育液中继续培养48 h 后观察2-细胞发育率。
1.2.6 胚胎的体外培养
我们改变KSOM培养液中BSA的浓度和渗透压,观察2细胞在其中的发育情况。
1.3 统计学检验
统计学分析所有试验数据用均数±标准差表示,用SPSS 11.0软件中的One-Way ANOVA进行单因素方差分析,两两比较采用LSD检验,P<0.05为差异有显著性。
2 结果
2.1 超排卵结果
超数排卵时我们一般不考虑其性周期,每只用40 IU的激素进行超排,二次激素间隔在96~100 h,每只沙鼠平均采卵数约20枚。
如果考虑性周期,我们数据表明,在发情后期进行超排效果较好,见表1。在激素间隔为96 h条件下,孕马血清和促绒毛膜性腺激素剂量分别为60 IU和80 IU,我们选用5月龄长爪沙鼠,在孕马血清注射前做了阴道涂片来判断激素注射时动物的发情状况,长爪沙鼠发情周期判定标准见图2。
2.2 长爪沙鼠精子的获能培养
沙鼠精子获能前运动轨迹呈之字形,获能后运动轨迹呈8字形,超激活前后的运动轨迹见图3~4。除了观察沙鼠运动方式外,我们用金霉素荧光染色法技术对沙鼠精子获能状态进行了观察, CTC染色后所有精子尾部均染上黄绿色荧光,未获能精子顶体完整,整个精子头部呈强烈的黄绿色荧光(图5),获能后荧光显著减弱甚至消失(图6)。
计算机辅助分析系统(CASA)结果表明,在我们实验室条件下沙鼠精子获能时间为4~5 h,平均曲线速度(VCL)最快,为(300.2±9.19)μm/s,因此我们把长爪沙鼠获能时间确定为4~5 h,结果见表2。
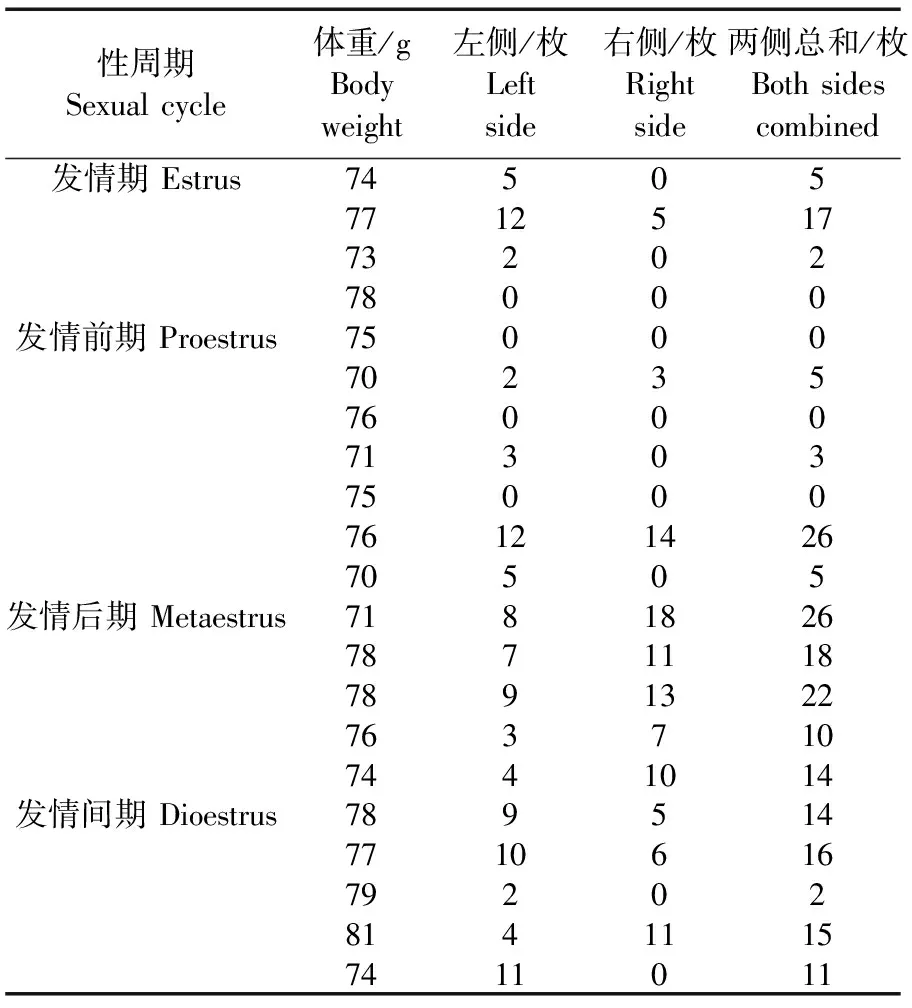
表1 5月龄长爪沙鼠不同性周期超排结果Tab.1 Results of superovulation of the 5-month old gerbils
2.3 长爪沙鼠体外受精
2.3.1 长爪沙鼠体外受精过程中雄原核和雌原核的观察
体外受精后8~9 h在清洗胚胎时可以看到雄原核和雌原核,见图7~8。
2.3.2 长爪沙鼠体外受精结果
体外受精48 h后观察2-细胞发生率 (图9),实验重复4次,2细胞发育率从65%到85%。
2.4 长爪沙鼠2-细胞胚胎的体外发育
2.4.1 体内受精后获得的2-细胞在体外发育
我们选用无BSA的KSOM培养基作沙鼠胚胎体外发育的基础培养液,在其中添加不同浓度的BSA,观察胚胎在其中的发育。沙鼠超排后与雄鼠合笼,10只动物中4只(体重分别55、60、65、66 g)见栓,见栓后第2天取卵,在BSA分别为0、1、4、8 mg/mL 的KSOM液中培养,结果见表3,图10。
长爪沙鼠体内受精后在渗透压分别为260、290、300 mOsm/k的KSOM中培养,培养第0天和第4天结果见表4,在渗透压为290 mOsm/kg的KSOM液中胚胎发育见图11。

注:A.发情间期;B.发情前期;C.发情期;D.发情后期。图2 长爪沙鼠发情周期Note.A.Dioestrus phase; B.Pre-estrus phase; C.Estrus phase; D.Metaestrus phase.Fig.2 The Mongolian gerbil estrus cycle
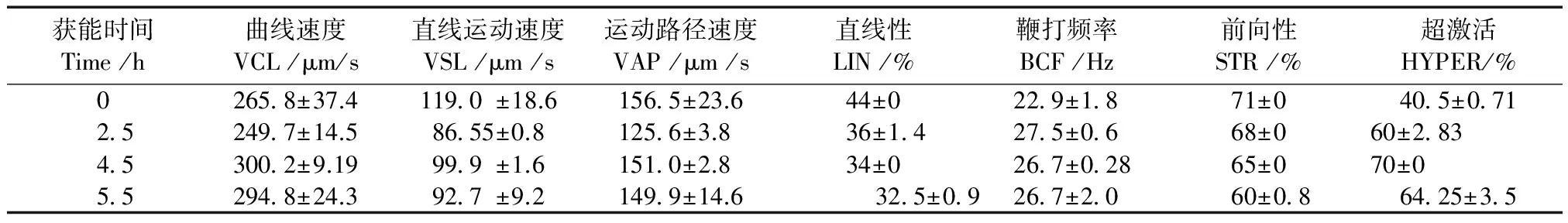
表2 利用计算机辅助分析技术对长爪沙鼠精子在自配的获能液中不同时间运动参数分析Tab.2 Analysis of the time motion parameters of gerbil sperm in the self-prepared liquid detected by computer-assisted analysis
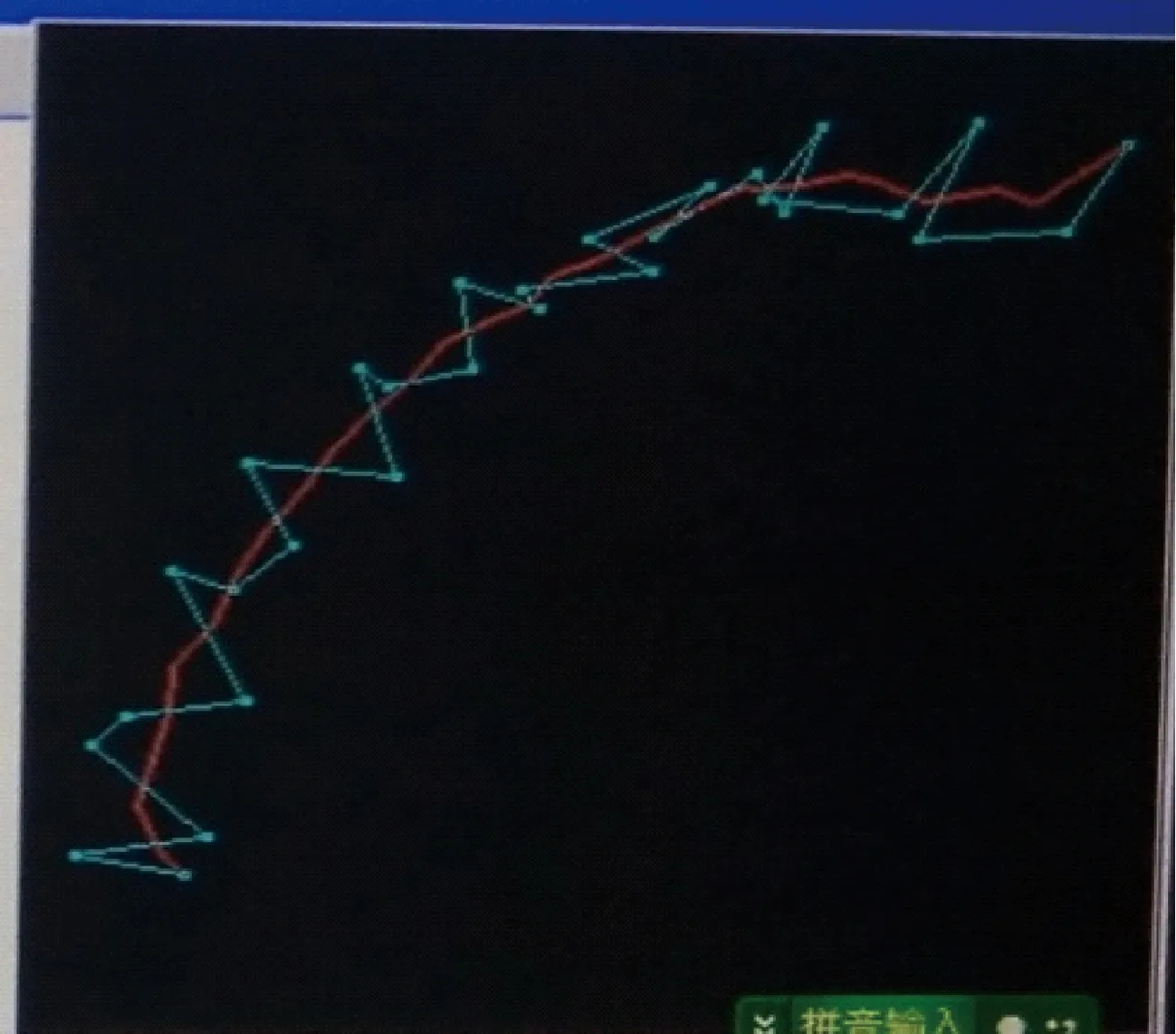
图3 沙鼠精子超激活前Fig.3 Before sperm hyperactivation
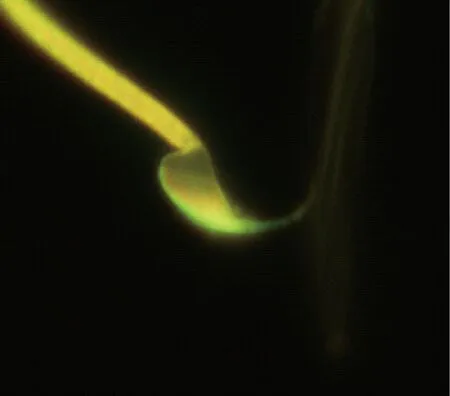
图5 获能前精子Fig.5 A sperm before capacitation
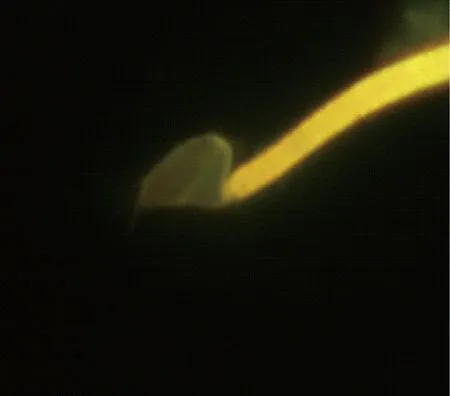
图6 获能后精子Fig.6 A sperm after capacitation

图7 长爪沙鼠体外受精8~9 h雄原核和雌原核Fig.7 In vitro fertilization of Mongolian gerbils for 8-9 hours,male and female pronuclei
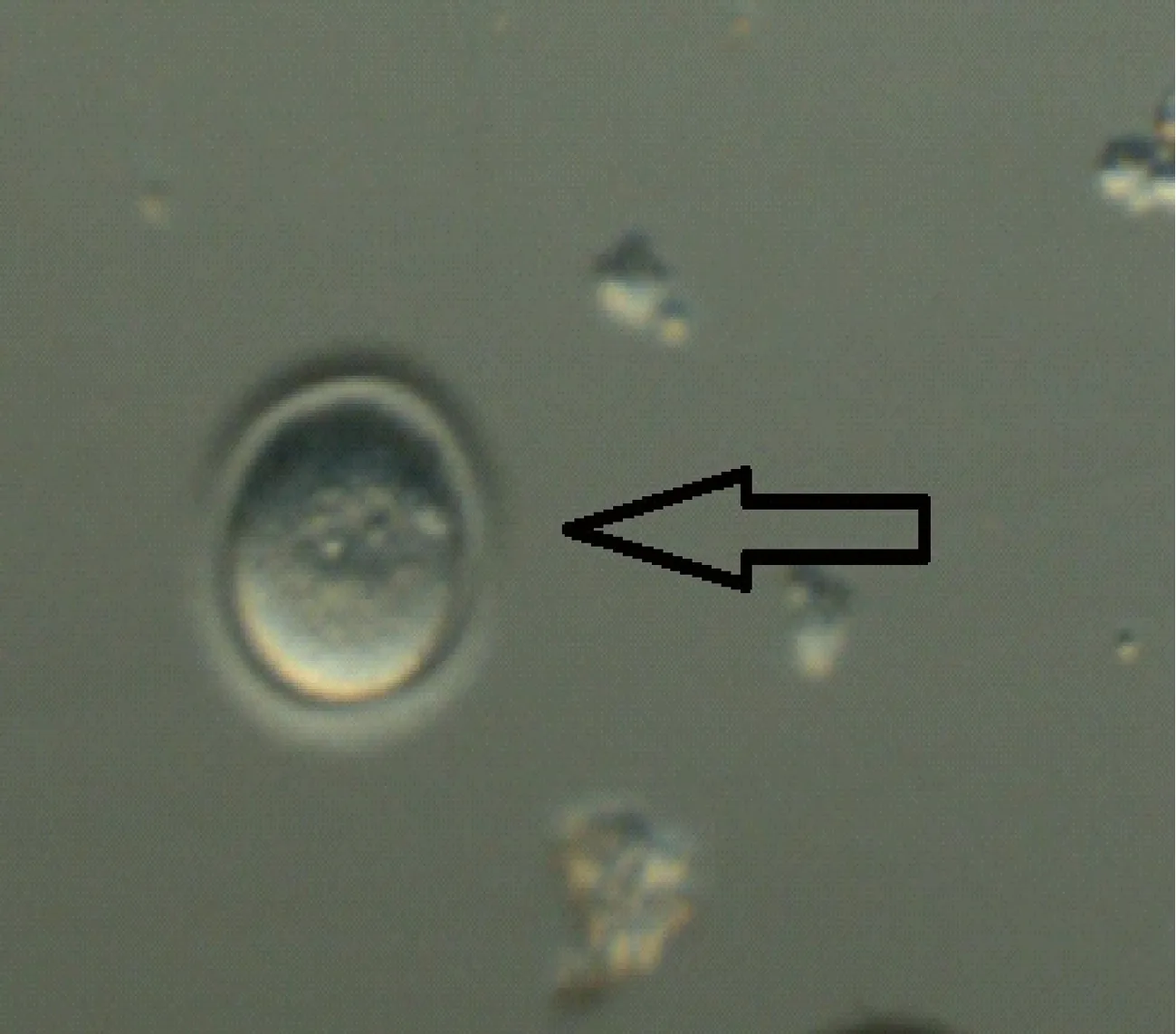
图8 长爪沙鼠体外受精8~9 h雄原核和雌原核Fig.8 In vitro fertilization of Mongolian gerbils for 8-9 hours,male and female pronuclei

注:沙鼠2细胞发育率分别为A.65%;B.71%;C.73%;D.85%。图9 沙鼠2细胞发育率Note.Crowth rates of gerbils two cells were A.65%,B.71%,C.73%,D.85%Fig.9 Gerbil two-cell growth rates
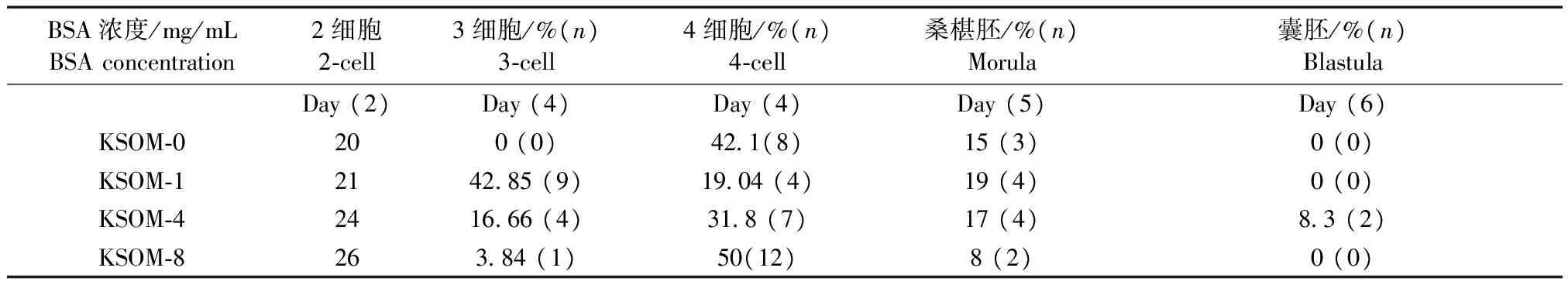
表3 长爪沙鼠体内受精后胚胎体外发育Tab.3 In vitro embryo development of the gerbils after in vivo fertilization
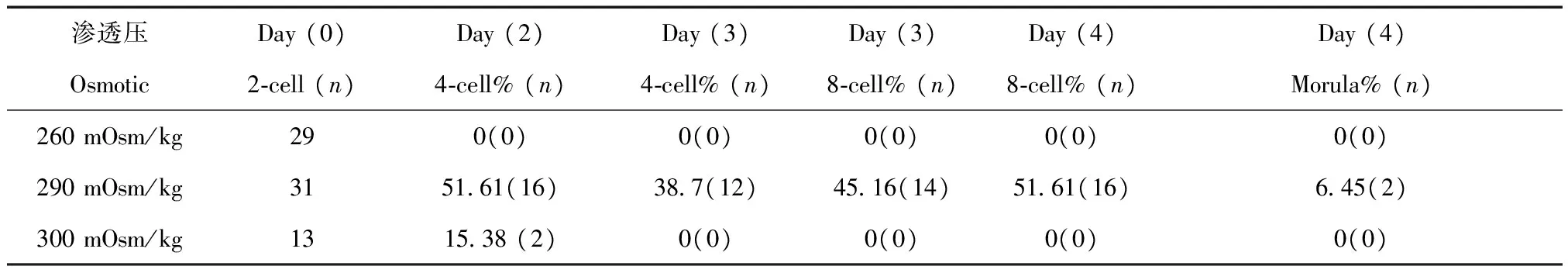
表4 体内受精后2-cell在不同渗透压的KSOM液中发育Tab.4 Development of 2-cells in different osmotic KSOM medium after fertilization in vivo

注:A.BSA-0 mg/mL组,培养第0天,见栓第2天;B.BSA-0 mg/mL组,培养第4天,3个桑葚胚;C.BSA-1 mg/mL组,培养第0天,见栓第2天;D.BSA-1 mg/mL组,培养第4天,4个桑葚胚;E.BSA-4 mg/mL组,培养第0天,见栓第2天;F.BSA-4 mg/mL组,培养第4天,2个囊胚;G.BSA-8 mg/mL组,培养第0天,见栓第2天;H.BSA-8 mg/mL组,培养第4天,2个桑葚胚。图10 长爪沙鼠体内受精后在不同BSA浓度的KSOM液中发育Note.A:BSA-0 mg/mL group,Culture at day 0,twenty 2-cells;B:BSA-0 mg/mL group, culture at day 4,three morulas; C: BSA-1 mg/mL group,culture at day 0,twenty-one 2-cells;D: BSA-1 mg/mL group,culture at day 4,four morulas; E: BSA-4 mg/mL group,culture at day 0,twenty-four 2-cells; F: BSA-4 mg/mL group,culture at day 4,two blastulas); G: BSA-8 mg/mL group,culture at day 0,twenty-six 2-cells;H: BSA-8 mg/mL group,culture at day 4,two morulas).Fig.10 Development of 2-cells in different concentrations of BSA in KSOM medium after fertilization in vivo
2.4.2 体外受精后体外培养
长爪沙鼠体外受精后在BSA浓度分别为4、8、 20 mg/mL 的KSOM液培养,培养第0天和第3天结果见表5。

注:A.培养第0天;B.培养第2天;C.培养第4天。图11 渗透压为290 mOsm/kg的KSOM中胚胎发育Note.A.Culture day 0;B.Culture day 2;C.Culture day 4.Fig.11 Development of 2-cells in the 290 mOsm/kg KSOM culture medium after fertilization in vivo
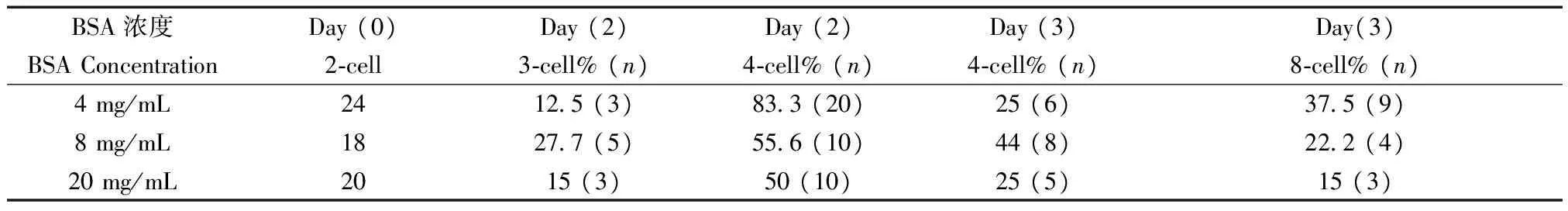
表5 体外受精后2-cell在改良后的KSOM中发育Tab.5 Development of 2-cells in the modified KSOM culture medium after in vitro fertilization
3 讨论
3.1 实验长爪沙鼠的超数排卵
超数排卵技术是利用促性腺激素刺激卵泡,卵巢中的优势卵泡数目增加,从而增加排卵数,超排处理是保证体外受精卵源的重要条件。正常长爪沙鼠性周期4~7 d[6],长爪沙鼠的超排不像小鼠那样稳定集中,且不同发情周期的长爪沙鼠对激素的感应性不同,导致成年长爪沙鼠的超排个体间差异显著。对于长爪沙鼠的超排,我们实验室使用宁波第二激素厂生产的孕马血清和促绒毛膜性腺激素,激素剂量为40 IU,体内受精间隔为96 h,体外受精激素间隔为100 h,平均超排卵20枚左右。考虑性周周期的话,我们数据表明发情后期开始激素处理效果较好。一般情况下,3月龄左右,体重50 g的雌性沙鼠即可达到性成熟,在雄性沙鼠的诱导下,即可进入发情周期。发情期的沙鼠阴道口大开,阴门红肿,有时发紫,阴道口湿润,有时阴道口可见白色分泌物,愿接受雄鼠爬跨,阴道涂片观察可见角质细胞很多,有时夹杂有核细胞,另有很多梭状黏液混杂其中;而间情期的雌鼠阴道口关闭或开口很小,涂片中有少量的白细胞及有核细胞;发情前期阴道口开,粉红色,阴道口有时湿润,涂片中有很多有核细胞、少量角质细胞,有时有梭状黏液;发情后期阴道口开,有消肿迹象,发情后期的早期角质细胞很多,成块,晚期白细胞多,角质细胞少,有死亡的有核细胞(图2)。
3.2 实验长爪沙鼠精子的获能
哺乳动物精子在受精前其运动方式发生了很大的变化。刚射出的精子不具备受精能力,需在雌性生殖道内或在合适的体外培养环境下完成获能,从而顺利受精。在此期间精子经历了复杂的生理变化,运动方式发生了很大的改变,运动更为激烈,呈“鞭打”、“小环形抛物”等形式,此过程称为超激活。一般认为精子超激活的意义主要在于有利于精子通过输卵管粘稠介质和穿越放射冠的弹性基质,增加精子摆脱输卵管上皮的能力,促使精子顺利地在输卵管中运行。沙鼠精子获能前运动轨迹呈“之”字形,获能后运动轨迹呈“8”字形。
我们使用计算机辅助分析系统对实验长爪沙鼠精子在自配的获能液中不同时间精子运动参数进行测量,初步发现精子获能时间在本实验室自配的获能液中4~5 h后运动速度最大,之后速度变小,提示我们在我们实验室条件下,沙鼠精子获能时间为4~5 h。精子获能的目的最终还是为了受精,所以IVF和人工受精也许是最令人信服的评价精子获能情况以及受精后胚胎的发育能力,但是卵母细胞的质量、培养系统、实验条件、雌性动物的健康状况、生理特征等都可以影响到体外受精的结果,因此实验中一定要消除这些不稳定因素的影响,另外还要结合其他指标才能对精子功能做出客观的评价。
3.3 实验长爪沙鼠的体外受精
目前长爪沙鼠胚胎来源主要是超排后体内受精,体外受精技术国内未见报道。Mochida等[7]比较沙鼠的体外受精和显微注射的效果,其体外受精率11%,后来选择显微注射,提高为63%,但是显微注射需要昂贵的仪器。Kimura等[8]沙鼠体外受精率最高为29.8%,我们课题组在前期工作基础上,研发了长爪沙鼠体外受精的获能液和受精液及细化了体外受精方法,初步建成长爪沙鼠体外受精体系,该体系包括长爪沙鼠的超排、长爪沙鼠精子获能、体外受精等步骤,使用该体系,长爪沙鼠体外受精率可达到60%以上。
3.4 长爪沙鼠胚胎的体外发育
目前小鼠胚胎体外发育一般使用KSOM或者M16,我们选KSOM液作为基础发育培养液,在此基础上调整BSA的浓度和渗透压来观察长爪沙鼠胚胎的体外发育情况,在我们实验室条件下长爪沙鼠体外胚胎可以发育到桑葚胚,个别可以发育到囊胚,目前长爪沙鼠体外胚胎体外发育的培养液还未成熟,还需要进一步的研究。
[1] Arguello GR,Ortega PMG,Giardia D.Analysis of humoral immune response in experimentally infected gerbils (Merionesunguiculatus) [J].Arch Med Res,1997,28: 171-178.
[2] Cruz YR,Tamos YM,Cernuda AM,et al.Treatment with nasal neuro-EPO improves the neurological,cognitive and histological state in a gerbil model of focal ischemia [J].Sci World J,2010,10: 2288-2300.
[3] Segatelli TM,Franca LR,Pinheiro PF,et al.Spermatogenic cycle length and spermatogenic efficiency in the gerbil (Meriones unguiculatus) [J].J Androl,2004,25(6): 872-880.
[4] Lee CH,Yoo KY,Choi JH,et al.Cyclin D1 immunoreactivity changes in CA1 pyramidal neurons and dentate granule cells in the gerbil hippocampus after transient forebrain ischemia [J].Neurol Res,2011,33(1): 93-100.
[5] Gleich O,Weiss M,Strutz J.Age-dependent changes in the lateral superior olive of the gerbil (Meriones unguiculatus) [J].Hear Res,2004,194(1-2): 47-59.
[6] Pool,T.(ed.): The UFAW Handbook on the Care and Management of Laboratory Animals(6th edition),1987.Longman Scientific & Technical,Essex.p.369.
[7] Mochida K,Matsuda J,Ponce RH,et al.Invitrofertilization and intracytoplasmic sperm injection in the mongolian gerbil (Merionesunguiculatus) [J].Biocell,2004,28(2): 189.
[8] Kimura N,Sasaki M,Totsukawa K.Development of Mongolian gerbil embryos in chemically defined medium [J].Bull Yamagiwa Univ Agric Sci,2005,14(4):195-200.(In Japanese)
Establishmentofamodifiedinvitromongoliangerbiloocytefertilizationandembryoculturesystem
GUO Hong-gang1,LI Li2,ZHOU Sheng-lai3,LU Ling-qun1,LI Kun1,DU Jiang-tao1,SHI Qiao-juan1,JIN Xiu-qing1,LI Chang-long4,SA Xiao-ying1,YING Hua-zhong1,CHU Xiao-feng1*
(1.Zhejiang Academy of Medical Sciences,Zhejiang Experimental Animal and Safety Research Laboratory,Hangzhou 310013,China; 2.Hangzhou Disease Prevention and Control Center,Hangzhou 3100212; 3.Experimental Animal Department of China Medical University,Shenyang 110001; 4.Capital Medical University Basic Medical College,Beijing 100069)
ObjectiveTo investigate the feasibility of self-made capacitation liquid forinvitrofertilization of Mongolian gerbils,and to provide a reference for gerbil embryo cryopreservation.MethodsInvitrofertilization of Mongolian gerbil was performed with the self-prepared capacitation solution and semen,and the 2-cell embryos of Mongolian gerbils were culturedinvitrousing an improved KSOM culture medium.ResultsTheinvitrofertilization rate of gerbils was over 60%,and some gerbil 2-cell embryos could develop furtherinvitro.ConclusionsAninvitrofertilization and embryo development system of Mongolian gerbil has been established,but it needs further optimization.
Mongolian gerbil;Invitrofertilization;Invitroculture
CHU Xiao-feng.E-mail: sydw@zjinfo.gov.cn
国家科技支撑计划子课题(No.2015BA109B01-02);浙江省级公益性技术应用研究计划(No.2015C37119);浙江省卫生厅课题(No.2015KYB093)。
郭红刚(1976-)男,助理研究员,研究方向:实验动物学。E-mail: sxguohonggang@163.com
褚晓峰 (1952-),男,副研究员,研究方向:实验动物学。E-mail: sydw@zjinfo.gov.cn
Q95-33
A
1005-4847(2017) 06-0624-08
10.3969/j.issn.1005-4847.2017.06.007
2017-06-07
