超越线性监管 系统构建国家药品安全治理体系
2017-12-21胡颖廉慕玲
文 / 胡颖廉 慕玲
药品安全概念包括制药产业安全和药品质量安全两方面,前者属于国家安全范畴,指民众对药品种类和数量基本可及;后者被纳入公共安全领域,指药品生产缺陷、副作用、错误用药以及其他风险对人体健康不造成危害。
国家药品安全面临三大深层次问题
当前我国药品安全主要存在三大深层次问题。
(一)药品市场需求和供给水平总体偏低
经济社会发展的特定阶段决定了我国正处于药品安全问题高发期,总体安全形势依然严峻。
供需关系是基本市场关系,也是影响药品安全的重要因素。欠发达地区、低收入群体尤其是贫困人口的整体需求水平偏低,使得一部分人群依然面临药品可及性挑战。由于低端市场和低水平需求存在,给低质量药品供给提供了空间,甚至诱发企业机会主义行为。供需两侧乏力导致药品市场结构不优,药品质量安全问题凸显。加之互联网药品经营、海外代购、跨境电商等新业态不断出现,药品供应链条日趋复杂,风险点随之增多。
(二)“大产业—弱监管”的结构性矛盾

图1 药品安全潜在风险与实际监管工作量的差异性趋势
发达国家现代化药品监管历程表明,强大的产业和强大的监管互为支撑,医药产业健康发展离不开科学监管体系。我国则呈现庞大产业与弱小监管的结构性矛盾,各类药品生产经营企业和医疗机构数量超过百万家,但监管能力和产业发展严重不匹配。典型例证是2016年山东济南非法经营疫苗系列案件,暴露出全国有相关药品检查资质的人员不足500人。受监管资源和能力硬性约束,静态事前审批成为主要政策工具,动态事中事后监管不足,加之属地管理容易滋生地方保护,严重阻碍了产业基础优化和监管效能提升。这一矛盾在现实中表现为全国查处药品违法案件数量显著下降,同时药品不良反应(ADR)报告数持续上升。尽管其成因复杂,但药品监管实际工作量与潜在安全风险呈现反向演进的差异化趋势(见图1)。
(三)多元药品安全风险交织并存
国际经验表明,药品安全风险包括掺杂使假、化学污染、新药未知性等多种类型。区分药品安全事件的因素主要有两个:一是风险源属性,既可以长期存在于产业链中,也可能突发短暂出现;二是危害后果的急慢性形式,即特定行为产生一次性危害还是持续危害。据此,我国药品安全事件可分为公共危机、系统性风险、“前市场”问题、媒体事件四类药品安全事件(见表1)。

表1 我国药品安全事件分类机制
国家药品安全治理体系框架
对以上药品安全存在的三大深层次问题,通过传统的以许可、检查、处罚为主要手段的线性监管模式过于单一,难以奏效,必须超越监管看安全,从更为广阔的视野思考药品安全,以整体治理为理念,构建“目标—结构—行动”框架。
整体治理是指通过横向与纵向协调的理念和行动,以实现预期利益的治理模式,其涉及各层级政府之间、政府各部门之间、不同政策领域之间,包括价值理念、组织结构、机制设计、技术支撑等要素。该理论假设基本符合药品安全治理实践。2012年,美国医学科学院基于20多个发展中国家比较研究后发布报告,认为发展中国家食品药品安全体系在遵循国际标准、供应链控制、基础设施建设、相关法律基础等方面存在9个共性问题,需要引入企业和消费者参与,进而提升监管效能。2015年5月,习近平总书记强调建立科学完善的药品安全治理体系。药品安全治理体系和治理能力现代化的新理念已经被纳入政策话语。因此,把握药品政策目标主体手段的多样性特征,提出“目标—结构—行动”框架(见图2),把药品安全治理看作整体性体系加以构建,是保障民众用药安全的必由之路。
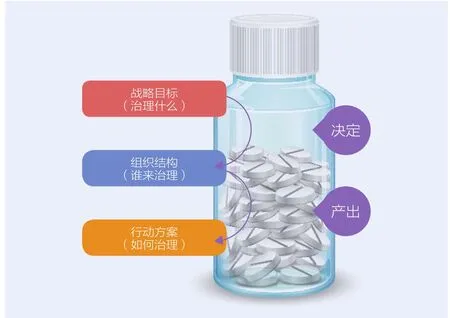
图2 基于“目标—结构—行动”框架的药品安全治理体系
框架自上而下分为三个层次:第一层次是战略目标,即厘清药品安全在健康中国、公共安全、供给侧结构性改革等国家战略中的地位,旨在破解现存的低水平供需、“大产业—弱监管”格局、多元风险并存三大问题,回答“治理什么”的命题。第二层次是组织结构,优化药品安全治理的体系架构、分工协作、权责关系等要素,构建各主体相互协同的治理体系,回答“谁来治理”的命题。第三层次是行动方案,细化为具体政策任务,关键是引入经济激励、行政监管、技术支撑等政策工具,回答“如何治理”的命题。归纳而言,药品安全治理是以提升药品质量安全水平为核心目标,以医药产业健康发展和药品监管体系建设为支撑,最终保障民众用药安全的现代化体系。
国家药品安全治理体系的战略目标
药品安全治理体系需要嵌入国家治理现代化进程并融入相关政策,与其他制度设计相耦合,并为未来改革留出接口。
(一)从健康中国战略高度优化药品供需结构
从健康中国的战略高度推进药品安全治理,要求我们构建“大健康—大安全—大监管”理论体系,从供需两侧拓展药品安全的视野和深度。
一方面是改革供方。针对当前药品领域突出问题,应当从整体治理高度释放政策红利。通过完善药品供应保障体系,规范临床试验,优化制药产业结构和药品流通秩序,解决不合理用药问题,形成全过程闭环政策链。提升药品安全整体水平,实现风险关口前移。另一方面是改革需方,重点是推动“三医联动”。强化价格、医保、采购等政策衔接,制定完善医保药品支付标准政策,增强民众对药品的可及性。只有激发全社会共治共享药品安全的内生动力,才能以需求结构优化倒逼供给端改善。
(二)用公共安全理念破解产管矛盾
在总体国家安全观框架下,药品安全不再局限于个体,而是多数人的公共安全。药品安全不能被简单理解为经济问题、监管问题,而要上升到民生的高度,作为一项基本公共服务向全民提供,实现基本监管服务均等化。我国城乡间、区域间经济社会发展差异大,药品安全风险又具有流动性,与属地管理的时空有限性形成结构性张力,分散化的本地策略难以应对系统性风险。
药品安全基本监管服务需要有一定基准,依据人口数量、产业发展、地理区域等要素测算监管资源配置标准,科学确定人员编制和经费投入,实现区域间基本监管服务均等化,避免出现系统性风险洼地。同时可考虑将全国划分为若干监管功能区,设置直属于国家食品药品监管总局的督察机构,协调跨区域事务和查处重大案件,将科层式工作流程转换为扁平化政策协调。
(三)医药产业供给侧改革防范药品安全源头风险
创新是引领发展和监管的第一动力,其核心是实现医药产业社会效益和经济效益相兼容,从而增加有效供给。新药要“新”,改剂型要“优”,仿制药要“同”,这是从制药大国向制药强国迈进的关键,其对于国家制药工业发展质量和国际竞争力、满足公众用药需求、减轻社会医药费负担都具有重要意义。
一是建立以临床价值为导向的审评审批体系。简化新药临床试验审批程序,开展药物临床试验数据自查核查,提高药品审批标准,开展药品上市许可持有人制度试点,使批准上市药品的有效性、安全性、质量可控性接近国际先进水平。二是分期分批对已上市的药品进行质量和疗效一致性评价。用市场机制激励企业内生动力,让仿制药在临床上能够与原研药相互替代,达不到一致性质量疗效的仿制药不能批准上市。
国家药品安全治理体系的组织结构
国家治理现代化强调改革的系统性、整体性、协同性,药品安全治理同样应当根据战略目标统筹监管者、产业、其他政府部门间关系,充分激发各类主体的内生动力。
(一)建立药品安全治理高层次议事协调机构
药品产业链条分为研发、生产、经营、使用四大环节,横跨一、二、三产业,涉及多个政府部门。发挥大健康体系的协同优势,必须建立各部门参与的组织架构,形成部门间横向政策协调。通过统筹食药监管、卫生计生、产业部门等职权,并明确日常办事机构,实现药品安全、产业发展、药物创新、保障药品可及等多元政策目标兼容。例如北京、吉林等地已经在省级层面将食品安全委员会扩展为食品药品安全委员会,国家层面可探索这一做法的可行性。
(二)科学划分各级监管事权和职能
要全方位提升药品监管效能,还应在合理配置横向监管资源的前提下科学划分纵向监管事权。我国行政体制具有权责同构特征,各级监管部门内设机构相似,事权划分缺乏刚性。以药品生产企业日常监管为例,《药品管理法》、省级食药监管部门文件、地方编制部门“三定方案”的划分方式并不一致,导致实践中省、市、县三级监管部门职责边界模糊甚至推诿。理想状态是根据监管能力比较优势,形成差异化事权划分体系。建议正在修订的《药品管理法》明确各级监管部门事权划分,其中国家负责法规标准、药品审评审批、产品上市前检查、高风险药品监督抽验等技术要求高的基础性工作;省级负责本行政区域内药品生产企业行政许可和飞行检查,并全覆盖抽检基本药物等重点品种,防范跨区域系统性风险;市级负责药品批发企业监督检查,并围绕复杂业态加强专业政策指导;县级落实属地管理责任,重点对零售药店等开展日常监管和监督抽验(见表2)。
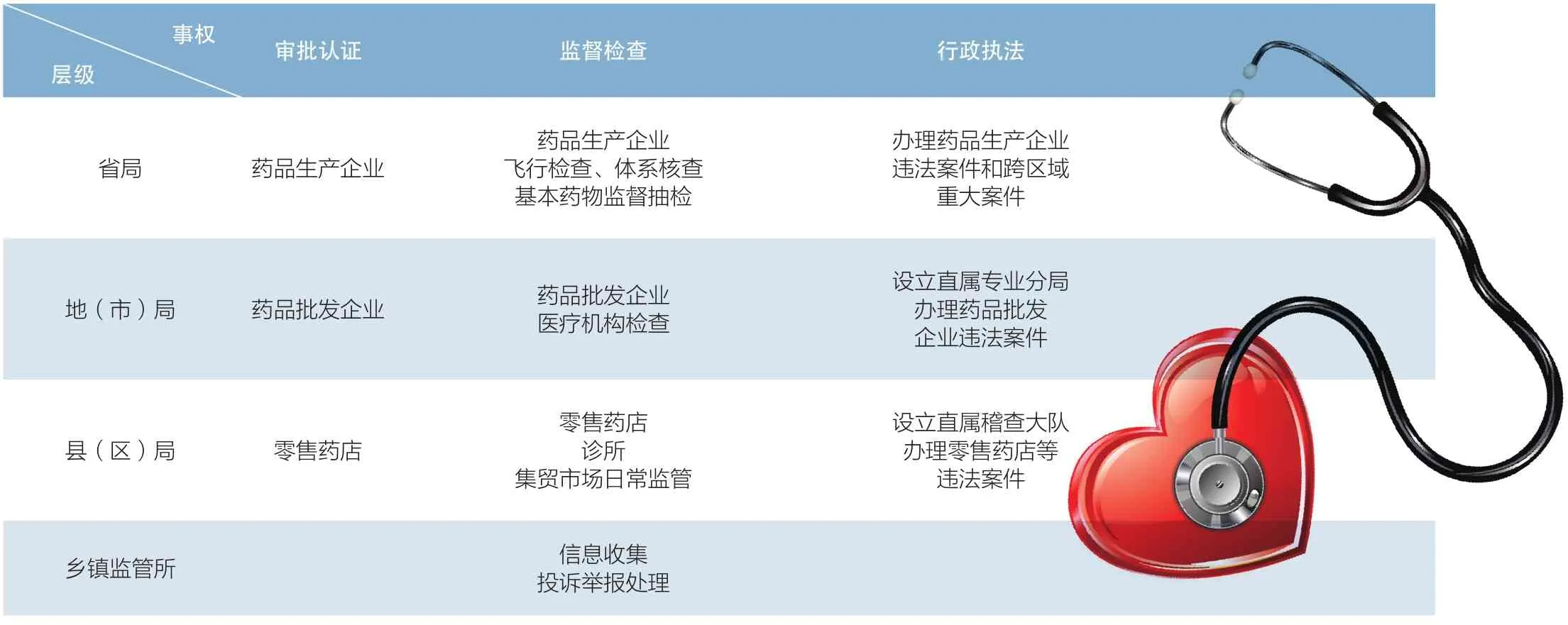
表2 省级以下药品监管部门主要事权划分建议
(三)探索市场嵌入型监管模式
理想的药品安全治理体系,应当将各方面激励和约束集中到生产经营行为上,让优胜劣汰的市场机制起决定作用。事实上,许多药品安全事件处理需要产业与监管协作,如应对行业“潜规则”等系统性风险的最佳途径是产业基础提升,消除非理性恐慌则依赖企业积极参与的风险交流。因此,监管政策要深嵌市场和产业,寓最严监管于最优服务,构建监管部门与医药产业的合作联盟。例如逐步完善药品审评和监管工作,坚持指导规范、沟通交流、审批决策的行政流程,充分听取业界意见;又如在仿制药一致性评价中制定和完善参比制剂遴选原则,并争取企业技术改造、医保支付、临床应用、药品集中招采等政策支持;还可以购买专业化社会第三方服务,探索药品可追溯体系、临床试验强制责任保险等做法,将“药品安全经济”打造为新经济增长点。
国家药品安全治理体系的行动方案
根据“前提—过程—结果”的逻辑顺序,针对药品安全基础设施建设、药品监管体系完善、药品安全水平提升等内容,构建可量化、可实施、可检验的具体行动方案,整体治理的目标和结构需要落实到具体政策行动上。
(一)前提性治理行动:全面完善药品安全基础设施
基础设施是强化药品安全治理能力和防范系统性风险的基本前提。一是制修订药品安全标准以持续更新监管基准。我国药品标准与发达国家存在较大差距,“十三五”期间要完成药品标准制修订数量3050个,制修订药品注册技术指导原则350项。二是健全药品安全状况监测体系。鼓励地方以“双安双创”为契机,建立药品监管财政投入长效增长机制,持续提高每千人药品监督抽验批次。同时鼓励企业建立药品质量全过程追溯体系。三是强化药品风险识别能力。完善监测评价体系建设,检查督促企业落实监测主体责任,县(市、区)报告药品不良反应/事件病例比例达到90%,稳步提升每百万人口药品不良反应/事件报告数,药品定期安全性更新报告评价率达到100%。四是显著提高执业药师服务水平。截至2016年底,全国具备执业药师资格的人员达到65万人,覆盖城乡的药品供应网络基本建成。下一步要将每万人口执业药师数量提高到4人,更好发挥执业药师的用药服务作用,引导其作为社会力量平衡监管部门、企业、消费者利益。
(二)过程性治理行动:药品监管能力建设与流程再造
我国药品监管面临人员专业水平偏低、执法装备短缺、技术支撑薄弱等挑战。需要遵循药品安全科学规律,从全面能力建设和全过程监管两方面提升监管效能。
一是建立职业检查员制度。药品监管具有高度专业性,要求监管执法人员具备较高业务素质和专业技能。食药监管部门要加快建设一支与我国医药产业创新发展相适应的职业化检查员队伍,通过薪酬、晋升制度改革激励检查员提升专业监管技能,净化行业生态环境。二是增加行政执法资源。要防止药品安全在第一线失守,必须提高基层监管机构执法装备标准化配备率,打通监管体系“最后一公里”,夯实地方政府落实属地管理责任的基础载体。三是再造监管行政流程。针对监管部门内部许可审批、日常监管和稽查办案不衔接问题,可整合药品监管、稽查、检查队伍,建立以检查为统领,集风险防范、案件调查、行政处罚、案件移送为一体的行政执法工作体系,实现各级药品监督检查频次标准化。
(三)结果性治理行动:提升药品安全水平
全面提升药品质量安全水平,是人民健康作为优先发展战略的体现。应确保制度短期、中期、长期的连续性,争取我国药品安全状况在2030年达到高收入国家水平,与健康中国建设总体规划相适应。同时可将药品安全核心任务纳入各地健康建设考核体系,形成顶层设计与地方实践的有机互动。
提升药品安全水平的具体任务需要摆脱单一追求合格率的静态思路,从主客观两方面引入动态结果性指标,科学测量药品安全状况。一是社会诉求及时得到回应,药品安全投诉举报办结率达到80%。二是监管部门根据问题导向采取行动,监管人员人均查处药品案件数量持续增加,以提升监管有效性。三是专业第三方机构开展的民众药品安全满意度评分达到85分。
总之,在健康中国的战略背景下,保障药品安全工作必须超越线性监管模式,结合已有政策和规划,系统构建国家药品安全治理体系。因此,建议尽快制定中长期《国家药品安全纲要》,高位推进改革并保持战略定力,持续提升民众健康福祉。
