低温低压环境对小鼠褐色脂肪组织形成的影响
2017-12-21仝永娟高娜娜张国英张晓迪
仝永娟,杨 朵,李 娜,束 华,马 刚,高娜娜,张国英,张晓迪
(1.首都医科大学附属北京世纪坛医院实验动物中心,北京 100038; 2.中国科学院昆明动物研究所灵长类研究 中心,昆明 650223)
低温低压环境对小鼠褐色脂肪组织形成的影响
仝永娟1,杨 朵1,李 娜1,束 华1,马 刚1,高娜娜1,张国英1,张晓迪2
(1.首都医科大学附属北京世纪坛医院实验动物中心,北京 100038; 2.中国科学院昆明动物研究所灵长类研究 中心,昆明 650223)
研究报告
目的探索低温低压环境对小鼠褐色脂肪组织的影响。方法选取个体健康均一的6周龄成年雄性C57BL/6 N小鼠24只,平均分为4组,每组6只鼠,分别饲养在常温常压(18~22℃、海拔20~60 m)、常温低压(18~22℃、海拔5000 m)、常压低温(0~6℃、海拔20~60 m)、低温低压(0~6℃、海拔5000 m)的环境中。实验周期为4周,在试验开始和结束时分别测量每只小鼠的体重,在实验结束后完整取下试验小鼠背部及腹股沟脂肪,并对背部及腹股沟脂肪组织进行HE染色,对背部脂肪的褐色脂肪的标志物UCP-1进行qPCR分子表达及western blot蛋白表达的测定。结果低温低压、低温常压和常温低压组小鼠的体重增加量显著低于同期正常对照组小鼠;低温低压、低温常压小鼠背部和腹股沟脂肪组织颜色较深,血运丰富,常温常压组的脂肪组织形态较其他组偏大;染色结果显示小鼠背部脂肪细胞充盈多个脂肪泡,细胞较小,颜色较深,形态上是典型的褐色脂肪细胞;在低温条件下,小鼠背部脂肪组织的褐色脂肪标志物UCP-1在mRNA和蛋白水平上高表达,低压条件下仅在mRNA的水平上有上调。结论模拟高原环境的低温低压条件对小鼠褐色脂肪组织的形成有刺激作用,这种作用更多的与温度的降低有关。
低压低氧;褐色脂肪组织;解偶联蛋白
哺乳动物体内的脂肪可根据不同的功能分为:白色脂肪(white adipose tissue,WAT)、米色脂肪细胞(brown-in-white)和褐色脂肪组织(brown adipose tissue,BAT)。褐色脂肪细胞来源于间充质干细胞(mesenchymal stem cells,MSCs),一部分是由脂肪前体细胞分化而来,另一部分是由成肌细胞在特定条件下分化而来,起初,人们认为褐色脂肪组织进仅存在于哺乳动物的婴幼儿时期,后来,大量学者通过活检分析发现成年人也有褐色脂肪组织,主要分布于肩胛间、脊椎周围、腋下、会阴等部位[1,2]。
褐色脂肪能够通过氧化磷酸化解偶联,促使体内储能的白色脂肪分解产热和消耗能量[3,4],维持机体温度恒定,影响能量代谢率[5]。很多研究发现,低温条件下刺激小鼠能够使其褐色脂肪组织含量显著增加以维持体温[6-8]。Toselli等[9]在测量了居住于海拔3600 m的秘鲁安第斯山脉的盖丘亚族人和海拔3200 m的吉尔吉斯人的体脂百分比后发现,高海拔条件下,肥胖人口数量较低。那么高原环境对褐色脂肪的形成是否有直接的影响,其中的影响机制是什么,目前还鲜有报道。本实验在动物试验负压舱中,对低压低温环境条件下小鼠体重及褐色脂肪的形成情况进行了研究,通过对脂肪组织HE染色切片的观察,及对褐色脂肪组织标志物解偶联蛋白(uncoupling protein 1, UCP-1) 的分子和蛋白表达量的检测来研究低压低温条件对小鼠背部褐色脂肪组织形成的影响。旨在探索高原环境下褐色脂肪组织的变化情况极其相关机制,为高原条件下脂肪代谢的研究提供重要的理论依据。
1 材料和方法
1.1 实验动物
SPF级雄性C57BL/6 J小鼠24只,6周龄,体重(20±1.5)g。购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0011]。饲养于首都医科大学附属北京世纪坛医院动物实验室[SYXK(京)2013-0003]。并按实验动物使用的3R原则给予人道的关怀。
1.2 实验分组
小鼠随机分为4组,每组6只鼠,分别为:常温常压组(normal atmospheric pressure and temperature group,NTNP),常温低压组(low atmospheric pressure and normal temperature group,NTLP)、低温常压组(normal atmospheric pressure and cold exposure group,LTNP)、低温低压组(low atmospheric pressure and cold exposure group,LTLP)(其中,常温为25℃室温,常压为北京平原地区海拔20~60 m,低温为0~6℃ 低温泡沫保温盒,低压为模拟海拔5000 m动物试验负压舱)。
1.3 主要试剂与仪器
脂肪固定液(Leagene);HE染色试剂盒(Leagene);Trizol(Invitrogen);氯仿(北京化工厂);乙醇(北京化工厂);异丙醇(北京化工厂);cDNA第一链合成试剂盒(康为世纪);UltraSYBR Mixture(康为世纪);蛋白裂解液(普利莱);CBA蛋白定量试剂盒(普利莱);蛋白凝胶试剂盒(普利莱);抗体[(一抗、二抗、内参)abcam]。
分析天平(Mettler);荧光定量PCR仪(ThermoFisher);全波长化学发光仪(Tecan Spark);电泳仪(Bio-Rad);摊片机(科迪KD-P);切片机(科迪KD-2258);显微镜(Nikon);动物试验负压舱(淮坊华信)。
1.4 负压舱参数
试验使用的低压低氧舱由潍坊华信氧业公司生产(DSF-Ⅱ动物实验负压舱),负压舱为横卧式全封闭不锈钢结构,设备容积为740 L,负压舱设置为(5000±100)m。
1.5 实验方法
1.5.1 小鼠体重的测量
在实验第1天小鼠进入低压氧舱前,称取每只小鼠的体重,在第28天实验结束后称取每只小鼠的体重。
1.5.2 小鼠背部及腹股沟脂肪组织样本的收集
采用10%水合氯醛麻醉后脱颈处死小鼠,解剖暴露小鼠背部及腹股沟脂肪并完整取下,拍照后取各组小鼠背部及腹股沟脂肪的相同部位保存于Leagene脂肪组织固定液,用于HE染色,将背部脂肪组织保存于液氮,分别用于RNA的提取,蛋白的裂解。
1.5.3 各组不同部位脂肪组织RNA的提取及cDNA文库的建立
取各组脂肪组织100 mg,分别加入1 mL Trizol于组织研磨器中充分研磨后移入1.5 mL离心管,室温静置5 min,加入0.2 mL氯仿,充分混匀后静置5 min;12 000 r/min离心15 min,小心将上层水相移入新1.5 mL离心管内,再加入等体积的异丙醇,充分混匀后静置5 min;12 000 r/min离心15 min,小心去掉上清液,用75%酒精(DEPC水稀释)充分洗涤2遍,即得到抽提的RNA样品。然后按照说明书,用cDNA逆转录试剂盒进行文库的建立。
1.5.4 相关基因的检测
以GAPDH为内参,按照试剂盒说明书,对UCP-1进行相关基因表达的检测,引物设计[8]见表1。

表1 小鼠GAPDH、UCP-1引物序列Tab.1 Primer sequences of the mouse GAPDH and UCP-1
1.5.5 相关蛋白的抽提及western bolt检测
从液氮中取出组织放入研钵内,在研钵中加入液氮,充分研磨组织,快速转移至1.5 mL离心管,加入RIPA裂解液(含1%PMSF)1 mL,离心后取上清。用CBA法测蛋白浓度后加入loading buffer,煮沸5 min使其变性,用12%分离胶和5%浓缩胶的聚丙烯酰胺凝胶进行电泳,待条带跑开后转膜,用5% TBST牛奶封闭1 h,分别加入内参和UCP-1的一抗进行孵育,TBS充分洗涤后再加入二抗进行孵育,TBS充分洗涤后上机检测。
1.5.6 组织石蜡切片的制备及HE染色
从固定液中取各组适当大小的固定好的脂肪块,参照文献[10]进行脱水和浸蜡,包埋于石蜡块中。将做好的石蜡块用切片机切片至适当的位置,于摊片机中摊片于载玻片上,烤片后按照说明书进行HE染色,于显微镜下观察拍片。
1.6 统计学方法
实验结果使用JMP 10.0(SAS Institute, Inc, Cary, NC)统计软件,采用单因素方差分析,通过least-significant-difference(LSD)最小显著性差异法,进行两两比较,以P<0.05为差异有显著性。
2 结果
2.1 低温低压对小鼠体重的影响
低温低压环境对小鼠体重的影响结果如图1所示,结果显示正常组小鼠体重平均增加4.35 g,常温低压组和低温低压组小鼠体重分别平均增加1.72 g和1.27 g,而低温常压组小鼠的体重略有下降,平均降低了0.38 g。图1中结果表明在常温低压,低温常压和低温低压的条件下,小鼠的体重增加量显著低于在常温常压条件下的增加量。
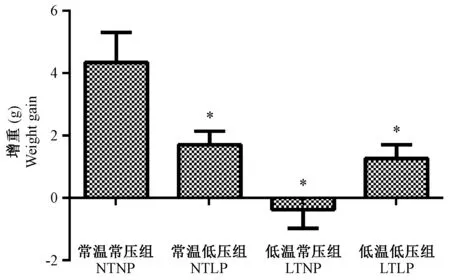
注:与常温常压组比较,* P< 0.05。图1 小鼠第四周实验结束后体重增重情况Note.Compared with the normal atmospheric pressure and temperature group,* P< 0.05.Fig.1 Body weight gains in the mice of different groups

图2 不同组别小鼠的背部及腹股沟脂肪Fig.2 The groin and back adipose tissues from different groups of mice
2.2 低温低压对小鼠脂肪组织及切片的影响
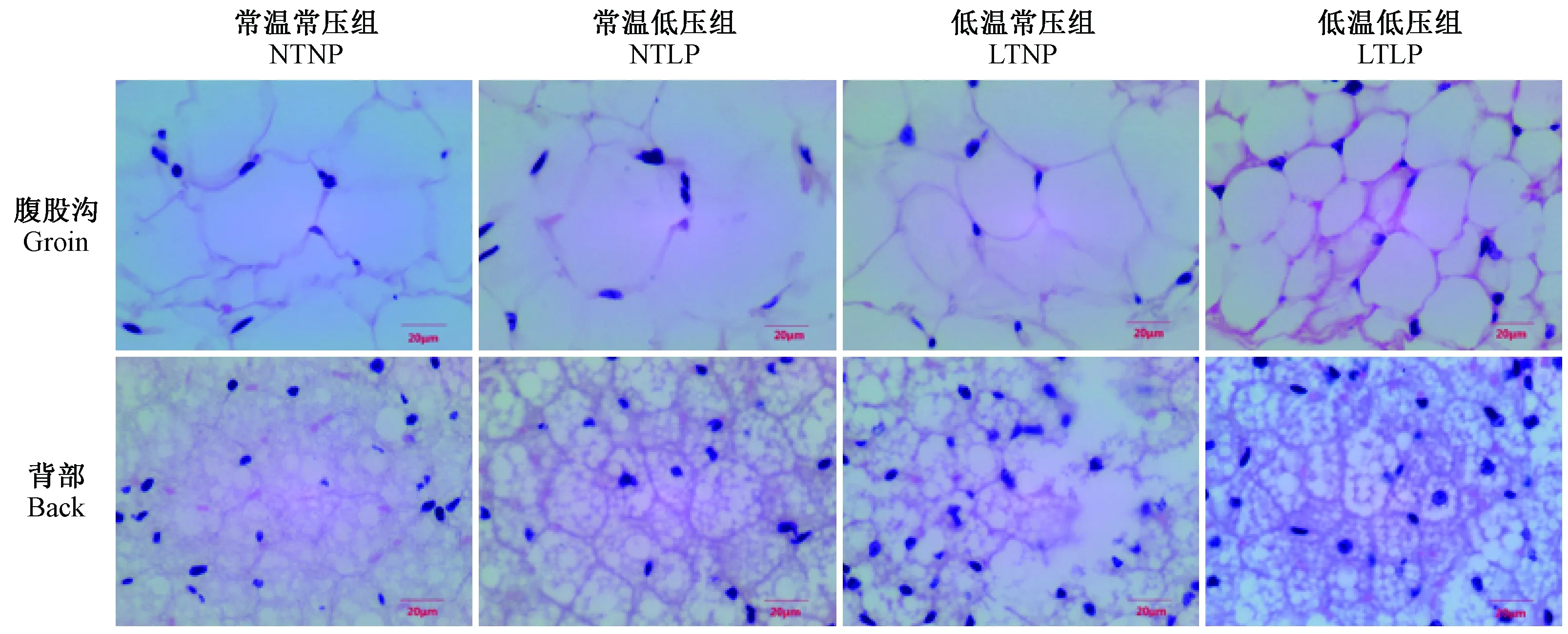
图3 不同组别小鼠腹股沟及背部脂肪HE染色切片(Bar=20 μm)Fig.3 Histology of groin and back adipose tissues of the mice.
各处理组小鼠的背部及腹股沟的脂肪形态如图2所示,低温低压及低温常压组小鼠的背部及腹股沟脂肪颜色较深,血运丰富,常温常压及常温低压组并未有明显差别,常温常压组的脂肪组织形态较其他组偏大。不同处理组小鼠背部及腹股沟脂肪组织切片形态呈相如图3所示(40倍物镜),可以看出,腹股沟脂肪细胞体积较大,细胞内部脂滴空泡较少且体积较大,颜色较浅,背部脂肪细胞体积较小,细胞内部脂滴空泡较多,体积也较小,颜色较深,说明褐色脂肪组织主要存在于小鼠背部的脂肪中。
2.3 低温低压对小鼠背部褐色脂肪基因表达的影响
在四周的实验周期结束后,各处理组小鼠背部脂肪的UCP-1在mRNA水平上的表达结果如图4所示。结果显示,小鼠在低温条件下UCP-1表达量显著上调,在低压条件下UCP-1的表达量也显著上调,但UCP-1表达量的上调在低压条件下没有低温条件下的大。
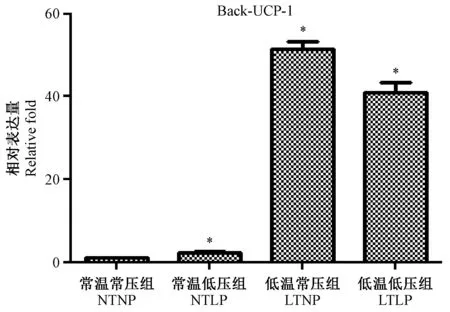
注:与常温常压组比较,* P< 0.05图4 不同组别小鼠背部脂肪UCP-1的mRNA表达结果Note.Compared with the normal atmospheric pressure and temperature group,* P< 0.05.Fig.4 UCP-1 expression in the back adipose tissue of mice from different groups
2.4 低温低压对小鼠背部褐色脂肪UCP-1蛋白质表达的影响
在四周的实验周期结束后,小鼠背部脂肪在蛋白水平上表达结果如图5所示。结果显示,常温常压和常温低压条件下UCP-1的蛋白表达量较低,而低温常压和低温低压条件下UCP-1的蛋白表达量高。
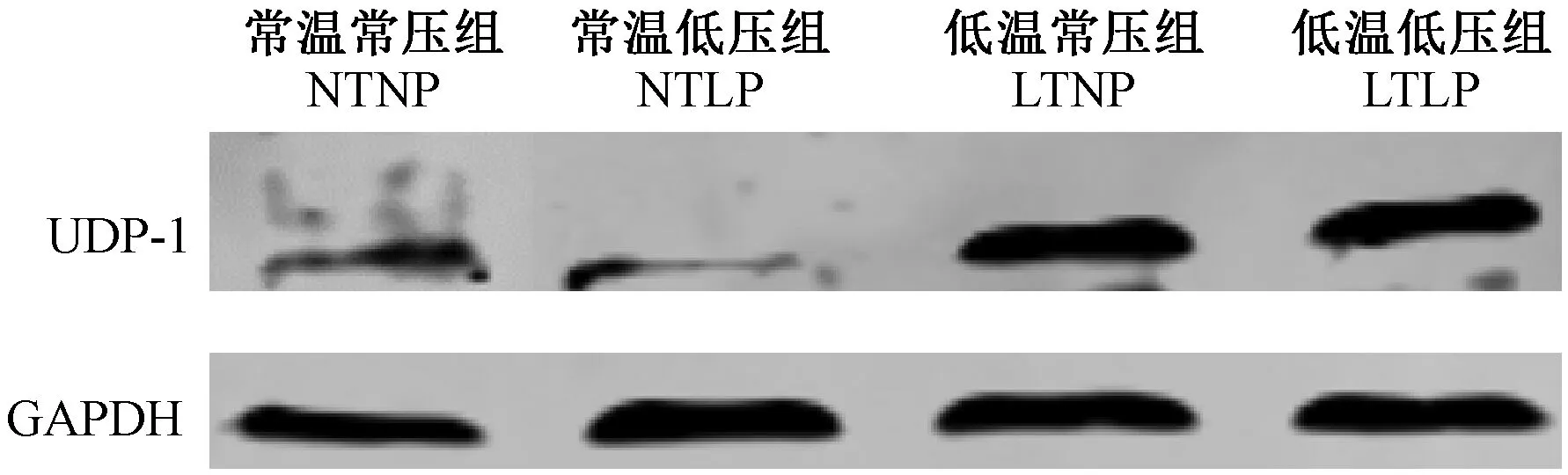
图5 不同组别小鼠背部脂肪UCP-1的蛋白表达结果Fig.5 The UCP-1 expression of back adipose tissue in the mice from different groups
3 讨论
有研究发现,褐色脂肪组织中含有β3肾上腺素受体[11],能够在解偶联代谢的过程中调节脂肪分解[12],提高非颤栗性产热,从而减少脂肪的堆积,降低体重,起到抗肥胖的作用[13,14]。本研究结果发现,褐色脂肪组织含量较高的低温低压以及低温常压组小鼠的体重增加量低于同时期常温常压组(图2),脂肪组织的形态也小于同时期常温常压组(图1),与上述研究结果一致,而常温低压组的体重增加量也低于常温常压组,这可能与低压条件下小鼠易形成肺动脉高压有关[15]。
UCP1、PRDM16、PGC-1、CIDEA、Deiodinase typeⅡ等的表达是褐色脂肪细胞形成的标志[16,17],其中最主要的标志物是UCP-1。有研究发现,寒冷环境刺激中枢神经系统,并通过β-肾上腺素能通路,增加产热活动,这个过程也与褐色脂肪组织有密不可分的关系。冷暴露和β-肾上腺激素等刺激能够直接或者间接的通过影响miR-133、miR-155、miR-196 a 和 miR-193b-365等mircoRNA的表达起到调节褐色脂肪组织的形成的作用[18]。本试验中低温组的褐色脂肪组织标志物UCP-1在分子水平和蛋白水平上的表达均显著高于同条件下的常温组,与上述研究的结论一致,说明低温冷暴露可以直接刺激褐色脂肪组织形成。
低氧可以直接或者辅助其他刺激因素调节notch、cox-2、Wnt等多种信号通路[19-21],其中有些信号通路与褐色脂肪组织的形成也密切相关,如影响细胞增殖分化的Wnt信号通路[22],低氧条件下神经干细胞中Wnt/β-catenin信号通路的相关分子β-catenin的表达明显高于常氧条件下[21]。又有研究发现激发wnt10b通路能够抑制褐色脂肪的形成[23]。Kang等[24]则在实验中发现,Wnt/β-catenin通路高表达能够抑制脂肪组织的形成。本试验结果中,低温低压组别的小鼠,褐色脂肪组织的形成与低温常压组并无明显差别,仅在mRNA的水平上有显著降低的趋势。低压条件是否对褐色脂肪组织形成过程中的某个信号通路有影响,仍需进一步的探讨研究与探索。
本研究结果表明,在压力相同的情况下,低温环境与常温环境相比,能抑制褐色脂肪组织的形成,而在温度相同的情况下,低压环境对褐色脂肪组织的形成是否有影响还有待进一步的研究与探索。本研究为今后进一步研究低温低压条件对棕色脂肪细胞形成的影响提供了研究基础,也为今后高原环境下脂肪代谢的相关研究提供了理论依据。
[1] Cypess AM, Lehman S, Williams G, et al. Identification and importance of brown adipose tissue in adult humans [J]. N Engl J Med, 2009, 360(15): 1509-1517.
[2] Grether-Beck S, Krutmann J. [Adipose tissue. Cellular and molecular principles] [J]. Hautarzt, 2010, 61(10): 838-846.
[3] Tews D, Wabitsch M. Renaissance of brown adipose tissue [J]. Horm Res Paediatr, 2011, 75(4): 231-239.
[4] Nicholls DG, Locke RM. Thermogenic mechanisms in brown fat [J]. Physiol Rev, 1984, 64(1): 1-64.
[5] Verty AN, Allen AM, Oldfield BJ. The endogenous actions of hypothalamic peptides on brown adipose tissue thermogenesis in the rat [J]. Endocrinology, 2013, 151(9): 4236-4246.
[6] Keipert S, Kutschke M, Lamp D, et al. Genetic disruption of uncoupling protein 1 (UCP1) in mice renders brown adipose tissue a significant source of FGF21 secretion [J]. Mol Metab, 2015, 4(7): 537-542.
[7] Tao C, Huang S, Wang Y, et al. Changes in white and brown adipose tissue microRNA expression in cold-induced mice [J]. Biochem Biophys Res Commun, 2015, 463(3): 193-199.
[8] Dempersmier J, Sambeat A, Gulyaeva O, et al. Cold-inducible Zfp516 activates UCP1 transcription to promote browning of white fat and development of brown fat [J]. Mol Cell, 2015, 57(2): 235-246.
[9] Toselli S, Tarazona-Santos E, Pettener D. Body size, composition, and blood pressure of high-altitude Quechua from the Peruvian Central Andes (Huancavelica, 3,680 m) [J]. Am J Hum Biol, 2001, 13(4): 539-547.
[10] 徐玉环, 徐艳峰, 刘颖, 等. 脂肪组织切片制备方法的改进 [J]. 中国比较医学杂志, 2017, 27(1): 79-84.
[11] Deiuliis JA, Liu LF, Belury MA, et al. Beta(3)-adrenergic signaling acutely down regulates adipose triglyceride lipase in brown adipocytes [J]. Lipids, 2010, 45(6): 479-489.
[12] Vrydag W, Michel MC. Tools to study beta3-adrenoceptors [J]. Naunyn Schmiedebergs Arch Pharmacol, 2007, 374(5-6): 385-398.
[13] Kramarova LI, Bronnikov GE, Ignat’ev DA, et al. Adrenergic receptor density in brown adipose tissue of active and hibernating hamsters and ground squirrels [J]. Comp Biochem Physiol A Mol Integr Physiol, 2007, 146(3): 408-414.
[14] Maclellan JD, Gerrits MF, Gowing A, et al. Physiological increases in uncoupling protein 3 augment fatty acid oxidation and decrease reactive oxygen species production without uncoupling respiration in muscle cells [J]. Diabetes, 2005, 54(8): 2343-2350.
[15] 李娟, 孙新, 毕辉, 等. 低压低氧性大鼠肺动脉高压模型的建立 [J]. 临床心血管病杂志, 2008, 24(4): 297-301.
[16] Sun C, Zeng R, Cao G, et al. Vibration training triggers brown adipocyte relative protein expression in rat white adipose tissue [J]. Biomed Res Int, 2015, 2015: 919401.
[17] Farmer SR. Molecular determinants of brown adipocyte formation and function [J]. GenesDev, 2008, 22(10): 1269-1275.
[18] Trajkovski M, Lodish H. MicroRNA networks regulate development of brown adipocytes [J]. Trends Endocrinol Metab, 2013, 24(9): 442-450.
[19] 夏世金, 汪海东, 张晓丽, 等. 低氧条件下共培养体系中肺动脉内皮细胞经Notch1/Jagged1信号通路调控肺动脉平滑肌细胞的增殖 [J]. 中国老年学, 2011, 31(4): 603-606.
[20] 潘新亭, 朱青云, 孙运波, 等. siRNA靶向沉默HIF-2对低氧微环境下胰腺癌细胞COX-2信号通路的影响 [J]. 青岛大学医学院学报, 2015, 51(1): 23-25,28.
[21] 崔晓萍, 林航, 陈建梅, 等. 低氧对体外培养的神经干细胞中Wnt/β-catenin信号通路相关分子表达的影响 [J]. 山东大学学报:医学版, 2010, 48(9): 44-48.
[22] MacDonald BT, Tamai K, He X. Wnt/β-catenin signaling: components, mechanisms, and diseases [J]. Dev Cell, 2009, 17: 9-26.
[23] Longo KA, Wright WS, Kang S, et al. Wnt10b inhibits development of white and brown adipose tissues [J]. J Biol Chem, 2004, 279(34): 35503-35509.
[24] Kang S, Bajnok L, Longo KA, et al. Effects of Wnt signaling on brown adipocyte differentiation and metabolism mediated by PGC-1alpha [J]. Mol Cell Biol, 2005, 25(4): 1272-1282.
Effectofhypobarichypoxiaandcoldexposureonformationofbrownadiposetissueinmice
TONG Yong-juan1, YANG Duo1, LI Na1, SHU Hua1, MA Gang1, GAO Na-na1, ZHANG Guo-ying1, ZHANG Xiao-di2
(1.Depantment of Laboratory Animal Center, Beijing Shijitan Hospital. CMU, Beijing 100038, China; 2.Kunming Institute of Zoology. CAS, Kunming 650223)
ObjectiveTo investigate the effect of hypobaric hypoxia and cold exposure on brown adipose tissue in mice.MethodsTwenty-four 6-week old SPF C57BL/6 male mice were randomly divided into 4 groups with 6 mice in each group: normal atmospheric pressure and temperature group (18~22℃, 20~60 m)(NTNP), low atmospheric pressure and normal temperature group(18~22℃, altitude of 5000 m)(NTLP), normal atmospheric pressure and cold exposure group(0~6℃, altitude of 20~60 m)(LTNP), low atmospheric pressure and cold exposure group(0~6℃, altitude of 5,000 m)(LTLP). The experimental period was 4 weeks. The body weight was measured at the beginning and end of the experiment. By the end of the four-week trial, the back and inguinal fat were dissected and observed by histology using HE staining. The expression of UCP-1 as the marker of brown adipose tissue in the back fat was detected by qPCR and western blot.ResultsThe body weight gain of NTNP group was higher (P< 0.05) than the other three groups. Meanwhile, the color of the back and groin fat tissue of mice of LTNP and LTLP groups were darker, the blood supply in mice of these two groups was richer than the NTLP group. The volume of adipose tissue of NTNP group was higher than others. The histology showed that the back adipose cells of the mice were smaller and darker and full of multilocular lipid droplets, exhibiting a typical morphology of brown fat cells. Compared with the NTNP and NTLP groups, the mRNA and protein levels of UCP-1 were higher under cold exposure, while low atmospheric pressure had a tendency to reduce the mRNA expression of UCP-1.ConclusionsThe formation of brown fat is affected by the imitated conditions of low atmospheric pressure and cold exposure, and is more closely related to the decresed temperature.
Cold exposure; Hypobaric hypoxia; Brown adipose tissue; UCP-1
2017-06-10
首都医科大学附属北京世纪坛医院院青年基金(2015-q15);中国铁路总公司科研项目(J2016Z031)。
仝永娟(1988-),女,研究实习员。研究方向:实验动物研究与应用。E-mail: tongyongjuan1020@163.com
R-33
A
1671-7856(2017) 12-0061-05
10.3969.j.issn.1671-7856. 2017.12.011
〔收稿日期〕2017-06-04
