大麻中THCA合成酶基因的表达分析
2017-12-21姜颖孙宇峰李秋芝潘冬梅韩喜财
姜颖,孙宇峰,李秋芝,潘冬梅,韩喜财
(黑龙江省科学院大庆分院,黑龙江大庆163319)
大麻中THCA合成酶基因的表达分析
姜颖,孙宇峰,李秋芝,潘冬梅,韩喜财
(黑龙江省科学院大庆分院,黑龙江大庆163319)
针对大麻不同品种的不同组织,利用半定量RT-PCR和荧光定量PCR进行THCA合成酶基因的表达分析,结果显示:不同品种CsTHCAmRNA表达量存在组织间的不同,CsTHCAmRNA在火麻一号的雄花中表达量最高;在五常40的雌花中表达量最高;在金刀15的叶片中表达量最高;且在根中的表达量相对较高,在茎和籽粒中的表达量较低。通过分析大麻中THCA合成酶基因的表达并结合薄层色谱法发现THC含量与CsTHCAmRNA表达量之间可能呈正相关,该发现可为大麻安全推广提供理论指导。
大麻;THCA合成酶基因(CsTHCA);半定量PCR;荧光定量PCR;表达分析
大麻(Cannabis sativaL.)是大麻科(Cannabinaceae)大麻属(CannabisL.)一年生草本植物[1-2],是我国传统经济作物,具有重要的工业及药用价值,在我国已有5000多年的栽培利用历史[3-4]。大麻的产品利用涉及纺织、造纸、军需、化工、建材、食品及制药等多个方面[5-6]。然而,由于大麻中含有一种致幻成瘾的活性成分——四氢大麻酚(THC),易被不法分子用来非法生产毒品,造成社会危害,因此许多国家把工业大麻也一并列为禁种作物[7-8]。受遗传控制、生长环境和栽培条件影响,大麻THC含量在个体之间存在差异,主要体现在大麻植株茎、叶、花、苞片等部位中[9]。THC生物合成关键酶四氢大麻酸(THCA)合成酶为单体脱氢酶,可催化由戊基间苯二酚酸到四氢大麻酸A的氧化环化反应[10]。Kojoma M.等[11]研究认为,高毒大麻(THC含量为1.19%~7.51%)和低毒大麻(THC含量为0%~0.12%)资源中均存在THCAS基因,基因序列多态性导致大麻植株中THCAS酶的活性高低,从而决定了THC含量。目前,有关THCA合成酶基因表达分析的报道较少。本研究针对大麻THCA合成酶基因CsTHCA在大麻正常生长发育过程中的表达情况,对不同品种、不同组织间CsTHCA的表达进行分析,结合薄层色谱法研究THC在不同组织间的积累情况,进而确定CsTHCA表达量与THC含量之间的关系,旨在为工业大麻和药用大麻的检测鉴定提供理论依据。
1 材料与方法
1.1 植物材料
植物材料选用3个大麻品种,分别为:火麻一号、五常40和金刀15。火麻一号、五常40由黑龙江省科学院大庆分院亚麻综合利用研究所提供,金刀15引种于乌克兰,3个品种在试验区种植性状都表现良好,以上植物材料均种植于黑龙江省科学院大庆分院试验基地。在各个品种开花期,分别采取各个品种的根、茎、叶、雄花、雌花,结实期采取各个品种的籽粒,液氮速冻,保存于-80℃。
1.2 大麻不同品种、不同组织间CsTHCA的半定量PCR
提取正常生长条件下不同品种、不同组织的总 RNA(ProbeGene公司),DNase I(TaKaRa)消化处理后,利用UV-2550紫外分光光度计测定其浓度,然后进行均一化定量,利用第一链cDNA Synthesis Kit(ProbeGene公司)反转录合成cDNA的第一链,以此为模板进行PCR扩增,反转录后进行半定量RT-PCR分析。CsTHCA的半定量RT-PCR引物为:
CsTHCAsq F:5’-AGAGAAATTATGGCCTTGCGG-3’CsTHCAsq R:5’-CGCACTGTAGTCTTATTCTTCCC-3’半定量分析中选用的内参基因用于数据分析时对不同处理样品的cDNA模板量进行校准,所用引物为:
C.sativa Specific F:5’-GGGGGATTACATTGTTAATTATTCC-3’
C.sativa Specific R:5’-ATCCTCTCATTCCGTTAGTGG-3’
反应体系:
ddH2O 11.5μL-XμL
10×Taq Master Mix 12.5μL
Forward primer 0.5μL
Reverse primer 0.5μL
RT products XμL
Total volume 25μL
反应条件:
预变性 94℃ 3 min

分别于第30、33、36、39个循环时取出5μL。
1.3 大麻不同品种、不同组织间CsTHC A的荧光定量PCR
提取正常生育条件下各品种(火麻一号和五常40)、不同组织材料的RNA(已去除基因组DNA),用微量分光光度计测定总RNA的量,结果见表1。
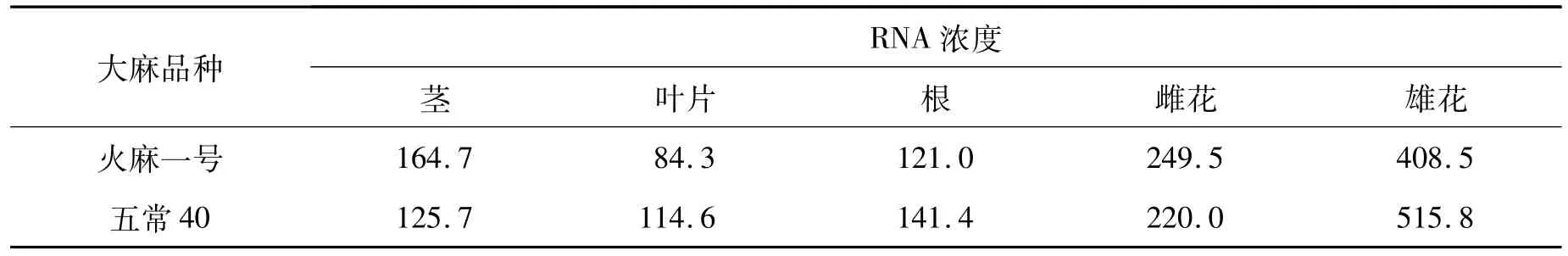
表1 不同材料不同组织RNA的浓度(ng/μL)Tab.1 RNA concentration of different tissues in different varieties(ng/μL)
反转录时 RNA的用量在200 ng/μL以上加 4μL,200~100 ng/μL加6μL,100 ng/μL以下加9μL。利用Rayscript cDNA Synthesis KIT(GENEray,GK8030)逆转录获得 cDNA,并以此为模板进行荧光定量PCR反应,荧光定量PCR仪:ABI7900,复孔重复3次。
反应体系:SYBR Green,Mix(GENEray,GK8020)和引物混合物配置:
Mix 10μL
Primer F+R 1μL
SYBR Green(16μL)96孔板:
Mix+引物 8μL
cDNA 8μL
反应条件:
预变性 95℃ 10 min

溶解曲线采集 60℃ 60 s
95℃ 30 s
60℃ 15 s
利用2-ΔΔCt法[12]计算得出CsTHCA相对表达量,再在Excel中作图分析。使用 Primer Premier 5.0(Premier Biosoft Inc,加拿大)和 Primer3在线工具(http://frodo.wi.mit.edu/primer3/)设计荧光定量PCR中CsTHCA的引物为:
CsTHCA F:5’-TTCCCAACAATGTAGCAAATCC-3’
CsTHCA R:5’-GAAGGAGTGACAATAACGAGTG -3’
内参基因18S的引物为:
18S F:5’-CGCTCCTACCGATTGAATGG -3’
18SR:5’-CCTTGTTACGACTTCTCCTTCC-3’
1.4 薄层色谱法分析大麻不同品种、不同组织间THC积累情况
将正常生育条件下各品种的不同组织材料进行晾干,称取一定量样品装于小玻璃瓶,120℃烘干0.5 h,取出后研碎,然后加入无水乙醇,4℃放置24 h,取出后用点样器点样于薄层板上,将点好的薄层板置于展开室中利用展开剂进行展开,然后晾干,用显色剂浸泡显色,取出后晾干观察结果。
2 结果与分析
2.1 大麻不同品种、不同组织间CsTHCA的半定量PCR
2.1.1 总RNA的提取与检测
用TRizol总RNA提取试剂盒提取的大麻不同组织的总RNA,可看见清晰的28s RNA和18s RNA,亮度、宽度适宜(见图1)。
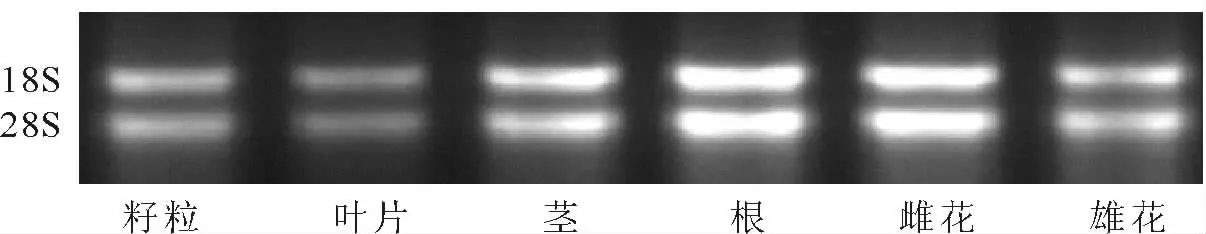
图1 大麻不同组织中RNA提取Fig.1 RNA extraction in different tissues of hemp
2.1.2 大麻不同品种、不同组织间CsTHCA的半定量PCR
通过半定量RT-PCR分析CsTHCA在大麻籽粒、叶片、根、雌花、雄花中的特异性表达,电泳后观察发现在第36个循环之后,mRNA水平较为稳定。结果表明,CsTHCA在大麻不同品种的不同器官均有表达,但表达量表现不同,在籽粒中表达量最低。利用Bio-Rad凝胶成像扫描分析系统,分别计算目的条带的峰度值(Volume,INT×mm2),以内参引物为标准进行校正,以其均数代表该样本的表达强度,反应目的基因mRNA的表达水平[13]。火麻一号的不同组织CsTHCAmRNA表达量为雄花>叶片>根>雌花>籽粒;五常40的不同组织CsTHCAmRNA表达量为雌花>根>叶片>雄花>籽粒;金刀15的不同组织CsTHCAmRNA表达量为叶片>根>雌花>雄花>籽粒。
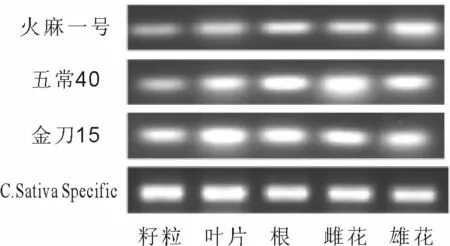
图2 大麻不同组织CsTHCA半定量RT-PCR结果Fig.2 Gene-specific semi-quantitative RT-PCR in different tissues of hemp
2.2 大麻不同品种、不同组织间CsTHCA的荧光定量PCR
以筛选后的内参基因作为衡量标准,通过荧光定量PCR对火麻一号和五常40的茎、叶片、根、雌花、雄花的表达进行分析,能够在一定程度上反映CsTHCA基因在不同器官中的表达差异。在选择的2个品种不同组织中CsTHCA均有表达,但表达量不同,在火麻一号的雄花中表达量最高,而在五常40的雌花中表达量最高。CsTHCA在2个品种的茎中表达量最低,但在根中的表达量相对较高。

图3 大麻CsTHCA qRT-PCR结果Fig.3 Gene-specific quantitative real-time PCR
2.3 薄层色谱法分析大麻不同品种、不同组织间THC积累情况
本试验利用薄层色谱法分析不同组织、不同材料间THC积累情况,结果发现,THC在叶片、雌花、雄花、根中含量较高,在籽粒和茎中含量较低,具体含量的多少还需采用液相色谱进一步分析。
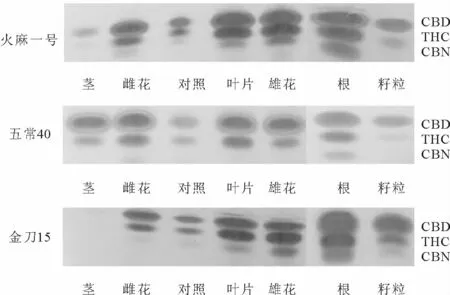
图4 大麻不同组织THC积累情况Fig.4 The accumulation of THC in different tissues of hemp
3 结论与讨论
THC的含量特征是区分毒品型大麻与工业大麻品种的唯一标准,THCA合成酶的分离对于大麻的相关研究具有重要意义[8]。本研究作者已克隆THCA合成酶基因CsTHCA,该基因开放阅读框全长1638 bp,起始密码子为ATG,终止密码子为TAA,共编码545个氨基酸[14]。大麻植株中THCA合成酶活性有高低之分,进而决定了THC的含量差异[11]。THC的含量在幼苗生长期较低,快速生长期最高,现蕾期达到顶峰,在茎秆及种子成熟期其含量下降[15]。THCA合成酶基因参与THCA的生物合成过程,进而产生大麻植物中的主要精神活性成分THC,所以可利用荧光定量PCR进行THCA合成酶基因的相对定量[16]。半定量RT-PCR技术的核心即PCR,是一种简单、快速、特异的RNA定量测定方法,在管家基因电泳带不变的情况下,来判断目的基因表达量的增减问题[17]。实时荧光定量PCR是一种高效的生物技术之一,是在 mRNA水平上对基因表达进行的定量分析,为避免样品之间和样品内部的差异,必须引入拷贝数高、稳定表达的内参基因对目标基因的表达量进行校正[18]。因此,本研究通过半定量RT-PCR和荧光定量PCR分析THCA合成酶在大麻不同品种、不同组织间的表达量,并结合薄层分析法以了解THC在不同组织间的积累情况,进一步确定THC含量与CsTHCAmRNA表达量之间的关系。本研究利用两种方法进行表达量分析,结果显示,不同品种CsTHCAmRNA表达量存在组织间的不同,CsTHCAmRNA在火麻一号的雄花中表达量最高;在五常40的雌花中表达量最高;在金刀15的叶片中表达量最高。本试验利用薄层分析法发现,THC含量在叶片、雌花、雄花、根中含量较高,在籽粒和茎中含量较低,这些发现与CsTHCAmRNA表达量基本一致。THC含量在大麻开花授粉期的雄花、雌花和植株叶片中含量较高,且THC含量与CsTHCAmRNA表达量之间可能呈正相关。有研究[19-20]表明,THC在大麻各个部位中的含量也不相同,一般按照苞片、花、叶、细茎和粗茎的顺序递减,THC在雌株的花和叶中含量最高,种子中含量极少,这与本研究结果相似。另外,UNODC[20]还发现,根中THC含量极少,这与研究结果不一致,本研究发现THC含量在根中相对较高,而且与根中CsTHCAmRNA表达量一致,故还需进一步验证根中THC含量及CsTHCAmRNA在根中的表达机理。
[1]王殿奎,关凤芝.黑龙江省大麻生产现状及发展对策[J].中国麻业科学,2005,27(2):98-101.
[2]吴广文.黑龙江省大麻发展问题和建议[J].中国麻业科学,2007,29(6):356-357.
[3]熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008:297.
[4]Bouloc P,Allegret S,Arnaud L,et al.Hemp:industrial production and uses[M].CABI,2013.
[5]姜颖.EMS对工业大麻种子萌发的影响[J].中国麻业科学,2016,38(6):258-262.
[6]姜颖,韩承伟,李秋芝,等.工业大麻籽的开发利用[J].黑龙江科学,2014,5(2):6-7.
[7]陈建华,臧巩固,赵立宁,等.大麻化学成分研究进展与开发我国大麻资源的探讨[J].中国麻业科学,2003,25(6):266-271.
[8]陈璇,杨明,郭鸿彦,等.大麻植物中大麻素成分研究进展[J].植物学报,2011,46(2):197-205.
[9]Sirikantaramas S,Taura F,Tanaka Y,et al.Tetrahydrocannabinolic acid synthase,the enzyme controlling marijuana psychoactivity,is secreted into the storage cavity of the glandular trichomes[J].Plant and Cell Physiology,2005,46(9):1578-1582.
[10]关凤芝.大麻遗传育种与栽培技术[M].哈尔滨:黑龙江人民出版社,2011:25-52.
[11]Kojoma M,Seki H,Yoshida S,et al.DNA polymorphisms in the tetrahydrocannabinolic acid(THCA)synthase gene in“drug-type”and“fiber-type”Cannabis sativaL.[J].Forensic Science International,2006,159(2-3):132-140.
[12]Pfaffl,M.W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic.Acids.Res.,2001,29(900):2002-2007.
[13]阮艳,蹇锐,程小星,等.Bmi-1调节干性相关分子转录的初步分析[J].第三军医大学学报,2009,31(9):768-771.
[14]姜颖,潘冬梅,李秋芝,等.大麻THCA合成酶基因的克隆及生物信息学分析[J].山西农业大学学报(自然科学版),2017,37(5):326-329.
[15]陈其本,余立惠,杨明,等.大麻栽培利用及发展对策[M].成都:电子科技大学出版社,1993:1-34.
[16]Cascini F,Passerotti S,Martello S.A real-time PCR assay for the relative quantification of the tetrahydrocannabinolic acid(THCA)synthase gene in herbal Cannabis samples[J].Forensic Science International,2011,10(1-3):134-138.
[17]姜颖.一个玉米RING蛋白基因克隆和功能分析[D].哈尔滨:黑龙江大学农作物研究院,2010:27.
[18]张兰,檀鹏辉,滕珂,等.草地早熟禾荧光定量 PCR分析中内参基因的筛选[J].草业学报,2017,26(3):75-81.
[19]Flores-Sanchez IJ.Polyketide Synthases inCannabis sativaL.,Chapter III.Polyketide synthase activities and biosynthesis of cannabinoids and flavonoids inCannabis sativaL.plants[M].Amsterdam:Print Partners Ipskamp BV,2008:58-61.
[20]United Nations Office on Drugs and Crime(UNODC).Recommended methods for the identification and analysis of Cannabis and Cannabis Products[M].New York:United Nations Publication,2009:14-16.
Expression Pattern Assay of THCA Synthase Gene in Hem p(Cannabis sativa.L)
JIANG Ying,SUN Yufeng,LI Qiuzhi,PAN Dongmei,HAN Xicai
(Daqing Branch of Heilongjiang Academy of Sciences,Daqing,Heilongjiang 163319,China)
The expression of THCA synthase genewas analyzed by semi-quantitative RT-PCR and quantitative real-time PCR in different tissues of different hemp varieties.The results showed that differences existed in the expression ofCsTHCAbetween tissues of different varieties.The expression level ofCsTHCAwas the highest in the male flower of Huoma No.1,the female flower of Wuchang 40,and the leaves of Jindao 15.We also found that the expression level in root was relatively high,and the expression level in stem and grain was comparatively low.There was a positive correlation between THC content and the expression ofCsTHCAwith the method of thin-layer chromatography.Result of the study could provide the theoretical guidance for the safety promotion of hemp.
Cannabis sativa L.;THCA synthase gene;semi-quantitative reverse transcription;quantitative real-time PCR;expression pattern assay
S563.3
A
1671-3532(2017)06-0278-06
2017-05-15
黑龙江省青年科学基金(QC2016037)
姜颖(1986-),女,助理研究员,研究方向为作物遗传育种。E-mail:bazhujiangying@126.com
