毛细管电泳用于碱性水解反应动力学研究
2017-12-20陆永超高庆宇
陆永超,路 瑶,高庆宇
(1.徐州医科大学 公共教育学院,江苏 徐州 221004;2.中国矿业大学 现代分析与计算中心,江苏 徐州 221116;3.中国矿业大学 化工学院,江苏 徐州 221116)

陆永超1,*,路 瑶2,高庆宇3
(1.徐州医科大学 公共教育学院,江苏 徐州 221004;2.中国矿业大学 现代分析与计算中心,江苏 徐州 221116;3.中国矿业大学 化工学院,江苏 徐州 221116)

连四硫酸根离子;水解;硫代硫酸根离子;毛细管电泳;动力学

1 实验部分
1.1 试剂与设备
实验中所采用试剂分别用于运行缓冲溶液、反应缓冲溶液和各种硫化合物溶液等。磷酸及磷酸盐、碳酸及碳酸氢盐等用来配置反应缓冲溶液,均采用分析纯级别(上海苏懿化学试剂有限公司),未进行进一步的处理。高氯酸钠用于调节反应缓冲溶液离子强度,采用分析纯。磷酸二氢钾KH2PO4和硫酸铵(NH4)2SO4用于配置毛细管电泳分离所用的运行缓冲溶液,采用分析纯。硫代硫酸钠Na2S2O3和连四硫酸钾K2S4O6采用优级纯(美国Fluka公司)试剂。其他含硫化合物K2SnO6均由实验室自行合成制备。连三硫酸钾K2S3O6采用在低温下,浓H2O2氧化饱和Na2S2O3溶液的方法得到。连五硫酸钾K2S5O6·1.5H2O合成是在As2O3催化条件下,饱和Na2S2O3溶液在浓盐酸溶液中的水解反应后,经分离提纯和多次重结晶等后续处理后制得。
所有溶液均采用由Millipore MilliQ超纯水系统(18.2 MΩ·cm, Millipore, USA)制备的超纯水配置。动力学实验研究中,将反应溶液在恒温振荡水浴槽中进行,恒定温度25℃。所有试剂和溶液在使用前,用0.22 μm微孔滤膜过滤。
毛细管电泳分离检测在Beckman Coulter P/ACE MDQ毛细管电泳仪(美国Beckman Coulter公司)上完成,配备了自动进样器和具有全波长(190~400 nm)扫描功能的二极管阵列检测器(DAD),数据采集及处理在32 Karat Software软件工作站进行。单独检测通道设置为195、214和254 nm。检测过程采用压力进样,0.5 psi.×5 s。采用聚酰亚胺外涂层的熔融硅毛细管(河北永年锐沣光导纤维厂),75 μm i.d.×57 cm(有效长度50 cm),分离检测设定温度为25 ℃。进样采用自动进样器定时从样品小瓶中抽取溶液进行分离检测。
1.2 实验方法
作为反应介质的pH缓冲液分别采用相应的缓冲酸及其盐配置达到所需pH值(pH 10.5~12.0),并添加适量的NaClO4以保证某特定的水解反应均在同一离子强度下进行,以消除因离子强度反应速率的影响:
lg kr=lgk0+2AzAzBI0.5
其中,zA和zB为反应物A和B的核电荷数,I为反应发生介质的离子强度,kr是离子强度为I时的反应速率,k0是无电解质时的极限反应速率,A为指数前因子(A的值为0.509)。

毛细管电泳分离使用的运行缓冲液采用5 mM的KH2PO4与5 mM (NH4)2SO4组成的混合溶液,分离电压-30 kV,分离温度为25℃[6]。确定各个反应物的初始浓度,控制反应速率,以便进行定性和定量的测定;定期从反应溶液中抽取反应液,对各个反应进行跟踪检测,确定反应过程中的物种分布规律;通过建立相应化合物的校正曲线确定它们的反应动力学变化情况。需要特别指出的是,由于所检测反应的反应速率相对于分离速率慢的多,或在所使用的检测方法下化学反应停止或更慢,因此可以认为进样时间即为反应时间,分离测定的物质浓度代表进样时体系各物质的浓度。
1.3 反应动力学研究原理



(E1)

当在某特定pH值缓冲溶液中反应时,可以认为[OH-]是恒定值,因此就有k[OH-]α是恒定值,即
kobs=k[OH-]α
(E2)
其中,kobs为准一级反应速率常数,于是E1就可以写成
(E3)

(E4)

(E5)
而对于OH-而言,由E2等号两边取自然对数为:
lnkobs= lnk + αln[OH-]
(E6)
因此,做出ln[OH-]与lnkobs的曲线,得直线关系,求得斜率即为OH-的反应级数α。根据α的值和OH-的浓度代入E2中,即可计算出反应速率常数k。
2.1 水解产物分布及变化规律


(R1)


(R2)



Fig.1 Electropherogram of sulfur species detected with capillary electrophoresis in the basic hydrolysis reaction solution of tetrathionate

图碱性水解反应中
2.2 水解速率与pH依赖关系

(a) 不同pH值下测定的浓度变化曲线;

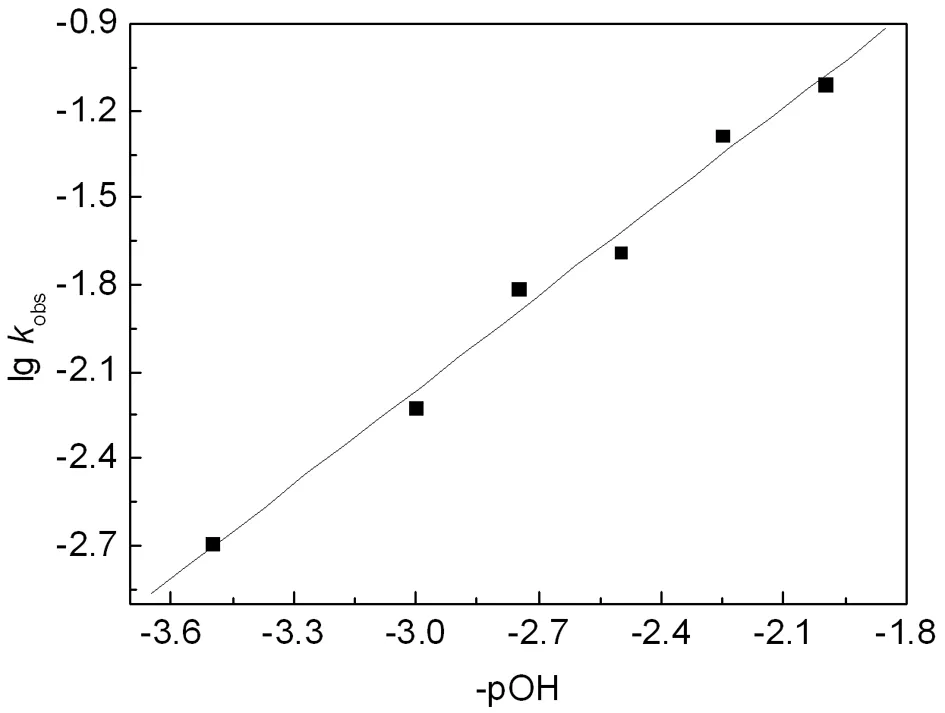
图水解反应准一级反应速率常数kobs与反应溶液[OH-]的关系
由图4中计算得到,直线的斜率为1.08457,即为水解反应速率对于[OH-]的级数为1;直线的截矩为1.0893,即lgk = 1.0893,进而计算得到反应速率为k约为12.29 M-1min-1,即0.205 M-1s-1。这个结果与文献中报道的结果很接近[12-13],由于离子强度,甚至缓冲盐的种类都会对水解反应有影响,所以必须准确评价体系的离子强度和所处的缓冲环境。


Table 1 Pseudo-first order rate constants kobs and rate constant k for hydrolysis reaction of tetrathionate, respectively



(R3)
(R4)

[S4]0 = 0.5 mM,[S2]0 = 0~1.6 mM,pH 9.80
3 结语

采用毛细管电泳方法对反应过程中硫氧化合物进行快速分离,并实现定性与定量分析,是化学动力学研究中的有力手段。由于化学反应相对于分析过程来说非常慢,因此在分离分析过程中各物种浓度可认为保持不变。另外,分离条件中所采用的运行缓冲溶液亦能维持样品中各化合物的稳定。
[1] Adani K G, Barley R, Pascoe R D. Silver recovery from synthetic photographic and medical X-ray process effluents using activated carbon[J].Miner Eng, 2005, 18 (13-14): 1269-1276.
[2] Breuer P L, Jeffrey M I. Thiosulfate leaching kinetics of gold in the presence of copper and ammonia[J]. Miner Eng, 2000, 13 (10-11): 1071-1081.
[3] Aylmore M G, Muir D M. Thiosulfate leaching of gold-A review[J]. Miner Eng,2001, 14 (2): 135-175.
[4] Grosse A C, Dicinoski G W, Shaw M J,et al. Leaching and recovery of gold using ammoniacal thiosulfate leach liquors (a review)[J]. Hydrometallurgy, 2003, 69 (1-3): 1-21.
[5] Ficeriová J, Baláǒ P, Villachica C L. Thiosulfate leaching of silver, gold and bismuth from a complex sulfide concentrates[J]. Hydrometallurgy, 2005, 77 (1-2): 35-39.
[6] 陆永超. 反应过程中硫氧化合物的检测和动力学分析[D]. 徐州:中国矿业大学,2010.
[7] Varga D, Horváth A K, Nagypál I. Unexpected formation of higher polythionates in the oxidation of thiosulfate by hypochlorous acid in a slightly acidic medium[J]. J Phys Chem B ,2006, 110(6): 2467-2470.
[8] Varga D, Horváth A K. Simultaneous evaluation of different types of kinetic traces of a complex system: Kinetics and mechanism of the tetrathionate-bromine reaction[J]. J Phys Chem A ,2009, 113:9988-9994.
[9] Varga D, Horváth A K. Kinetics and mechanism of the decomposition of tetrathionate ion in alkaline medium[J]. Inorg Chem, 2007, 46: 7654-7661.
[10] Voslaǐ M, MatejkáP. Schreiber I. Oscillatory reactions involving hydrogen peroxide and thiosulfates: Kinetics of the oxidation of tetrathionate by hydrogen peroxide[J] Inorg Chem: 2006, 45(7): 2824-2834.
[11] Kurin-Csörgei K, Orbán M, Rabái G, et al. Model for the oscillatory reaction between hydrogen peroxide and thiosulfate catalyzed by copper(II) ions[J]. J Chem Soc Faraday Trans, 1996, 92(16): 2851-2855.
[12] Zhang H G, Dreisinger D B. Kinetics of the decomposition of tetrathionate in alkaline solutions[J]. Hydrometallurgy, 2002, 66: 59-68.
[13] Breuer P L, Jeffrey M I. The effect of ionic strength and buffer choice on the decomposition of tetrathionate in alkaline solutions[J]. Hydrometallurgy, 2004, 72: 335-338.
KineticStudyofHydrolysisofTetrathionateUnderBasicConditionsUsingCapillaryElectrophoresis
LuYongchao1,*,LuYao2,GaoQingyu3
(1. School of Public Education, Xuzhou Medical University,Xuzhou 221004,China; 2. Center for Modern Analysis and Computation, China University of Mining and Technology, Xuzhou 221116,China; 3. School of Chemical Engineering and Technology , China University of Mining and Technology, Xuzhou 221116,China)

tetrathionate; hydrolysis; thiosulfate; capillary electrophoresis; kinetics
2017-11-07
徐州医科大学优秀人才科研启动基金项目(D2015020)
陆永超(1983—),讲师,徐州医科大学化学教研室。主要从事硫化学及色谱分析等研究。
O613.51
A
1008-021X(2017)22-0021-04

