一株三价砷氧化菌的分离鉴定及生长情况分析
2017-12-20潘灵锋李明兰潘继承
潘灵锋,李明兰,潘继承
(湖北师范大学 生命科学学院,湖北 黄石 435002)
一株三价砷氧化菌的分离鉴定及生长情况分析
潘灵锋,李明兰,潘继承
(湖北师范大学 生命科学学院,湖北 黄石 435002)
砷及其化合物是常见的环境污染物,地壳中的砷丰度约为1.8 ppm,岩石和土壤中砷的含量从小于1 ppm至几百ppm,砷在自然界广泛的存在性导致了砷污染的不可避免。微生物砷氧化有两点重要意义:一是As (Ⅲ) 的毒性大大强于As(Ⅴ),因此通过氧化反应可以降低环境中的砷污染毒性,同时三价砷氧化菌通过砷氧化反应过程中产生的能量能够完成自身的代谢和生长。从黄石某冶炼厂取得的土样及水样中分离出耐受砷菌株,对单菌落进行三价砷氧化能力鉴定,获得一株菌株,其能在培养基环境中将As (Ⅲ) 氧化为As (Ⅴ),且其氧化率接近100%,将其命名为11号菌株。根据16S rRNA基因构建的进化树结果分析表明,11号菌株属于假单胞菌属。分析11号菌株对As(Ⅲ)和Cu2+浓度的耐受性结果表明,As (Ⅲ) 和Cu2+对11号菌株生长的抑制作用呈浓度正相关。
三价砷;三价砷氧化菌;生长曲线
0 前言
砷又称砒,属于类金属,即一种两性元素,同时具有金属性和非金属性。砷的毒性和某些性质与重金属相似,且在自然环境中常与各种重金属离子共存,形成复合污染,即其来源和危害与重金属相似,因此,砷常常又被列为重金属来研究。是一种分布广泛,有毒并且危害人类健康的化学元素,皮肤接触低剂量的砷即可能致癌或致命。过量的砷对环境和人体都有严重的危害作用,我国已经将砷及其化合物列为“水中优先控制污染物黑名单”。
在2011年国务院批文的《重金属污染防治十二五规划》中将砷(As)污染列为工作重点之一,是重点污染物。《重金属污染防治十二五规划》指出由于重金属污染持续时间长,治理技术落后,监督管理薄弱,重金属的不可降解性使部分地区的水体底泥,场地和土壤污染物不断积累,潜在事故风险高,对群众健康造成严重威胁。 由于砷不能被降解的性质,将砷转移到安全的地方或者把高毒性的砷转化为低毒性的砷,甚至转化为低水溶性或不溶于水的矿化物质成为砷污染治理的方向。目前的处理方法有离子交换法、共沉淀、反渗透、吸附法和生物法五类处理方法。但是离子交换法费用高、共沉淀会产生砷废渣、反渗透在实际应用中并不广泛、而生物法个体微小,多为单个个体或个体结构简单的多细胞体作为土壤中重要的活性胶体组分,微生物比表面积大,易于繁殖,分布范围广,具有积累作用另外,微生物可作为电子传递体或受体氧化,还能分泌相关生物酶来氧化或甲基化As(Ⅲ),因此,微生物技术在砷污染治理过程中,也占据很重要的地位,是最具发展潜力的方法[2,3]。
1 材料与方法
1.1 砷耐受菌株的筛选
本研究从黄石某冶炼厂取得的土样及水样筛选砷耐受菌株。 配制土壤悬液: 称取5g 土样或10 mL水样,溶于200mL蒸馏水中,于37 ℃,180rpm恒温摇床振荡30min。取灭完菌含15%琼脂的TSB(胰蛋白胨大豆)培养基加入经细菌过滤器处理砷酸钠或亚砷酸钠(终浓度分别为35mM和55mM),倒平板,待平板凝固后在每个平板中均匀涂布100uL样品稀释液(将样品稀释成10-1,10-2,10-3,10-4,10-5,10-6)放置于28 ℃恒温培养箱中培养,挑单菌落稀释划线纯化菌种。
1.2 菌株砷氧化能力的鉴定
砷离子与银离子发生反应,As(Ⅲ)产生亚砷酸银呈淡黄色,As(Ⅴ)产生砷酸银呈红棕色,且溶液中两种价态砷含量的不同与银离子反应亦有不同颜色产物。且颜色变化呈梯度变化。因此根据菌株在含As(Ⅲ)培养基中生长过后与AgNO3反应的颜色与As (Ⅴ)/ As (Ⅲ)梯度混合溶液与AgNO3反应后产物颜色相对比即可获得该菌株大致氧化As(Ⅲ)能力[4]。取砷耐受菌株,置于终浓度0.1 M的含As (Ⅲ)TSB培养基中,于28℃,180rpm恒温摇床中培养。配置As(Ⅴ)/ As (Ⅲ)梯度混合TSB培养基溶液分别为As (Ⅴ)/ As (Ⅲ) 100/0;90/10;80/20;70/30;60/40;50/50;40/60;30/70;20/80;10/90;0/100置于28 ℃,180rpm恒温摇床中培养。培养12h及24h后分别取1mL培养液10000rpm离心5min,取100μL培养液上清加入等体积0.1M AgNO3溶液,观察并对比实验组与As(Ⅴ)/ As(Ⅲ)梯度组产物颜色。
1.3 16S rRNA基因测序鉴定砷氧化菌株
1.3.1 制备扩增模板 将细菌液体培养至对数生长期,取1mL菌液离心,弃上清;向离心管中加入50L无菌水重悬菌体;将离心管至于沸水中煮沸5~10min,10000rpm离心2min;取2L上清液作为PCR模板。
1.3.2 PCR扩增: 以砷氧化菌DNA为模板,根据16SrRNA通用扩增引物27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'- GGTTACCTTGTTACGACTT-3'进行PCR扩增反应。
扩增体系(50 L):
10×PCR buffer(+MgCl2) 5.0L
细菌总DNA 2.0L
27F(10M) 1.0L
1492R(10M) 1.0L
dNTP(10mM each) 1.0L
Taq酶(10U/L) 0.25L
ddH2O 补至50L
按以下条件扩增:94℃预变性6min,94℃ 60s,53℃ 50s,72℃ 60s共35个循环,最后72℃延伸6min。
1.3.3 PCR产物的回收 拿出扩增结束Ep管,从中取出5L反应产物,加入1L上样缓冲液,再加入4L的ddH2O混匀。点入预先制备好的1%的琼脂糖凝胶中,120V电泳。在紫外灯下检测扩增结果。切胶到1.5mL的EP管中,称重(不超过200mg),加入600L QG,50 ℃水浴10min,(如果未完全溶解,要继续水浴,直至完全溶解),每2~3min钟漩涡混匀一次。将溶液转到吸附柱上,12000rmp 1min。倒废液,向吸附柱中加入300 LQG,12000 rmp 1min。倒废液,加入700LPE,室温放置2~5min,12000rmp 1min。倒废液,加入500LPE,室温放置2-5min,12000rmp 1min。倒废液,空柱子12000rmp 2min。将吸附柱转移至无菌EP管中,静置5min挥发残留的PE。向膜中央加入10L的EB,静置3min,12000rmp 2min,扔掉吸附柱,EP管中即为凝胶回收产物。
1.3.4 DNA片段测序 将回收的片段送至生物公司测序,测序引物为16S rDNA 通用引物。
2.4 砷氧化菌株的生长情况监测:
1.4.1 菌株在砷胁迫和无砷胁迫中生长曲线的测定 分别以1%接种量至TSB培养基和1m mol/L As(III)的TSB培养基中摇床培养(37℃,200r/min),每隔2h取样,用紫外分光光度计在OD600测其吸光值。以时间t(h) 为横坐标,OD600值为纵坐标,绘制菌株的生长曲线图。
1.4.2 菌株对砷的耐受性 在斜面上用接种针取一环菌种至5mL TSB培养基中,摇瓶培养 12h (200r/min,30℃)。取下将菌液摇匀,以1% 接种量分别接种于含 As(III)的TSB试管培养基,置于摇床培养。砷浓度分别是0、1、10、30、35、40、45、50、55、60、65 m mol/L,培养20h,菌株的菌密度值用分光光度计OD600测定。
1.4.3 菌株对重金属铜的耐受性 在斜面上用接种针取一环菌种至 5mL TSB培养基中,摇瓶培养 12h (200r/min,30 ℃)。取下将菌液摇匀,以1%接种量分别接种于含 Cu2+的TSB试管培养基,置于摇床培养。砷浓度分别是0、0.2、0.4、0.7、1.0m mol/L,培养20h,菌株的菌密度值用分光光度计OD600测定。
2 结果与分析
2.1 筛选砷耐受菌及其砷氧化能力的鉴定:
分离得到并命名为11号菌株对砷氧化能力明显。在含1mM As(Ⅲ)的TSB培养基中培养11号菌,12h后取培养液上清与AgNO3溶液反应,并与As(Ⅴ)/ As (Ⅲ)梯度溶液于AgNO3溶液反应对比,发现11号菌株在培养12h后其上清液与AgNO3溶液发生反应后颜色同As(Ⅴ)/ As(Ⅲ)梯度溶液100/0接近,可推断出该菌株氧化能力接近100%.
2.2 砷氧化菌株16S rRNA基因测序鉴定菌种:
2.2.1 PCR扩增电泳分析
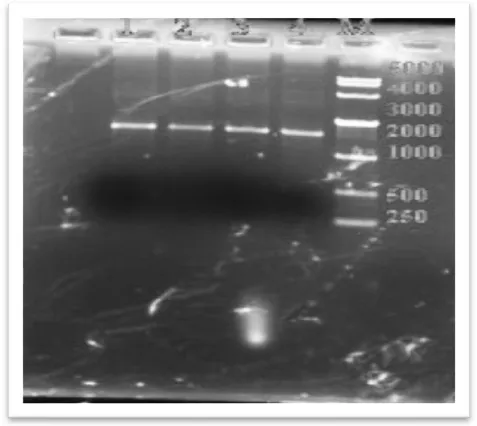
图1 泳道1~4为PCR产物,M道为标准核酸分子量MARKER
由图2可以看出,16S rRNA大小为1.5KB左右,图中1~4道电泳条带单一,分子量符合,可以进行下一步测序。
2.2.2 菌株16S rRNA基因测序结果:

2.2.3 构建进化树:

图2 根据11号菌16srRNA测序结果构建进化树
根据上述结果初步确定11号菌属于假单胞菌属(pseudomonas),而已有假单胞菌属被发现有对砷的氧化还原代谢能力。
2.3 在砷胁迫下菌株生长曲线的测定:
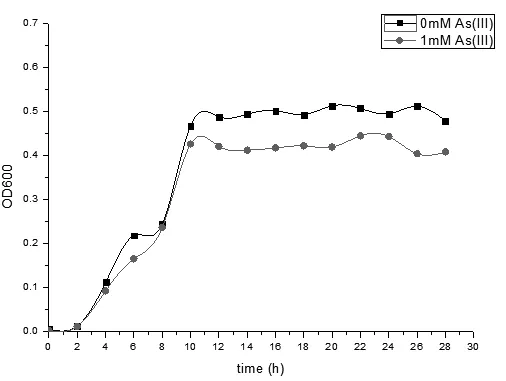
图4可以看出,菌株8 h 达到生长的对数期,12 ~ 28h达到生长的稳定期。砷的加入并不改变菌体的生长规律,而在砷胁迫下砷对菌体的生长有一定的抑制作用。
2.4 菌株对砷的耐受性分析:
由图5可见,含砷量越高, 砷对菌的生长抑制越大。当水中As(Ⅲ)达 65mM/L 时, 菌的生长出现了停止,说明菌株对As(Ⅲ)的耐受量为65mM/L.
2.5 菌株对铜的耐受性分析:
由图6可见,含铜离子浓度越高,其对菌的生长抑制越大。当水中Cu2+达1mM/L 时, 菌的生长出现了停止,说明菌株对 Cu2+的耐受量1mM/L.
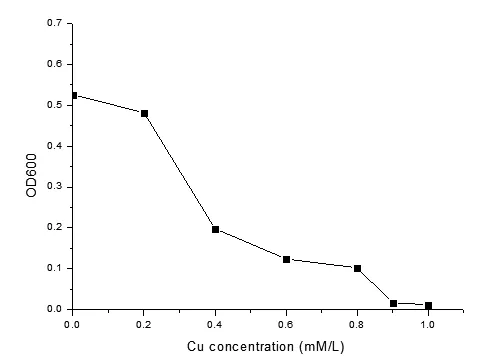
图5 菌株对铜的耐受性
3 展望
对微生物砷代谢机制的研究发现,微生物的砷甲基化和微生物对砷的氧化作用都可以将 As (Ⅲ)转化为毒性较低的有机砷或 As (Ⅴ)。 如何利用微生物对砷污染环境进行修复已成为国内外关注的焦点,因此生物修复被认为是修复砷污染环境的重要手段。本研究发现的这株砷氧化菌,能在As(Ⅲ)环境下氧化As(Ⅲ)为As(Ⅴ),降低环境中的毒性,同时完成自身的生长。对As(Ⅲ)的耐受量为65mM/L,相较已报道的CLL-B7[10],其耐受性达到CLL-B7的1.5倍,有很高的研究价值。后续将针对其砷环境胁迫中的相关基因表达及重要代谢循环的过程变化研究其对砷的氧化代谢机制。
[1]Rodríguez-Lado L, Sun G, Berg M, et al. Groundwater arsenic contamination throughout China[J]. Science, 2013, 341(6148):866.
[2]纪冬丽, 孟凡生, 薛 浩,等. 国内外土壤砷污染及其修复技术现状与展望[J]. 环境工程技术学报,2016, 6(1): 90~99.
[3]陈雪梅,胡锋平.含砷饮用水处理技术综述[J].江西化工, 2009, (4):42~45.
[4]Simeonova D D, Lièvremont D, Lagarde F, et al. Microplate screening assay for the detection of arsenite-oxidizing and arsenate-reducing bacteria[J]. Fems Microbiology Letters, 2004, 237(2):249~253.
[5]Jahan K, Mosto P, Mattson C, et al. Microbial Removal of Arsenic[J]. Water, Air, & Soil Pollution: Focus, 2006, 6(1):71~82.
[6]Mishra D, Rhee Y H. Microbial leaching of metals from solid industrial wastes[J]. Journal of Microbiology, 2014, 52(1):1~7.
[7]Oremland R S, Stolz J F. The ecology of arsenic[J]. Cheminform, 2003, 300(5621):939~44.
[8]Hamamura N, Fukushima K, Itai T. Identification of antimony-and arsenic-oxidizing bacteria associated with antimony mine tailing[J]. Microbes & Environments, 2013, 28(2):257~263.
[9]Amend J P, Saltikov C, Lu G S, et al. Microbial Arsenic Metabolism and Reaction Energetics[J]. Reviews in Mineralogy & Geochemistry, 2014, 79(1):391~433.
[10]Chen L L. Isolation and Identification of a Microbacterium Strain with Arsenite-Oxidizing and Arsenate-Reducing Abilities[J]. Journal of Anhui Agricultural Sciences, 2011,21(2):216~218.
Isolationandidentificationofatrivalentarsenicoxidizingbacteriumandanalysisofitsgrowth
PAN Ling-feng, LI Ming-lan, PAN Ji-cheng
(College of Life Science,Hubei Normal University Huangshi 435002,China)
Arsenic and its compounds are environmental pollution, arsenic abundance in the crust is about 1.8ppm, the rock and the arsenic content in soil from less than 1ppm to several hundred ppm, arsenic in nature widely existence leads to the inevitable arsenic pollution. There are two important influence of microbial oxidate arsenic: one is As (III) toxicity is much stronger than that of As (V), so the oxidation reaction can reduce the toxicity of arsenic pollution in the environment,at the same time produce trivalent arsenic oxidizing bacteria by arsenic oxidation process to complete its energy metabolism and growth. In this study the separation of arsenic tolerance strains out soil samples and water samples obtained from the Huangshi smelter in the identification of arsenic oxidation ability of single colony, a strain found in the culture medium in the environment of As(III) can be oxidized to As(V), and the oxidation rate is close to 100% and named strain No. 11.The results showed that strain No.11 belonged to pseudomonas according to the phylogenetic tree constructed by 16S rRNA gene.Analyzing strain No.11 tolerance to As (III) and Cu2+,the results shows that the inhibitory effects of As (III) and Cu2+on the growth of strain No.11 are positively correlated.
Trivalent arsenic; arsenic oxidizing bacteria; growth curve
Q93
A
2096-3149(2017)04- 0067-06
10.3969/j.issn.2096-3149.2017.04.014
2017—09—28
潘灵锋(1991— ),湖北黄石人,硕士生.
