拔节期低温胁迫对小麦生理特性和产量的影响
2017-12-20李国领张建周张德奇
张 磊,李国领,张建周,张德奇
(1.河南省农业科学院 科研管理处,河南 郑州 450002; 2.河南省农业科学院 小麦研究所,河南 郑州 450002)
拔节期低温胁迫对小麦生理特性和产量的影响
张 磊1,李国领2,张建周2,张德奇2
(1.河南省农业科学院 科研管理处,河南 郑州 450002; 2.河南省农业科学院 小麦研究所,河南 郑州 450002)
为明确拔节期低温胁迫对小麦生理特性和产量的影响,以周麦18和众麦1号为材料,利用人工智能温室模拟0 ℃低温胁迫,测定了试材在低温胁迫24 h和48 h后的气体交换参数、叶绿素荧光参数、生理指标和单株产量相关性状。结果表明,小麦品种的耐低温特性存在基因型间差异,众麦1号的耐低温特性显著优于周麦18。低温胁迫处理后,2个小麦品种的气体交换参数、叶绿素荧光参数Fv/Fm和qP值、叶绿素含量均显著降低,众麦1号的降低幅度显著低于周麦18,其中低温胁迫24 h后,两品种的净光合速率较对照处理分别降低36.47%和30.91%,48 h后分别降低57.00%和49.18%;叶绿素荧光参数NPQ、脯氨酸含量、可溶性蛋白含量均显著上升,众麦1号的上升幅度显著高于周麦18;SOD、POD、CAT酶活性呈现先升后降的趋势,众麦1号的上升幅度高于周麦18,而下降幅度小于周麦18;周麦18和众麦1号的单株产量显著降低,低温胁迫24 h后周麦18和众麦1号的单株产量较对照分别下降31.00%、19.09%,48 h后分别下降56.85%、46.59%,低温胁迫主要影响了单株穗数和单穗粒数。综上,低温胁迫下众麦1号可积累更多的脯氨酸和可溶性蛋白,同时具有较高水平的抗氧化酶活性,可减轻逆境下小麦受伤害程度,维持较高的光合效率并获得较高的产量,这是其具有较好耐低温特性的原因。
小麦; 拔节期; 低温胁迫; 生理特性; 产量
黄淮南部麦区是我国小麦主产区,播种面积和总产量约占全国的40%。该麦区位于我国中部,处于南北方过渡地带,小麦生产上经常遇到“倒春寒”灾害。近10 a来,受全球变暖影响,春季气温回升不平稳,常出现骤升骤降现象,对小麦生产造成较大的影响[1-2]。春季冻害已成为影响黄淮南部麦区小麦高产稳产的主要气象灾害因子之一[3]。
小麦拔节期遭遇低温胁迫,常造成整个幼穗或部分小穗死亡,生育后期不抽穗、空穗、半截穗、缺粒穗,影响小麦高产稳产;对小麦生理特性的影响主要表现在细胞膜系统受损、叶绿素合成受阻、酶系统失活、光合作用效率降低等[4-5]。前人关于低温胁迫对小麦生理和产量的影响已有报道,但多数就同一品种展开研究,对不同小麦品种的耐低温胁迫特性探讨较少[6-8]。孙苗苗等[9]用冰柜对12个小麦品种进行低温胁迫,研究了不同品种的耐低温特性,但冰柜环境与大田实际低温胁迫环境差异较大,易造成低温弱光交叉胁迫,不能完全反映不同品种的耐低温特性。为此,利用人工智能温室模拟田间低温逆境,研究了周麦18和众麦1号在0 ℃低温胁迫24 h和48 h后的生理和产量性状的变化,以期为耐低温小麦新品种选育和小麦抗春季低温胁迫栽培技术的研制提供理论依据。
1 材料和方法
1.1 试验材料及试验设计
供试材料为小麦品种周麦18和众麦1号,分别播种于内径25 cm、高30 cm的花盆中,每盆装入12 kg耕层土,基础肥力为碱解氮92.5 mg/kg、有效磷22.7 mg/kg、速效钾93.8 mg/kg,每品种种植30盆,其余栽培措施同大田。
于小麦拔节期(基部节间伸长3 cm)进行低温胁迫处理,处理前浇水,将盆栽整体移入人工智能温室内进行处理。将处理开始前正常生长的小麦盆栽设为对照处理(CK);低温胁迫处理:温度设置为0 ℃,胁迫时间为24 h和48 h,光强为1 000 μmol/(m2·s),光照时间为7:00—17:00,空气相对湿度控制为65%。
1.2 测定指标与方法
1.2.1 气体交换参数 用CIRAS-2型便携式光合作用测定仪(PP SYSTEMS,USA)测定小麦植株最上部全展叶的净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,Ci)。采用CO2钢瓶供气,CO2浓度设置为380 μmol/mol,气体流速为300 mL/min,内部光源控制光照强度,光强设置为1 500 μmol/(m2·s),重复3次。
1.2.2 叶绿素荧光参数 参照Genty等[10]方法,利用FMS-2便携式脉冲调制式荧光仪(Hansatech,UK) 测定小麦植株最上部全展叶的叶绿素荧光参数,重复3次,测定叶片PSⅡ的最大光化学效率(Fv/Fm)之前,先用暗适应夹进行20 min的暗适应。
荧光参数计算公式:PSⅡ的最大光化学效率Fv/Fm=(Fm-Fo)/Fm,光化学猝灭qP=(Fm′-Fs)/(Fm′-Fo′),非光化学猝灭NPQ=(Fm-Fm′)/Fm。
1.2.3 叶绿素含量 参考Arnon[11]方法进行测定。
1.2.4 脯氨酸含量 参考Troll等[12]方法进行测定。
1.2.5 可溶性蛋白含量 参考Read等[13]方法进行测定。
1.2.6 抗氧化酶活性 参照Qi等[14]改进的方法,测定超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase,CAT)活性、过氧化物酶(peroxidase,POD)活性。
1.2.7 单株产量性状 小麦成熟后,收获盆栽单株,调查单株产量、单株穗数、穗粒数、千粒质量等产量性状,每处理下每个材料调查10株。
1.3 统计分析
用SPSS 16.0进行统计分析,Microsoft Excel 2003绘图。
2 结果与分析
2.1 低温胁迫对2个小麦品种气体交换参数的影响
如图1所示,低温胁迫显著降低了周麦18和众麦1号的净光合速率,低温胁迫24 h后,两品种较对照处理分别降低36.47%和30.91%,48 h后分别降低57.00%和49.18%,低温胁迫下众麦1号的净光合速率均显著高于周麦18;蒸腾速率、气孔导度和胞间CO2浓度的变化趋势与净光合速率一致,说明2个小麦品种的耐低温胁迫能力不同,低温胁迫下众麦1号仍能维持相对较高的净光合效率,其耐低温特性显著优于周麦18。
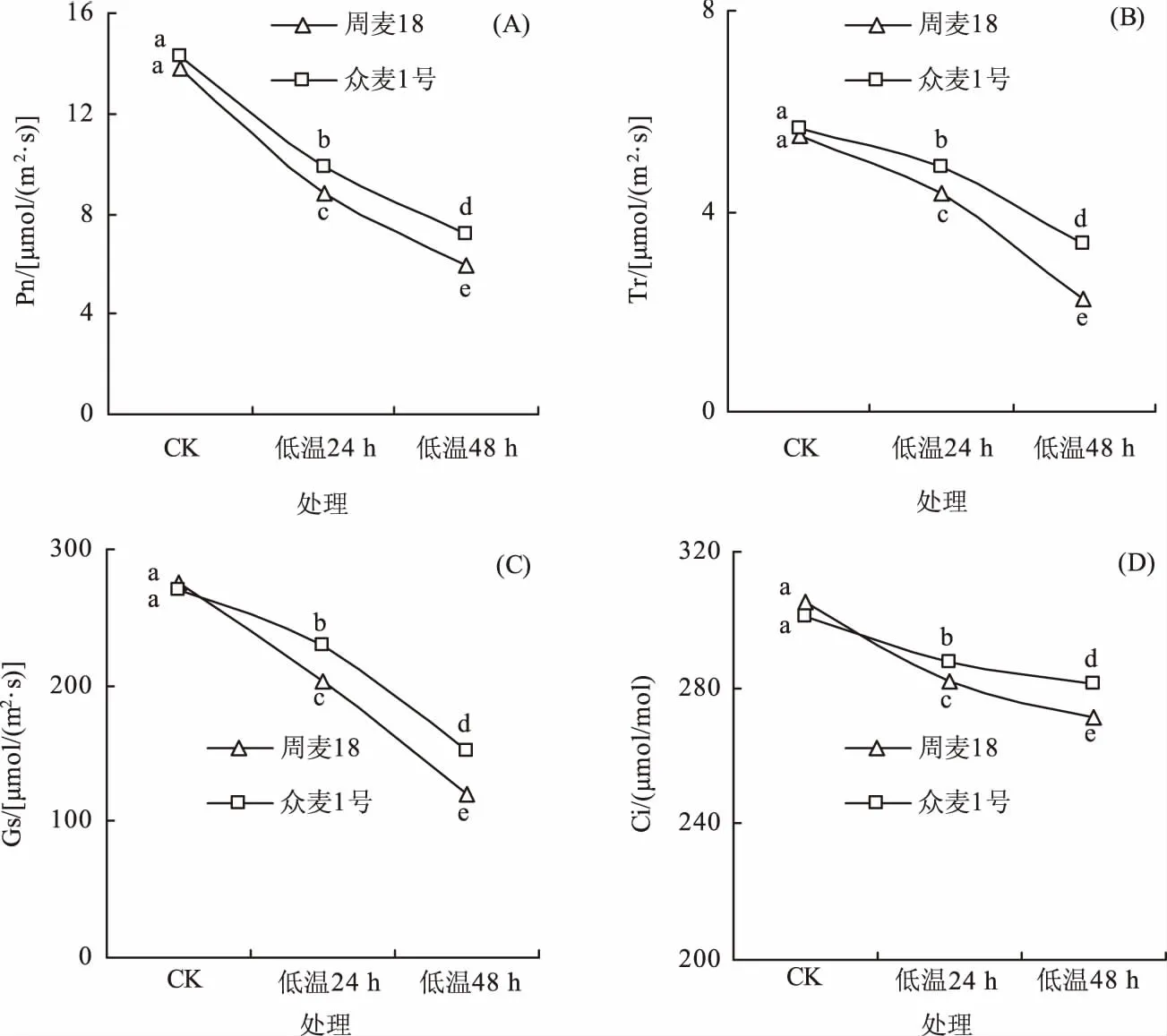
不同字母表示处理间差异显著(P<0.05),下同
2.2 低温胁迫对2个小麦品种叶绿素荧光参数的影响
如图2(A)所示,低温胁迫显著降低了周麦18和众麦1号的Fv/Fm值,低温胁迫24 h后,两品种较对照处理分别降低40.15%和31.84%,48 h后分别降低59.15%和43.82%,众麦1号的Fv/Fm值显著高于周麦18,说明众麦1号在低温胁迫下较周麦18具有更高的潜在最大光化学效率。
如图2(B)所示,低温胁迫显著降低了周麦18和众麦1号的qP值,低温胁迫24 h后,两品种较对照处理分别降低42.58%和34.76%,48 h后分别降低54.19%和47.15%,众麦1号的qP显著高于周麦18,说明低温胁迫下众麦1号仍能维持较高水平的光化学效率。
如图2(C)所示,低温胁迫后,周麦18和众麦1号的NPQ值均显著升高,低温胁迫24 h后,两品种较对照处理分别升高22.26%和14.39%,48 h后分别升高51.98%和41.67%,众麦1号的NPQ显著低于周麦18,说明低温胁迫下众麦1号用于热耗散的能量低于周麦18。
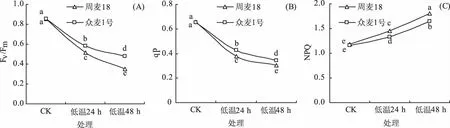
图2 低温胁迫对2个小麦品种叶绿素荧光参数的影响
2.3 低温胁迫对2个小麦品种叶绿素含量的影响
如图3所示,低温胁迫阻碍了小麦叶绿素合成,低温胁迫后周麦18和众麦1号的叶绿素含量显著降低,低温胁迫24 h后,周麦18和众麦1号的叶绿素含量较对照处理分别降低11.55%和5.92%,48 h后分别降低26.75%和19.28%,众麦1号的叶绿素含量显著高于周麦18,说明低温胁迫下众麦1号的叶绿素合成受阻较轻。
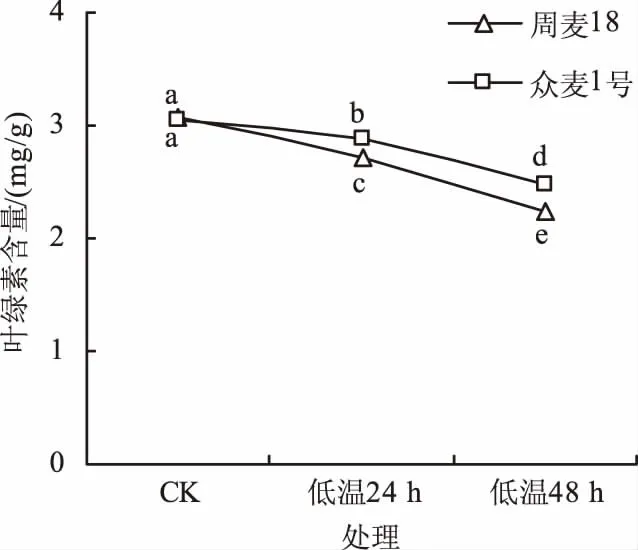
图3 低温胁迫对2个小麦品种叶绿素含量的影响
2.4 低温胁迫对2个小麦品种渗透调节物质的影响
如图4所示,低温胁迫后周麦18和众麦1号的脯氨酸和可溶性蛋白含量均显著上升,低温胁迫24 h后,周麦18和众麦1号的脯氨酸含量较对照处理分别升高14.42%和19.56%,可溶性蛋白含量分别升高20.12%和26.82%;48 h后脯氨酸含量较对照处理分别升高30.41%和38.5%,可溶性蛋白含量分别升高44.72%和57.30%。众麦1号的脯氨酸和可溶性蛋白含量显著高于周麦18,说明低温胁迫下众麦1号可合成更多的渗透调节物质,以缓解低温伤害。
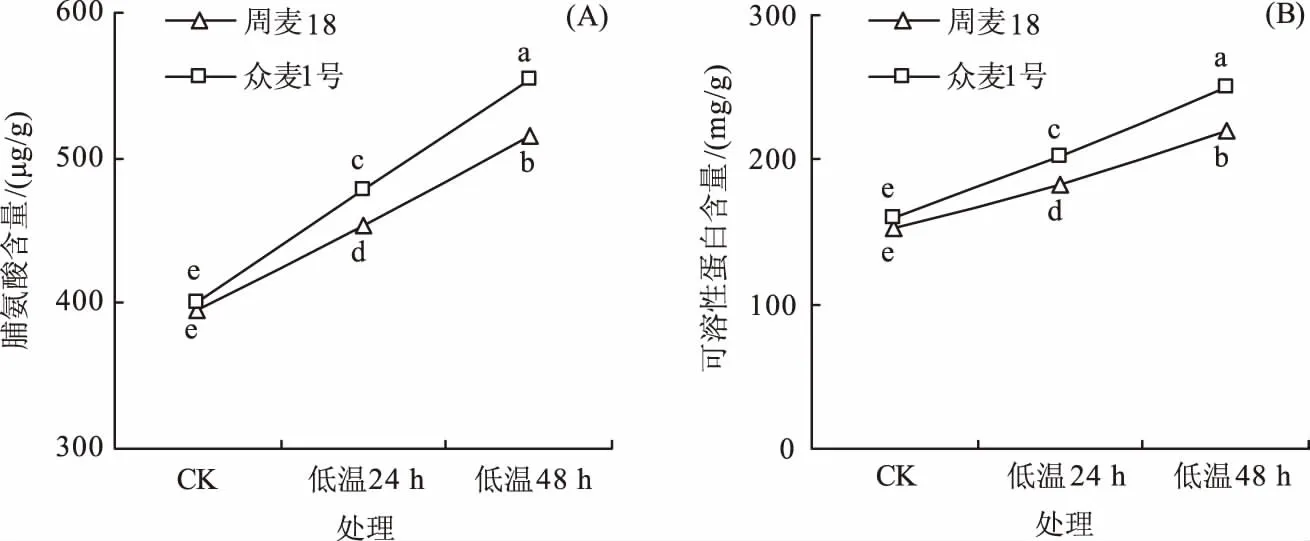
图4 低温胁迫对2个小麦品种脯氨酸和可溶性蛋白含量的影响
2.5 低温胁迫对2个小麦品种抗氧化酶活性的影响
如图5所示,低温胁迫后SOD、POD和CAT活性均出现先升后降的趋势,低温胁迫24 h后,周麦18和众麦1号的SOD活性较对照分别升高5.49%和11.41%,POD活性分别升高29.93%和45.94%,CAT活性分别升高23.45%和31.98%;低温胁迫48 h后,两品种的SOD活性较对照处理分别降低10.87%和3.70%,POD活性分别降低20.20%和9.98%,CAT活性分别降低21.86%和12.60%。说明低温胁迫下众麦1号具有更高的抗氧化酶活性,可有效清除低温胁迫下小麦体内积累的活性氧类物质。

图5 低温胁迫对2个小麦品种抗氧化酶活性的影响
2.6 低温胁迫对2个小麦品种单株产量性状的影响
由表1可见,低温胁迫使周麦18和众麦1号的单株产量均显著降低,低温胁迫24 h后周麦18和众麦1号的单株产量较对照分别下降31.00%和19.09%,48 h后分别下降56.85%和46.59%。
分析其产量构成因素发现,低温胁迫主要降低了单株穗数和单穗粒数,低温胁迫24 h后周麦18和众麦1号的单株穗数较对照处理分别下降19.23%和8.75%,单穗粒数分别下降13.65%和10.50%;低温胁迫48 h后周麦18和众麦1号的单株穗数较对照处理分别下降34.62%和22.50%,单穗粒数分别下降33.40%和31.49%(表1)。结果表明,低温主要影响小麦穗数和穗粒数,对千粒质量的影响不显著。
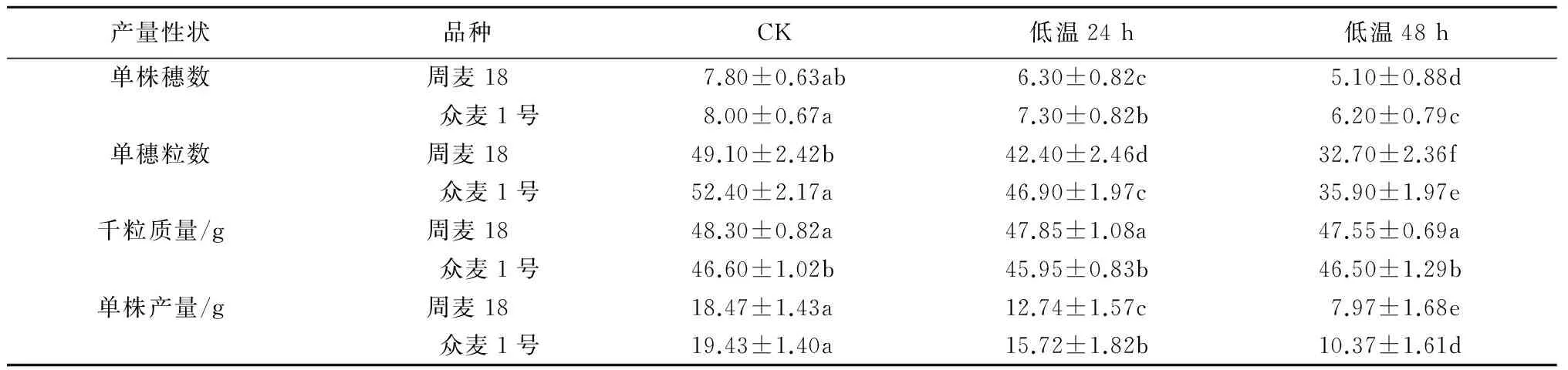
表1 低温胁迫对2个小麦品种产量性状的影响
注:同一指标数值后不同字母表示差异显著(P<0.05)。
3 结论与讨论
植物的光合作用对环境胁迫极为敏感,受到低温、高温和干旱等非生物逆境胁迫后其光合速率显著降低[14-17],低温胁迫下不同品种光合速率的高低,可反映其耐低温特性的优劣。本研究发现,众麦1号在低温胁迫处理后,净光合速率的下降幅度显著小于周麦18,说明逆境下众麦1号的光合机构活性降低较少,仍能维持较高的光合碳同化水平,耐低温特性显著优于周麦18。同时还发现,低温胁迫后净光合速率和气孔导度均显著下降,前人研究也表明,低温胁迫可引起植物光合速率与气孔导度同时下降[18-19],与本研究结果一致。
有研究表明,低温胁迫会引起植物PSⅡ光抑制[15],本研究发现,低温胁迫下众麦1号和周麦18的Fv/Fm和qP显著降低,说明低温胁迫大大抑制了PSⅡ活性,出现这一现象的原因是:低温下光合电子传递链和碳同化相关酶活性降低,导致PSⅡ复合体同化的光能相对增加,形成大量活性氧类物质,对D1蛋白造成损伤,使PSⅡ活性受到强烈抑制。从结果可以看出,低温胁迫下众麦1号的光抑制程度较轻,仍能保持较高水平的光化学效率。
低温胁迫下小麦叶片内部发生的生理生化变化是其表型变化的根本原因,叶绿素含量的变化影响植物吸收太阳光能的能力,逆境下众麦1号的叶绿素含量下降幅度显著低于周麦18,原因是逆境下众麦1号仍可保持较高水平的光化学效率,产生的过剩电子较少,对叶绿素分子的破坏程度较轻。植物体内可溶性蛋白和脯氨酸的积累有助于小麦在低温胁迫下保持细胞膜的稳定,也有利于叶绿素的合成[20]。本研究中发现,低温胁迫后众麦1号的可溶性蛋白和脯氨酸含量下降幅度显著低于周麦18,这对其维持细胞膜稳定性和叶绿素合成均具有重要作用。同时还发现,低温胁迫后,众麦1号的SOD、POD和CAT活性下降幅度显著低于周麦18,较高的抗氧化酶系统活性可有效清除由于过剩电子累积产生的活性氧类物质,维持细胞膜稳定性,有效降低光合机构元件的受损程度,最终使众麦1号在逆境下保持较高的光合效率,合成更多的干物质,最终获得更高的产量。产量测定结果表明,低温主要影响小麦的单株穗数和单穗粒数,对千粒质量影响较小,低温胁迫后众麦1号的单株穗数和单穗粒数下降幅度显著低于周麦18,这是其最终获得较高单株产量的原因。因此,对于易发生倒春寒危害的小麦生产地区而言,生产上应首选耐低温小麦品种种植,此外,在品种遭遇到不同程度的春季冻害后,应通过补浇水、补施肥的措施,促进新生分蘖形成,减少小穗小花退化,最大程度地降低冻害对产量造成的影响。
综上所述,小麦品种的耐低温特性存在基因型间差异,众麦1号的耐低温特性显著优于周麦18。低温胁迫下众麦1号可积累更多的脯氨酸和可溶性蛋白,同时具有较高水平的抗氧化酶活性,可减轻逆境下小麦受伤害程度,维持较高的光合效率并获得较高的产量,这是其具有较好耐低温特性的原因。
[1] Liu B,Asseng S,Müller C,etal.Similar estimates of temperature impacts on global wheat yield by three independent methods[J].Nature Climate Change,2016,6(12):1130-1136.
[2] 陈襄礼,李林峰,王重锋,等.小麦倒春寒发生特点及防御措施初探[J].河南农业科学,2014,43(2):35-37.
[3] 赵虹,王西成,胡卫国,等.黄淮南片麦区小麦倒春寒冻害成因及预防措施[J].河南农业科学,2014,43(8):34-38.
[4] Sonoike K.The different roles of chilling temperatures in the photoinhibition of photosystem Ⅰ and photosystem Ⅱ[J].Journal of Photochemistry and Photobiology B,1999,48(2):136-141.
[5] Savvides A,Ali S,Tester M,etal.Chemical priming of plants against multiple abiotic stresses:Mission possible?[J].Trends in Plant Science,2016,21(4):329-340.
[6] Sun X C,Hu C X,Tan Q L.Effects of molybdenum on antioxidative defense system and membrane lipid peroxidation in winter wheat under low temperature stress[J].Journal of Plant Physiology and Molecular Biology,2006,32(2):175-182.
[7] Tchagang A B,Fauteux F,Tulpan D,etal.Bioinformatics identification of new targets for improving low temperature stress tolerance in spring and winter wheat[J].BMC Bioinformatics,2017,18(1):174-189.
[8] Ji H,Xiao L,Xia Y,etal.Effects of jointing and booting low temperature stresses on grain yield and yield components in wheat[J].Agricultural and Forest Meteorology,2017,243:33-42.
[9] 孙苗苗,王志强,高翔,等.河南主推小麦品种对低温胁迫的生理响应及耐寒性分析[J].麦类作物学报,2016,36(3):316-324.
[10] Genty B,Briantais J,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].Biochim Biophys Acta,1989,990:87-92.
[11] Arnon D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase inBetavulgaris[J].Plant Physiology,1949,24(1):1-15.
[12] Troll W,Lindsley J.A photometric method for the determination of proline[J].Journal of Biological Chemistry,1955,215:655-660.
[13] Read S M,Northcote D H.Minimization of variation in the response to different proteins of the Coomassie blue G dye-binding assay for protein[J].Analytical Biochemistry,1981,116(1):53-64.
[14] Qi X,Xu W,Zhang J,etal.Physiological characteristics and metabolomics of transgenic wheat containing the maize C4phosphoenolpyruvate carboxylase(PEPC) gene under high temperature stress[J].Protoplasma,2017,254(2):1017-1030.
[15] 张子山,张立涛,高辉远,等.不同光强与低温交叉胁迫下黄瓜 PSⅠ 与 PSⅡ 的光抑制研究[J].中国农业科学,2009,42(12):4288-4293.
[16] Kratsch H A,Wise R R.The ultrastructure of chilling stress[J].Plant,Cell & Environment,2000,23(4):337-350.
[17] Takahashi S,Murata N.How do environmental stresses accelerate photoinhibition?[J].Trends in Plant Science,2008,13(4):178-182.
[18] 陈思思,李春燕,杨景,等.拔节期低温冻害对扬麦 16 光合特性及产量形成的影响[J].扬州大学学报(农业与生命科学版),2014,35(3):59-64.
[19] 范琼花,孙万春,李兆君,等.硅对短期低温胁迫小麦叶片光合作用及其主要相关酶的影响[J].植物营养与肥料学报,2009,15(3):544-550.
[20] Mansour M M F.Protection of plasma membrane of onion epidermal cells by glycinebetaine and proline against NaCl stress[J].Plant Physiology and Biochemistry,1998,36(10):767-772.
Effects of Low Temperature Stress on Physiological Characters and Yield of Two Wheat Varieties at Jointing Stage
ZHANG Lei1,LI Guoling2,ZHANG Jianzhou2,ZHANG Deqi2
(1.Department of Scientific Research Management,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China;2.Wheat Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
In order to explore the effects of low temperature stress on physiological characters and yield of different wheat varieties at jointing stage,we took two wheat varieties named Zhoumai 18 and Zhongmai 1 as materials,and treated them in an artificial phytotron under low temperature(0 ℃) stress.The gas exchange parameters,chlorophyll fluorescence parameters,biochemical indexes and yield characters were determined after 24 h and 48 h.The results showed that two wheat varieties had different tolerance to low temperature,and the tolerance of Zhongmai 1 was better than Zhoumai 18.After low temperature stress,the inhibition degree of gas exchange characters,maximum photochemical efficiency(Fv/Fm) and photochemical quenching(qP),chlorophyll content in Zhongmai 1 was lower than that in Zhoumai 18;the increased degree of non-photochemical quenching(NPQ),the content of proline and soluble protein in Zhongmai 1 was higher than that in Zhoumai 18.The net photosynthetic rate of Zhongmai 1 and Zhoumai 18 decreased by 36.47% and 30.91% after low temperature stress for 24 h,and decreased by 57.00% and 49.18% after 48 h.The tendency of superoxide dismutase,peroxidase and catalase activities rose first and fell later,the increase degree of Zhongmai 1 was higher than that of Zhoumai 18,while it showed the opposite tendency for the inhibition degree.The yield per plant decreased significantly,Zhoumai 18 and Zhongmai 1 decreased by 31.00% and 19.09% after low temperature stress for 24 h,and decreased by 56.85% and 46.59% after 48 h.The effective heads per plant and grains per head were seriously reduced by low temperature.Collectively,Zhongmai 1 can accumulate more proline and soluble protein,and maintain higher antioxidant enzyme activities than Zhoumai 18 under low temperature stress,which can relieve the damage to the leaves,keep in higher level of photosynthetic efficiency and get higher yield.This is the reason for its good tolerance to low temperature.
wheat; jointing stage; low temperature stress; physiological characters; yield
S512.1
A
1004-3268(2017)11-0013-06
2017-07-26
国家自然科学基金面上项目(31371707)
张 磊(1979-),男,安徽蒙城人,副研究员,博士,主要从事小麦遗传育种研究。E-mail:zhagnlei7971@163.com
