广西地方鸡微卫星位点LEI0258多态性研究
2017-12-20黄勋和邓春苗柯振华谢洁如陈洁波钟福生
黄勋和,邓春苗,柯振华,谢洁如,陈洁波,钟福生
(嘉应学院 生命科学学院,广东 梅州 514015)
广西地方鸡微卫星位点LEI0258多态性研究
黄勋和,邓春苗,柯振华,谢洁如,陈洁波,钟福生*
(嘉应学院 生命科学学院,广东 梅州 514015)
通过微卫星位点LEI0258基因分型和基因测序,分析6个广西地方鸡品种的遗传变异并构建中介网络图,研究广西地方鸡的遗传多样性与分子进化。结果表明,120份样品经基因分型,检测到38个等位基因,长度为181~507 bp,等位基因205出现的频率最高(0.125),其次是275(0.113)、310(0.100) 和251(0.067)。广西地方鸡保持着较高的遗传多样性水平,观察杂合度、期望杂合度和多态信息含量分别为0.800、0.943和0.936。经测序鉴定出39个等位基因,其中9个为首次发现。11个等位基因与已知的21种血清型相对应。基于侧翼序列变异信息的中介网络图显示,39个等位基因分为3个进化枝,红原鸡的部分基因存在于这些进化枝中,提示红原鸡可能是广西地方鸡的主要祖先。
广西地方鸡; 微卫星; LEI0258; 多态性; 分子进化
家禽遗传资源是动物遗传资源的重要组成部分,研究家禽遗传多样性,有助于揭示品种的形成历史及其相互之间的亲缘关系,对科学保护和合理利用地方品种的优良基因库具有重要意义[1]。微卫星位点LEI0258因位于鸡的16号染色体上主要组织相容性复合体B区域(major histocompatibility complex B region,MHC-B)而与常规的微卫星标记不同[2]。MHC-B的遗传多态性通常与宿主的抗病能力相关[3-4],并且微卫星位点LEI0258与MHC-B血清型有较强的对应性[5]。因此,近年来微卫星位点LEI0258被广泛应用于家鸡的遗传多样性和分子进化研究[6-10]。黄勋和等[9]应用LEI0258研究了华南家鸡的遗传多样性与进化历史,发现华南家鸡保持着较高的遗传多样性,中介网络图分析提示,红原鸡是华南家鸡的主要祖先,同时探讨了应用LEI0258变异信息进行品种鉴定的可行性。
我国广西地区拥有众多各具特色的本土鸡品种,其中有6个品种入选《中国畜禽遗传资源志·家禽志》[11],其在家鸡的驯化研究中具有重要地位。因此,研究广西地方鸡遗传多样性与种系关系,不仅可以了解广西地方鸡遗传多样性水平和保护潜力,也可为家鸡驯化起源和扩散研究提供新视野。常规微卫星标记和线粒体DNA D-loop研究表明,广西地方鸡保持着较高的遗传变异水平,具有较高的选育潜力,母系起源于东南亚和我国西南地区[12-14]。本研究应用微卫星LEI0258位点变异信息对广西地方鸡进行遗传多样性分析,评估品种保护潜力,为了解广西地方鸡品种资源动态、提高保种选育效果和促进分子进化研究提供科学依据。
1 材料和方法
1.1 试验材料和试剂
本试验采取东兰乌鸡(DL)、广西麻鸡(GM)、霞烟鸡(XY)、龙胜凤鸡(LS)、南丹瑶鸡(ND)、广西三黄鸡(GX)6个广西地方品种各20份血液样品,样品均来源于原产地。采用传统的酚氯仿法提取基因组DNA。PCR相关试剂购自宝生物工程(大连)有限公司,引物由英潍捷基(上海)贸易有限公司合成。
1.2 PCR扩增与基因分型
引物序列:带荧光标记的上游引物LEI0258F为FAM-5′-CACGCAGCAGAACTTGGTAAGG-3′,下游引物LEI0258R为5′-AGCTGTGCTCAGTCCTCAGTGC-3′[2]。PCR反应体系: 3 μL 10×PCR Buffer,2.4 μL dNTPs(含Mg2+),上、下游引物(20 μmol/L)各0.3 μL,1 UTaqDNA 聚合酶(大连宝生物工程有限公司),50 ng DNA模板,用灭菌双蒸水补至30 μL。PCR扩增条件: 94 ℃预变性4 min;94 ℃变性30 s,63 ℃退火1 min,72 ℃延伸1 min,36个循环;最后72 ℃延伸7 min。经1.5%琼脂糖凝胶电泳检测后,对目的亮带大小符合预期的PCR产物送上海翼和生物技术有限公司进行基因分型。
1.3 微卫星测序
挑选含不同的等位基因个体(分布于多个群体的等位基因则挑选不同品种的个体),经电泳检测后将含有目的亮带的PCR产物送往广州艾基生物技术有限公司进行双向测序。
1.4 数据处理
应用软件Cervus 3.0.3计算期望杂合度(expected heterozygosity,He)、观察杂合度(observed heterozygosity,Ho)、多态信息含量(polymorphic information content,PIC)、等位基因数(NA)和等位基因频率等[15]。应用软件ADZE 1.0计算群体的等位基因丰度(Ar)和私有等位基因丰度(Ap)[16]。应用序列分析软件MEGA 6.0编辑整理等位基因序列[17],并辅以人工校正。利用软件SplitsTree 4.10建立基于侧翼序列变异信息的中介网络图(median-joining network)[18]。根据已有研究结果整理血清型与LEI0258等位基因的对应关系[5,19-20]。
2 结果与分析
2.1 LEI0258基因型多态性
经过基因分型,120个样品中检测到等位基因数38个,片段长度为181~507 bp。等位基因频率最高的是205(0.125),其次是275(0.113)、310(0.100)和251(0.067)(表1)。广西地方鸡大部分品种的观察杂合度较高,除广西三黄鸡和东兰乌鸡外,观察杂合度均大于0.8;多态信息含量均大于0.8(表2)。由此可见,广西地方鸡保持着较高的遗传变异水平。

表1 广西地方鸡群体微卫星位点LEI0258等位基因统计

续表1 广西地方鸡群体微卫星位点LEI0258等位基因统计

表2 广西地方鸡群体微卫星LEI0258遗传变异分析
2.2 LEI0258核苷酸多态性
根据基因分型的结果,选取46个等位基因片段进行双向测序,获得了片段长度从182 bp到501 bp不等的等位基因39个,其中9个等位基因为首次发现(表3)。大部分等位基因经基因分型和基因测序所得的片段长度不同,但也有个别是一致的(193、194、205和206)。LEI0258呈现典型的重复单元结构,分别是长度为13 bp的R13(CTATGTCTTCTTT)和12 bp的R12(CTTTCCTTCTTT),重复次数分别为1~17和2~28不等,不同的等位基因由这2个重复单元在数量上的不同组合构成。在2个重复区域的上游有55个碱基(不含引物序列),共发现有8个变异位点,主要以碱基替换为主,其次是碱基缺失(如在-29~-30出现TT碱基缺失)。而在重复区下游的54个碱基(不含引物序列)中,鉴定出6个变异位点,变异方式以颠换(如A、T碱基的颠换)为主,其次是C/T转换,并且有少数插入缺失的现象。在片段长度小于237 bp的等位基因中,下游11~18位点ATTTTGAG缺失的现象比较普遍,该多态现象虽然与Fulton等[5]报道的ATTTGAGG缺失现象不一致,但与Han等[19]、Chazara等[20]和黄勋和等[9-10,21]的报道结果相同。

2.3 LEI0258侧翼序列中介网络图分析
除去中间的重复区域,获得了39个等位基因侧翼序列,构建了基于侧翼序列变异信息的中介网络图(图1)。根据先前的命名方法[9,20],39个等位基因分为3个进化枝(A、B和D),每个进化枝包含等位基因数7~21个不等。每个进化枝所包括的品种较丰富,其中南丹瑶鸡、龙胜凤鸡和广西三黄鸡更多地集中在A进化枝上。虽然有些等位基因在各个品种中广泛分布(如205、273、307、309),但大部分等位基因仅分布于少数品种中,如193(东兰乌鸡、广西三黄鸡)、283(广西麻鸡、南丹瑶鸡)、379(广西麻鸡、霞烟鸡)等,并且有个别等位基因仅存在于某个单一群体,如206(广西三黄鸡)、237(龙胜凤鸡)、259(南丹瑶鸡)、357(霞烟鸡)等。综合之前的测定数据分析可知,红原鸡有部分等位基因与这3个进化枝相同[5,9,20],11个LEI0258等位基因与21种已知的MHC血清型相对应,在每个进化枝都有分布[22-23]。
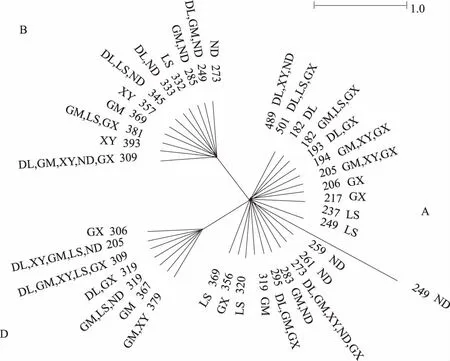
图1 基于微卫星位点LEI0258侧翼区变异信息的中介网络图
3 结论与讨论
群体等位基因丰度、杂合度和多态信息含量可用于评价群体的遗传变异水平[1]。本研究应用微卫星位点LEI0258分析了6个广西地方鸡品种的遗传多样性及分子进化。总体上,广西地方鸡保持着较高的遗传多样性水平,如观测杂合度大部分大于0.8,而多态信息含量均大于0.8,这与之前的相关报道是相符的[9,12-14]。通常地方家鸡品种的遗传多样性较高,如文昌鸡、惠阳胡须鸡、五华三黄鸡等[9],这与品种的群体数量和所受选择压力较小有关[1]。此外,广西地方鸡微卫星位点LEI0258的11个等位基因分别与21种已知血清型相对应[22-23],可为其疾病方面的研究提供理论参考。因此,将微卫星位点LEI0258作为分子标记研究鸡的群体遗传多样性是可行的。
以LEI0258稀有等位基因作为家鸡品种鉴定的依据已得到进一步论证[9,19]。本研究首次发现的9个LEI0258等位基因中,有部分是特定品种所特有的,如249(南丹瑶鸡)、369(广西麻鸡)、332(龙胜凤鸡)和393(霞烟鸡),说明LEI0258可作为品种鉴定的候选分子标记之一。但由于本研究受限于样品数量,后续研究还需加大样品数量,以及结合形态学特征和其他有效技术,如DNA条形码[24]和细胞色素b基因[25]等进一步的探索。
微卫星位点LEI0258由2个重复单元(R13、R12)的不同数量组合组成。此外,侧翼序列的变异也可作为等位基因的定义标准,因而等位基因数量众多。目前,除本研究新发现的9个广西地方鸡特有基因外,在GenBank登录的LEI0258等位基因已有160个。基于侧翼区变异信息构建的中介网络图显示,广西地方鸡分为3个进化枝,而红原鸡中也有部分基因存在于这些进化枝中,因此,广西地方鸡可能起源于红原鸡,与先前的研究相吻合[9]。
致谢:感谢广西大学夏中生教授、杨秀荣教授、研究生侯宇在采集样品时提供的帮助。
[1] Groeneveld L F,Lenstra J A,Eding H,etal.Genetic diversity in farm animals—A review[J].Animal Genetics,2010,41(S1):6-31.
[2] McConnell S K,Dawson D A,Wardle A,etal.The isolation and mapping of 19 tetranucleotide microsatellite markers in the chicken[J].Animal Genetics,1999,30(3):183-189.
[3] Bacon L D,Hunt H D,Cheng H H.Genetic resistance to Marker’s disease[J].Current Top Microbiology Immunogenetics,2001,255:121-141.
[4] Lee L F,Bacon L D,Yoshida S,etal.The efficacy of recombinant fowlpox vaccine protection against Marek’s disease:Its dependence on chicken line and B haplotype[J].Avian Diseases,2004,48(1):129-137.
[5] Fulton J E,Juul-Madsen H R,Ashwell C M,etal.Molecular genotype identification of theGallusgallusmajorhistocompatibility complex[J].Immunogenetics,2006,58:407-421.
[6] Izadi F,Ritland C,Cheng K M.Genetic diversity of the major histocompatibility complex region in commercial and noncommercial chicken flocks using the LEI0258 microsatellite marker[J].Poultry Science,2011,90:2711-2717.
[7] Chang C S,Chen C F,Berthouly-Salazar C,etal.A global analysis of molecular markers and phenotypic traits in local chicken breeds in Taiwan[J].Animal Genetics,2012,43(2):172-182.
[8] Nikbakht G,Esmailnejad A,Barjesteh N,etal.LEI0258 microsatellite variability in Khorasan,Marandi,and Arian chickens[J].Biochemical Genetics,2013,51(5/6):341-349.
[9] 黄勋和,李丽芝,张金枫,等.华南家鸡MHC-B区域复合微卫星位点LEI0258的遗传多样性与进化研究[J].畜牧兽医学报,2016,47(11):2175-2183.
[10] 黄勋和,张金枫,谭坤凤,等.五华三黄鸡MHC-B区域复合微卫星位点LEI0258遗传多样性与进化研究[J].广东农业科学,2016,43(6):163-168.
[11] 国家畜禽遗传资源委员会.中国畜禽遗传资源志·家禽志[M].北京:中国农业出版社,2011.
[12] 窦新红,韦凤英,黄雄,等.广西三黄鸡群体遗传多样性研究[J].中国家禽,2011,33(15):20-23.
[13] 廖玉英,莫国东,黄英飞,等.广西东兰乌鸡的遗传多样性分析[J].农业科学与技术,2016,17(1):136-140.
[14] Liao Y Y,Mo G D,Sun J L,etal.Genetic diversity of Guangxi chicken breeds assessedwith microsatellites and the mitochondrial DNA D-loop region[J].Molecular Biology Reports,2016,43:415-425.
[15] Kalinowski S T,Taper M L,Marshall T C.Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment[J].Molecular Ecology,2007,16(5):1099-1106.
[16] Szpiech Z A,Jakobsson M,Rosenberg N A.ADZE:A rarefaction approach for counting alleles private to combinations of populations[J].Bioinformatics,2008,24(21):2498-2504.
[17] Tamura K,Stecher G,Peterson D,etal.MEGA6: Molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[18] Huson D H,Bryant D.Application of phylogenetic networks in evolutionary studies[J].Molecular Biology and Evolution,2006,23(2):254-267.
[19] Han B,Lian L,Qu L J,etal.Abundant polymorphisms at the microsatellite locus LEI0258 in indigenous chickens[J].Poultry Science,2013,92(12):3113-3119.
[20] Chazara O,Chang C S,Bruneau N,etal.Diversity and evolution of the highly polymorphic tandem repeat LEI0258 in the chicken MHC-B region[J].Immunogenetics,2013,65(6):447-459.
[21] 黄勋和,张金枫,陈洁波,等.贵妃鸡MHC-B区域微卫星位点LEI0258遗传多样性研究[J].中国畜牧兽医,2016,43(12):3300-3305.
[22] Rogers S L,Kaufman J.High allelic polymorphism,moderate sequence diversity and diversifying selection for B-NK but not B-lec,the pair of lectin-like receptor genes in the chicken MHC[J].Immunogenetics,2008,60(8):461-475.
[23] Wang H Z,Ma T,Chang G B,etal.Molecular genotype identification of different chickens:Major histocompatibility complex[J].Journal of Science and Technology,2014,2:1-7.
[24] 黄勋和,陈洁波,何丹林,等.DNA条形码技术鉴定中国地方鸡品种的重新评估[J].中国农业科学,2016,49(13):2622-2633.
[25] Yacoub H A,Fathi M M,Sadek M A.Using cytochrome b gene of mtDNA as a DNA barcoding marker in chicken strains[J].Mitochondrial DNA,2013,26(2):217-223.
Polymorphisms at the Microsatellite Locus LEI0258 in the Indigenous Chickens from Guangxi Province
HUANG Xunhe,DENG Chunmiao,KE Zhenhua,XIE Jieru,CHEN Jiebo,ZHONG Fusheng*
(School of Life Sciences,Jiaying University,Meizhou 514015)
In order to uncover the genetic diversity and molecular evolution of indigenous chicken of Guangxi province,120 blood samples from 6 breeds were used to microsatellite LEI0258 genotyping and sequencing,and the data were used to analyse genetic variation and construct median-joining network.A total of 38 alleles ranging from 181 bp to 507 bp were found by genotyping,with the allele frequency arrangement of 205(0.125),275(0.113),310(0.100) and 251(0.067).The LEI0258 showed high levels of polymorphism in Guangxi indigenous chickens,with 0.800,0.943 and 0.936 for observed heterozygosity,expected heterozygosity and polymorphic information content,respectively.Thirty-nine alleles were identified by DNA sequencing,and nine of which were newly found.Eleven alleles of LEI0258 were corresponding to 21 available serotypes of MHC.The median-joining network,which was based on the SNPs and indels found within the flanking sequences,39 alleles were classified into three clusters,and partial of those were also found in Red junglefowl.Our results pointed out the Red junglefowl origin for Guangxi indigenous chickens.
Guangxi indigenous chicken; microsatellite; LEI0258; polymorphism; molecular evolution
S831.2
A
1004-3268(2017)11-0127-06
2017-06-16
广东省自然科学基金项目(2014A030307018);广东省公益研究与能力建设项目(2015A020208020, 2016A030303068);嘉应学院省市共建重点建设项目(嘉院[2017]27号)
黄勋和(1982-),男,广东河源人,副教授,博士,主要从事中国家鸡遗传多样性与进化研究。
E-mail:hxh826@jyu.edu.cn
*
钟福生(1958-),男,湖南衡阳人,教授,博士,主要从事动物生产与畜牧工程方面研究。
E-mail:zfs@jyu.edu.cn
