细胞外组蛋白在脑缺血再灌注损伤中的作用研究
2017-12-20鲁芳芳高鸿翔
鲁芳芳,沈 楠,高鸿翔,莫 茜,王 伟
·基础研究·
细胞外组蛋白在脑缺血再灌注损伤中的作用研究
鲁芳芳,沈 楠,高鸿翔,莫 茜,王 伟
目的研究细胞外组蛋白在脑组织缺血再灌注(I/R)中的损伤作用,并探索组蛋白的来源。方法采用Longa法建立大鼠I/R模型,脑组织切片后H3荧光染色,观察脑组织中组蛋白含量。采用酶消化法培养孕18 d SD胎鼠脑皮质神经元,小牛胸腺组蛋白不同浓度(μg/ml)(50、100、200、400、800)刺激神经元1 h后检测细胞存活率。分别在2% O2培养箱培养细胞0 h、24 h、48 h,然后H3荧光染色,观察核内组蛋白的释放。结果大鼠脑组织梗死侧H3含量较未梗死侧增多。50 μg/ml组蛋白处理1 h后细胞存活率为45.69%(P<0.01),并呈浓度依赖性下降。低氧培养24 h时组蛋白分布在细胞核以及细胞质中,48 h时组蛋白分布范围进一步扩大,少量位于细胞核外。结论脑I/R损伤中,神经元在缺氧刺激下主动释放组蛋白至细胞外,直接损伤神经元,加重脑损伤。
脑缺血再灌注损伤;细胞外组蛋白;神经元
近年来,随着我国医疗技术的进步,每年心脏病手术病例逐年增多,其中80%需要进行心肺转流[1](cardiopulmonary bypass,CPB)。由于外科手术的进步、重症监护设备的完善,患者的术后生存率不断提高,CPB相关的中枢神经系统损伤逐渐成为影响患者术后生存质量的最重要并发症[2],这不仅严重影响了患者的术后生存质量[3],也给社会带来沉重的负担,在低龄的先天性心脏病患儿中表现尤为突出[4]。然而,针对神经系统损伤目前却没有更好的办法治疗。目前研究发现,小儿中枢神经系统损伤主要原因是CPB过程引起大脑亚缺血缺氧状态,其机理和脑缺血再灌注(ischemic/reperfusion,I/R)损伤非常相似[5-6],再灌注过程对神经系统造成二次损伤打击。
组蛋白(histone)是一种核内蛋白,主要功能是在核内与DNA结合,形成核小体,参与染色质形成。组蛋白可由激活的中性粒细胞、受损伤后的肝细胞、死亡细胞被动或主动地分泌到细胞外,统称为细胞外组蛋白[7-8],参与不同的病理过程[9]。在脑I/R损伤研究中发现,循环以及脑组织中均检测到高浓度胞外组蛋白[10],而拮抗组蛋白后脑梗死面积显著下降[11]。这表明,组蛋白参与了脑I/R损伤二次打击神经系统过程。然而目前尚不了解脑组织内胞外组蛋白的来源,因此,本文旨在研究细胞外组蛋白在脑I/R损伤中的作用以及释放途径。
1 材料与方法
1.1实验动物 健康雄性Sprague Dawley(SD)大鼠用于建立大鼠短暂大脑中动脉栓塞(transient middle cerebral artery occlusion, tMCAO)模型;健康雄性和雌性SD大鼠一对,> 200 g,用于配种获得孕18 d胎鼠培养原代皮质神经元。整个动物实验过程中对动物的处置符合动物伦理学标准。
1.2tMCAO模型的建立 采用改良的Longa[12]线栓法制备tMCAO模型,简要叙述如下:腹腔注射水合氯醛麻醉大鼠,做颈部正中切口,游离右侧颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端、颈外动脉,在颈总动脉上做一切口,将包被聚乙烯的尼龙栓线插入颈总动脉,并沿颈总动脉、颈内动脉到达大脑中动脉并形成栓塞,1 h后拔除栓线,形成再灌注,结扎颈内动脉避免失血,再灌注23 h后,心脏灌注,取出脑组织。
1.3心脏灌注后取脑组织 水合氯醛麻醉大鼠,从上腹部正中剪开大鼠皮肤,剪开膈肌,暴露心脏,找到并剪开右心耳,待流出血液时,立即用注射器插入心尖缓慢注射生理盐水,待观察到右心房流出清亮液体后,换用4%多聚甲醛,继续灌注。待灌注完全后,剥出脑组织,用30%蔗糖溶液脱水3 d。3 d后吸干脑组织表面水后包埋。
1.4脑切片免疫荧光染色 脑组织进行冠状面连续冰冻切片,切片为40 μm厚度,然后进行荧光染色。抗原修复液1.5 ml,95℃水浴,热修复5 min;加入含1∶300比例稀释的H3抗体,室温下孵育1 h,然后置于4℃冰箱过夜。第二天取出,加入二抗,室温下避光孵育2 h后,DAPI(4',6-diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚)染色。描片后用80%的甘油封片,观察并记录结果。
1.5原代神经元培养[13-14]及纯度鉴定 取孕18 d SD胎鼠,消毒后取脑组织,用PBS(磷酸盐缓冲液)清洗三次,剪碎成1 mm3碎块,0.5%胰酶37℃下消化10 min,含血清培养基终止消化后吹打成细胞悬液,过200目筛网后离心,接种液重悬,以5×105浓度接种至事先包被PDL(多聚赖氨酸)的12孔板中。培养第8 天时,使用神经元特异性抗体MAP-2(微管蛋白-2)进行免疫荧光染色,鉴定神经元纯度。
1.6细胞外组蛋白对神经元毒性作用 分别用浓度为50 μg/ml,100 μg/ml,200 μg/ml,400 μg/ml,800 μg/ml小牛胸腺组蛋白(calf thymus histone,CTH)加入培养基中,37℃孵育1 h后,吸弃上清,加入20%MTS[水溶性甲臢化合物,3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑,内盐]溶液,37℃孵育4 h,酶标仪OD=490测光度值。
1.7低氧培养神经元后H3免疫荧光染色 使用低氧培养箱(2% O2,5% CO2,93% N2)培养神经元,试验设置3个时间点:0 h,24 h,48 h。取出细胞,弃去培养基;4%多聚甲醛固定60 min;0.5%Txiton X-100 处理20 min;3% H2O2处理15 min;5% BSA的血清封闭液,37°C,30 min;加入一抗(Anti-Histone H3antibody,ab1791)(1∶200稀释),4°C过夜;二抗(Alex flour 488-山羊抗兔,1∶500)孵育60 min;PBS漂洗;拍照记录。

2 结 果
2.1I/R损伤中组蛋白变化 在损伤模型组,脑组织内梗死侧的H3较未梗死侧明显增多,如图1所示。数据表明,在脑I/R损伤中,组蛋白释放至细胞外,分散在细胞周围,直接接触神经元。

注:图中左侧为未梗死侧脑组织,右侧为梗死损伤侧脑 组织,左右两侧取材为大脑相同区域。蓝色荧光为 DAPI,染色细胞核;黄色荧光为H3。图1 H3荧光染色结果
2.2神经元鉴定及组蛋白处理后细胞存活率 如图2所示,A图为培养至第3天的神经元,细胞树突短小,量较多,形成疏散的网状结构,细胞多样性,纺锤形、三角形及圆形多见;B图为培养至第七天的神经元。胞体进一步增大,树突增多且延长,呈密集的网状结构,形成复杂紧密的神经元网络;C图为核染DAPI镜下,为原代神经元细胞核,核圆,大小均匀;D图为MAP-2荧光染色鉴定图,神经元核呈椭圆形,树突交织成网状,手动计数神经元细胞阳性率为96%。细胞在培养第七天时生长状态良好,随后使用CTH处理1 h,使用MTS检测细胞存活率,检测组蛋白对皮质神经元的直接细胞毒性。结果如图3所示:当CTH浓度50 μg/ml时细胞生存率为45.69%,与对照组比较P<0.01;CTH为100 μg/ml时为27.79%,P<0.001。细胞生存率下降与组蛋白浓度呈剂量依赖关系。

注:A:培养至第三天的神经元;B:培养至第七天的神 经元;C:核染DAPI;D:MAP-2荧光染色。图2 神经细胞生长及MAP-2鉴定图
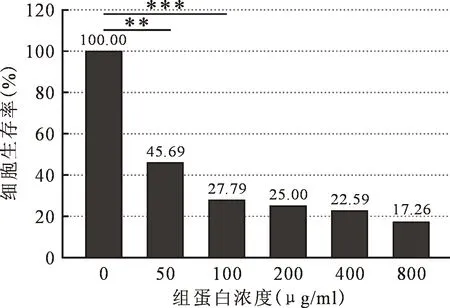
注:**P<0.01,***P<0.001。图3 不同浓度组蛋白处理后神经细胞存活率
2.3低氧下组蛋白分布 先前的实验表明,脑I/R损伤再灌注模型中组蛋白直接被释放,以至循环以及脑组织中组蛋白升高,再次损伤神经元,对细胞造成二次打击损伤。如图4所示,蓝色荧光为DAPI染色,表示细胞核,绿色荧光为H3染色。0 h时组蛋白完全位于细胞核内。24 h时组蛋白部分分布在核外,胞质中有大量H3分布;48 h组蛋白分布范围进一步扩大,组蛋白呈颗粒状分布在轴突附近。在低氧(2% O2)的培养箱处理24 h后,可观察到组蛋白(绿色荧光)释放至核外,在48 h时组蛋白分布范围进一步扩大,甚至在轴突也有组蛋白分布。
3 讨 论
脑I/R损伤是在包含脑卒中等一系列病理生理中造成脑损伤的重要机制。目前对缺血造成的脑损伤的治疗方向主要在试图令病变血管再通,然而这同时又不可避免地引发再灌注的损伤,而目前针对再灌注损伤本身并没有十分有效的控制手段,因此对脑缺血治疗的手段十分有限。
组蛋白是一种核内蛋白,参与染色质的组成。2009年首次发现组蛋白的病理作用[15]后,陆续发现组蛋白可能通过损伤内皮细胞,激活凝血系统,引起一系列细胞炎性因子释放,激活细胞表面Toll样受体[16-19]等,引起体内免疫功能紊乱、血小板聚集、血栓形成等,损伤机体各器官。目前已经发现的与组蛋白相关的损伤包括急性肺损伤、肝脏无菌性炎症、急性肾损伤[20-23]等,表明组蛋白可能是一种参与各种炎症损伤过程的致病因子。
本研究中,笔者对大鼠建立I/R模型,通过免疫荧光染色的方法观察到I/R损伤时脑组织内组蛋白含量增高,梗死侧脑组织组蛋白H3较未梗死侧明显增多,提示在I/R损伤中,组蛋白被释放出细胞核,这些组蛋白分布在脑组织内。为进一步探索组蛋白的来源,笔者进行细胞层面研究。首先培养原代皮质神经元,组蛋白刺激后,验证了组蛋白对神经细胞的直接毒性,如图3所示。本研究还观察到,在低氧箱中孵育一段时间的神经元其组蛋白已不局限于细胞核内,胞质内有H3分布,以及呈颗粒状分布于细胞轴突附近,细胞核形状发生变化。这表明,在低氧环境中,神经元可将核内组蛋白释放至核外。由此,笔者认为脑I/R中,梗死侧组蛋白含量增高,接触周围神经元,使细胞死亡,进一步损伤神经系统,其来源是神经元主动释放至细胞核外。
综上所述,本研究初步探索了脑I/R损伤时,组蛋白可能是加剧神经元死亡的主要物质,而这一机理可能是脑I/R过程中神经元受到持续的缺血缺氧导致细胞释放核内组蛋白至胞外,通过直接接触周围神经元,发挥细胞毒性作用,进一步损伤神经元。

注:蓝色荧光为DAPI核染,绿色荧光为H3 染色,MERGE为蓝色与绿色合成图。图4 组蛋白分布变化图
[1]Jepson BM, Mackay-Bojack S, Moller JH. The first cardiac operation using cardiopulmonary bypass[J]. Ann Thorac Surg, 2017, 103(4): e339-e340.
[2]韩思扬, 蔡国华, 刁力为,等. 老年患者心脏手术后认知功能障碍影响因素的临床研究[J]. 心肺血管病杂志, 2016, 35(12): 943-945.
[3]Wernovsky G, Shillingford AJ, Gaynor JW. Central nervous system outcomes in children with complex congenital heart disease[J]. Curr Opin Cardiol, 2005, 20(2): 94-99.
[4]McQuillen PS, Barkovich AJ, Hamrick SE,etal. Temporal and anatomic risk profile of brain injury with neonatal repair of congenital heart defects[J]. Stroke, 2007, 38(2 Suppl): 736-741.
[5]Sanganalmath SK, Gopal P, Parker JR,etal. Global cerebral ischemia due to circulatory arrest: insights into cellular pathophysiology and diagnostic modalities[J]. Mol Cell Biochem, 2017, 426(1-2): 111-127.
[6]Xu Z, Xu RX, Liu BS,etal. Time window characteristics of cultured rat hippocampal neurons subjected to ischemia and reperfusion[J]. Chin J Traumatol, 2005, 8(3): 179-182.
[7]Jahr S, Hentze H, Englisch S,etal. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells[J]. Cancer Res, 2001, 61(4): 1659-1665.
[8]von Kockritz-Blickwede M, Goldmann O, Thulin P,etal. Phagocytosis-independent antimicrobial activity of mast cells by means of extracellular trap formation[J]. Blood, 2008, 111(6): 3070-3080.
[9]Perez-Cremades D, Bueno-Beti C, Garcia-Gimenez JL,etal. Extracellular histones disarrange vasoactive mediators release through a COX-NOS interaction in human endothelial cells[J]. J Cell Mol Med, 2017, 21(8):1584-1592.
[10]张迺璞, 于新迪, 莫茜,等. 细胞外组蛋白与脑缺血再灌注损伤关系的初探[J]. 中国体外循环杂志, 2015,(03): 178-180.
[11]De Meyer SF, Suidan GL, Fuchs TA,etal. Extracellular chromatin is an important mediator of ischemic stroke in mice[J]. Arterioscler Thromb Vasc Biol, 2012, 32(8): 1884-1891.
[12]Longa EZ, Weinstein PR, Carlson S,etal. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[13]Meberg PJ, Miller MW. Culturing hippocampal and cortical neurons[J]. Methods Cell Biol, 2003, 71: 111-127.
[14]Xu SY, Wu YM, Ji Z,etal. A modified technique for culturing primary fetal rat cortical neurons[J]. J Biomed Biotechnol, 2012, 2012: 803930.
[15]Xu J, Zhang X, Pelayo R,etal. Extracellular histones are major mediators of death in sepsis[J]. Nat Med, 2009, 15(11): 1318-1321.
[16]Yang X, Li L, Liu J,etal. Extracellular histones induce tissue factor expression in vascular endothelial cells via TLR and activation of NF-kappaB and AP-1[J]. Thromb Res, 2016, 137: 211-218.
[17]Yu Y, Koehn CD, Yue Y,etal. Celastrol inhibits inflammatory stimuli-induced neutrophil extracellular trap formation[J]. Curr Mol Med, 2015, 15(4): 401-410.
[18]Allam R, Kumar SV, Darisipudi MN,etal. Extracellular histones in tissue injury and inflammation[J]. J Mol Med(Berl), 2014, 92(5): 465-472.
[19]Lam FW, Cruz MA, Leung HC,etal. Histone induced platelet aggregation is inhibited by normal albumin[J]. Thromb Res, 2013, 132(1): 69-76.
[20]Huang H, Tohme S, Al-Khafaji AB,etal. Damage-associated molecular pattern-activated neutrophil extracellular trap exacerbates sterile inflammatory liver injury[J]. Hepatology, 2015, 62(2): 600-614.
[21]Allam R, Scherbaum CR, Darisipudi MN,etal. Histones from dying renal cells aggravate kidney injury via TLR2 and TLR4[J]. J Am Soc Nephrol, 2012, 23(8): 1375-1388.
[22]Semeraro F, Ammollo CT, Morrissey JH,etal. Extracellular histones promote thrombin generation through platelet-dependent mechanisms: involvement of platelet TLR2 and TLR4[J]. Blood, 2011, 118(7): 1952-1961.
[23]Liu S, Su X, Pan P,etal. Neutrophil extracellular traps are indirectly triggered by lipopolysaccharide and contribute to acute lung injury[J]. Sci Rep, 2016, 6: 37252.
Theresearchoftheroleofextracellularhistoneincerebralischemia-reperfusioninjury
Lu Fang-fang, Shen Nan, Gao Hong-xiang, Mo Xi, Wang Wei
ThoracicandCardiovascularSurgeryDepartment,ShanghaiChildren'sMedicalCenter,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai, 200127
WangWei,Email:wangwei@scmc.com.cn
ObjectiveTo study the effects of extracellular histone on cerebral ischemic reperfusion (I/R) injury and the source of histone.MethodsRat I/R model was established according to Longa method, and H3fluorescent staining was operated with sliced brain tissue to observe the level of histone in brain tissue. SD fetal rats cortex neurons of 18 days were cultured with the method of enzyme digestion, and different concentrations of calf thymus histone (μg/ml)(50, 100, 200, 400, 800) were added to neurons. Cell survival was tested after 1 hour. Neurons were cultured in 2% O2incubator for 0 hour, 24 hours, 48 hours, then the H3fluorescent staining was operated to observe the release of nucleus histone.ResultsThe level of H3in infarction side was higher than that in the non-infarction side. The cell survival rate was 45.69% when histone was 50 μg/ml(P<0.01). Histone was distributed in the nucleus and cytoplasm when neurons were cultured 24 hours in the hypoxia incubator, and it was outside the cells at 48 hours.ConclusionHistone actively released outside the nucleus by neurons in cerebral I/R injury damaged neurons directly and aggravated the brain damage.
Brain ischemia/reperfusion; Extracellular histone; Neurons
10.13498/j.cnki.chin.j.ecc.2017.04.12
200127 上海,上海交通大学附属上海儿童医学中心心胸外科(鲁芳芳、高鸿翔、王 伟),中心转化所(沈 楠、莫 茜)
王 伟,Email: wangwei@scmc.com.cn
2017-05-25)
2017-08-18)
