2016年国家药品不良反应监测年度报告发布儿童用药不良反应报告数量下降
2017-12-19庞村
文 / 本刊记者 庞村
药品不良反应监测工作是药品上市后安全监管的重要支撑,目的是为了及时发现、及时控制药品安全风险。《药品不良反应报告和监测管理办法》中规定国家实行药品不良反应报告制度,国家鼓励公民、法人和其他组织报告药品不良反应。
4月28日,国家食品药品监督管理总局发布2016年《国家药品不良反应监测年度报告》(下称《报告》)。《报告》指出,2016年,国家药品不良反应监测工作持续有效开展,不良反应报告数量进一步增长,分析评价能力逐渐提升,预警处置能力不断加强,在保障人民群众用药安全和推进药品安全监管等方面发挥了重要作用。
年增2.3%:监测能力进一步增强
《报告》显示,2016年,国家药品不良反应监测网络共收到药品不良反应/事件143万份,较2015年增长了2.3%。其中,新的和严重的药品不良反应/事件报告42.3万份,占同期报告总量的29.6%,与2015年相比增加了1.4个百分点。(见图1)
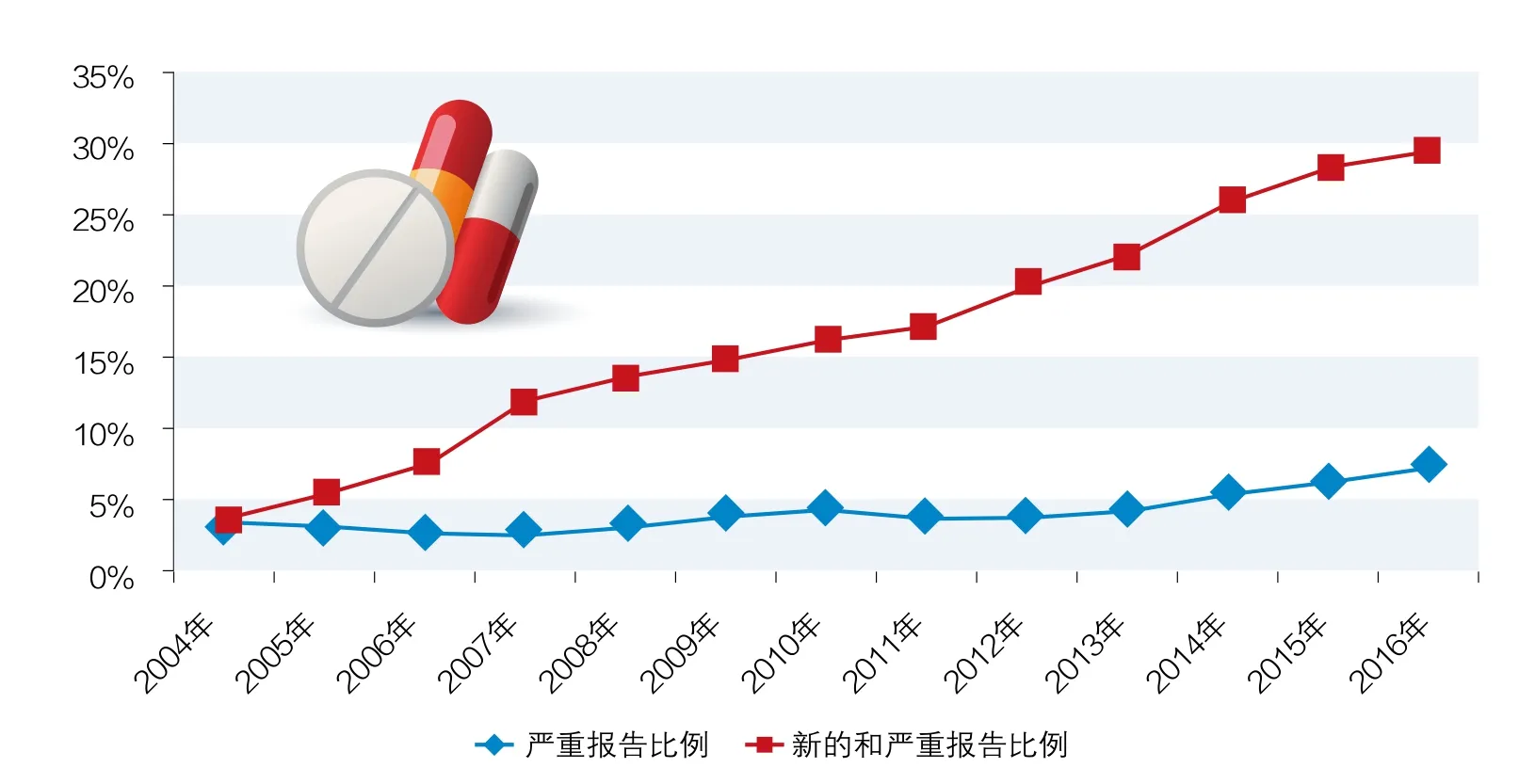
图1 2004-2016年新的和严重以及严重药品不良反应/事件报告比例
对此,国家食品药品监督管理总局药品化妆品监管司司长丁建华表示,药品不良反应报告数量多了,标志着国家药品不良反应监测网络建设进一步深入,发现和收集药品不良反应信息的能力进一步增强。
据悉,目前,全国已有 31 万余个医疗机构、药品生产经营企业注册为药品不良反应监测网络用户,并通过该网络报送药品不良反应报告。
对于不良反应数量增多是否表明药品安全水平下降的困惑,丁建华给予了否认。他说,这意味着我们掌握的信息越来越全面,对药品的风险更了解,风险更可控,对药品的评价更加有依据,监管决策更加准确。同样,在医疗实践中,能及时地了解药品不良反应发生的表现、程度,并最大限度地加以避免,也是保证医疗安全的重要措施。

图2 2016年药品不良反应/事件报告年龄分布

图3 2016年药品不良反应/事件报告给药途径分布
据了解,药品不良反应/事件每百万人口平均病例报告数量和县级报告比例分别是衡量一个国家药品不良反应监测工作水平和均衡发展及覆盖程度的重要指标之一,而《报告》统计显示,2016 年我国每百万人口平均病例报告数为 1068份,比2015年增加了 2.4%;县级报告比例为 97.7%,比2015年增长了1.1 个百分点。
在患者占比方面,男性和女性患者比例接近 0.89∶1;14 岁以下儿童患者的报告占 9.9%,与 2015年持平;65 岁以上老年患者的报告占23.5%,较 2015 年升高了 2.0 个百分点(见图2)。
《报告》指出,在涉及药品情况方面,按怀疑药品类别统计,化学药占 81.5%、中药占 16.9%、生物制品(不含疫苗)占 1.6%,与 2015年基本一致;按照药品给药途径统计,静脉注射给药占 59.7%、其他注射给药(如肌内注射、皮下注射等)占 3.4%、口服给药占 33.7%、其他给药途径(如外用、贴剂等)占 3.2%(见图3)。在累及器官系统情况方面,排名前三位的为皮肤及其附件损害(占 27.6%)、胃肠系统损害(占 25.4%)和全身性损害(占10.9%)。化学药、中成药累及系统前三位排序与总体情况一致,生物制品累及系统前三位的分别是皮肤及其附件损害、全身性损害及免疫功能紊乱。
丁建华表示,从2016 年药品不良反应/事件报告来源看,医疗机构占比 85.6%,与 2015 年相比来自医疗机构的报告增加了 3.4 个百分点。其中医生报告占比 55.5%,与2015 年相比增加了 1.5 个百分点,表明医疗机构仍发挥药品不良反应报告的主渠道作用。
同时他也强调,来自药品经营企业的报告占 12.8%,来自药品生产企业的报告占 1.4%,与去年持平,报告数量仍偏低。
“这表明药品生产企业开展不良反应监测工作的努力程度不够。”丁建华指出,药品生产企业应进一步加强对药品不良反应工作的认识,加强上市药品的安全性研究,建立风险管理制度,强化企业责任意识,及时预防和控制风险,充分发挥“药品安全第一责任人”的责任。
一降一升:儿童用药和抗感染药受关注
《报告》对儿童用药和抗感染药物的安全性给予了重点关注。
《报告》指出,2016年,来自医疗机构的药品不良反应报告中,14岁(含)以下儿童报告数量占报告总量的10.6%,较2015年下降0.2个百分点。其中严重报告占儿童报告总量的5.5%,儿童患者严重报告比例低于整体人群用药。
国家食品药品监督管理总局药品评价中心主任杨威告诉记者,儿童用药涉及的怀疑药品以化学药为主,占比为84.0%;涉及的药品剂型仍以注射剂为主,一般报告和严重报告的占比分别为84.9%和91.0%。与2015年相比,分别降低了1.2百分点和0.8个百分点,表明注射剂在儿童中合理使用进一步加强。
杨威表示,注射剂在儿童中使用相对较多,与儿童口服用药依从性差有关。儿童作为一个相对特殊群体,机体脏器和组织结构的生理功能发育尚未完全,免疫力低下,药物代谢酶分泌不足或缺少,血浆蛋白结合能力差, 对水、电解质的代谢功能较差, 故对药物的吸收、分布、代谢和排泄等与成人不同,对药物的敏感性和耐受性也与成人相差较远。因此,儿童使用注射给药风险也较大。近年来,国家总局不断加强儿童用药不良反应监测,对风险信号开展分析评价,及时采取风险控制措施。“总局提示临床用药应了解儿童发育时期的生理、病理特点及体质特征,在医生指导下合理用药,能口服、外用给药就不选用注射给药”。
而在抗感染性药物方面,国家药品不良反应监测网络2016年共收到不良反应/事件报告51.8万例,其中严重报告3.3万例。与2015年相比,2016年抗感染药物报告数量同期增长1.1%,严重报告同期增长18.6%。
“虽然抗感染药物报告增长水平(1.1%)低于总体报告的增长水平(2.3%),但报告数量仍然居首位,其安全性一直受到关注。”杨威表示,2016年抗感染药物的药品不良反应/事件严重报告数量排名前3位的是头孢菌素类、喹诺酮类、抗结核病药。“抗感染药物中喹诺酮类药品严重报告比例仅次于头孢类药物,其中氟喹诺酮类药品严重不良反应较多”。
决策参考:及时识别和控制风险
根据 2016 年药品不良反应监测数据和评估结果,国家总局对发现存在安全隐患的药品及时采取相应风险控制措施,以保障公众用药安全。
统计显示,2016年,国家总局对睾酮药品、注射用单磷酸阿糖腺苷、复方大青叶片、复方氨基酸注射液(18AA)及同类制剂、仙灵骨葆口服制剂等42个(类)品种进行了安全性评价;全年共提出修改说明书建议35个;发布药品不良反应信息通报4期,提示关注注射用单磷酸阿糖腺苷、仙灵骨葆口服制剂、睾酮药品、新复方大青叶片的用药安全;发布药物警戒快讯12期,涉及68个品种;并对氯美扎酮和苯乙双胍两个品种发布撤市公告。
同时,国家总局对不良事件的监测处置能力继续增强,预警工作效能得到提升。规范药品不良事件聚集性信号处置,加强预警平台建设,提高预警工作效能,对重点关注的150多条药品不良事件聚集性信号及时进行处置,经评价确认对黄体酮注射液等6起聚集事件采取风险控制措施,进一步保障公众用药安全。
据介绍,2016 年,国家总局还加强对企业药品不良反应监测工作的培训,推进药品生产企业提升责任意识、提高药品安全评价能力。
丁建华表示,国家总局每月向药品生产企业反馈不良反应监测数据,指导企业开展数据分析评价,及时采取措施控制风险,落实企业安全风险主体责任。“确保药品安全保障水平进一步增强”。
