生脉注射液治疗脓毒症相关肝损伤的临床疗效观察
2017-12-18刘曼曼徐红丰朱颖倩
王 欢,刘曼曼,徐红丰,秦 兵,李 执,朱颖倩
(南京中医药大学太仓附属医院太仓市中医医院重症医学科,江苏 苏州 215400)
生脉注射液治疗脓毒症相关肝损伤的临床疗效观察
王 欢,刘曼曼,徐红丰,秦 兵,李 执,朱颖倩
(南京中医药大学太仓附属医院太仓市中医医院重症医学科,江苏 苏州 215400)
目的 探讨生脉注射液对脓毒症肝损伤患者血流动力学指标、肝功能、白蛋白、胆红素、凝血功能的影响。方法 将51例脓毒症肝损伤患者随机分为2组,A组常规西药标准治疗组,B组在常规西医治疗基础上加用生脉注射液60 ml/d,连用7天,在治疗前先对两组年龄、APACHE Ⅱ评分进行比较,再分别比较两组治疗前及治疗后1天、3天、5天、7天血流动力学指标、肝功能(谷丙、谷草)、白蛋白,胆红素(TBIL、DBIL)、凝血功能(PT、APTT、TT)。结果 两组在治疗前年龄、APACHE Ⅱ评分比较均无明显差异(P>0.05),两组治疗后比较,A组、B组治疗后血流动力学指标、肝功能、白蛋白、胆红素、凝血功能均较治疗前有明显改善(P<0.05)。结论 生脉注射液治疗组可以更有效改善脓毒症肝损伤患者的血流动力学指标、肝功能与肝脏排泄功能。
生脉注射液;脓毒症;脓毒症肝损伤
脓毒症是指由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),临床上证实有细菌存在或有高度可疑感染灶[1]。近十年来抗感染治疗和器官功能支持技术均取得了长足的进步,但脓毒症的病死率仍高达40%~70%[2]。脓毒症患者易并发肝功能损伤,且脓毒症患者一旦发生肝损伤,病死率明显增加。现对我院ICU病房2012年1月~2016年12月收治的51例脓毒症本研究观察生脉注射液对脓毒症患者血流动力学指标、肝功能、白蛋白、胆红素、凝血功能的影响,评价生脉注射液在脓毒症相关肝损伤中的治疗价值,为中医药在危重症疾病治疗提供新途径。
1 临床资料
1.1 一般资料
将纳入的51例患者按照简单随机化随机分组方法分A组(标准治疗)和B组(生脉注射液联合标准治疗)。A组27例,其中男13例,女14例,平均年龄72.34岁;原发病因:肺部感染12例,脑梗塞1例,脑出血1例,急性化脓性胆管炎4例,结肠癌1例,胃癌1例,急性闭合性颅脑损伤2例,多发伤2例,股骨粗隆间骨折2例,急性重症胰腺炎1例。B组24例,其中男13例,女11例,平均年龄69.21岁;原发病因:肺部感染10例,脑梗塞5例,急性重症胰腺炎2例,股骨颈骨折2例,结肠癌1例,肠穿孔1例,肠道感染2例,食管癌放疗后1例。
1.2 诊断标准
1.2.1 脓毒症诊断
按照1992年和2001年美国胸科医师协会及危重病学会制定的脓毒症诊断标准,感染加上两项或两项以上全身炎症反应综合症(Systemic In fl ammatory Response Syndrome,SIRS)表现,即感染加上以下任意两条或两条以上:①体温>38℃或<36℃;②心率>90次/分钟;③过度通气,表现为呼吸>20次/分钟或PaCO2<32 mmHg;④外周血白细胞>12000/ul或<4000/ul,或未成熟细胞>10%。
1.2.2 重症脓毒症诊断标准
脓毒症合并一个或一个以上重要器官功能障碍。
器官功能障碍诊断标准:单个系统的序贯性脏器衰竭评分(Sequential Organ Failure Assessment,SOFA评分)2分。
1.3 纳入标准
入选的病例满足以下条件:①2012年1月~2016年12月间,太仓市中医医院ICU所连续收治并被确诊为脓毒症;②年龄>18岁;③存活时间>24 h;④谷丙转氨酶(ALT)或谷草转氨酶(AST)异常或短期内黄疸进行性加深,总胆红素(TBIL)及直接胆红素(DBIL)异常或凝血功能障碍。
1.4 排除标准
①患有原发性肝病并有长期症状者;②合并急性心肌梗死者;③合并急性脑梗塞或脑出血者;④住院期间放弃积极治疗者;⑤有慢性肾衰需长期接受透析治疗者。
2 治疗与观察方法
2.1 治疗方法
2.1.1 A组标准治疗组
①感染控制:广谱抗生素、降阶梯治疗。
②液体疗法:晶体液、必要时白蛋白,不用赫斯。
③血液制品:HCT<30%时。
④ARDS时的机械通气:小潮气量6 ml/Kg,考虑平台压的高PEEP。
⑤镇痛镇静:丙泊酚、咪达唑仑、芬太尼透皮贴。
⑥血糖控制:<8.3 mmol/l。
⑦肾替代治疗:急性肾损害时。
⑧应激性溃疡的预防:H2受体拮抗剂,不用质子泵抑制剂。
⑨营养治疗:首选肠内营养。
⑩保肝降酶退黄治疗:甘草酸二铵注射液、还原型谷胱甘肽。
2.1.2 B组
在标准治疗的基础上给予生脉注射液每次60 ml,以5%葡萄糖250 ml或者0.9%氯化钠250 ml稀释后静脉点滴,每日1次,连用7天。
2.2 观察方法
观察2组病例治疗前后的血流动力学指标呼吸频率(R)、心率(HR)、平均动脉压(MAP);肝功能(谷丙、谷草)、白蛋白,胆红素(TBIL、DBIL)、凝血功能(PT、APTT、TT);并在治疗前对两组性别、年龄、急性生理和慢性健康评分Ⅱ(APACHE Ⅱ)进行比较。
2.3 统计学方法
采用SPSS 15.0软件,计量资料,均数±标准差表示,数据符合方差齐性检验,组内及组间治疗前后不同时间点比较采用重复测量,不符合方差齐性,采用秩和检验进行对比;计数资料,通过卡方检验或Fisher确切概率法对比。所有的检验都是双侧检验,且P<0.05被认为有统计学意义。
3 结 果
3.1 治疗前A组、B组比较
两组患者年龄及治疗前APACHE Ⅱ评分比较差异无统计学意义(P>0.05),见表1。
表1 年龄、治疗前APACHE Ⅱ评分比较(±s)

表1 年龄、治疗前APACHE Ⅱ评分比较(±s)
注:两组年龄、APACHE Ⅱ评分比较均P>0.05
组别 n 年龄(岁) APACHEⅡ评分A组 27 72.34±9.81 20.34±10.13 B组 24 69.21±8.62 20.06±8.29
3.2 治疗前后两组血流动力学指标比较
1)治疗后,A组与治疗前组内比较,平均动脉压升高,心率下降,呼吸频率下降,各项指标比较差异均有统计学意义(P<0.05),见表2;2)治疗后,B组与治疗前组内比较,平均动脉压升高,心率下降,呼吸频率下降,各项指标比较差异均有统计学意义(P<0.05),且在降低心率、升高平均动脉压方面有极显著差异(P<0.01),第3天与治疗前相比心率下降即有统计学差异,见表2;3)治疗后,A组和B组组间相比,在心率、平均动脉压方面比较,差异有统计学意义(P<0.05),B组在降低心率、升高平均动脉压作用优于A组,见表2。
表2 两组治疗前后呼吸频率(R)、心率(HR)、平均动脉压(MAP)比较(±s)
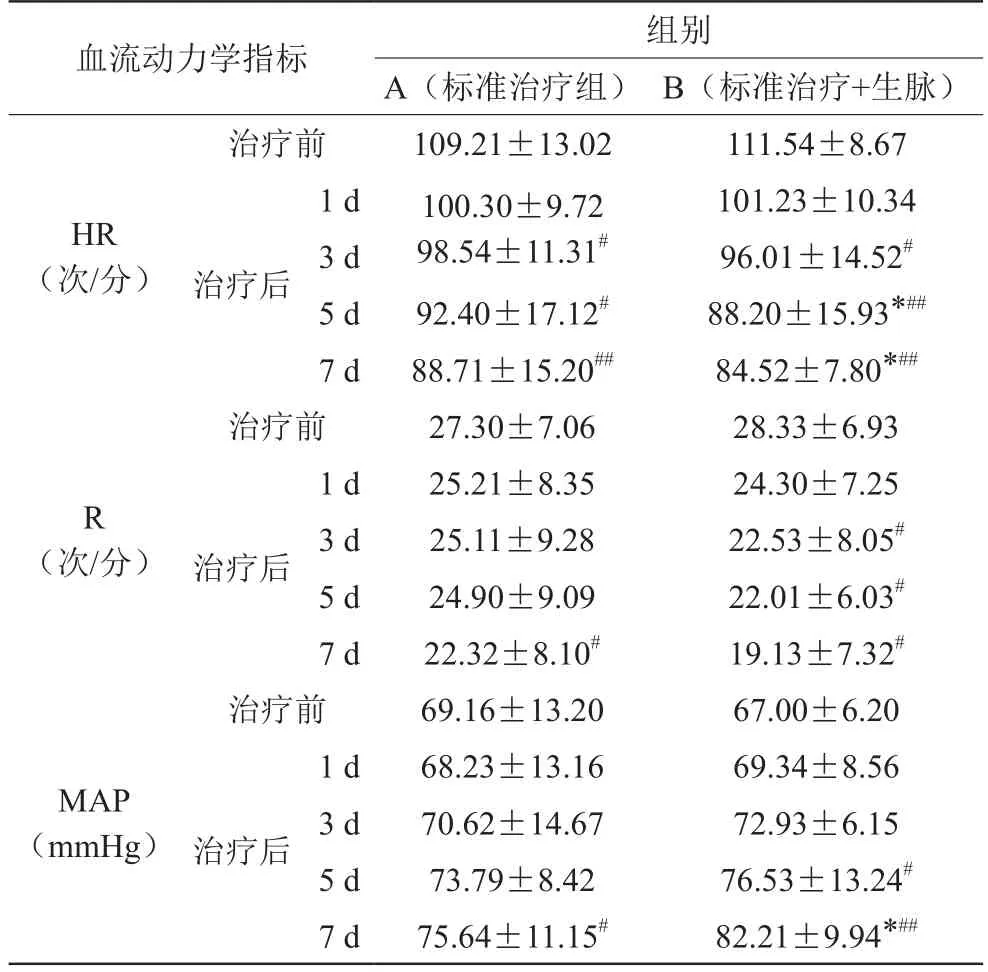
表2 两组治疗前后呼吸频率(R)、心率(HR)、平均动脉压(MAP)比较(±s)
注:与A组比较,*P<0.05;与治疗前比较,#P<0.05,##P<0.01
血流动力学指标 组别A(标准治疗组) B(标准治疗+生脉)治疗前 109.21±13.02 111.54±8.67 HR(次/分)1 d 100.30±9.72 98.54±11.31#治疗后101.23±10.34 3 d 96.01±14.52#5 d 92.40±17.12# 88.20±15.93*##7 d 88.71±15.20## 84.52±7.80*##治疗前 27.30±7.06 28.33±6.93 R(次/分) 治疗后1 d 25.21±8.35 24.30±7.25 3 d 25.11±9.28 22.53±8.05#5 d 24.90±9.09 22.01±6.03#7 d 22.32±8.10# 19.13±7.32#治疗前 69.16±13.20 67.00±6.20 1 d 68.23±13.16 69.34±8.56 3 d 70.62±14.67 72.93±6.15 5 d 73.79±8.42 76.53±13.24#7 d 75.64±11.15# 82.21±9.94*##MAP(mmHg) 治疗后
3.3 治疗前后两组肝功能(谷丙ALT、谷草AST)、白蛋白,肝脏排泄功能:胆红素(总胆红素TBIL、直接胆红素DBIL)、凝血功能(血浆凝血酶原时间PT、活化部分凝血活酶时间APTT、血浆凝血酶时间TT)比较
1)治疗后,A组与治疗前组内比较,ALT、AST、白蛋白、TBIL、DBIL、凝血功能,各项指标比较差异均有统计学意义(P<0.05),见表3;2)治疗后,B 组与治疗前组内比较,ALT、AST、白蛋白、TBIL、DBIL、凝血功能,各项指标比较差异均有统计学意义(P<0.05),其中在改善ALT、AST治疗3天有极显著差异(P<0.01),在降低TBIL、DBIL治疗5天差异均有统计学意义(P<0.05),见表3;3)治疗后,A组和B组组间相比,在ALT、AST、DBIL方面比较,差异有统计学意义(P <0.05),B组在改善肝功能及肝脏排泄功能方面作用优于A组,见表3。
表3 两组治疗前后肝功能相关指标比较s)
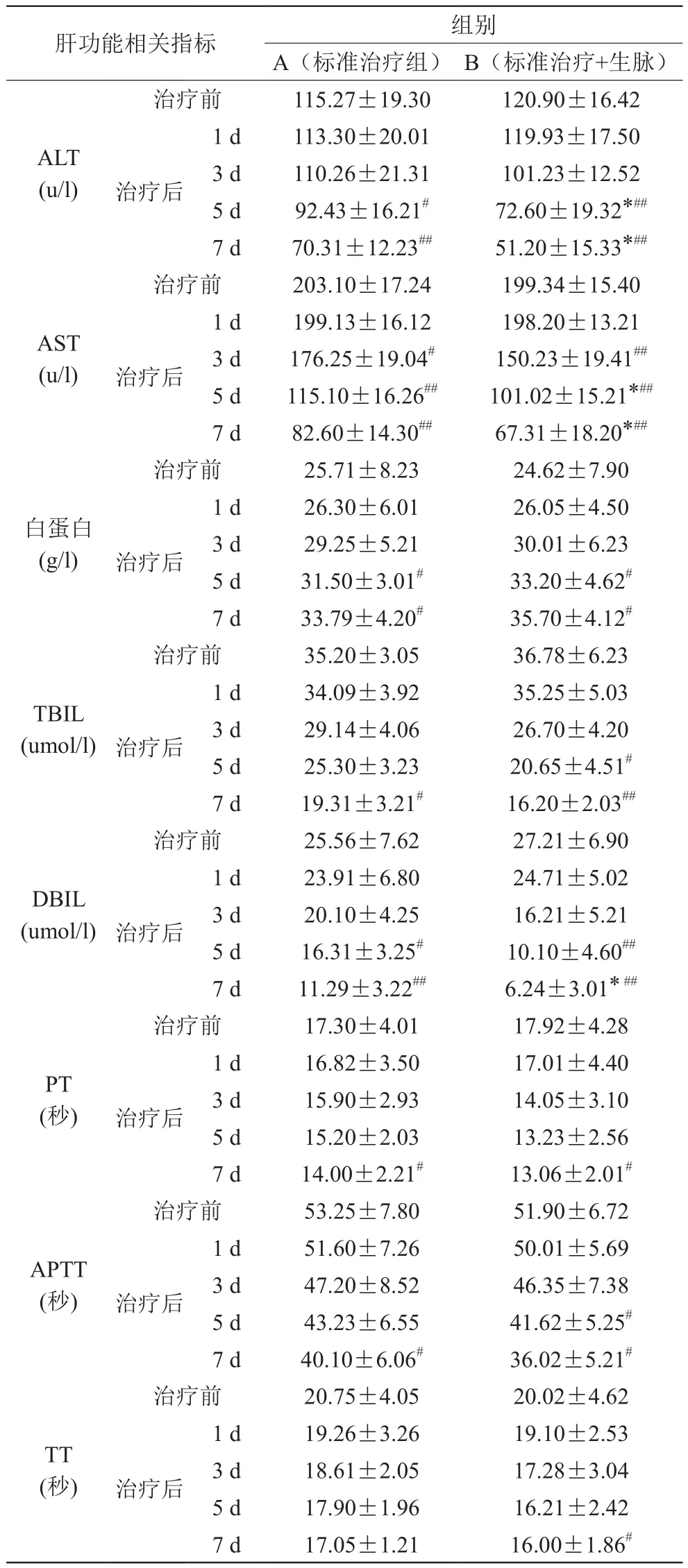
表3 两组治疗前后肝功能相关指标比较s)
注:与A组比较,*P<0.05;与治疗前比较,#P<0.05,##P<0.01
肝功能相关指标 组别A(标准治疗组) B(标准治疗+生脉)治疗前 115.27±19.30 120.90±16.42 ALT(u/l)治疗后1 d 113.30±20.01 119.93±17.50 3 d 110.26±21.31 101.23±12.52 5 d 92.43±16.21# 72.60±19.32*##7 d 70.31±12.23## 51.20±15.33*##治疗前 203.10±17.24 199.34±15.40 AST(u/l)治疗后1 d 199.13±16.12 198.20±13.21 3 d 176.25±19.04# 150.23±19.41##5 d 115.10±16.26## 101.02±15.21*##7 d 82.60±14.30## 67.31±18.20*##治疗前 25.71±8.23 24.62±7.90白蛋白(g/l)治疗后1 d 26.30±6.01 26.05±4.50 3 d 29.25±5.21 30.01±6.23 5 d 31.50±3.01# 33.20±4.62#7 d 33.79±4.20# 35.70±4.12#治疗前 35.20±3.05 36.78±6.23 TBIL(umol/l)治疗后1 d 34.09±3.92 35.25±5.03 3 d 29.14±4.06 26.70±4.20 5 d 25.30±3.23 20.65±4.51#7 d 19.31±3.21# 16.20±2.03##治疗前 25.56±7.62 27.21±6.90 DBIL(umol/l)治疗后1 d 23.91±6.80 24.71±5.02 3 d 20.10±4.25 16.21±5.21 5 d 16.31±3.25# 10.10±4.60##7 d 11.29±3.22## 6.24±3.01* ##治疗前 17.30±4.01 17.92±4.28 PT(秒)治疗后1 d 16.82±3.50 17.01±4.40 3 d 15.90±2.93 14.05±3.10 5 d 15.20±2.03 13.23±2.56 7 d 14.00±2.21# 13.06±2.01#治疗前 53.25±7.80 51.90±6.72 APTT(秒)治疗后1 d 51.60±7.26 50.01±5.69 3 d 47.20±8.52 46.35±7.38 5 d 43.23±6.55 41.62±5.25#7 d 40.10±6.06# 36.02±5.21#治疗前 20.75±4.05 20.02±4.62 1 d 19.26±3.26 19.10±2.53 3 d 18.61±2.05 17.28±3.04 5 d 17.90±1.96 16.21±2.42 7 d 17.05±1.21 16.00±1.86#TT(秒)治疗后
4 讨 论
脓毒症病人相关肝损伤发生率较高,合并肝功能异常的脓毒症病人预后差,多器官功能障碍综合征发生率高,其中以胆红素升高为表现的脓毒症病人肝功能恢复率低[3]。脓毒症相关肝损伤主要特征为继发于缺氧性代谢障碍所致的肝细胞功能异常,肝脏氧化和合成代谢功能下降,导致肝功能异常,出现肝损伤[4]。在发生缺氧性肝损伤后24~48 h,超过50%的患者血清转氨酶明显升高、血清碱性磷酸酶升高(不超过正常上限的2~3倍)[5];脓毒症时胆汁淤积的危重症病人可表现出黄疸,发生率高达40%[6]。结合胆红素水平往往波动于24.2~171.0 umol/L,有的病人可更高[7]。若病人表现出持续性黄疸,则表明病人预后不良[8]。脓毒症相关性肝损伤的临床特点:肝内胆管胆泥样胆汁淤积,西医无良好办法,同时脓毒症抗感染药物都或多或少肝损害作用。因此,改善脓毒症相关性肝损伤患者的肝损伤是目前脓毒症治疗的热点和难点。生脉注射液是将生脉散中的人参、麦冬、五味子制成可静脉注射的药物,含人参皂甙、麦冬皂甙、麦冬黄酮和五味子素等有效成分,中医认为其有益气生津,复脉固脱之效。目前关于生脉注射液对器官和组织缺血再灌注的保护研究多集中在心、肺、肠黏膜以及休克状态下的器官[9-11],而对肝脏损伤保护研究的报道则极为少见。有研究表明[12]生脉注射液可以通过清除氧自由基、调解细胞内钙稳态、抑制NO酶的活性、增加肠黏膜灌注及氧合,发挥肠黏膜保护效应,减轻肠黏膜缺血再灌注损伤。另有研究显示[13]肝缺血大鼠模型给予生脉注射液预处理,ALT、AST、TNF-α、MDA等指标与缺血再灌注组比较显著降低,组织病理也显示肝细胞肿胀轻、坏死范围小,提示生脉注射液对大鼠肝脏缺血再灌注损伤有明显的保护作用。本研究中对脓毒症相关肝损伤患者在按指南治疗基础上加以生脉注射液,发现生脉注射液联合标准治疗能降低脓毒症相关肝损伤,改善肝功能(谷丙、谷草)、白蛋白,胆红素(TBIL、DBIL)、凝血功能(PT、APTT、TT),提示生脉注射液治疗脓毒症相关肝损伤具有可行性、有效性,拓宽了部分危重症疾病西医治疗局限性,提供了中医药在危重症疾病治疗价值的新证据和新途径。
[1] Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2012. Critical Care Medicine,2013,41:580-637.
[2] Kim TH, Lee SH, Lee SM. Role of Kupffer cells in pathogenesis of sepsis-induced drug metabolizing dysfunction. FEBS J,2011,278:2307-2317.
[3] 刘一娜,马晓春.脓毒症相关肝损伤49例临床分析[J].中国实用外科杂志,2012,32:916-918.
[4] Henrion J, Deltenre P, De Maeght S, et al. Acute lower limbischemia as a triggering condition in hypoxic hepatitis: a study of fi ve cases. J Clin Gastroenterol, 2011, 45: 274-277.
[5] Spahr L,Rubbia BL,Genevay M,et al.Early liver biopsy, intraparenchymal cholestasis,and prognosis in patients with alco-holic steatohepatitis.BMC Gastroenterol,2011,28:115.
[6] Koseesirikul P, Chotinaruemol S, Ukarapol N. Incidence andrisk factors of parenteral nutrition-associated liver disease innewborn infants. Pediatr Int, 2012, 54: 434-436.
[7] Le BB. Pathology: A pictorial review. A selected atlas of paediatric liver pathology. Clin Res Hepatol Gastroenterol, 2012,36:248-252.
[8] Fleming JC,Bailey CS,Hundt H, et al. Remote in fl ammatoryresponse in liver is dependent on the segmental level of spinalcord injury. J Trauma Acute Care Surg,2012,72:1194-1201.
[9] 黄翠瑶,邵 尉.参脉注射液抗心源性休克的作用[J].实用医学杂志,2003,19(6):681-682.
[10] 薛 萍.参脉注射液治疗休克32例临床疗效观察[J].中国中医急症,2000,9(2):65.
[11] 李庆海,吕安清,张 芳,等.参脉注射液对慢性充血性心力衰竭患者心率变异性的影响[J].中国中西医结合急救杂志,2000,7(5):237-241.
[12] 顾振华.生脉注射液对心肌缺血—再灌注损伤的保护作用及其机制的临床研究[D].南京中医药大学,2011.
[13] 陈 雪,姜树民,等.生脉注射液对脓毒症大鼠血流变学指标影响[J].实用中医内科杂志,2013,27(7):63-64.
R322.4+7
B
ISSN.2095-8242.2017.068.13327.03
太仓市科技支撑计划项目(TC2013Z008)
本文编辑:吴 卫
