温度对海捕野生大黄鱼精子活力的影响
2017-12-18黄伟卿阮少江李进寿陈小小阮俊峰周逢芳
罗 芬, 黄伟卿,2, 阮少江, 李进寿, 陈小小, 阮俊峰, 周逢芳
( 1.宁德师范学院 生物系,福建 宁德 352100;2.宁德市鼎诚水产有限公司,福建 宁德 352100 )
温度对海捕野生大黄鱼精子活力的影响
罗 芬1, 黄伟卿1,2, 阮少江1, 李进寿1, 陈小小1, 阮俊峰1, 周逢芳1
( 1.宁德师范学院 生物系,福建 宁德 352100;2.宁德市鼎诚水产有限公司,福建 宁德 352100 )
给7尾体质量325~520 g的成熟海捕野生大黄鱼人工催产后采精液,在20 ℃(室温)和4 ℃(冰箱)下保存0、1、3、6、12、24、36 h,以砂滤海水为激活剂,观察大黄鱼精子活力,以精子的激烈运动、摇尾运动、缓慢运动和寿命作为评价指标。试验结果表明,4 ℃和20 ℃下随保存时间的延长,精子活力逐渐减弱;4 ℃下保存24 h、20 ℃下保存12 h,精子仍具有激烈运动的能力;4 ℃下保存的3个运动阶段和寿命较20 ℃下均有所延长,4 ℃保存大黄鱼精子更佳。
野生;大黄鱼;精子活力;温度
大黄鱼(Pseudosciaenacrocea)为我国特有的中下层暖温性近海集群洄游鱼类,主要分布于南海、东海和黄海南部,曾是传统“四大海产”(大黄鱼、小黄鱼、带鱼、乌贼)之一[1-2]。大黄鱼自人工繁育技术突破今,经过30多年养殖发展,2015年全国产量达1.48×105t ,产值逾120亿元,已成为我国最大规模的海水网箱养殖鱼类和八大优势出口养殖水产品之一[3]。随着大黄鱼养殖的快速发展,也出现了累代近亲繁殖导致的生长性能和抗逆性降低等问题[4-6]。而海捕野生大黄鱼群体的遗传特性、营养结构、形态特征、抗逆性能等均优于养殖大黄鱼群体,对大黄鱼群体的遗传性状改良和良种选育具有现实意义[7-10]。但海捕野生大黄鱼成活率低,直接或培育至亲本用于种质改良难度大,如能及时有效保存海捕野生大黄鱼的精液,保存精子活力,对改良大黄鱼种质资源具有重要意义。
温度主要通过控制三磷酸腺苷来影响精子的活动强度及寿命[11]。罗芬[12]研究表明,4 ℃下保存的长鳍吻(Rhinogobioventralis)精子3个运动阶段和寿命均较20 ℃下长;李加儿等[13]报道,将平鲷(Rhabdosargussarba)精子保藏在3~5 ℃的冰箱中,寿命较室温条件下延长;韩英等[14]发现,黑龙江茴鱼(Thymallusarcticusgrubei)的精液随保存时间的延长,精子的激活率、快速运动时间和寿命均显著下降。朱东发[15]报道了环境因子对养殖大黄鱼精子激活率和活动时间的影响,而关于保存温度对海捕野生大黄鱼精子活力的影响尚未见报道。本试验研究了温度对海捕野生大黄鱼精子活力的影响,旨在补充大黄鱼精子的生理特性资料,探寻适宜的保存温度,以延长大黄鱼精子的保存时间,提高精子的授精能力。
1 材料与方法
1.1 精液的采集与保存
给体长26.5~35.4 cm、体质量325~520 g的体质健壮、外表无损伤及病害的7尾成熟海捕野生大黄鱼雄鱼注射促黄体素释放激素类似物(LRH-A),剂量为5 μg/kg,暂养24 h后用干毛巾擦干生殖孔周围及体表的水分,用手轻压鱼腹部两侧,使精液流出,用干净的胶头滴管从生殖孔吸取没有受到污染的精液,盛放于小培养皿中并加盖,快速放进4 ℃低温中保存,定期取出少许精液待检,待检精液无水、无尿、无血,遇水迅速散开。经显微镜检查,精子活力在90%以上者用于试验。
1.2 精液在20 ℃和4 ℃下保存与激活
将所取精液分成两等份,置于20 ℃(室温)和4 ℃(冰箱)下保存,0、1、3、6、12、24、36 h定时取样观察,以砂滤海水为激活剂。
1.3 精子活力的观察
采用平板载玻片法观察精子活力。滴一滴试验液于干燥洁净的载玻片上,用消毒的解剖针蘸取少许精液,使其均匀分散,在10×40倍的显微镜下观察,精液与试验液接触的瞬间立即启动秒表计时,记录精子活动情况[16]。观察以1个视野为准,每个样品重复3~5次。
根据精子在水中的运动状态分为激烈运动、缓慢运动和摇尾运动3个连续阶段。这3个阶段时间的总和为总运动时间,即精子的寿命。各阶段的具体划分标准参照文献[17]。
1.4 数据处理
试验数据以平均值±标准差表示。显著性差异采用SPSS 17.0软件的单因素方差分析法处理相关数据。
2 结 果
4 ℃下保存36 h,精子失去了激烈运动能力,仅缓慢运动和摇尾运动,缓慢运动、摇尾运动和寿命均显著减少(P<0.05);保存1 h与0 h相比精子活力差异不显著(P>0.05);保存3、6、12、24 h与0 h相比,精子运动时间和寿命均存在显著差异(P<0.05)(表1)。
20 ℃下保存24 h,精子就已丧失激烈运动的能力,缓慢运动和摇尾运动也显著减少(P<0.05);保存1 h精子活力显著低于0 h(P<0.05);保存3、6、12 h精子运动时间和寿命显著缩短(P<0.05);36 h后精子仅有摇尾运动,且摇尾运动和寿命显著减少(P< 0.05)(表2)。
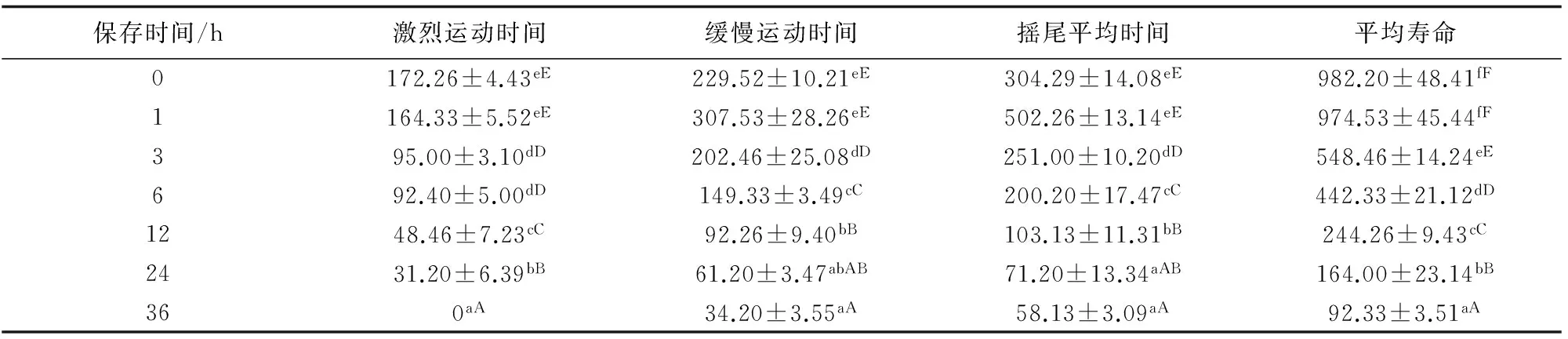
表1 4 ℃下保存不同时间时海捕野生大黄鱼精子的活力 s
注:同列中上标不同字母的平均值间差异显著(P<0.05),下同.

表2 20 ℃下保存不同时间时海捕野生大黄鱼精子的活力 s
*表示相关显著(P<0.05),**表示相关极显著(P<0.01),下同.

图2 4 ℃和20 ℃下保存不同时间时黄鱼精子的寿命
4 ℃下3 h和6 h时精子激烈运动时间显著长于20 ℃(P<0.05);4 ℃下24 h时,精子激烈运动时间极显著长于20 ℃(P<0.01)(图1)。4 ℃下3 h和24 h时,精子寿命显著高于20 ℃(P<0.05);12 h时,4 ℃下精子寿命极显著高于20 ℃(P<0.01)(图2)。
海捕野生大黄鱼精子的运动时间和寿命随保存时间的延长而下降。4 ℃下保存的3个运动阶段和寿命较20 ℃下有所延长;4 ℃下保存24 h、20 ℃下保存12 h精子仍具有激烈运动能力,4 ℃下保存精子活力明显提高。
3 讨 论
精子靠尾部鞭毛的摆动来运动。外界因子通过干预cAMP-ATP-Mg2+系统来影响鞭毛的活动而制约鱼类精子的活力[17]。本试验表明,保存温度和时间影响海捕野生大黄鱼精子的活力。4 ℃低温保存的海捕野生大黄鱼精子活力激烈运动时间、寿命及保存时间均比20 ℃时更长,这与长鳍吻、黑龙江茴鱼、鞍带石斑鱼(Epinepheluslanceolatus)、石鲽(Kareiusbicoloratus)和褐牙鲆(Paralichthysolivaceus)的研究结果相似[12-14,18-19]。不同保存温度对精子活力的影响不同。温度在鱼类精子激活生理中的作用可能主要是参与代谢酶活性的调节[14],低温减少了精子对三磷酸腺苷的消耗,延长了精子的运动时间[20]。鱼类精子的原生质含量极少,蕴藏的能量十分有限,低温抑制了精子新陈代谢的速度,能量消耗减缓,精子寿命延长;低温条件下精子运动频率明显降低,激烈运动时间及寿命延长;低温还抑制了细菌的滋生,这也是精子在低温下延长运动时间和寿命的重要原因。瓣结鱼[Tor(Folifer)brevifilis]精子在4 ℃下保存24 h仍活力正常[21];鞍带石斑鱼精液在0~4 ℃冰箱中保存6 h活力未显著降低[18];褐牙鲆精子在4 ℃下保存24 h、石鲽精子在4 ℃下保存6 h仍具较强活力[19]。长鳍吻精子在4 ℃下保存36 h仍具激烈运动能力,但在20 ℃下仅能保存12 h;4 ℃下保存不同时间3个运动阶段和寿命均较20 ℃下延长[12]。海捕野生大黄鱼精子活力较强,在4 ℃下保存24 h可以维持激烈运动时间(31.20±6.39) s、寿命长达(164.00±23.14) s;而20 ℃下保存24 h已丧失激烈运动能力,寿命缩短,仅(69.46±3.31) s。林丹军等[22]将养殖大黄鱼精液置于4 ℃冰箱中24 h后用海水激活,精子活力仍可达到60%以上。在人工繁殖中,低温保存对精子激活及提高受精率具有重要应用意义。不过低温条件下只是抑制了精子的新陈代谢,耗能仍在继续,精子活力随时间延长而下降,精液保存的时间有限。因此,在人工授精过程中应缩短海捕野生大黄鱼精液保存时间,取得精液后保存于低温(4 ℃)并尽早使用,可以有效延长精子活动时间,尤其是延长激烈运动的时间,增加了精卵接触机会,能够提高受精率,确保人工授精成功。
[1] 黄振远,苏永全,张建设,等.闽粤群和岱衢群养殖大黄鱼(Pseudosciaenacrocea)及其杂交子代遗传差异的SSR分析[J].海洋与湖沼,2011,42(4):592-596.
[2] 王娟,封永辉,蔡立胜,等.来自大黄鱼(Pseudosciaenacrocea)肠道的弧菌拮抗菌的筛选与鉴定[J].海洋与湖沼, 2010,41(5):707-713.
[3] 黄伟卿,张艺,柯巧珍,等.大黄鱼选育子二代生长性状研究[J].南方水产科学, 2013,9(3):14-19.
[4] 丁诗华,黄丽英,张海琪,等.大黄鱼(Pseudosciaenacrocea)岱衢洋选育群体和官井洋养殖群体的遗传差异分析[J].海洋与湖沼,2006,37(1):41-46.
[5] 王军,全成干,苏永全,等.官井洋大黄鱼遗传多样性的RAPD分析[J].海洋学报,2001,23(3):87-91.
[6] 黄伟卿,刘招坤,郑昇阳,等.2个大黄鱼群体选育世代F2生长性状研究[J].水生态学杂志,2014,35(2):80-84.
[7] 刘必谦,董文琦,王亚军,等.岱衢族大黄鱼种质的AFLP分析[J].水生生物学报,2005,29(4):413-416.
[8] 徐继林,严小军,罗瑜萍,等.岱衢族野生大黄鱼与养殖大黄鱼肌肉脂类和脂肪酸组成的比较研究[J].中国食品学报, 2008,8(1):108-114.
[9] 陈慧,陈武,林国文,等.官井洋种群网箱养殖大黄鱼的形态特征与生长式型[J].海洋渔业,2007,29(4): 331 -336.
[10] 苗亮,李明云,陈炯,等.快长、耐低温大黄鱼新品种东海1号的选育[J].农业生物技术学报,2014,10(4):1314 -1320.
[11] Perchec G, Jeulin C, Cosson J, et al. Relationship between sperm ATP content and motility of carp spermatozoa [J]. J Cell Sci,1995,108(2):747-753.
[12] 罗芬.长鳍吻鮈精子活力的观察[J].泉州师范学院学报, 2011,29(6):26-27.
[13] 李加儿,区又君,江世贵. 环境因子变化对平鲷精子活力的影响[J].动物学杂志,1996, 31(3):6-9.
[14] 韩英,张澜澜,徐革峰,等.黑龙江茴鱼(Thymallusarcticusgrubei) 精子活力的观察[J].水产学杂志,2008, 21(1):9-13.
[15] 朱冬发.环境因子对大黄鱼精子活力的影响[J]. 水产科学, 2005, 24(12):4-6.
[16] 罗芬. 氯化钠浓度对宽口光唇鱼精子活力的影响[J]. 四川动物, 1999, 18(2):70-72.
[17] 邓岳松. 鱼类精子活力研究进展[J]. 生命科学研究, 1999, 3(4):271-278.
[18] 梁伟峰, 张海发, 王云新,等. 几种因子对鞍带石斑鱼精子活力的影响[J].广东海洋大学学报,2009,29(3):29-32.
[19] 王华,牛从从,邵明瑜,等.几种鲆鲽鱼类精子超微结构及生理特性的比较研究[J].海洋科学,2008,32(10):17-23.
[20] Billard R, Cosson M P. Some problems related to the assessment of sperm motility in freshwater fish[J]. J Exp Zool,1992(261):122-131.
[21] 谢恩义,何学福.瓣结鱼的繁殖习性以及精子的活力与寿命[J]. 动物学杂志, 1999, 34(2):5-8.
[22] 林丹军,尤永隆,陈炳英.大黄鱼精子冷冻复苏后活力和超微结构的变化[J].福建师范大学学报:自然科学版,2006, 22(3):71-76.
EffectsofTemperatureonSpermMotilityofWildLargeYellowCroakerPseudosciaenacrocea
LUO Fen1,HUANG Weiqing1,2,RUAN Shaojiang1,LI Jinshou1,CHEN Xiaoxiao1,RUAN Junfeng1, ZHOU Fengfang1
( 1.Department of Bioengineering,Ningde Normal University, Ningde 352100, China; 2.Ningde Dingcheng Fishery Company Limited, Ningde 352100, China )
The activation and motility of spermatozoa collected from captured wild male large yellow croaker (Pseudosciaenacrocea) with body weight of 325-520 g were investigated under the different preservation time (0, 1, 3, 6, 12, 24 h and 36 h) at the temperature of 4 ℃ and 20 ℃. The strenuous movement, wagging movement, slow movement and life time of sperm were taken as an index to evaluate sperm activity. The results showed that the sperm had gradually weak motility over time at the temperature of 4 ℃ and 20 ℃, being still strenuous movement when the sperm was preserved at 4 ℃ for 24 h or 20 ℃ for 12 h. However, there were longer movement in the three stages of life at 4 ℃ than at 20 ℃, with stronger motility at 4 ℃ than at 20 ℃.
wild;Pseudosciaenacrocea; sperm motility; temperature
10.16378/j.cnki.1003-1111.2017.06.022
S965.322
A
1003-1111(2017)06-0814-04
2016-09-01;
2016-12-12.
福建省科技计划项目(2017N0027);宁德师范学院创新团队建设项目(2015T10).
罗芬(1963-),女,教授;研究方向:鱼类生理学及水产保护学.E-mail:luofen1999@163.com.
