不同生长阶段可口革囊星虫的营养组成和消化酶活性
2017-12-18董兰芳曾梦清许明珠
董兰芳,曾梦清,蒋 艳,张 琴,许明珠
( 广西壮族自治区海洋研究所,广西海洋生物技术重点实验室,广西 北海 536000 )
不同生长阶段可口革囊星虫的营养组成和消化酶活性
董兰芳,曾梦清,蒋 艳,张 琴,许明珠
( 广西壮族自治区海洋研究所,广西海洋生物技术重点实验室,广西 北海 536000 )
为了解不同生长阶段可口革囊星虫营养生理和消化生理,比较了稚虫(0.35±0.00) g 、幼虫(1.43±0.10) g、成虫(5.15±0.34) g 3个生长阶段可口革囊星虫体壁的营养成分和氨基酸组成以及肠道消化酶活性。结果表明,随着个体生长,星虫体壁水分、粗灰分和总糖含量显著降低(P<0.05),粗蛋白含量显著升高(P<0.05),粗脂肪含量无显著变化(P>0.05)。除脯氨酸和甘氨酸含量显著降低(P<0.05)外,其他氨基酸含量均随星虫个体的生长而增加。随着个体的生长,星虫肠道蛋白酶活性显著升高(P<0.05),成虫显著高于稚虫(P<0.05)而与幼虫无显著差异(P>0.05)。相反,淀粉酶和脂肪酶活性随星虫的生长而显著降低(P<0.05)。稚虫和幼虫的淀粉酶活性显著高于成虫(P<0.05),两者间无显著差异(P>0.05);稚虫的脂肪酶活性显著高于幼虫和成虫(P<0.05)。因此,不同生长阶段可口革囊星虫的营养需求和消化酶活性均不同,在饲养过程中,应考虑星虫这种生理的变化,适当调整饲料营养配比,以提高饲料利用效率。
可口革囊星虫;生长阶段;营养成分;消化酶活性;氨基酸
可口革囊星虫(Phascolosomaesculenta),属星虫动物门、革囊星虫属,是我国特有的星虫种类,主要分布在东海和南海[1]。可口革囊星虫不仅是海洋底栖动物的天然饵料,也是人们喜爱的特色海鲜食品,其味道鲜美、营养丰富,具有清肺泻火、滋阴补肾、补虚活血等保健功能[2-3]。可口革囊星虫抗逆性强、生长快、活动范围小,是理想的增养殖品种[4]。目前,在浙江乐清、温岭等少数地区可口革囊星虫的人工养殖已取得比较理想的成效,但其苗种生产工作滞后,主要依靠海区自然苗种。为了更合理地开发可口革囊星虫资源,促进可口革囊星虫养殖业的发展,有必要对其生理生化、生物学特性、营养需求等方面进行研究和探讨。本研究通过测定不同生长阶段可口革囊星虫体壁组织的营养成分和氨基酸组成以及肠道消化酶活性,旨在丰富可口革囊星虫营养生理的基础资料,为可口革囊星虫的人工养殖和苗种生产提供理论指导。
1 材料与方法
1.1 材料来源
试验用可口革囊星虫稚虫(0.35±0.00) g和幼虫(1.43±0.10) g为广西海洋研究所海水增养殖基地自主培育的人工苗种,成虫(5.15±0.34) g采集自广西北海市合浦县闸口镇红树林区,于海水增养殖基地的育苗池内人工饲养3~4个月后收集用于测定。3个生长阶段星虫的样品数分别为稚虫100条、幼虫50条、成虫20条,每个阶段设3个重复。
1.2 样品处理
收集的鲜活可口革囊星虫样品洗净体表淤泥,用剪刀纵向剖开清理取出内脏,体壁用纯水洗净、滤纸吸干后称量质量,用恒温干燥法105 ℃烘干24 h测定水分,干品磨成细粉,保存用于常规营养成分和氨基酸组成分析。
清理取出的内脏用镊子挑出肠道部分,剪取收集于离心管,储存于-20 ℃用于消化酶的测定。酶液制备:取星虫肠道按质量体积比1∶4的比例加入预冷的磷酸缓冲液(pH=7),用玻璃匀浆器在冰浴中匀浆,匀浆液转移至1.5 mL离心管于4 ℃,3000 r/min离心10 min,上清液冷冻保存,用于消化酶活性测定。
1.3 样品测定
1.3.1 体壁常规营养成分测定
粗蛋白采用凯氏定氮法测定(Kjeltec 8400,瑞典);粗脂肪采用索氏提取法(Soxtec 2050,瑞士);灰分采用马福炉550 ℃灰化12 h测定;总糖用苯酚硫酸法[5]测定。
1.3.2 消化酶测定
蛋白酶活性采用Folin-酚法测定;脂肪酶活性、淀粉酶活性和酶液蛋白质量分数均采用南京建成生物工程研究所研制的试剂盒测定。酶活力用比活力(U/mg)表示。
1.3.3 体壁氨基酸组成分析
星虫体壁的氨基酸组成参照GB/T 5009.124—2003 《食品中氨基酸的测定》的方法测定。
1.4 数据分析
采用SPSS 19.0软件对数据进行分析处理,每组数据先分别做齐性检验再进行方差分析,显著性水平为0.05,若差异达到显著性水平则进行Tukey多重比较,结果表示为“平均值±标准差”。
2 结果与分析
2.1 不同生长阶段可口革囊星虫的营养成分
不同生长阶段可口革囊星虫体壁的水分、粗蛋白、粗灰分和总糖含量有显著差异(P<0.05),而粗脂肪含量的变化差异不显著(P>0.05)。随着个体的生长,星虫体壁水分、粗灰分和总糖含量显著降低(P<0.05),粗蛋白含量显著升高(P<0.05)。稚虫的水分含量最高,显著高于幼虫和成虫(P<0.05),幼虫和成虫无显著差异(P>0.05);粗灰分含量也是稚虫显著高于其他两组(P<0.05),而成虫最低,显著低于稚虫和幼虫(P<0.05);稚虫和幼虫的总糖含量显著高于成虫(P<0.05),而两者间无显著差异(P>0.05);成虫的粗蛋白含量最高,显著高于稚虫和幼虫(P<0.05)。
注:同行数据肩标字母不同表示差异显著(P<0.05),下同.
2.2 不同生长阶段可口革囊星虫的氨基酸组成及其特征
不同生长阶段可口革囊星虫体壁氨基酸组成见表2。随着星虫的生长,氨基酸总量增加,成虫的总氨基酸显著高于稚虫和幼虫(P<0.05),其变化趋势与体壁蛋白质含量的变化相符。除脯氨酸和甘氨酸外,其他氨基酸含量均随着星虫的生长呈增加的趋势,其中苯丙氨酸和组氨酸增大趋势不显著(P>0.05),苏氨酸、丝氨酸、丙氨酸和蛋氨酸含量在稚虫到幼虫阶段无显著变化,而在幼虫到成虫阶段显著增加。脯氨酸和甘氨酸含量随星虫的生长而显著降低(P<0.05)。脯氨酸含量在稚虫到幼虫阶段无显著变化(P>0.05),在幼虫到成虫阶段显著降低(P<0.05);甘氨酸含量亦是成虫最低,显著低于稚虫(P<0.05)而与幼虫无显著差异(P>0.05)。随着星虫的生长,必需氨基酸含量显著增加(P<0.05),成虫的必需氨基酸含量显著高于幼虫(P<0.05),幼虫显著高于稚虫(P<0.05)。可口革囊星虫呈味氨基酸含量在稚虫到幼虫阶段无显著变化,在幼虫到成虫阶段显著增加(P<0.05)。
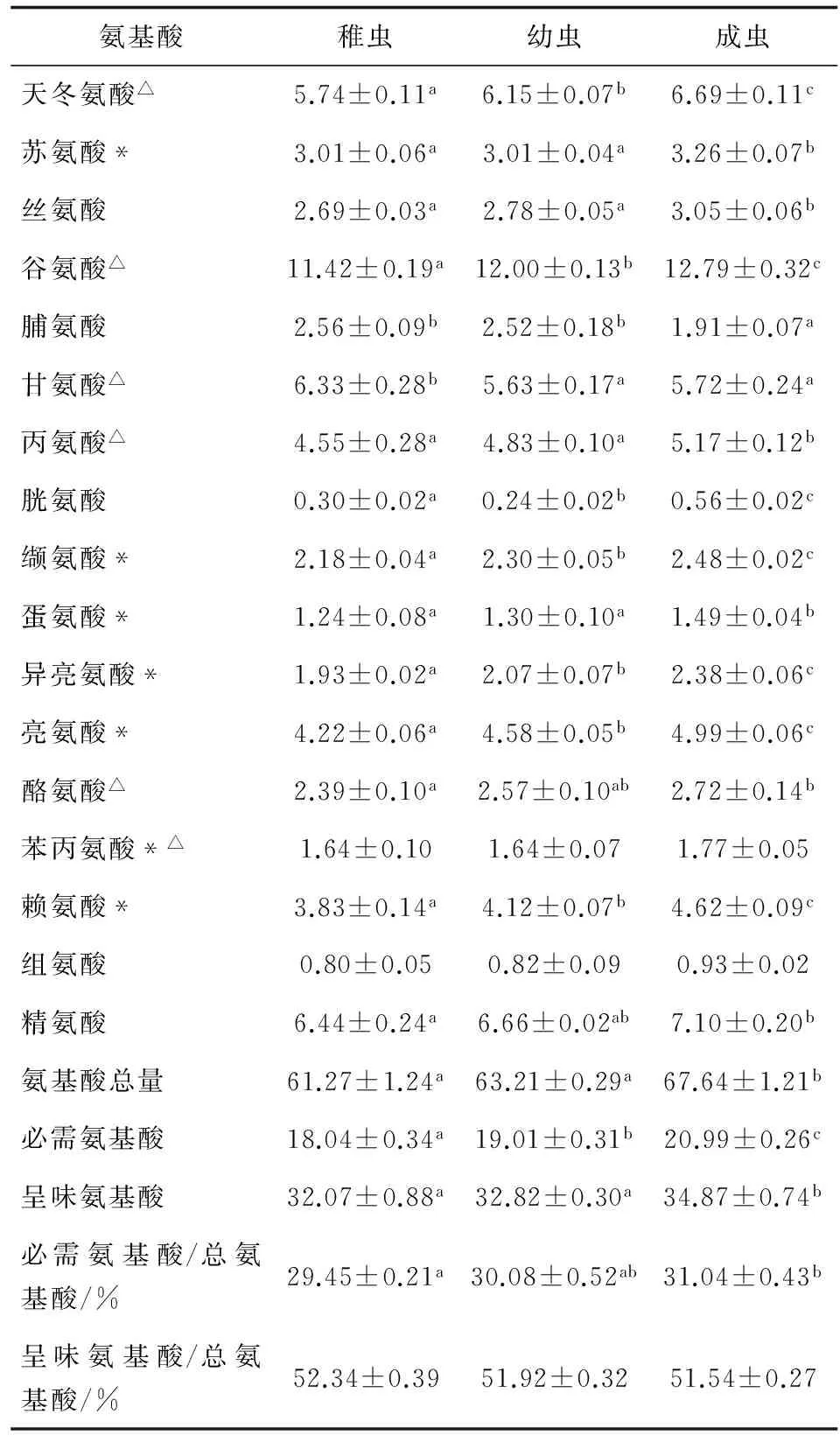
表2 不同生长阶段可口革囊星虫体壁的氨基酸组成及其特征(干基计) g/100g
注:*为必需氨基酸,△为呈味氨基酸.
2.3 不同生长阶段可口革囊星虫的消化酶活性
可口革囊星虫蛋白酶活性较高,淀粉酶和脂肪酶活性较低(图1)。不同生长阶段可口革囊星虫的蛋白酶、淀粉酶和脂肪酶活性均有显著差异(P<0.05)。成虫的蛋白酶活性显著高于稚虫(P<0.05)而与幼虫无显著差异(P>0.05);稚虫和幼虫的淀粉酶活性显著高于成虫(P<0.05),稚虫和幼虫间无显著差异(P>0.05);稚虫的脂肪酶活性显著高于幼虫和成虫(P<0.05)。
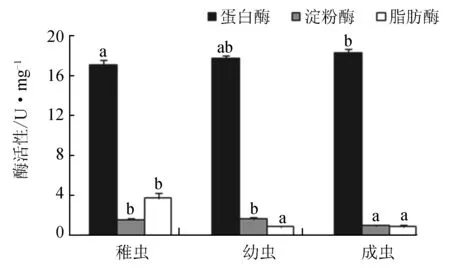
图1 不同生长阶段可口革囊星虫肠道消化酶活性同种消化酶相比较,不同字母表示差异显著(P<0.05).
3 讨 论
3.1 不同生长阶段可口革囊星虫营养成分的变化
生物体的生长实际上是各类营养素在其体内不断累积的过程。不同生长阶段生物体内营养成分的组成变化,反映了生物体对各类营养素的累积状况,有助于了解该生物体在不同生长阶段的营养需求。宋志东等[6]研究发现,仿刺参(Apostichopusjaponicus)体壁水分、脂肪和灰分含量随着个体增长而逐渐降低,蛋白含量逐渐升高,因仿刺参由幼体发育至成体的过程中摄食高蛋白低脂肪藻类,致其蛋白质含量增加,脂肪含量减少,而灰分含量的降低与其对钙磷等矿物质的积累速度较其他营养成分的积累速度慢有关。随着个体的增长,方格星虫(Sipunculusnudus)体壁蛋白和脂肪含量呈升高的趋势,而水分、灰分和总糖含量呈降低趋势[7]。管角螺(Hemifusustuba)肌肉的粗蛋白和粗脂肪含量随体质量的增加显著升高,水分含量显著降低,而灰分含量则没有显著变化[8]。类似的研究还有凡纳滨对虾(Litopenaeusvannamei)[9]、斑节对虾(Penaeusmonodon)[10]、大菱鲆(Scophthalmusmaximus)、褐牙鲆(Paralichthysolivaceus)[11]、匙吻鲟(Polyodonspathula)[12]等。研究结果不尽相同,说明不同水产动物对各营养成分的积累有很大的差异性。本研究中,随着可口革囊星虫个体的生长,体壁蛋白含量显著升高,水分、灰分和总糖含量显著降低,脂肪含量无显著变化。在幼虫到成虫阶段星虫体壁蛋白含量显著增加,因此在这一阶段,必需保证充足的饵料蛋白,以满足其生长需求。可口革囊星虫成虫体壁蛋白、脂肪和总糖含量(分别为73.86%、2.03%和5.26%)与方格星虫成虫体壁组成(蛋白、脂肪和总糖含量分别为74.84%、2.95%和5.62%)相近,这可能是可口革囊星虫和方格星虫同属星虫动物门的红树林大型底栖动物,生物种类相近的原因。
3.2 不同生长阶段可口革囊星虫氨基酸组成及其特征的变化
除脯氨酸、甘氨酸外,其他氨基酸及总氨基酸含量均随可口革囊星虫的生长而增加,整体符合蛋白质含量的变化趋势。脯氨酸含量在稚虫到幼虫阶段没有显著变化,在幼虫到成虫阶段显著降低。脯氨酸是组成蛋白质常见20种氨基酸中唯一的亚氨基酸,研究表明,脯氨酸在细胞分化方面有重要作用[13-14],成虫阶段脯氨酸含量的变化可能与其生殖细胞的发育有关。甘氨酸作为非必需氨基酸,不仅参与构成蛋白质,还是一些重要激素及脱氧核糖核酸、蛋氨酸、胆碱等的基本结构和前体[15],星虫生长过程各功能结构的积累增加,甘氨酸作为前体或结构单元被消耗,可能导致其含量下降。可口革囊星虫体壁的必需氨基酸和呈味氨基酸含量均随星虫个体的生长而显著增加。不同生长阶段可口革囊星虫必需氨基酸/总氨基酸为29.45%~30.04%,低于不同生长阶段的匙吻鲟(必需氨基酸/总氨基酸为39.38%~39.61%,呈味氨基酸/总氨基酸为37.22%~37.90%)[12]、湖鲚(Coiliaectenestaihuensis)(必需氨基酸/总氨基酸为39.74%~40.42%,呈味氨基酸/总氨基酸为38.65%~38.86%)[16]、瓯江彩鲤(Cypinuscarpiovar.color)(必需氨基酸/总氨基酸为44%,呈味氨基酸/总氨基酸为39.72%~40.63%)[17]等鱼类及凡纳滨对虾(必需氨基酸/总氨基酸为33.29%~34.04%,呈味氨基酸/总氨基酸为37.22%~37.90%)[9]、管角螺(必需氨基酸/总氨基酸为40.06%~43.18%,呈味氨基酸/总氨基酸为44.16%~48.71%)[8]等水产动物,而其呈味氨基酸/总氨基酸(51.54%~52.34%)却远高于这些水产动物,说明了可口革囊星虫从幼虫开始就具备肉味鲜美的特点。这一组成特征也与同属物种方格星虫(必需氨基酸/总氨基酸为27.56%~32.61%,呈味氨基酸/总氨基酸为51.92%~58.76%)[7]相似。
3.3 不同生长阶段可口革囊星虫消化酶活性的变化
生物体对营养物质的积累与其消化生理密不可分,而消化酶活性是评价消化机能的重要指标,消化酶活性的高低一定程度上反映了生物体对各营养物质的消化吸收能力。李芹等[18]的研究证明,消化酶的发生不是外源摄食的结果,而是生物体生长过程中自身生长、发育的一个生命现象。水产动物消化酶活性与饵料、温度、生长阶段等众多因素有关[19-20]。不同生长阶段的消化酶活性活性又有很大差异,这在许多水产动物的研究中得到了验证[21-25]。可口革囊星虫肠道的蛋白酶活性远高于淀粉酶和脂肪酶,这表明在整个生长时期可口革囊星虫对蛋白质的利用效率要优于淀粉和脂肪,这也是其体壁粗蛋白含量高、糖和粗脂肪含量低的原因。随着星虫的生长,蛋白酶活性显著升高而淀粉酶和脂肪酶活性显著降低,可以确定可口革囊星虫成虫对蛋白的消化能力最强,而其对饵料脂肪和糖类的需求可能较稚虫和幼虫低,这也是成虫体壁蛋白含量显著高于稚虫和幼虫,而脂肪和糖含量没有差别甚至降低的原因。可口革囊星虫蛋白酶活性随着生长而提高,生长后期能够更好地利用饵料蛋白,从这个角度来说,大规格星虫对饵料蛋白的要求又没有那么高,因此有必要在下一步开展不同生长阶段可口革囊星虫营养需求的研究,为苗种生产和人工养殖过程中研发经济高效的星虫饲料提供理论指导。
[1] 纪其雄,丁理发,苏秀榕,等. 可口革囊星虫体液细胞组成及营养成分研究[J]. 水产科学,2007,26(7):387-389.
[2] 牛荣丽,唐健红. 可口革囊星虫抗疲劳作用的研究[J]. 食品工业科技,2012,33(24):389-391.
[3] 周化斌,张勇普,吴洪喜,等. 可口革囊星虫的营养成分分析与评价[J]. 海洋湖沼通报,2006(2):62-68.
[4] 吴洪喜,应雪萍,陈琛,等. 可口革囊星虫胚胎与幼体的发育[J]. 动物学报,2006,52(4):765-773.
[5] 张青,张天民. 苯酚—硫酸比色法测定多糖含量[J]. 山东食品科技,2004(7):17-18.
[6] 宋志东,王际英,王世信,等. 不同生长发育阶段刺参体壁营养成分及氨基酸组成比较分析[J]. 水产科技情报,2009,36(1):11-13.
[7] 董兰芳,张琴,童潼,等. 不同生长发育阶段方格星虫氨基酸组成的研究[J]. 南方水产科学,2012,8(5):60-65.
[8] 蒋敏霞,姜小敏,杜学星,等. 不同规格管角螺肌肉营养成分分析[J]. 动物营养学报,2012,24(10):2059-2066.
[9] 文国樑,李卓佳,林黑着,等. 规格与盐度对凡纳滨对虾肌肉营养成分的影响[J]. 南方水产科学,2007,3(3):31-34.
[10] 周凡,肖金星,何中央,等. 不同规格莫桑比克草虾肌肉营养组成、消化酶及免疫酶活分析[J]. 水产科学,2013,32(11):653-656.
[11] 腾瑜,郭晓华,苑德顺,等. 不同规格鲆鲽类的生化组成及营养价值比较[J]. 渔业科学进展,2010,31(4):120-125.
[12] 陈静,梁银铨,黄道明,等. 不同生长阶段匙吻鲟肌肉成分的研究[J]. 水生态学杂志,2008,1(1):65-68.
[13] Wu G Y, Bazer F W, Datta S, et al. Proline metabolism in the conceptus:implications for fetal growth and development[J]. Amino Acids, 2008, 35(4):691-702.
[14] Phang J M, Liu W. Proline metabolism and cancer [J]. Frontiers in Bioscience, 2012, 17(1):1835-1845.
[15] 袁小娟,吴希茜. 甘氨酸的生理作用与应用[J]. 饮料工业,2011,14(7):5-7.
[16] 段金荣,刘凯,徐东坡,等. 湖鲚不同生长阶段鱼体肌肉组成的比较研究[J]. 云南农业大学学报,2009,24(5):695-699.
[17] 徐如卫,申屠基康,江锦坡,等. 3种不同规格瓯江彩鲤含肉率及肌肉营养成分比较[J]. 宁波大学学报,2012,25(1):13-19.
[18] 李芹,龙勇,屈波,等. 瓦氏黄颡鱼仔稚鱼发育过程中消化酶活性变化的研究[J]. 中国水产科学,2008,15(1):73-78.
[19] 潘鲁青,刘泓宇,肖国强. 甲壳动物幼体消化酶研究进展[J]. 中国水产科学,2006,13(3):492-501.
[20] 田宏杰,庄平,高露姣. 生态因子对鱼类消化酶活力影响的研究进展[J]. 海洋渔业,2006,28(2):158-162.
[21] 孙翰昌. 不同规格大鲵消化酶活性的比较研究[J]. 水产科学,2014,33(7):459-461.
[22] 刘永士,施永海,张根玉,等. 不同生长阶段哈氏仿对虾消化酶及非特异性免疫酶的活性研究[J]. 中国农学通报,2014,30(14):19-25.
[23] 王桂学,沈志刚,高远明,等. 太湖秀丽白虾不同生长阶段主要消化酶活性研究[J]. 南方水产科学,2010,6(3):58-62.
[24] 丁雪燕,何中央,邱晓力,等. 三疣梭子蟹不同生长阶段消化酶活性及配合饲料对其影响的研究[J]. 动物营养学报,2010,22(2):492-497.
[25] 郇志利,何蓝波,胡毅,等. 不同规格黄鳝消化酶活性的比较[J]. 水生态学杂志,2012,33(5):57-60.
ChangesinNutritiveComponents,AminoAcidCompositionandDigestiveEnzymeActivitiesofSipunculidPhascolosomaesculentaatDifferentGrowthStages
DONG Lanfang, ZENG Mengqing, JIANG Yan, ZHANG Qin, XU Mingzhu
( Key Laboratory of Marine Biotechnology of Guangxi, Guangxi Institute of Oceanology, Beihai 536000, China )
The nutritive components, amino acid composition and digestive enzyme activities of larval (0.35±0.00) g, juvenile (1.43±0.10) g and adult (5.15±0.34) g sipunculidPhascolosomaesculentawere compared to investigate the nutrition and digestive physiology of the sipunculid at different growth stages. Results showed that the contents of body moisture, crude ash and total sugar were significantly decreased (P<0.05) with the growth of the sipunculid, while the body crude protein content significantly increased (P<0.05), without significant difference in crude lipid content (P>0.05). Except for proline and glycine, the contents of the most amino acids increased significantly (P<0.05) as the sipunculid grew up. The analysis of intestine digestive enzymes indicated that protease activity significantly increased (P<0.05) with the growth of the sipunculid, but amylase and lipase activities significantly decreased (P<0.05). There were significantly higher amylase activities in the larvae and juveniles than those in the adult (P<0.05), and significantly higher lipase activity in the larvae than that in the others (P<0.05). In practical production, growth stage should be taken into account to adjust the nutritive ratio for high efficiency in feed utilization.
Phascolosomaesculenta; growth stage; nutritive component; amino acid composition; digestive enzyme activity
10.16378/j.cnki.1003-1111.2017.06.017
S966.9
A
1003-1111(2017)06-0789-05
2016-09-14;
2017-01-03.
广西科学研究与技术开发计划项目(桂科攻14121006-2-3);广西培养新世纪学术科技带头人专项资金资助项目.
董兰芳(1987-),女,助理研究员;研究方向:水产动物营养与饲料.E-mail:0xiao0dong0@163.com. 通讯作者:蒋艳(1980-),女,副研究员;研究方向:海水新品种繁育技术.E-mail:hdjy98@163.com.
