初情期启动过程中MeCP2和GnRH在母羊下丘脑的分布定位
2017-12-18宫永胜苑志宇吕文发
宫永胜,苑志宇,张 涛,吕文发*,王 军,3*
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.吉林省科技创新平台管理中心,吉林长春 130012;3. 锦州医科大学畜牧兽医学院,辽宁锦州 121001)
初情期启动过程中MeCP2和GnRH在母羊下丘脑的分布定位
宫永胜1,苑志宇1,张 涛2,吕文发1*,王 军1,3*
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.吉林省科技创新平台管理中心,吉林长春 130012;3. 锦州医科大学畜牧兽医学院,辽宁锦州 121001)
本实验旨在研究甲基化CpG结合蛋白(MeCP2)和促性腺激素释放激素(GnRH)初情期启动过程中在母羊下丘脑的分布及二者关系。选取初情期前、临近初情期和初情期阶段雌性小尾寒羊各3只,采集下丘脑,利用免疫荧光双标记技术研究MeCP2和GnRH在母羊下丘脑视前区(POA)和弓状核(ARC)中的分布。结果表明:MeCP2和GnRH在下丘脑ARC和POA均有分布,且呈现共表达模式,ARC中共表达阳性细胞数在初情期显著高于初情期前期和临近初情期(P<0.05),POA中共表达阳性细胞数初情期显著低于初情期前期和临近初情期(P<0.05)。结果提示,MeCP2可能通过调控下丘脑GnRH的表达而参与母羊初情期启动的调控。
初情期;下丘脑;MeCP2;GnRH;免疫荧光
初情期是动物从幼年向获得繁殖能力过渡的重要阶段,其启动时间关系到动物的繁殖性能和相关疾病的发生,初情期启动过程极其复杂,其机制尚未完全阐明[1]。现已明确,下丘脑-垂体-性腺轴(Hypothalamic-Pituitary-Gonadal Axis,HPG)的激活能够引起母畜的初情期启动[2]。研究表明,HPG轴活化受DNA甲基化的调控,激活相关基因的表达,从而参与初情期启动过程[3-4]。甲基化CpG结合蛋白(Methyl-CpG-Binding Protein 2,MeCP2)可协同DNA甲基转移酶1(DNA Methyltransferase 1,Dnmt1)维持甲基化水平,参与调控甲基化模式。MeCP2是下丘脑中一个关键的蛋白[5-6],其在神经细胞中作为一个转录抑制因子并调控基因活性[7]。
下丘脑中的视前区(Preoptic Area,POA)和弓状核(Arcuate Nucleus,ARC)分布有大量的促性腺激素释放激素(Gonadotropin Releasing Hormone,GnRH)神经元胞体,MeCP2能够调控基因的表达,参与初情期启动,但初情期启动过程中下丘脑MeCP2与GnRH的关系尚不清楚。本实验通过免疫荧光双标记技术研究初情期启动过程中MeCP2和GnRH在母羊下丘脑POA和ARC核团的分布及二者的关系,为阐明母羊初情启动机制提供参考。
1 材料与方法
1.1 药品和试剂 组织冰冻切片包埋剂、冰冻切片快速抗原修复液、免疫染色封闭液和含抗荧光淬灭封片液等试剂购自碧云天生物技术有限公司。GnRH(ab5617)和MeCP2(ab5005)抗体均购自Abcam公司;相应免疫荧光二抗均购自北京博奥森生物技术有限公司。
1.2 试验样品 采集初情期启动不同阶段(初情期前,临近初情期,初情期)母羊的下丘脑组织,下丘脑前端止于视交叉,后端止于乳头体,置于4%多聚甲醛中固定48 h,首先转入20%蔗糖PBS溶液,后转入30%蔗糖PBS溶液中脱水,待其组织完全沉浸于溶液中,用组织冰冻切片包埋剂对组织进行包埋,制作下丘脑组织冰冻切片,切片厚度25 μm,用于后续免疫荧光双标记实验。
1.3 免疫荧光实验 利用冰冻切片快速抗原修复液对组织切片进行修复,TBST洗片5 min,用4%多聚甲醛进行固定、洗片,组织上滴加免疫染色封闭液,湿盒中37℃封闭1 h,以减少非特异性染色;弃去封闭液滴加GnRH一抗(稀释比例为1:500),湿盒中4℃孵育过夜,擦干后滴加相对应的荧光二抗(稀释比例为1:60),37℃孵育1 h;洗净后滴加MeCP2一抗(稀释比例为1:100),4℃孵育过夜后,滴加对应的荧光二抗(稀释比例为1:60),同时对组织进行复核染,滴加DAPI室温孵育5 min,用含抗荧光淬灭剂的封片液进行封片,激光扫描共聚焦显微镜下观察采集图像。
1.4 统计分析 通过Olympus激光共聚焦显微镜配套ZEN软件分析免疫荧光图片并统计阳性细胞数量。应用SPSS 18.0统计软件进行方差分析,用Duncan´s法进行多重比较确定各组之间的差异显著性,以P<0.05为差异显著。
2 结果与分析
2.1 MeCP2和GnRH在下丘脑POA的分布 如图1所示,在母羊下丘脑中POA均有MeCP2和GnRH分布,且二者呈现共表达模式。如图2所示,初情期前期和临近初情期下丘脑阳性细胞数差异不显著(P>0.05),初情期阳性细胞数显著低于初情期前期和临近初情期(P<0.05)。
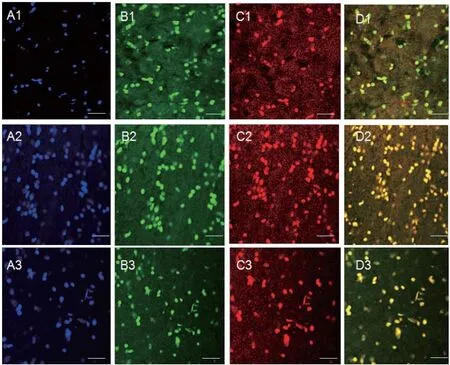
图1 MeCP2和GnRH在下丘脑中POA的分布

图2 母羊初情期启动过程MeCP2与GnRH在下丘脑POA的共表达阳性细胞数
2.2 MeCP2和GnRH在下丘脑ARC的分布 如图3所示,在下丘脑ARC核团中均有MeCP2和GnRH分布,且二者呈现共表达模式。如图4所示,初情期前期和临近初情期阳性细胞数差异不显著(P>0.05),初情期阳性细胞数显著高于初情期前期和临近初情期(P<0.05)。
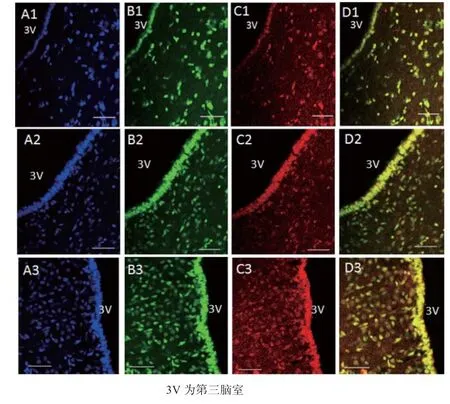
图3 MeCP2和GnRH在下丘脑中ARC的分布
3 讨 论
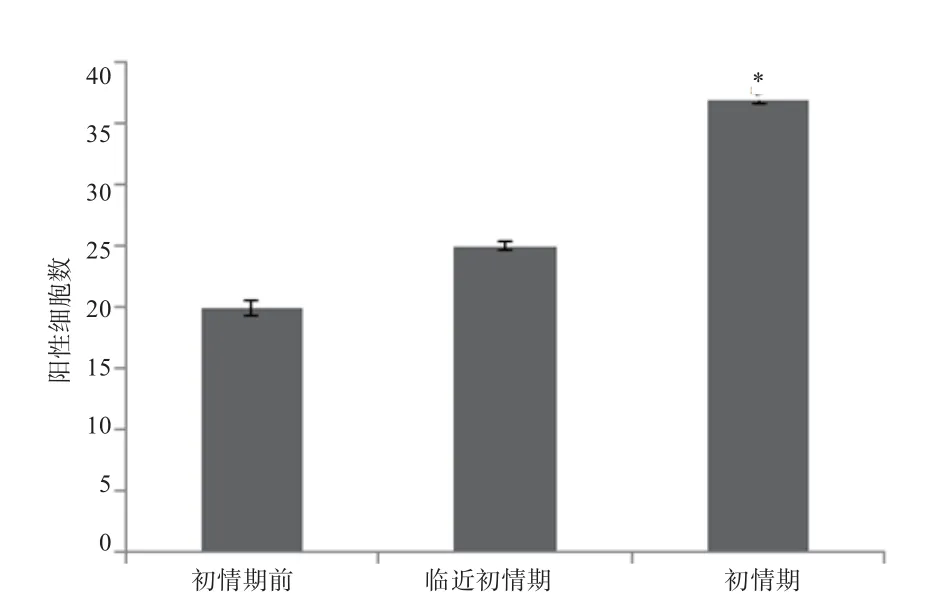
图4 母羊初情期启动过程中MeCP2与GnRH在下丘脑ARC的共表达阳性细胞数
初情期启动受HPG轴的调控,垂体前叶分泌促性腺激素刺激卵泡发育,与此同时,性腺类固醇激素也对下丘脑起到反馈调节作用,调控GnRH分泌[8]。下丘脑中POA和ARC是GnRH神经元主要分布的核团,也是GnRH神经元接受性腺类固醇激素反馈的关键位[9]。最近,有证据显示,DNA甲基化是表观遗传学重要的方式之一,其可调节初情期启动关键基因的表达[10]。MeCP2作为一种重要的表观遗传因子,不仅具备转录抑制功能,而且还能够协同Dnmt1维持基因组的甲基化模式[6],其在初情期启动过程中的作用尚不清楚。本实验发现,MeCP2在下丘脑POA和ARC均有分布,主要分布于母羊下丘脑ARC,其与GnRH存在明显的共表达,且初情期启动时ARC共表达阳性细胞数量显著增多。
GnRH脉冲水平是初情期启动的关键,初情期启动时下丘脑ARC的GnRH表达水平显著上升。本实验发现,母羊初情期时下丘脑GnRH水平显著高于初情期前和临近初情期。目前,有关MeCP2在哺乳类动物下丘脑中分布报道甚少。本研究发现,随着初情期启动,MeCP2和GnRH在ARC和POA呈现共表达模式,且在初情期时ARC核团共表达水平最高。上述证据表明,MeCP2可能通过调节下丘脑GnRH表达水平而参与母羊初情期启动,但要明确MeCP2对母羊初情期启动的作用及机制尚需进一步研究。
4 结 论
本实验结果表明,初情期启动过程中MeCP2在母羊下丘脑POA和ARC核团均有分布,其与GnRH存在共表达模式;随着初情期的到来,MeCP2与GnRH在ARC共表达阳性细胞数显著上升。
[1]Rzeczkowska P A, Hou H, Wilson M D,et al. Epigenetics:a new player in the regulation of mammalian puberty[J].Neuroendocrinology, 2014, 99(3-4): 139-155.
[2]Plant T M. Neuroendocrine control of the onset of puberty[J]. Front Neurondocrin, 2015, 38(7): 73-88.
[3]Kurian J R, Terasawa E. Epigenetic control of gonadotropin releasing hormone neurons[J]. Front Endocrinol, 2013,4(4): 61.
[4]韩威, 李慧芳, 朱云芬, 等. GnRH依赖型性早熟遗传调控系统研究进展[J]. 家畜生态学报, 2013, (1): 1-5.
[5]Chahrour M, Jung S Y, Shaw C,et al. MeCP2, a key contributor to neurological disease, activates and represses transcription[J]. Science, 2008, 320(5880): 1224-1229.
[6]Kimura H, Shiota K. Methyl-CpG-binding protein,MeCP2, is a target molecule for maintenance DNA methyltransferase, Dnmt1[J]. J Biol Chem, 2003, 278(7):4806-4812.
[7]Zhao Y T, Goffin D, Johnson B S,et al. Loss of MeCP2 function is associated with distinct gene expression changes in the striatum[J]. Neurobiol Dis, 2013, 59(11):257-266.
[8]Ojeda S R, Lomniczi A, Sandau U,et al. New concepts on the control of the onset of puberty[J]. Endocr Res, 2010,17: 44-51.
[9]Wankowska M, Polkowska J. Gonadotrophin-releasing hormone and GnRH-associated peptide neurobiology from the rearing period until puberty in the female sheep[J]. J Chem Neuroanat, 2009, 38(1): 9-19.
[10]Zielske S P. Epigenetic DNA methylation in radiation biology: on the field or on the sidelines? [J]. J Cell Biochem, 2014, 116(2): 212-217.
S826.3
A
10.19556/j.0258-7033.2017-12-053
2017-10-09;
2017-10-30
国家自然科学基金(31402073);辽宁省科技厅自然科学基金(2014022050);吉林省教育厅科学技术研究项目(JJKH20170319KJ)
宫永胜(1992-),男,吉林长春人,硕士,主要从事动物生殖调控研究,E-mail:380728795@qq.com
*通讯作者:吕文发,教授,E-mail:wenfa2004@163.com;王军,副教授,E-mail:junwang2004@126.com
