不同配比的亚麻籽油与大豆油混合油全部替代鱼油对杂交鲟生长的影响
2017-12-16刘彩霞李铁梁马志宏李文通
刘彩霞 邢 薇 刘 洋 李铁梁 马志宏 姜 娜 李文通 罗 琳*
(1.北京市水产科学研究所,北京 100068;2.北京京朝花园农业发展中心,北京 100018)
不同配比的亚麻籽油与大豆油混合油全部替代鱼油对杂交鲟生长的影响
刘彩霞1邢 薇1刘 洋2李铁梁1马志宏1姜 娜1李文通1罗 琳1*
(1.北京市水产科学研究所,北京 100068;2.北京京朝花园农业发展中心,北京 100018)
本试验的主要目的是研究用不同配比的亚麻籽油与大豆油混合油全部替代鱼油后对杂交鲟生长性能、肌肉脂肪酸组成及血清肝功能和抗氧化指标的影响。试验共配制4种等氮等脂等能的试验饲料,A组饲料添加8%的鱼油,B、C、D组饲料分别用75%亚麻籽油+25%大豆油的混合油(混合油中亚麻籽油与大豆油的配比为3∶1)、50%亚麻籽油+50%大豆油的混合油(混合油中亚麻籽油与大豆油的配比为1∶1)以及25%亚麻籽油+75%大豆油的混合油(混合油中亚麻籽油与大豆油的配比为1∶3)替代A组饲料中全部鱼油。每种试验饲料投喂3个养殖桶(重复),每个养殖桶放养40尾初始体重为(70.8±0.5) g的杂交鲟,共进行12周的养殖试验。结果表明:B组杂交鲟的末均重(FBW)、增重率(WGR)和特定生长率(SGR)是4组中最高的,且与A组之间存在显著差异(P<0.05)。B组杂交鲟肌肉中粗脂肪含量和肝脏中粗脂肪含量均显著高于A组(P<0.05),而与C、D组差异不显著(P>0.05)。A、B组杂交鲟血清中总抗氧化能力(T-AOC)显著高于C、D组(P<0.05);B组杂交鲟血清中高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的含量最高,并显著高于其他各组(P<0.05);血清甘油三酯(TG)含量以B组最低,显著低于C组(P<0.05),但与A、D组相比差异不显著(P>0.05)。此外,B组杂交鲟肌肉中二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的含量分别为A组对应脂肪酸的65.7%和74.5%,肌肉中EPA和DHA的含量并没有因为混合油替代鱼油而大幅下降。由以上结果得出,以不同配比的亚麻籽油与大豆油的混合油全部替代饲料中的鱼油,当混合油中亚麻籽油与大豆油的配比为3∶1(即75%的亚麻籽油+25%的大豆油)时杂交鲟的生长效果较好。
杂交鲟;鱼油;亚麻籽油;大豆油;生长性能;脂肪酸
脂肪是鱼类所需能量和脂肪酸的重要来源,是运输脂溶性维生素的结构生物膜组分[1]。传统上,鱼油因其适宜的消化率和丰富的多不饱和脂肪酸(PUFA),成为商业鱼饲料中较好的脂肪源[2]。然而,随着水产养殖业的不断扩大,全球用于水产养殖的鱼油消费急剧增加,鱼油供应将不能满足未来的需求[3-4]。因此,在不影响鱼类生长和肉质的前提下为鱼类选择合适的鱼油替代脂肪源是目前研究的热点之一[5-6]。以其他脂肪源部分或全部替代鱼油的研究已经在多种鱼类中得以实现[7-9]。其中,植物油因其来源和价格相对稳定,几乎不含二英和其他有机污染物而在鱼油替代脂肪源中备受欢迎[10-11]。
值得注意的是,亚麻油是所有植物油中亚麻酸含量最为丰富的[18-19],亚麻酸又是淡水鱼合成长链n-3 HUFA(LC-n-3HUFA)的主要来源,而大豆油中富含亚油酸[20],是淡水鱼合成n-6 HUFA的主要来源,因此亚麻油和大豆油均有可能成为鲟饲料中优质的鱼油替代植物脂肪源。但是,有关亚麻油在杂交鲟饲料中的应用研究报道较少。其中,Li等[21]的研究指出,亚麻籽油、葵花籽油和牛油混合油能让俄罗斯鲟保持较好的生长性能和健康状况;而Zhu等[22]的研究表明,从生长性能上看,与亚麻籽油相比,葵花籽油更适合在俄罗斯鲟饲料中替代鱼油使用。
针对目前亚麻油市场价格较高的现状,本研究的主要目的是探讨用不同配比的亚麻油和大豆油混合油全部替代鱼油后对杂交鲟生长的影响,以期找出亚麻油和大豆油的合理配比,为鲟饲料的实际生产提供参考。
1 材料与方法
1.1 饲料配方及制备
以鱼粉为基础,通过添加8%的不同脂肪源,配制4种等氮(38.7%的粗蛋白质)、等脂(13.4%的粗脂肪)等能(180 MJ/kg的总能)的试验饲料。试验饲料中鱼粉和鳀鱼油购自丹麦TripleNine鱼产品有限公司,面粉购自北京古船集团,预混料购自北京英惠尔生物技术有限公司,大豆磷脂购自山东益海嘉里投资有限公司,亚麻籽油购自锡林郭勒盟红井源油脂有限责任公司,大豆油购自福临门食品有限公司。A组饲料中含有8%的鱼油(实际添加物为鳀鱼油),B、C、D组饲料分别用75%亚麻籽油+25%大豆油的混合油(混合油中亚麻籽油与大豆油的配比为3∶1)、50%亚麻籽油+50%大豆油的混合油(混合油中亚麻籽油与大豆油的配比为1∶1)以及25%亚麻籽油+75%大豆油的混合油(混合油中亚麻籽油与大豆油的配比为1∶3)替代A组饲料中全部鱼油。试验饲料组成及营养水平见表1。试验饲料中脂肪酸组成见表2。根据鱼生长过程中大小的变化,饲料通过熟化挤压工艺制成3.0和4.0 mm的2种粒径的沉性膨化颗粒料(膨化机型号MY56X2A,江苏牧羊集团)。所有饲料均在国家淡水饲料安全评价基地加工制得,所有饲料自然风干后用双层塑料袋包装贮存于-20 ℃冰箱保存备用。
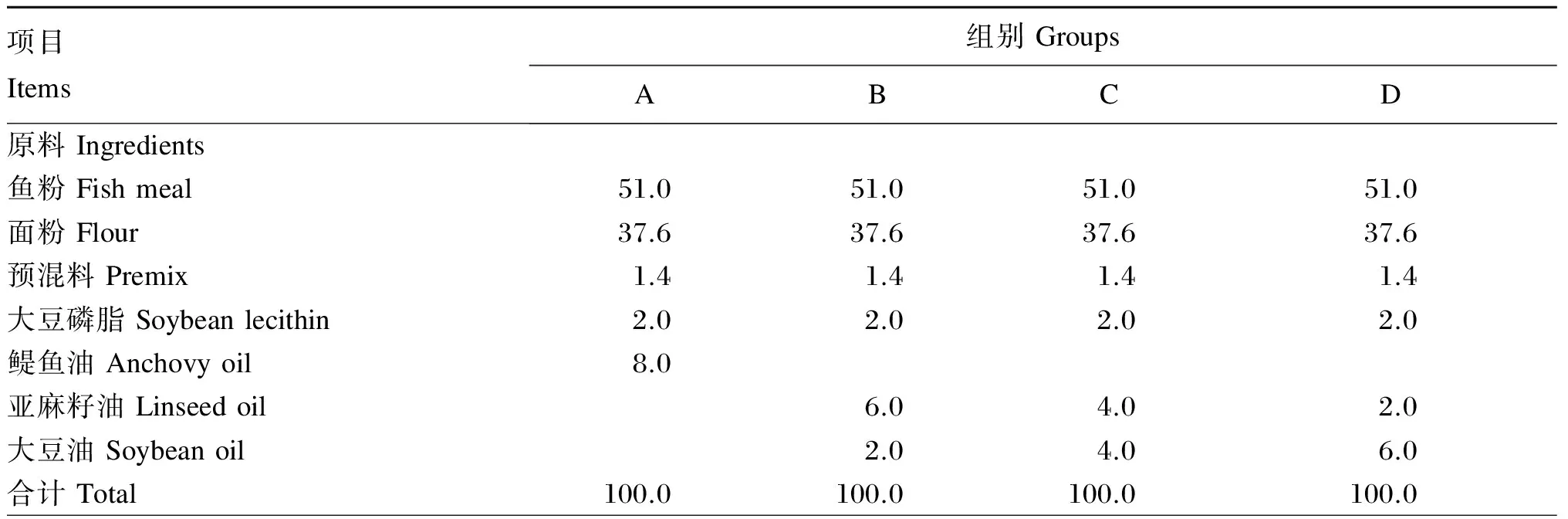
表1 试验饲料组成及营养水平(干物质基础)

续表1项目Items组别GroupsABCD营养水平Nutrientlevels干物质Drymatter90.2690.2890.2490.26粗蛋白质Crudeprotein38.7238.7238.7938.71粗脂肪Crudelipid13.3713.5113.4813.47粗灰分Ash6.386.396.376.38总能Grossenergy/(MJ/kg)180.6181.2180.2180.4
每千克预混料含有Contained the following per kg of premix:VA 600 000 IU,VB1600 mg,VB21 000 mg,VB6800 mg,VB123.0 mg,VC 12 000 mg,VD3200 000 IU,VE 4 000 IU,VK31 000 mg,生物素 biotin 10.0 mg,叶酸 folic acid 200 mg,D-泛酸D-pantothenic acid 2 500 mg,烟酸 nicotinic acid 3 500 mg,Cu (as copper sulfate) 300 mg,Fe (as ferrous sulfate) 10 000 mg,Mn (as manganese sulfate) 1 500 mg,Zn (as zinc sulfate) 3 000 mg,I (as potassium iodide) 70 mg,Se (as sodium selenite) 30 mg,Co (as sodium selenite) 30 mg。
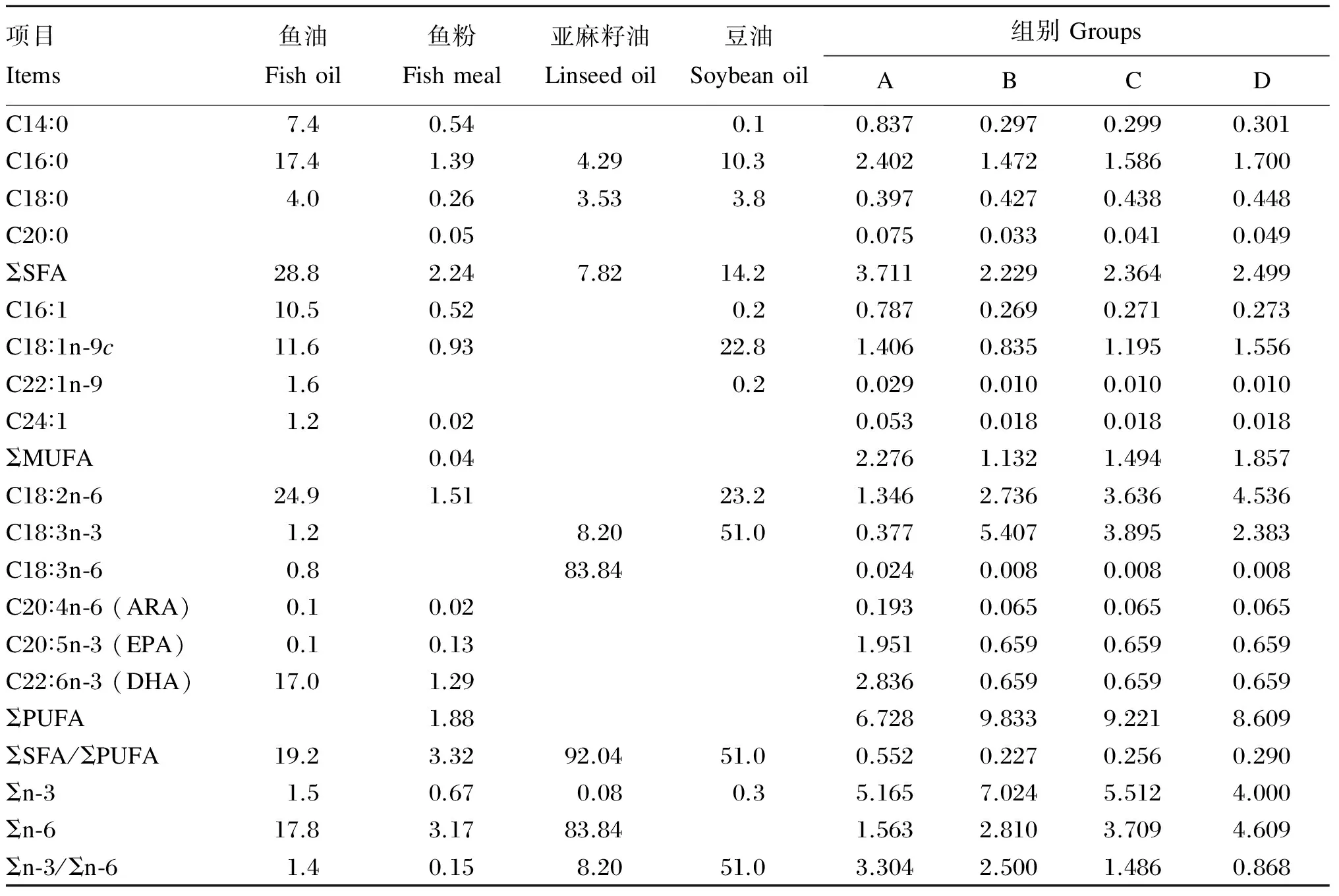
表2 试验饲料中脂肪酸组成 (占总脂肪酸的百分比)
SFA:饱和脂肪酸 saturated fatty acid;MUFA:单不饱和脂肪酸 monounsaturated fatty acid;ARA:花生四烯酸 arachidonic acid;EPA:二十碳五烯酸 eicosapentaenoic acid;DHA:二十二碳六烯酸 docosahexaenoic acid;PUFA:多不饱和脂肪酸 polyunsaturated fatty acid;n-3:n-3多不饱和脂肪酸 n-3 polyunsaturated fatty acid;n-6:n-6多不饱和脂肪酸 n-6 polyunsaturated fatty acid。表7同 The same as Table 7。
1.2 试验鱼及养殖条件
养殖试验在北京京朝花园农业发展中心的工厂化循环水养殖车间进行。试验用鱼为该中心自行繁育的同批次的统一规格西伯利亚杂交鲟。在停食24 h后,将初始体重为(70.8±0.5) g的试验鱼随机分到12个养殖桶(700 L,40尾/桶)中,每种饲料投喂3个养殖桶(重复)的试验鱼。每天饱食投喂3次(09:30、13:30、17:30),养殖周期为12周。在养殖过程中,水温为(20±1) ℃,溶氧浓度在7 mg/L左右,氨氮和亚硝酸盐浓度均低于100.0 μg/L。
1.3 样品采集
12周的养殖试验结束后,所有试验鱼都饥饿48 h以确保血清的脂肪水平维持在基准线上[16],然后分别从每个养殖桶中取3尾鱼进行血液样品的采集。采血时迅速从每个养殖桶中随机取3尾鱼,用0.30 ml/L的三氯叔丁醇麻醉,分别称重后用2 mL的一次性注射器从尾静脉采血,采集的血样放在2.5 mL离心管里,1 500 r/min离心5 min后取血清保存于-80 ℃下用于后续指标的检测分析。采完血后的全鱼取肌肉和肝脏样品,肌肉样品取自体侧背部肌肉,肝脏与肌肉样品也存于-80 ℃下用于后续指标的检测分析。采样结束后,将每个养殖桶中剩余的试验鱼称重记数,用于生长性能指标的计算。
1.4 饲料、肌肉、肝脏营养成分分析
饲料和肌肉均测定水分、粗蛋白质、粗脂肪、粗灰分和各脂肪酸含量;肝脏测定粗脂肪含量。样品在105 ℃烘干6 h至恒重后求得水分含量,然后进行生化组分分析[10]。粗蛋白质含量采用凯氏定氮法测定;粗脂肪含量采用索氏抽提法测定;粗灰分含量采用马弗炉法测定;总能采用弹式热量仪检测;各脂肪酸含量的测定参照Caballero等[5]的方法使用安捷伦6890型气相色谱仪进行。每份样品均重复测定3次。
血清样品用于检测甘油三酯(TG)、总胆固醇(TC)、游离脂肪酸(NEFA)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)以及酮体含量。TG含量采用酶比色法、TC含量采用比色法、HDL-C和LDL-C含量采用均相酶比色法进行检测,所有试剂均由德国罗氏诊断有限公司提供,使用罗氏ROCHE/E601全自动生化分析仪测定。血清酮体和NEFA含量采用南京建成生物工程研究所提供的商用试剂盒,采用日立HITACHI7160自动生化分析仪进行检测。
血清样品还用于检测肝功能和抗氧化指标,肝功能指标包括乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)和谷草转氨酶(AST),抗氧化指标包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、髓过氧化物酶(MPO)和总抗氧化能力(T-AOC)。其中LDH、ALT和AST活性检测所用试剂盒均由德国罗氏诊断有限公司提供;SOD、GSH-Px活性和T-AOC检测所用试剂盒由南京建成生物工程研究所提供,MPO活性检测所用试剂盒由北京华英生物工程研究所提供。这些试剂盒都是通过HITACH 7160型生化分析仪进行检测。
1.5 计算方法
存活率(SR,%)=100×Nf/Ni;增重率(WGR,%)=100×(Wf-Wi)/Wi;特定生长率(SGR,%/d)=100×(lnWf-lnWi)/t;饲料效率(FE,%)=100×(Wf-Wi)/F。
式中:Wi代表初均重;Wf代表末均重;Ni代表桶内初始鱼尾数;Nf代表桶内终末鱼尾数;t表示试验天数;F代表干饲料消耗量。
1.6 统计分析
试验数据采用Statistica 7.0软件进行统计分析,在单因素方差分析(one-way ANOVA)达到显著水平(P<0.05)时,采用Duncan氏法检验组间差异显著性,数据表示为平均值±标准误。取样时间点与不同脂肪源对杂交鲟脂肪代谢的影响采用双因素方差分析(two-way ANOVA)。采用线性回归(linear regression)和皮尔逊相关系数(Pearson correlation)进行饲料与肌肉脂肪酸组成的相关性分析,当R2>0.5时表示显著相关。
2 结 果
2.1 不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟生长性能的影响
用不同配比的亚麻籽油和大豆油混合后替代饲料中的全部鱼油饲喂杂交鲟,12周后其生长性能指标详见表3。其中,B组杂交鲟的末均重、WGR和SGR均显著高于A、C组(P<0.05),但与D组杂交鲟相比差异不显著(P>0.05);不同配比的亚麻籽油和大豆油混合油全部替代鱼油显著升高了杂交鲟的FE(P<0.05),但混合油中亚麻籽油和大豆油的配比没有对杂交鲟的FE产生显著影响(P>0.05);各组杂交鲟在养殖试验期间没有死亡,SR均为100%。

表3 投喂不同饲料的杂交鲟的生长性能
同行数据肩标相同或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with the same small or no letter superscripts were not significantly different(P>0.05), while with different small letter superscripts were significantly different (P<0.05).The same as below.
2.2 不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟肌肉营养成分及肝脏在粗脂肪含量的影响
表4显示了投喂不同饲料的杂交鲟的肌肉营养成分分析结果与肝脏中粗脂肪含量。其中,A组杂交鲟肌肉中水分含量显著高于其他组(P<0.05);B、D组杂交鲟肌肉中粗蛋白质含量显著高于A组(P<0.05),但B、C、D组之间没有显著差异(P>0.05);A组肌肉中粗脂肪含量和肝脏中粗脂肪含量均显著低于其他组(P<0.05);A组肌肉中粗灰分含量高于B、C、D组,且与B和D组的差异达到显著水平(P<0.05),B、C、D组之间没有显著差异(P>0.05)。
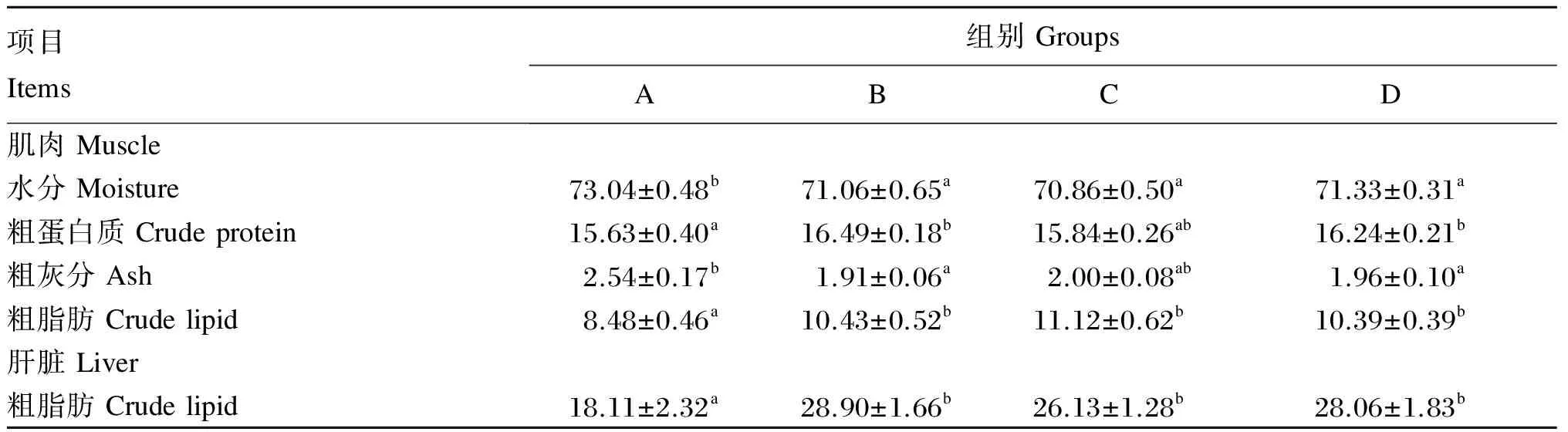
表4 投喂不同饲料的杂交鲟的肌肉营养成分和肝脏中粗脂肪含量
2.3 不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟血清肝功能和抗氧化指标的影响
从表5中可以看出,不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟的血清肝功能指标(LDH、ALT和AST活性)没有产生显著影响(P>0.05),对部分血清抗氧化指标(SOD、GSH-Px和MPO活性)也没有产生显著影响(P>0.05)。B组杂交鲟的血清T-AOC显著高于C、D组(P<0.05),而与A组差异不显著(P>0.05)。
2.4 不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟血清脂肪代谢指标的影响
从表6中可以看出,B组杂交鲟血清中TG含量最低,显著低于C组(P<0.05),但与A、D组相比差异不显著(P>0.05)。C组杂交鲟血清中NEFA的含量最低,与A、B组差异显著(P<0.05)。B组杂交鲟血清中HDL-C与LDL-C的含量显著高于其他3组(P<0.05)。不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟血清中TC和酮体含量没有产生显著影响(P>0.05)。

表5 投喂不同饲料的杂交鲟的血清肝功能和抗氧化指标
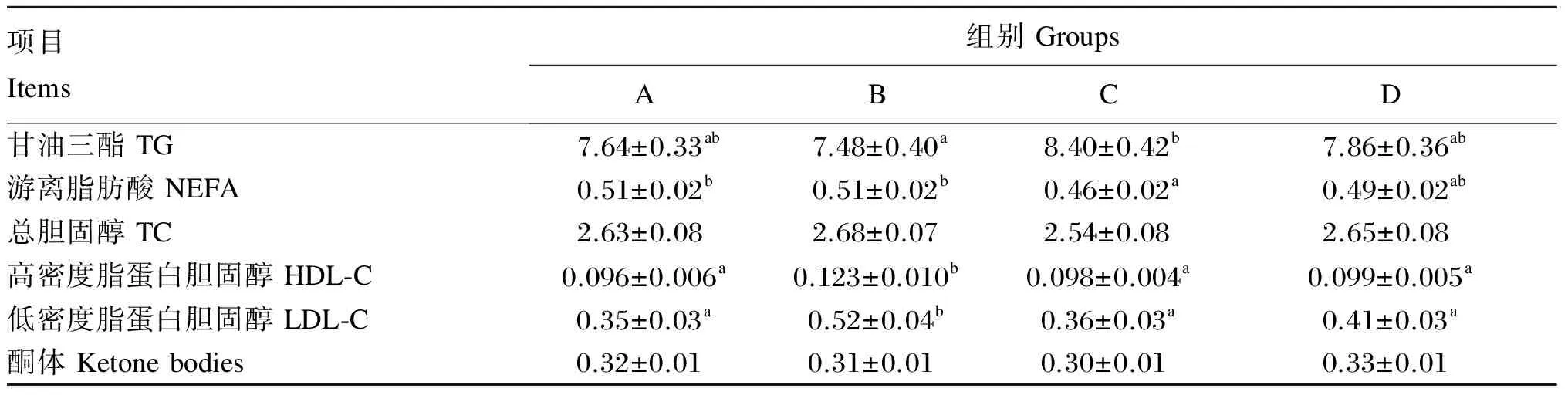
表6 投喂不同饲料的杂交鲟的血清脂肪代谢指标
2.5 不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟肌肉脂肪酸组成的影响
投喂不同饲料的杂交鲟的肌肉脂肪酸组成见表7。其中,不同配比的亚麻籽油和大豆油混合油全部替代鱼油对杂交鲟肌肉中总饱和脂肪酸(SFA)含量没有产生显著影响(P>0.05);杂交鲟肌肉中总单不饱和脂肪酸(MUFA)含量以A组最低,且显著低于C组(P<0.05);A组中杂交鲟肌肉中总PUFA含量显著低于其他各组(P<0.05),而EPA和DHA含量则显著高于其他各组(P<0.05)。表8显示,肌肉中亚油酸、亚麻酸、总n-3 PUFA、总n-6 PUFA含量以及n-3/n-6 PUFA与试验饲料中对应脂肪酸的含量表现出显著的线性相关。投喂A组饲料的杂交鲟,其肌肉中亚油酸和亚麻酸的含量在4组中是最低的,并且显著低于其他各组(P<0.05)(表7)。肌肉中亚油酸和亚麻酸的含量分别随着试验饲料中大豆油和亚麻籽油添加量的增加而显著增加(P<0.05)。同时,杂交鲟肌肉中总n-6 PUFA含量同样随着试验饲料中大豆油添加量的增加而显著增加(P<0.05)。
3 讨 论
本试验所有组中100%的存活率与快速生长的态势表明杂交鲟幼鱼对替代脂肪源表现出了良好的适应性,用不含鱼油的饲料饲喂的杂交鲟和用全鱼油的A组饲料饲喂的杂交鲟相比有着相同(C和D组饲料)甚至更好(B组饲料)的生长性能。研究显示,尽管EPA与DHA的含量相同,但是饲料中n-3/n-6 PUFA的不同对鱼类生长产生的影响也是不同的。比如,食用低比例的n-3/n-6 PUFA比食用高比例的n-3/n-6 PUFA的动物更容易发生炎症反应[23]和形成动脉粥样硬化板块[24]。ener等[15]用含有不同脂肪源(鱼油、大豆油和葵花籽油)的饲料投喂俄罗斯鲟后发现,俄罗斯鲟能够很好地利用豆油和葵花籽油;Xu等[14]用不同的脂肪源(包括亚麻籽油、大豆油、葵花籽油和玉米油)替代饲料中的鱼油饲喂高首鲟(Acipensertransmontanus)后也发现高首鲟能够很好地利用植物油源。在本试验中,随着饲料中亚麻籽油添加量的降低,C、D组杂交鲟的末均重、SGR和FE都低于B组,考虑到4种饲料配方中脂肪酸组成是唯一的变量,因此这种生长上的差异可能就是因为饲料中n-3/n-6 PUFA的不同造成的。和其他脊椎动物一样,鲟自身不能合成18碳PUFA,因此需要从食物中摄取n-6系列的亚油酸和n-3系列的亚麻酸用于生长和繁殖[25-26]。Li等[27]的研究指出,在俄罗斯鲟生长过程中对亚油酸和亚麻酸都有需求,而且当亚油酸和亚麻酸的添加量均为1.00%时,俄罗斯鲟的生长性能优于其添加量均为0.25%和0.50%时,其原因可能是由于1.00%的添加量更适宜俄罗斯鲟的生长。本试验中B组杂交鲟的生长性能优于其他3组的原因可能也是因为B组饲料中亚油酸和亚麻酸的配比和添加量更适宜杂交鲟的生长需求。

表8 肌肉中部分脂肪酸含量与饲料中对应脂肪酸含量的相关系数(R2)与P值
此外,本研究发现,杂交鲟的肌肉营养成分和肝脏中粗脂肪含量都因亚麻籽油和大豆油的添加而产生了显著变化。3个鱼油替代组(B、C、D组)肌肉中粗脂肪含量和肝脏中粗脂肪含量均显著高于鱼油对照组(A组),3个鱼油替代组中脂肪沉积的原因可能是饲料中的n-6 PUFA含量较高所致[28]。Turchini等[29]研究发现,用富含n-6 PUFA的菜籽油饲料投喂棕鳟后肌肉中的粗脂肪含量显著高于鱼油对照组。在本研究中,随着混合油中大豆油比例的增加,饲料中n-6 PUFA的含量逐渐升高(表2),这可能就是造成肌肉和肝脏中脂肪沉积的原因之一。
LDH、ALT和AST在肝脏脂肪代谢中起着重要的作用,它们是肝脏受损程度的重要指标[30],三者活性的显著升高表明了由于细胞损伤而导致的肝脏变性和坏死[31]。本研究结果显示,尽管B、C、D组杂交鲟的肝脏粗脂肪含量显著高于A组,饲料中脂肪源的改变确实引起了脂肪在肌肉和肝脏中的沉积,但是这3组杂交鲟血清的LDH、ALT和AST的活性与A组相比并没有产生显著性差异(表5),也就是说3种肝脏代谢酶的活性没有受到饲料不同脂肪源的影响,说明这种脂肪沉积在3个月的投喂周期中并没有对肝脏造成实质性的损伤,而长期的影响效果还需要进一步试验的验证。
HUFA,如EPA和DHA,可以抑制内源性胆固醇和TG的合成,增加脂蛋白脂酶的活性,促进周围组织对极低密度脂蛋白的清除,降低血清中TG、胆固醇和低密度脂蛋白的含量,提高高密度脂蛋白的含量。此外,抗氧化能力可以通过测定组织匀浆中T-AOC来衡量,而不用通过漫长的变化过程确定抗氧化系统中每个组分的变化[32]。对鱼类而言,T-AOC能够反映其抗氧化能力并且与其健康状况密切相关。Liu等[33]的研究指出,HUFA的存在抑制了活性氧产物的增加,提高了血清SOD活性、GSH含量和T-AOC,进而抑制了血清丙二醛(MDA)的产生。因此,LC-n-3HUFA含量的增加诱导氧化环境发生了改变。本研究中,投喂B组饲料的杂交鲟血清T-AOC显著高于C、D组,可能是B组饲料中LC-n-3HUFA含量适当造成的(表2),这与之前的研究结果[34]相一致,即LC-n-3HUFA含量的增加降低了活性氧的产生。
大量研究表明,饲料中的HUFA,特别是DHA和EPA,对降低血清胆固醇和抑制体内TG的合成具有显著的促进作用[35-36],而亚麻酸作为EPA和DHA的前体物质对降低TG有着显著效果[37-38]。在本研究中,B组杂交鲟血清中TG的含量与A组之间无显著差异,但比C和D组杂交鲟血清中TG的含量低,这是因为在饲料中EPA和DHA含量相当的前提下,B组饲料中的高亚麻酸含量在降低TG方面起到了关键的作用。此外,研究指出,高含量的低密度脂蛋白可能会加重血管和组织的负担[39]。本研究中,B组杂交鲟血清中不仅HDL-C含量增加,LDL-C的含量也显著升高,原因是高含量的低密度脂蛋白与脂酰辅酶A有关。胆固醇酰基转移酶(ACAT)是重要的肝酶,优先利用不饱和脂肪酸而非饱和脂肪酸作为底物,将自由胆固醇酯化为胆固醇酯。因此,富含不饱和脂肪酸的B组饲料增加了ACAT的活性,更多的胆固醇酯被运送给低密度脂蛋白微粒,从而提高了血清LDL-C的含量。Huang等[40]在史氏鲟的研究中同样指出血清中LDL-C含量在菜籽油组中显著高于鱼油组,并推测产生该结果的原因可能与饲料中脂肪酸的种类和含量有关。
血清中NEFA是脊椎动物血液中最重要的脂质动力代谢部分,反映了能量代谢中脂质的重要性,因为NEFA在血液中的运输有助于维持组织中脂肪酸的氧化[41]。研究显示,从脂肪储备中优先调动的脂肪酸取决于碳链长度、不饱和程度和位置异构[42-43]。其中,饱和脂肪酸各部分的周转率在整个有机水平上是稳定的并准确地反映了总NEFA的周转率;相反的是,长链PUFA呈现出了一种不同的动力学行为[44]。因此,饱和脂肪酸含量越高,总NEFA的周转率越低。在本试验中,饲喂A组饲料的杂交鲟,其血清中NEFA含量最高(表6),原因可能是A组饲料中的饱和脂肪酸含量偏高(表2)。
本研究结果显示,杂交鲟肌肉中脂肪酸组成明显受饲料中脂肪酸组成的影响,特别是亚麻酸和亚油酸(表7)。相关报道也指出,饲料中任何脂肪源的替代在一定程度上都会体现在鱼体脂肪酸组成上,以反映饲料脂肪来源[4,45-46]。本研究中,饲料中脂肪源为亚麻籽油和大豆油,它们分别富含亚麻酸和亚油酸(表2),所以,肌肉中亚麻酸和亚油酸含量与饲料中亚麻酸和亚油酸的含量呈正相关关系(表8)也是合理的。此外,与A组相比,B组杂交鲟肌肉中EPA和DHA含量分别高达70.3%和77.3%,这进一步说明杂交鲟能够将亚麻酸和亚油酸转化成相应的长链n-3和n-6 PUFA[47]。因此,把亚麻籽油作为鱼饲料中的鱼油的一个优良替代品而不会影响鱼的生长性能是可行的[4,48]。
4 结 论
本试验中,以不同配比的亚麻籽油与大豆油的混合油全部替代饲料中的鱼油,当混合油中亚麻籽油与大豆油的配比为3∶1(即75%的亚麻籽油+25%的大豆油)时,杂交鲟的生长效果较好。
致谢:
感谢北京京朝花园农业发展中心于凤翔先生为本试验开展过程中提供的帮助。
[1] HIGGS D A,DONG F M.Lipids and fatty acids[C]//STICKNEY R R.The encyclopedia of aquaculture.New York:John Wiley and Sons,2000:476-496.
[2] MONTERO D,LOPEZ-BOTE C J,BAUTISTA J M,et al.Growth,digestibility and fatty acid utilization in large Atlantic salmon (Salmosalar) fed varying levels of n-3 and saturated fatty acids[J].Aquaculture,2003,225(1/2/3/4):295-307.
[3] TURCHINI G M,TORSTENSEN B E,NG W K.Fish oil replacement in finfish nutrition[J].Reviews in Aquaculture,2009,1(1):10-57.
[4] TACON A G J,METIAN M.Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds:trends and future prospects[J].Aquaculture,2008,285(1/2/3/4):146-158.
[5] CABALLERO M J,OBACH A,ROSENLUND G,et al.Impact of different dietary lipid sources on growth,lipid digestibility,tissue fatty acid composition and histology of rainbow trout,Oncorhynchusmykiss[J].Aquaculture,2002,214(1/2/3/4):253-271.
[6] NG W K,LIM P K,BOEY P L.Dietary lipid and palm oil source affects growth,fatty acid composition and muscle a-tocopherol concentration of African catfish,Clariasgariepinus[J].Aquaculture,2003,215(1/2/3/4):229-243.
[7] REGOST C,ARZEL J,CARDINAL M,et al.Total replacement of fish oil by soybean or linseed oil with a return to fish oil in turbot (Psettamaxima):2.Flesh quality properties[J].Aquaculture,2003,220(1/2/3/4):737-747.
[8] MONTERO D,ROBAINA L,CABALLERO M J,et al.Growth,feed utilization and flesh quality of European sea bass (Dicentrarchuslabrax) fed diets containing vegetable oils:a time-course study on the effect of a re-feeding period with a 100% fish oil diet[J].Aquaculture,2005,248(1/2/3/4):121-134.
[9] MOURENTE G,DICK J R,BELL J G,et al.Effect of partial substitution of dietary fish oil by vegetable oils on desaturation and β-oxidation of [1-14C]18∶3n-3 (LNA) and [1-14C] 20∶5n-3 (EPA) in hepatocytes and enterocytes of European sea bass (DicentrarchuslabraxL.)[J].Aquaculture,2005,248(1/2/3/4):173-186.
[10] IZQUIERDO M S,OBACH A,ARANTZAMENDI L,et al.Dietarylipid sources for seabream and seabass:growth performance,tissue composition and flesh quality[J].Aquaculture Nutrition,2003,9(6):397-407.
[11] FIGUEIREDO-SILVA A,ROCHA E,DIAS J,et al.Partial replacement of fish oil by soybean oil on lipid distribution and liver histology in European sea bass (Dicentrarchuslabrax) and rainbow trout (Oncorhynchusmykiss) juveniles[J].Aquaculture Nutrition,2005,11(2):147-155.
[12] VACCARO A M,BUFFA G,MESSINA C M,et al.Fatty acid composition of a cultured sturgeon hybrid,Acipensernaccarii×Acipenserbaerii[J].Food Chemistry,2005,93(4):627-631.
[13] KAYA Y,TURAN H,ERDEM M E.Fatty acid and amino acid composition of raw and hot smoked sturgeon (Husohuso,L.1758)[J].International Journal of Food Science and Nutrition,2007,59(7/8):635-642.
[14] XU R P,HUNG S S O,GERMAN J B.White sturgeon tissue fatty acid compositions are affected by dietary lipids[J].The Journal of Nutrition,1993,123(10):1685-1692.
[17] OPSAHL-FERSTAD H G,RUDI H,RUYTER B,et al.Biotechnological approaches to modify rapeseed oil composition for applications in aquaculture[J].Plant Science,2003,165(2):349-357.
[18] CASTELL J D,LEE D J,SINNHUBER R O.Essential fatty acids in the diet of rainbow trout (Salmogairdneri):lipid metabolism and fatty acid composition[J].The Journal of Nutrition,1972,102(1):93-99.
[19] TAKEUCHI T,WATANABE T.Requirement of carp for essential fatty acids[J].Bulletin of the Japanese Society for the Science of Fish,1977,43(5):541-551.
[20] KANAZAWA A,TESHIMA S I,SAKAMOTO M,et al.Requirements ofTilapiazilliifor essential fatty acids[J].Bulletin of the Japanese Society for the Science of Fish,1980,46(11):1353-1356.
[21] LI Q,ZHU H Y,WEI J J,et al.Effects of dietary lipid sources on growth performance,lipid metabolism and antioxidant status of juvenile Russian sturgeonAcipensergueldenstaedtii[J].Aquaculture Nutrition,2016,23(3):500-510.
[22] ZHU H Y,LI Q,WANG H W,et al.Growth,fatty acid composition and lipid deposition of Russian sturgeon (Acipensergueldenstaedtii) fed different lipid sources[J].Aquaculture Research,2016,48(9):5126-5132.
[23] YU M,GAO Q Q,WANG Y,et al.Unbalanced omega-6/omega-3 ratio in red meat products in China[J].The Journal of Biomedical Research,2013,27(5):366-371.
[24] YAMASHITA T,ODA E,SANO T,et al.Varying the ratio of dietary n-6/n-3 polyunsaturated fatty acid alters the tendency to thrombosis and progress of atherosclerosis inapoE-/-LDLR-/-double knockout mouse[J].Thrombsis Research,2005,116(5):393-401.
[25] CHOU B S,SHIAU S Y.Both n-6 and n-3 fatty acids are required for maximal growth of juvenile hybrid tilapia[J].North American Journal of Aquaculture,1999,61(1):13-20.
[27] LI Q,ZHU H Y,LI E C,et al.Growth performance,lipid requirement and antioxidant capacity of juvenile Russian sturgeonAcipensergueldenstaedtifed various levels of linoleic and linolenic acids[J].Aquaculture Research,2017,48(6):3216-3229.
[28] DENG D F,HUNG S S O,CONKLIN D E.White sturgeon (Acipencertransmontanus) require both n-3 and n-6 fatty acids[J]. Aquaculture,1998,161:333-335.
[29] TURCHINI G M,MENTASTI T,FRØYLAND L,et al.Effects of alternative dietary lipid sources on performance,tissue chemical composition,mitochondrial fatty acid oxidation capabilities and sensory characteristics in brown trout (SalmotruttaL.)[J].Aquaculture,2003,225(1/2/3/4):251-267.
[30] TORCHINSKY Y M.Transamination:its discovery,biological and chemical aspects (1937—1987)[J].Trends in Biochemical Science,1987,12:115-117.
[31] BHARDWAJ S,SRIVASTAVA M K,KAPOOR U,et al.A 90 days oral toxicity of imidacloprid in female rats:morphological,biochemical and histopathological evaluations[J].Food and Chemical Toxicology,2010,48(5):1185-1190.
[32] WINSTON G W,REGOLI F,DUGAS A J,Jr,et al.A Rapid gas chromatographic assay for determining oxyradical scavenging capacity of antioxidants and biological fluids[J].Free Radical Biology and Medicine,1998,24(3):480-493.
[33] LIU L,HU Q L,WU H H,et al.Protective role of n6/n3 PUFA supplementation with varying DHA/EPA ratios against atherosclerosis in mice[J].Journal of Nutritional Biochemistry,2016,32:171-180.
[34] MÉNDEZ L,PAZOS M,GALLARDO J M,et al.Reduced protein oxidation in Wistar rats supplemented with marine ω3 PUFAs[J].Free Radical Biology and Medicine,2013,55:8-20.
[35] NAKAGAWA H.Classification of albumin and globulin in yellow tail plasma[J].Nippon Suisan Gakkaishi,1978,44(3):251-257.
[36] DAVIDSON M H.Mechanisms for the hypotriglyceridemic effect of marine omega-3 fatty acids[J].The American Journal of Cardiology,2006,98(4):27-33.
[37] SHEARER G C,SAVINOVA O V,HARRIS W S.Fish oil—how does it reduce plasma triglycerides[J].Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids,2012,1821(5):843-851.
[38] JEFFERY N M,SANDERSON P,SHERRINGTON E J,et al.The ratio of n-6 to n-3 polyunsaturated fatty acids in the rat diet alters serum lipid levels and lymphocyte functions[J].Lipids,1996,31(7):737-745.
[39] 杨蕊,SHIN J S,刘玉海,等.饲粮中添加微藻DHA和ALA对蛋黄脂肪酸构成及蛋黄胆固醇、三酰甘油的影响[J].科学实验与研究,2014(21):11-14,64.
[40] KODAMA K,SASAKI H,SHIMIZU Y.Trend of coronary heart disease and its relationship to risk factors in a Japanese population: a 26-year follow-up, Hiroshima/Nagasaki study[J].Circulation Journal,1990,54:414-421.
[41] HUANG F,JIANG M,WEN H,et al.Effects of different dietary lipid sources on growth performance,tissue fatty acid composition and serum lipid indices of juvenile Amur sturgeon,AcipenserschrenckiiBrandt,1869[J].Applied Ichthyology,2014,30(6):1602-1608.
[42] HENDERSON R J,TOCHER D R.The lipid composition and biochemistry of freshwater fish[J].Progress in Lipid Research,1987,26(4):281-347.
[43] RACLOT T,GROSCOLAS R.Differential mobilization of white adipose tissue fatty acids according to chain length,unsaturation,and positional isomerism[J].Lipid Research,1993,34:1515-1526.
[44] RACLOT T,MIOSKOWSKI E,BACH A C,et al.Selectivity of fatty acid mobilization:a general metabolic feature of adipose tissue[J].American Journal of Physiology:Regulatory,1995,269(5):R1060-R1067.
[45] HAGENFELDT L.Turnover of individual free fatty acids in man[J].Federation Proceedings,1975,34(13):2236-2240.
[46] GLENCROSS B D.Exploring the nutritional demand for essential fatty acids by aquaculture species[J].Reviews in Aquaculture,2009,1(2):71-124.
[47] BELL M V,HENDERSON R J,SARGENT J R.The role of polyunsaturated fatty acids in fish.Comp[J].Comparative Biochemistry & Physiology B:Comparative Biochemistry,1986,83(4):711-719.
[48] TURCHINI G M,FRANCIS D S.Fatty acid metabolism (desaturation,elongation and β-oxidation) in rainbow trout fed fish oil-or linseed oil-based diets[J].The British Journal of Nutrition,2009,102(1):69-81.
LIU Caixia1XING Wei1LIU Yang2LI Tieliang1MA Zhihong1JIANG Na1LI Wentong1LUO Lin1*
(1.BeijingFisheriesResearchInstitute,Beijing100068,China; 2.BeijingChaoyangHatcheryandAquacultureFarm,Beijing100018,China)
10.3969/j.issn.1006-267x.2017.12.019
S963
A
1006-267X(2017)12-4386-12
2017-06-02
北京市鲟鱼、鲑鳟创新团队(SCGWZJ 20161103-2)
刘彩霞(1989—),女,河北石家庄人,硕士研究生,研究方向为动物资源开发与功能食品。E-mail: liucxmm@163.com
*通信作者:罗 琳,研究员,E-mail: luo_lin666@sina.com
*Corresponding author, professor, E-mail: luo_lin666@sina.com
(责任编辑 菅景颖)
