2013至2015年血流感染大肠埃希菌耐药性监测
2017-12-15陈燕罗欲承
陈燕 罗欲承
·药物研究·
2013至2015年血流感染大肠埃希菌耐药性监测
陈燕 罗欲承
目的了解2013至2015年血培养分离的血流感染大肠埃希菌的临床分布与耐药性。方法共分离48株血流感染大肠埃希菌。采用 VITEK 2 Compact 系统进行药敏试验,药敏试验结果按 2016 年版 CLSI 标准进行回顾判读,使用 WHONET 5.6 软件进行数据分析。结果48 株大肠埃希菌主要分离自内科(52%)。大肠埃希菌对亚胺培南的敏感率最高(100%),其次为厄他培南(95.8%)、阿米卡星(93.8%)和哌拉西林/他唑巴坦(89.6%);对氨苄西林的耐药率最高(87.5%),其次为复方新诺明(72.9%)和头孢唑啉(72.9%)。结论江苏省兴化市中医院分离的血流感染大肠埃希菌对氨苄西林、复方新诺明和头孢唑啉呈高度耐药,对部分抗菌药物的耐药率与文献报道的数据存在一定差异。
大肠埃希菌;抗菌药物;耐药;血流感染
血流感染(bloodstream infections,BSl)指病原微生物在机体循环血液中短暂、间歇或持续存在,可对所有器官造成损害,是引起患者休克、多器官衰竭和急性死亡的原因之一;近年来随着广谱抗菌药物及各种侵入性操作的广泛应用,大大增加了血流感染的发生率。大肠埃希菌(Escherichia coli)又名大肠杆菌,是最为常见的血流感染病原菌之一[1,2]。定期监测本地区常见血流感染分离菌种的耐药现状,在细菌耐药性防范中起着至关重要的作用。现将江苏省兴化市中医院2013至2015年经血培养分离的血流感染大肠埃希菌对抗菌药物的耐药性监测结果报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株来源:江苏省兴化市中医院2013年1月1日至2015年12月31日经血培养分离的大肠埃希菌株(剔除同一患者相同部位来源的重复菌株)48 株。
1.1.2 抗菌药物:抗菌药物采用 VITEK 2 Compact AST-GN 16 药敏卡。
1.2 方法
1.2.1 血培养:按《全国临床检验操作规程(第4版)》要求采集有适应证的患者血液标本于血培养瓶中,放入 BacT/Alert 3D 血培养仪进行培养,待血培养仪报警提示有细菌生长时取出于血培养瓶,转种于血平板、巧克力平板和麦康凯平板,置于35℃ CO2温箱中孵育18~24 h。
1.2.2 菌株鉴定及药敏试验:采用 VITEK 2 Compact系统进行菌株鉴定和药敏试验。质控菌株为大肠埃希菌 ATCC®25922TM和铜绿假单胞菌ATCC®27853TM。
1.3 判定标准 药敏结果按 2016 年版美国临床实验室标准协会(clinical and laboratory standards institute,CLSI)标准进行回顾判读,对亚胺培南、厄他培南任一碳青霉烯类抗菌药物药敏结果为中介或耐药即判定为碳青霉烯类不敏感菌株。
2 结果
2.1 科室分布 48 株血流感染大肠埃希菌主要分离自内科 25 株(52.1%),其次为外科 7 株(14.6%)、血液/肿瘤科 4 株(8.3%)、ICU 3 株(6.3%)、感染科 2 株(4.2%)、妇产科 2 株(4.2%)、儿科 2 株(4.2%)。见表1。

表1 血流感染大肠埃希菌的科室分布 n=48
2.2 年龄分布 48 株血流感染大肠埃希菌主要分离自成年人(15~64岁,23株,47.9%),其次为老年人(≥65岁,22株,45.8%)、儿童(≤14岁,3株,6.3%)。
2.3 血流感染大肠埃希菌对抗菌药物的药敏试验结果 48 株血流感染大肠埃希菌对亚胺培南的敏感率最高(100%),其次为厄他培南(95.8%)、阿米卡星(93.8%)和哌拉西林/他唑巴坦(89.6%);对氨苄西林的耐药率最高(87.5%),其次为复方新诺明(72.9%)和头孢唑啉(72.9%),筛选出 2 株(4.2%)碳青霉烯类不敏感菌株。见表2。
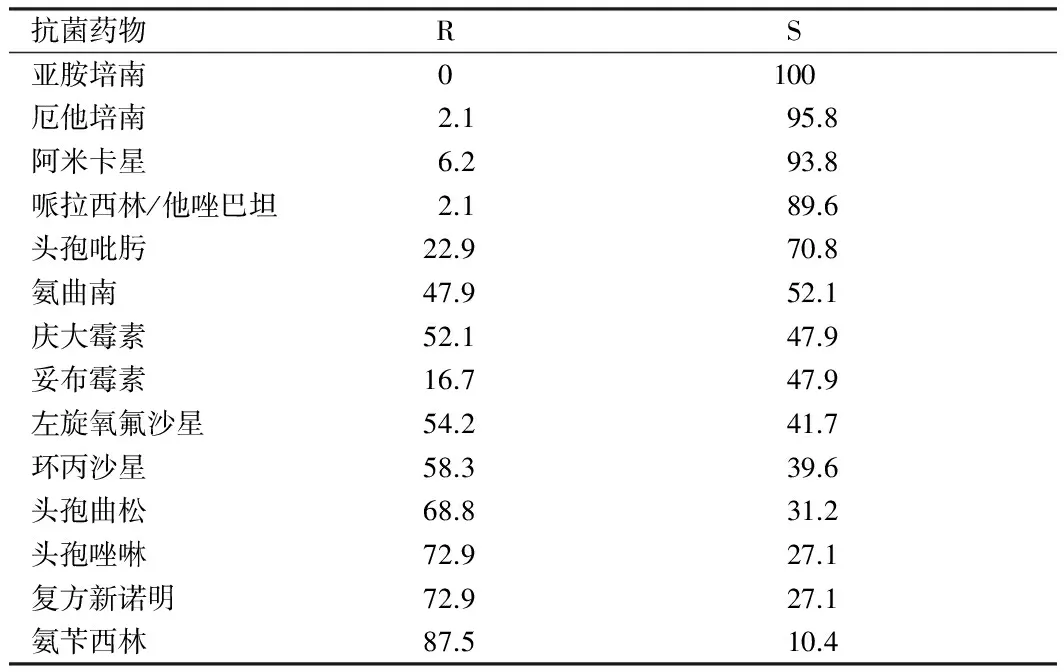
表2 血流感染大肠埃希菌对抗菌药物的耐药率和敏感率 n=48,%
2.4 产ESBLs的大肠埃希菌与不产 ESBLs 的大肠埃希菌对抗菌药物的耐药率 48 株血流感染大肠埃希菌中,检出 2 株(4.2%)碳青霉烯类不敏感大肠埃希菌,分别分离自血液科和 ICU 患者。未检出泛耐药大肠埃希菌(指对所测抗菌药物全部耐药的菌株)。检出 31 株(64.6%)产超广谱 β-内酰胺酶(ESBLs)大肠埃希菌。产 ESBLs 菌株对复方新诺明、喹诺酮类、氨基糖苷类抗菌药物的耐药率亦明显高于不产 ESBLs 菌株。见表3。

表3 产ESBLs的大肠埃希菌与不产 ESBLs 的大肠埃希菌对抗菌药物的耐药率 %
3 讨论
大肠埃希菌是临床分离的革兰阴性杆菌中最为常见的菌种之一[3],常见于泌尿系统感染,还可见于胆囊炎、肺炎、腹腔感染、大面积灼伤创面感染等,该菌亦是血流感染革兰阴性杆菌中最常见的病原菌[4-11]。
本研究中,我院临床分离的 48 株血流感染大肠埃希菌主要分离自内科(52.1%),与王菊梅[12]的报道不同。48株大肠埃希菌对亚胺培南的敏感率最高(100%),与李娟等[7,12,13]的报道一致;对厄他培南的敏感率(95.8%)与熊中政等[9]的报道基本一致;对阿米卡星的敏感率(93.8%)与燕成岭等[1,9,12]的报道基本一致,高于李娟等[7]的报道;对哌拉西林/他唑巴坦的敏感率(89.6%)高于燕成岭等[1]的报道,低于熊中政等[9,12]的报道,与李娟等[7]的报道基本一致;对氨苄西林的耐药率最高(87.5%),与沈振华等[1,7,9,11]的报道基本一致;对复方新诺明的耐药率(72.9%)高于振华等[9,11,12]的报道,与燕成岭等[1,6,7]的报道基本一致;对头孢唑啉的耐药率(72.9%)与沈振华等[6,11,13]的报道一致,高于燕成岭等[1,12]的报道。筛选出 2 株(4.2%)对碳青霉烯类不敏感菌株,这 2 株均对厄他培南不敏感同时对亚胺培南敏感,与邹颖等[14]的报道相似;对碳青霉烯类的耐药率(2.1%)与 2015 年全国细菌耐药监测报告中江苏地区的数据(2.2%,所有标本类型)[3]基本一致。
产 ESBLs 大肠埃希菌(31 株,64.6%)的检出率低于 Mohnarin 2011至2012 年度[2]的报道,高于艾根伟[4,6,8,12,13,15-17]的报道;产 ESBLs 菌株对复方新诺明、喹诺酮类、氨基糖苷类抗菌药物的耐药率明显高于不产 ESBLs 菌株,与王菊梅等[4,12,13]的报道一致。
总之,某院血流感染大肠埃希菌的耐药谱与文献报道存在一定差异。应做好本地区血流感染病原菌的流行病学调查和细菌耐药性监测,根据本地区监测结果合理使用抗菌药物,从而有效降低细菌耐药性的产生。
1 燕成岭,韩艳秋.血流感染病人的病原菌研究分析.内蒙古医科大学学报,2016,3:210-214,219.
2 吕媛,李耘,薛峰,等.卫生部全国细菌耐药监测网(Mohnarin)2011-2012年度血流感染细菌耐药监测报告.中国临床药理学杂志,2014,3:278-288.
3 全国细菌耐药监测网.2015年全国细菌耐药监测报告.中国执业药师,2016,3:3-8.
4 陈利涛,王晶莹,杨青.血流感染大肠埃希菌耐药性分析.中华医院感染学杂志,2013,13:3246-3248.
5 冯强生,宋月娟,哈小琴,等.2012年-2015年血培养标本病原微生物分布特征及血流感染患者感染指标分析.中国卫生检验杂志,2016,14:2032-2035.
6 陈斌泽,张媛媛,薛荣利,等.某三级医院2012—2015年血培养病原菌分布及其耐药性.中国感染控制杂志,2016,3:164-167.
7 李娟,赵英萍,郭淑丽,等.血流感染病原菌分布及耐药性分析.中国实验诊断学,2016,2:272-275.
8 刘德华,张红娟,杜艳,等.14519例血流感染病原菌构成及耐药分析.中国抗生素杂志,2016,2:137-143.
9 熊中政,廖俐雅.血培养病原菌分布及耐药性分析.检验医学与临床,2016,8:1123-1125.
10 徐佳庆,张肖,陆峰泉,等.2012~2014年江苏某医院血培养阳性病原菌种类及耐药性监测.国际检验医学杂志,2016,10:1350-1351,1354.
11 沈振华,刘兴晖,朱慧,等.血流感染病原菌分布及其体外药物敏感性试验结果分析.检验医学,2016,10:854-857.
12 王菊梅.血流感染大肠埃希菌流行情况和耐药性分析.现代实用医学,2015,12:1652-1653,1676.
13 何卫平,崔恩博,王钱,等.235株血流感染大肠埃希菌耐药性分析.中国感染控制杂志,2015,14:170-173.
14 邹颖,徐晓刚,郭庆兰,等.革兰阴性杆菌血流感染的病原菌分布、耐药性及碳青霉烯酶基因的检测与分析.中国感染与化疗杂志,2016,16:214-220.
15 艾根伟.血流感染大肠埃希菌的耐药性及耐药性变迁.中国现代医药杂志,2016,18:98-99.
16 龙辉,吴莎,江振友.血流感染大肠埃希菌的耐药性与聚类分析.热带医学杂志,2015,15:909-913.
17 翟如波,李云慧,孙跃岭,等.某院连续三年医院血流感染病原菌分布特征及耐药性分析.中华实验和临床感染病杂志(电子版),2016,10:36-40.
10.3969/j.issn.1002-7386.2017.24.042
225700 江苏省兴化市中医院检验科(陈燕);江苏省兴化市人民医院检验科(罗欲承)
罗欲承,225700 江苏省兴化市人民医院检验科;E-mail:luo.yu.chang@163.com
R 378.21
A
1002-7386(2017)24-3816-03
2017-05-18)
