[Gly14]-Humanin对大鼠局灶性脑缺血再灌注损伤后炎症反应及细胞凋亡的影响
2017-12-15余智顾苏兵于民邵晓莉洪小琴姜慧华吴燕飞
余智 顾苏兵 于民 邵晓莉 洪小琴 姜慧华 吴燕飞
[Gly14]-Humanin对大鼠局灶性脑缺血再灌注损伤后炎症反应及细胞凋亡的影响
余智 顾苏兵 于民 邵晓莉 洪小琴 姜慧华 吴燕飞
目的 探讨Humanin衍生物([Gly14]-Humanin,HNG)预处理对大鼠局灶性脑缺血再灌注损伤后炎症反应、细胞凋亡的影响及其机制。方法 将96只健康雄性SD大鼠按随机数字法分为HNG组、生理盐水组、模型组及假手术组,每组24只。采用改良的Zea-longa线栓法制备大脑中动脉缺血再灌注损伤模型,HNG组大鼠术前5 d给予HNG(2 μl/kg),生理盐水组与假手术组大鼠予0.9%氯化钠溶液(2 ml/kg),均为股静脉注射,1次/d;模型组不作处理。各组大鼠在再灌注24 h后进行神经功能缺损评分(NDS),采用ELISA法测定大鼠脑组织核因子-κB p65(NF-κB p65)及干扰素-γ(IFN-γ)水平,原位末端标记染色观察凋亡细胞数及尼氏染色检测健存神经细胞数。结果 HNG组、生理盐水组、模型组及假手术组NDS分别为1.5(1.0,2.0)分、3.0(2.0,3.0)分、3.0(2.0,3.0)分和0.0(0.0,0.0)分,假手术组NDS低于另外3组,HNG组NDS低于模型组和生理盐水组(均P<0.05)。与假手术组比较,HNG组、生理盐水组及模型组大鼠的NF-κB p65水平[(13.48±0.85)、(22.15±0.96)、(22.62±0.64)pg/mg],IFN-γ水平[(5.17±0.67)、(10.83±0.34)、(10.81±0.19)pg/mg]及凋亡细胞的百分率[(48.09±7.62)%、(70.19±8.33)%、(69.02±9.07)%]均较高,不重叠高倍镜视野中尼氏小体的数量[(10.57±0.51)、(5.16±0.56)和(5.65±0.98)个]较少,差异有统计学意义(P<0.05);HNG组大鼠的NDS、NF-κB p65和IFN-γ水平及细胞凋亡率均低于生理盐水组及模型组,尼氏小体数多于生理盐水组及模型组,差异有统计学意义(P<0.05);HNG组大鼠IFN-γ与NF-κB p65水平呈正相关(r=0.873,P<0.01)。结论 [Gly14]-Humanin可抑制脑缺血再灌注损伤过程中的局部炎症反应、减少细胞的凋亡,从而减轻临床神经功能的缺损。其机制可能与下调脑组织NF-κB p65的释放,进一步减少IFN-γ的表达有关。
[Gly14]-Humanin 脑缺血再灌注 核因子-κB p65 干扰素-γ 细胞凋亡
缺血性脑血管病具有较高的发病率、病死率、致残率及复发率,是目前临床重点防治的一种疾病。提高患者的疗效及改善预后是临床实践中迫切需要解决的难题。近年来,炎症反应在脑缺血再灌注损伤机制中的地位越来越受到关注[1],既往的实验研究也已证实,核转录因子的表达和炎性细胞的浸润均参与了脑缺血再灌注损伤过程[2]。新近研究表明,Humanin衍生物([Gly14]-Humanin,HNG)可通过受体的介导及抗凋亡这两条途径发挥对脑外伤神经保护作用,但目前鲜有HNG对脑缺血再灌注影响的报道。本研究通过观察HNG对脑缺血再灌注大鼠神经功能缺损、炎性因子及细胞凋亡的影响,初步探讨HNG对脑缺血再灌注损伤的神经保护作用机制,为缺血性脑血管病的药物治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1 大鼠与分组 健康雄性SD大鼠(浙江大学医学院实验动物中心提供,SPF级)96只,体重250~300(279.75±18.71)g,按随机数字法分为 HNG 组、生理盐水组、模型组及假手术组,每组24只。HNG组、生理盐水组、模型组大鼠均完成大脑中动脉阻塞造模,假手术组大鼠在术中不插入尼龙线,仅分离左侧颈总动脉、颈内动脉及颈外动脉。HNG组大鼠造模前5d给予HNG(2μl/kg),假手术组与生理盐水组给予0.9%氯化钠溶液(2 ml/kg),连续 5d股静脉注射,1次/d;模型组术前不作药物处理。
1.1.2 药物、主要试剂与仪器 HNG购自美国R&D Systems公司;核因子-κB p65(NF-κB p65)及干扰素-γ(IFN-γ)ELISA试剂盒购自美国Promega公司;甲苯胺蓝、原位末端标记(TUNEL)试剂盒购自美国Sigma公司;酶标仪购自德国Heraeus公司,电子显微镜购自日本OLYMPUS公司,Labo fuge 400R高速低温离心机购自美国BioTek公司等。
1.2 方法
1.2.1 大鼠局灶性脑缺血再灌注损伤模型的制备 采用改良的Zea-longa法制备大鼠大脑中动脉阻塞再灌注损伤模型[3]。采用10%水合氯醛(0.35ml/100g)腹腔注射麻醉成功后,仰卧固定在手术台上,颈部左旁正中切开皮肤约2~3cm,钝性分离左侧颈总动脉、颈内动脉及颈外动脉,避免损伤迷走神经。结扎并游离颈外动脉主干一段,予蛙心夹关闭颈总动脉和颈内动脉后在颈外动脉游离段上剪一小口将进口尼龙鱼线栓经颈总动脉分支处通过颈内动脉入颅,深度为(18.0±0.5)mm,使大脑中动脉栓塞并留置1cm左右的线栓头于体外;缺血4.5h后无需再次麻醉直接外拉尼龙线抽出颈内动脉约20 mm。模型成功判断标准:大鼠苏醒后出现左侧Horner征,爬行时向右侧转圈或跌倒;提尾悬拉后出现右前肢蜷缩屈曲。剔除标准:术后4.5h之内未苏醒者;并发蛛网膜下腔出血者;镜下观察无缺血病理改变者(观察的是大鼠缺血侧的脑组织,在镜下未发现明显凋亡细胞者则说明造模不成功,予以剔除)。造模过程中大鼠死亡或不符合模型要求,予以剔除并随机补充,模型制备方法同上述,以保证每组样本量保持在24只。1.2.2 神经功能缺损评分(NDS) 再灌注24h后,采用单盲法行Zea-longa 5分制法对4组大鼠进行计分;(1)0分:无神经功能缺失症状,活动正常者;(2)1分:不能完全伸展右前肢;(3)2分:左侧Horner征,爬行时向对侧转圈;(4)3分:爬行时身体向右侧倾倒;(5)4分:不能自发爬行或意识障碍。
1.2.3 测定脑组织匀浆液NF-κBp65及IFN-γ水平每组分别抽取12只大鼠,于麻醉成功后立即断头取脑,切除枕部和额部,于冰上距额叶前端4mm和8mm处进行冠状分离,取中间4mm厚的脑组织块,沿矢状缝两侧约2mm处,从上至下切除两侧半球的正中结构,将左侧部分的匀浆液,按照检测试剂盒说明,采用ELISA检测匀浆液中NF-κB p65及IFN-γ的含量水平。
1.2.4 观察凋亡细胞及尼氏小体染色 缺血4.5h再灌注24h后,4组分别取另外12只大鼠行腹腔麻醉,之后以4℃肝素化0.9%氯化钠溶液对大鼠进行快速心脏灌洗,直到右心房流出的液体变清即可断头。然后续用4℃4%多聚甲醛溶液快速灌注固定直到全身僵硬,断头取脑固定于10%的甲醛溶液中,常规脱水、透明、浸蜡、包埋,于视交叉处从前至后连续冠状切片(厚约 2μm),置37℃温箱内过夜烤干分别进行TUNEL染色和尼氏染色,按照试剂盒检测步骤进行严格操作。TUNEL染色切片在光镜下(×400)观察凋亡细胞(胞核出现棕黄染色颗粒),取5个不重复高倍镜视野(×400),计数凋亡细胞数及细胞总数,计算凋亡细胞率(凋亡细胞数/细胞总数×100%)。尼氏染色切片在光镜(×400)下以缺血皮层区随机取5个不重叠高倍镜视野对尼氏小体的数量进行检测,计算尼氏小体的数目/相应面积。
1.3 统计学处理 采用SPSS 19.0统计软件,首先对各组计量资料进行正态性检验和方差齐性检验,符合正态分布的计量资料以表示,多组间均数比较用单因素方差分析,两两比较采用LSD-t检验;非正态分布的计量资料以中位数(四分位数间距)表示,多组间比较采用Kruskal-Wallis H检验,两两比较采用Nemenyi检验;相关性分析采用Pearson直线相关。P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠NDS的比较 HNG组NDS计1.5(1.0,2.0)分;假手术组大鼠无神经功能缺损,计0.0(0.0,0.0)分;生理盐水组及模型组均为3.0(2.0,3.0)分。假手术组NDS低于其它3组,HNG组NDS低于生理盐水组和模型组,差异均有统计学意义(均P<0.05)。
2.2 4组大鼠脑组织NF-κB p65及IFN-γ水平、凋亡细胞率及尼氏小体的比较 见表1。
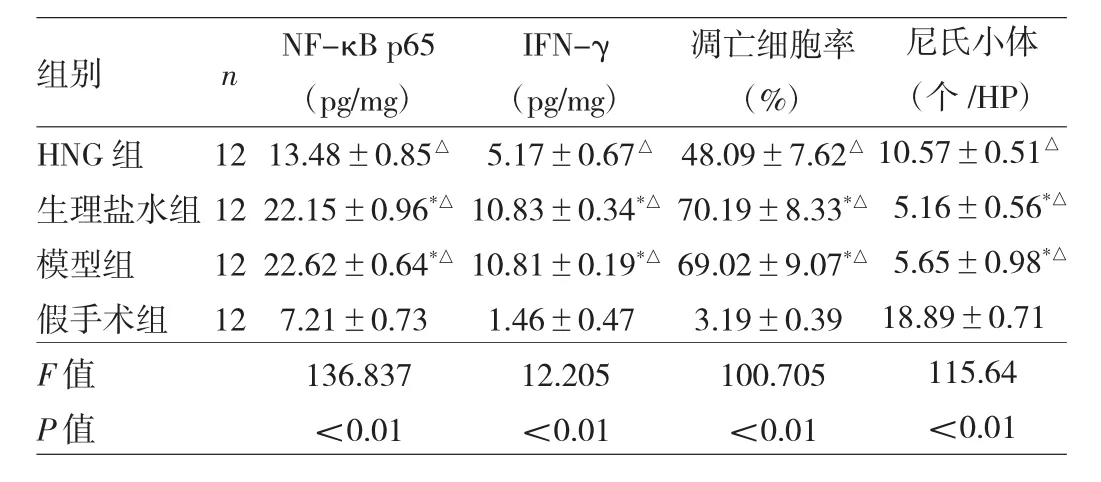
表1 4组大鼠脑组织NF-κB p65及IFN-γ水平、凋亡细胞率及尼氏小体的比较
由表1可见,与假手术组大鼠比较,HNG组、生理盐水组及模型组脑组织NF-κB p65及IFN-γ水平、细胞凋亡率均较高,而尼氏小体数较少,差异均有统计学意义(均P<0.05);与生理盐水组及模型组比较,HNG组大鼠的NF-κB p65和IFN-γ水平、细胞凋亡率较低,尼氏小体数较多,差异有统计学意义(P<0.05);生理盐水组与模型组NF-κB p65及IFN-γ含量水平、细胞凋亡率及尼氏小体数差异无统计学意义(P>0.05)。
此外,光镜下显示假手术组大鼠脑组织凋亡细胞很少表达(图1a),且尼氏小体数目多且体积大,呈紫色均匀分布于核周围(图2a);生理盐水组和模型组凋亡细胞较多表达(图1b、c)、体积形态不一,而尼氏小体数目减少,即使存在的尼氏小体亦发生变形或变小(图2b、c)。HNG组凋亡细胞较生理盐水组和模型组大鼠减少(图1d),体积形态亦基本一致,而尼氏小体数目较上述2组均增多且变形较少(图2d)。
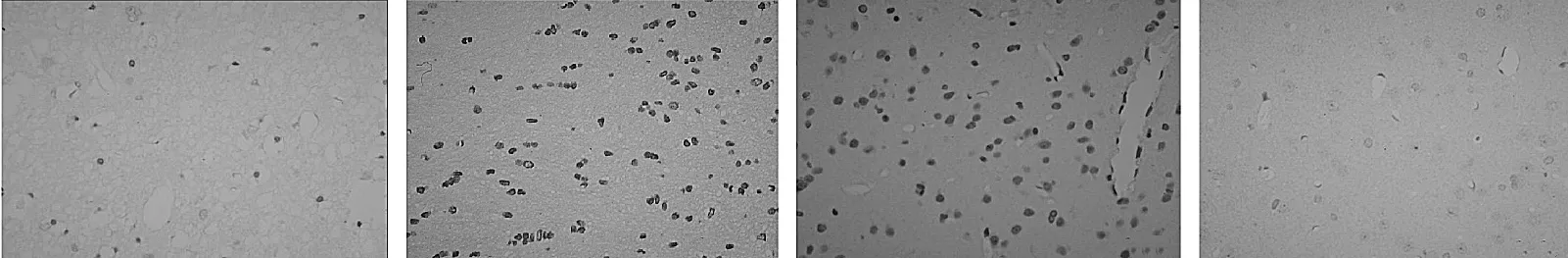
图1 原位末端标记染色结果(a:HNG组见少量凋亡细胞表达;b、c:生理盐水组和模型组凋亡细胞明显增多;d:假手术组未见明显的凋亡细胞;TUNEL 法,×400)
2.3 HNG组大鼠脑组织NF-κB p65与IFN-γ水平的相关性 HNG组大鼠脑组织IFN-γ与NF-κB p65含量水平呈显著正相关(r=0.873,P<0.01)。
3 讨论
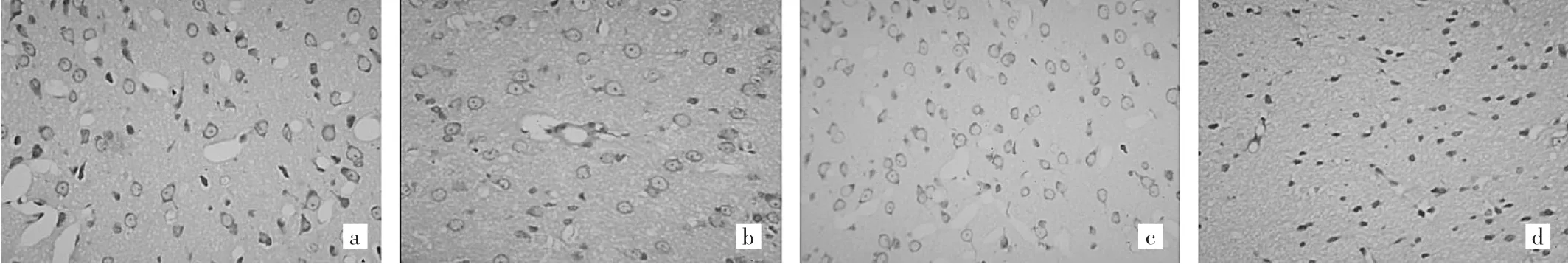
图2 尼氏染色结果(a:HNG组尼氏小体较多;b、c:生理盐水组和模型组尼氏小体数量明显减少;d:假手术组大鼠脑组织尼氏小体多;Nissl法,×400)
临床实践中发现,急性脑缺血后在4.5h内应用重组人组织型纤溶酶原激活物(rt-PA)静脉溶栓恢复血液灌流时发生再灌注损伤而使神经功能缺损加重,认为再灌注时受血液流变学和缺血缺氧的改变引起神经细胞释放大量的炎症介质,促进炎性细胞的聚集和炎性因子的释放[4],导致脑缺血损伤区炎性细胞浸润,加速神经细胞的凋亡。其中炎性细胞的激活和多种炎性因子的级联反应均参与其中。炎症反应的要素包括转录因子、信号传导分子、黏附分子和炎症细胞[5]。目前已知,NF-κB存在于神经细胞、胶质细胞和血管内皮细胞等几乎所有细胞中,由NF-κB p65与NF-κB p50组成二聚体,而前者亚单位中含有激活转录的处理区并能与其他细胞基因启动子或增强子序列发生特异性结合而促进其转录和表达,与炎症反应、免疫反应以及细胞的分化、增殖和凋亡等密切相关[6]。其中小胶质细胞被缺血激活后,转变为吞噬细胞,释放蛋白水解酶、一氧化氮、氧自由基及细胞因子(如 IFN-γ、TNF-α、IFN-α、IL-1及IL-6)的等细胞毒性物质。而IFN-γ作为一种重要的细胞因子,介导周围组织的细胞毒效应,产生一系列炎症反应,加重脑缺血损伤。有研究表明,IFN-γ通过活化p38激酶,诱导Ⅱ类组织相容性复合体和细胞因子的表达[7]。
近期大量的体外实验表明,HNG不仅能有效地抑制多种阿尔茨海默病相关致病因子(如黄素腺嘌呤二核苷酸基因突变及胸膜肺炎放线杆菌抗体等)诱发的神经细胞和非神经细胞的凋亡,还能保护各种应激对细胞的各类损伤,包括I/R诱导的小鼠原代皮质神经细胞凋亡、脂多糖诱导的原代星形胶质细胞炎症反应等[8]。体内实验也证明HNG不仅能改善东莨菪碱[9],二苯乙醇酸及β-淀粉样肽相关因子诱导的神经记忆功能的损害,还能改善AD转基因小鼠的学习记忆能力[10-11]。此外,研究还进一步证实HNG除能抵御外伤诱导的神经细胞质膜完整性的破坏抑制颅脑损伤诱导的自噬激活和凋亡,减少脑缺损体积,改善记忆和运动障碍之外[12],还能改善小鼠大脑中动脉闭塞诱导的急性脑卒中的运动功能并减少损伤侧大脑半球的梗死体积[13]。
人们发现通过药物模拟缺血预处理对脑缺血再灌注损伤产生保护作用,具有较好的临床应用价值,故备受关注。本研究发现,在脑缺血4.5h再灌注24h后,发现假手术组大鼠无神经功能缺损;生理盐水组及模型组神经功能缺损症状较重,而经HNG预处理的大鼠NDS明显轻于生理盐水组及模型组,差异有统计学意义。这表明HNG预处理对改善脑缺血再灌注损伤后的神经功能缺损具有积极意义。
本研究还发现,经HNG预处理的大鼠脑组织NF-κB p65及IFN-γ水平低于生理盐水组及模型组,差异有统计学意义,生理盐水组及模型组NF-κB p65及IFN-γ水平的差异无统计学意义;有研究报道,NF-κB可以通过激活细胞因子级联反应,释放IFN-γ,导致细胞的凋亡[14]。本研究行相关性分析也发现,HNG组大鼠脑组织NF-κB p65与IFN-γ水平呈正相关。上述结果表明HNG可降低诱发NF-κB p65的释放,进而减少IFN-γ的水平,从而改善临床神经功能缺损症状。细胞凋亡是由于细胞内外因素激活细胞本身自杀性程序而引起的一种细胞死亡形式,也是一个复杂的生理性调节机制,受到细胞外因子和细胞内基因调控,同时也参与正常细胞的更新及调节细胞分化。从本研究的TUNEL染色和尼氏小体染色结果观察发现,生理盐水组及模型组大鼠凋亡细胞较多表达,且尼氏小体数目减少,即使存在的尼氏小体亦发生变形或变小,而经HNG预处理的大鼠缺血半暗带中细胞凋亡数明显减少而尼氏小体数量增多,差异有统计学意义。表明HNG具有延缓或阻止缺血再灌注损伤后神经细胞的凋亡,相应的健存的神经细胞数目增多,这对脑缺血再灌注损伤的防治具有重要的意义。
综合上述研究结果,HNG预处理可减少脑缺血再灌注损伤过程中的神经细胞的凋亡,从而改善神经功能缺损程度,其机制可能与HNG下调脑组织中NF-κB p65的水平,进一步减少促炎介质的释放有关,这为其在缺血性脑血管疾病治疗中的应用提供一定的理论参考。本研究未对不同剂量的HNG疗效进行观察,有待在今后作进一步比较。
[1]Moraga A,Pradillo J M,García-Culebras A,et al.Aging increases microglial proliferation,delays cell migration,and decreases cortical neurogenesis after focal cerebral ischemia[J].J Neuroinflammation,2015,12(1):87.doi:10.1186/s12974-015-0314-8.
[2]余智,刘开祥,廖小明,等.吡格列酮对脑缺血再灌注损伤大鼠的神经保护作用及其机制的研究[J].临床神经病学,2013,26(2):44-46.
[3]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(5):84.doi:org/10.1161/01.STR.20.1.84.
[4]Deng J,Wu G,Yang C,et al.Rsuvastatin attenuates contrast-in-duced nephropathy through modulation of nitric oxide,Inflammatory responses,oxidative stress and apoptosis in diabetic male rats[J].J Transl Med,2015,13(1):53.doi:org/10.1186/s12967-015-0416-1.
[5]Wang Q,Tang X N,Yenari M A.The inflarnrnatory response in stroke[J].Neuroinllnunol,2007,184(l-2):53-56.doi:org/10.1016/j.jneuroim.2007.11.014.
[6]Ridder D A,Schwaninger M.NF-κB signaling in cerebral ischemia[J].Neuroscience,2009,158(3):995-1006.doi:org/10.1016/j.neuroscience.2009.07.007.
[7]Tham E L,MescherM F.Signaling alterations in activation-induced nonresponsive CD8+T cells[J].Immunol,2001,167(4):2040-2048.doi:org/10.4049/jimmunol.167.4.2040.
[8]Kaur N,Dhiman M,Perez-Polo J R,et al.Ginkgolide B revamps neuroprotective role of apurinic/apyrimidinic endonuclease 1 and mitochondrial oxidative phosphorylation against Abeta-induced neurotoxicity in human neuroblastoma cells[J].J Neurosci Res,2015,93(14):938-947.doi:10.1002/jnr.23565.
[9]Matsuoka M.Humanin signal for Alzheimer's disease[J].J Alzheimers Dis,2011,24(2):27-32.doi:10.3233/JAD-2011-102076.
[10]Haiyan Xu,Min Cai,Xuedong Zhang.Effect of the blockade of the IL-23-Th17-IL-17A pathway on streptozotocin-induced diabetic retinopathy in rats[J].Graefe's Archive for Clinicaland ExperimentalOphthalmology,2015,253(9):1485-1492.doi:org/10.1007/s00417-014-2842-9.
[11]Sisi Sun,Xiyao Chen,Yang Gao,et al.Mn-SOD upregulation by electroacupuncture attenuates ischemic oxidative damage via CB1R-Mediated STAT3 Phosphorylation[J].Molecular Neurobiology,2016,53(1):331-343.doi:org/10.1007/s12035-014-8971-7.
[12]靳辉,胡海涛,王唯析.[Gyl14]-Humanin对Aβ_(25-35)诱导PC12细胞凋亡的影响[J].细胞与分子免疫学杂志,2010,11(5):427-430.doi:10.13423/j.cnki.cjcmi.005525.
[13]Jin H,Liu T,Wang W X,et al.Protective effects of[Gly14]-Humanin on beta-amyloid-induced PC12 celldeath by preventing mitochondrial dysfunction[J].Neurochem Int,2010,56:417-4 23.doi:org/10.1016/j.neuint.2010.11.015.
[14]刘丽,李世大,赵丽燕.膈下逐瘀冲剂对输卵管炎性不孕大鼠NF-κB、IFN-γ蛋白表达的影响[J].世界中西医结合杂志,2014,9(3):251-253.doi:10.13935/j.cnki.sjzx.2014.03.033.
Effect of [Gly14]-Humanin on inflammation and cell apoptotic in brain tissue after focal cerebral ischemia-reperfusion in rats
YU Zhi,GU Subing,YU Min,et al.Department of Rehabilitation Medicine,the First People's Hospital of Chun'an County,Hangzhou 311700,China
Objective To investigate the effect of[Gly14]-Humanin(HNG)on inflammation and cell apoptosis in brain tissue after focal cerebral ischemia-reperfusion injury in rats. Methods Ninety-six male Sprague-Dawley rats were randomly divided into sham-operation group,model group,normal saline (NS)group and HNG group with 24 rats in each group.The ischemia-reperfusion model was induced by middle cerebral artery occlusion(MCAO)with Zea-longa suture embolism method in rats.HNG (2μl/kg)or normal saline (2ml/kg)were given to rats in HNG and NS group 5 days before operation (i.v.qd x5),respectively.After 4.5h of cerebral ischemia and 24h of reperfusion,neurological deficit score(NDS)was assessed,the NF-κB p65 and IFN-γ levels in cerebral tissue were measured by ELISA,neuron apoptosis was detected by Nissl and TUNEL staining;the correlation between IFN-γ and NF-κB p65 levels in cerebral tissue was analyzed. Results The median NDS values in HNG,NS,model and sham-operation groups were 1.5(1.0,2.0),3.0(2.0,3.0),3.0(2.0,3.0)and 0.0(0.0,0.0),respectively;the NDS of sham-operation group was significantly lower than those of other three groups,the NDS of HNG group was significantly lower than that of model group and normal saline group(all P<0.05).Compared with sham-operation group,the levels of NF-κB p65in HNG group,normal saline group and model group (13.48±0.85,22.15±0.96 and 22.62±0.64pg/mg),the levels of IFN-γ(5.17±0.67,10.83±0.34 and10.81±0.19pg/mg),the ratio of apoptotic neurocyte(48.09±7.62,70.19±8.33 and 69.02±9.07)were significantly increased,and the number of neurons(10.57±0.51,5.16±0.56 and 5.65±0.98)was significantly decreased(all P<0.05).The NDS,NF-κB p65 and IFN-γ levels,ratio of apoptotic neurocytes in HNG group were significantly lower than those in NS group and model group;while the number of neurons was significantly higher than that in normal saline group and model group(all P<0.05).The levels of IFN-γ was positively correlated with NF-κB p65 in HNG group (r=0.873,P<0.01).Conclusion [Gly14]-Humanin can alleviate the inflammation and neuron apoptosis in brain tissue and mitigate the neurologic deficit after focal cerebral ischemia reperfusion injury,which may be associated with down-regulating NF-κB p65 and reducing IFN-γ levels.
[Gly14]-Humanin Cerebral ischemia/reperfusion NF-κB p65 IFN-γ Cell apoptosis
10.12056/j.issn.1006-2785.2017.39.20.2016-1561
浙江省医药卫生科技项目(201482575);杭州市科技发展计划项目(20140633B66)
311700 淳安县第一人民医院康复医学科(余智),神经内科(邵晓莉、洪小琴、姜慧华、吴燕飞);浙江省人民医院神经内科(顾苏兵、于民)
余智,E-mail:wjy001982@163.com
2016-10-05)
杨丽)
