超高效液相色谱的发展及在分析领域的应用
2017-12-14,2,2*
,2 ,2*
(1.青岛大学生物医用材料与工程研究院,青岛大学化学化工学院, 青岛 266071;2.纤维新材料与现代纺织国家重点实验室培育基地,青岛大学材料科学与工程学院,青岛 266071)
超高效液相色谱的发展及在分析领域的应用
张帅1丛海林1,2于冰1,2*
(1.青岛大学生物医用材料与工程研究院,青岛大学化学化工学院, 青岛 266071;2.纤维新材料与现代纺织国家重点实验室培育基地,青岛大学材料科学与工程学院,青岛 266071)
近年来,超高效液相色谱凭借其超快速,超灵敏等优势越来越受到人们的关注。人们在对超高效液相色谱的原理逐渐完善的同时,对色谱柱填料方面的研究也取得了一系列的突破。随着超高效液相色谱技术的发展以及与质谱等仪器的联用技术的出现,这项技术在食品分析、环境分析、生化分析及药物分析等多个领域显示出重大的理论意义和实际应用价值,具有广阔的发展前景。本文对超高效液相色谱柱的发展及其在多个分析领域的应用进展进行了综述。
超高效液相色谱柱 液质联用 柱填料 分离分析
1903年,俄国植物学家Tswett通过色谱分离技术对叶绿素等色素实现分离,首次提出了色谱法的概念。迄今为止,在这100多年的时间里,不仅高效液相色谱(HPLC)技术取得了飞速的发展,而且超高效液相色谱(UHPLC)也被人们开发与利用。由于UHPLC在分离方面有更快的分析速度,更好的分离度、精密度和稳定性等优越的性能,也受到研究者越来越多的关注与应用。早在1996年沃特世(Waters)公司推出Alliance®HPLC时,很多研究者认为HPLC技术已经发展到了极致。但是在2004年,沃特世公司在色谱柱填料技术上的创新,使其率先在超高效液相色谱方面取得突破性进展[1,2],并研发推出了全球第一台超高效液相色谱仪— ACQUITY®UPLC。超高效液相色谱的开发应用有许多难题需要克服。首先,需要克服色谱柱固定相填料的粒径对色谱柱效能的限制,采用杂化颗粒技术,合成了有机多孔硅的色谱柱填料,通过在硅胶中形成桥形交联结构的乙基基团,使硅胶的机械强度大大提高;其次采用了具有精确梯度的超高压色谱泵,解决了超高压下溶剂的压缩性以及绝热升温的问题;第三在进样技术上采取创新,有效的降低了死体积并减少了样品之间的交叉污染;最后对检测器的种类进行多样性的开发,由最开始的紫外检测器等发展到荧光检测器、蒸发光散射检测器等,以使UHPLC在更多领域进行分析应用。2011年,安捷伦公司推出新型的超高分离色谱柱,其采用了1.8μm的硅胶色谱柱填料,在分析蛋白质时能够获得较好的回收率和较高的分离度。随后,安捷伦推出了Agilent 1290 Infinity系列高分离度快速液相色谱系统,压力可达1200bar,流速最高可达5mL/min,明显降低了基线漂移,且有较大的采集速率。另一色谱厂家-岛津公司也采用均一的2.2μm的柱填料,并最新推出了超高效液相色谱系统Nexera UHPLC LC 30A,使可承受的压力达到130Mpa,柱温也达到150℃。总之近十几年来,前后数十家国内外的色谱司推出了基于亚2μm填料的UHPLC,推动了UHPLC在分析领域的快速发展。
1 UHPLC的基本原理
超高效液相色谱(UHPLC)技术是在基于传统液相色谱技术(HPLC)原理的基础上,对分离系统整体设计进行创新,从而大幅度改善色谱分离度、样品通量和灵敏度的最新液相色谱技术[3]。相比较于HPLC,UHPLC的分析速度,分辨率以及灵敏度大大提高,分析所得的数据信息更加完整[4]。UHPLC原理的理论基础是著名的Van Deemter方程[5],该方程是一个描述线速度和理论塔板高度(柱效)之间关系的经验性方程:
H=A+B/μ+Cμ
(1)
上式中,H代表塔板高度,A代表涡流扩散系数,B是纵向扩散系数,C为传质阻抗系数,μ代表流动相流速。式中A(涡轮扩散项)、C(空气传质阻力系数Cg和液相传质阻力系数Cl)两项与填料颗粒度(dp)之间的关系为:A=2λdp,λ为不规则因子;C=Cg+Cl,Cg与(dp)2成正比,因此可得出, 色谱柱的塔板高度(H)受色谱柱色谱填料粒径的影响较大。一般随着色谱柱中色谱填料粒径的减小而降低,反之色谱柱的柱效则增高,但柱效与填料粒径的大小并非简单的反比例关系,还受填装不规则因子等其他因素的影响。
图1也证明了填料粒径越小,塔板的高度也越小,相应的柱效也越高。另外,由图中曲线可看出,不同粒径的色谱柱填料都有其所对应的最佳流速,颗粒粒径的减小使最高柱效点向线速度的方向移动,并且线速度的范围也渐渐变宽。因此,使用小粒径填料更有利于发挥高流速的优势,可以在更宽的线速范围内使用。虽然粒径的减小,会伴随着压力的不断增大,达不到理想的流速,但是粒径的减小一定程度上提高了分离效率。

图1 液相色谱塔板高度与填料粒径及流速的关系[5]
另一方面,液相色谱分离度与柱效(N)的平方根成正比:
(2)
(2)式中k2是容量因子,α是选择性系数,N是理论塔板数。可见,随着填料粒径的降低,柱效得到提高,进而分离度也增加。由于分离能力用峰容量衡量,单位时间的峰容量越高,表明可以分离出的色谱峰越多,分析的分辨率越高[6]。这也说明了可以通过减小色谱柱中装填固定相颗粒度来提高色谱柱的柱效和分离度。除提高柱效和改善分离度外,依据Van Deemter理论可进一步推测,减小填料粒径还可在分析速度、灵敏度方面提高色谱分离分析的效能。
此外,当一些工作者利用UHPLC完成越来越多的分离工作时,也有很多研究人员对UHPLC的分离分析原理进行进一步的完善。戴朝政等[7]对UHPLC色谱过程动力学进一步研究,以热传导方程为出发点,利用色谱动力学原理推导了包括流动相摩擦生热影响的UHPLC塔板高度方程:

上述方程也解释出流动相摩擦生热对塔板高度的贡献所在,进而进一步得出UHPLC的柱效率与柱内径密切相关,采用细内径柱有利于实现高效率;过高的流动相线速度将导致柱效率崩溃,从而更加完善了对UHPLC工作原理的阐述。
2 色谱柱填料及色谱柱的进展
色谱柱一直被称为色谱仪的心脏,色谱分析应用的关键在于色谱柱开发和利用。由于色谱柱开发的关键在于色谱柱填料,因此近年来色谱柱取得快速发展得益于色谱柱填料的研发。总而言之,色谱柱填料的创新更是推动了UHPLC发展。本章节主要对几种UHPLC色谱柱填料技术进行描述。
色谱柱填料制备技术的创新决定着色谱柱性能所能到达的高度。目前色谱柱填料颗粒应用最多的有多孔的杂化颗粒和实心的小粒径二氧化硅微球,这几种填料都表现出了较好的色谱性能。
2.1 亚乙基桥杂化颗粒(BEH)
10多年来,杂化颗粒技术[Hybrid Particle Technology, HPT]已经提供了无法超越的通用性和优异性能,帮助色谱工作者推开色谱分离技术的局限。第二代杂化颗粒技术合成出第二代有机多孔硅胶(粒径为1.7μm)的色谱柱填料[8]。它使用双(三乙氧基硅)乙烷在硅胶中形成桥式乙基基团,使其合出来的二氧化硅微球内部具有更多的类交联的介孔结构大大增加其机械强度。杂化颗粒技术因其固有的化学稳定性而能采用更宽的pH范围(pH为1~12),也赋予了其优越的分离性能。基于固定相填料BEH杂化技术的创新,表面带电杂化颗粒(CSH)[9]和高强度硅胶颗粒(HSS)[10]也相继出现,使得色谱技术迅速发展。
2.2 核壳型颗粒色谱柱填料
近年来,核壳型填料在超高效液相色谱领域取得了较快的发展,以适应超高效快速分析的要求[11]。
核壳型颗粒并不是从里到外的通透孔状结构,而是采用溶胶-凝胶处理技术与纳米结构技术的结合,在坚实的硅胶核心表面生成了一个既坚稳又均匀的多孔外壳。例如核壳颗粒技术在2007年获得突出进步,在HPLC引入了填充有2.7μm固体二氧化硅核壳颗粒的色谱柱[12]。殷亚东等[13]开发了一种有效的方法合成单分散纤维状核壳型二氧化硅微球,并能通过改变实验条件控制二氧化硅内核的粒(0.5~3μm)、外层核壳的厚度(13~67nm)以及孔径的大小(5~16nm)。在HPLC仪器上使用填充这些核壳颗粒的色谱柱被描述为UHPLC的替代物,提供高效率而不需要更高的压力;但同时也为核壳型色谱填料在UHPLC的分离应用上奠定了良好的基础。最近的一个重要趋势是开发了用于UHPLC系统的亚2μm核壳颗粒的色谱柱。与使用2.6~2.7μm核壳颗粒色谱柱的HPLC仪器相比,使用亚2μm核壳颗粒色谱柱的UHPLC提供了更快的分离速度和更高效的分离效率。对于填充有具有更薄壳的1.7μm核壳型颗粒的色谱柱,其分离效率达到350,000 plates/m[14]。壳的厚度被证明对效率和保留有显着的影响[15]。2013年,在UHPLC系统引入了2.1 x 50 mm的填充有1.3μm核壳微粒的色谱柱[16],通过测量得到这些色谱柱的最大效率为435,000~510,000plates/ m[17]。然而,1.3μm核壳颗粒的色谱柱的比磁导率比含有1.7μm核壳微粒的色谱柱的比磁导率低45%[18],这导致用在恒定流速和柱长度的条件下,压力是1.7μm核壳颗粒色谱柱压力的两倍。所以只有50mm长的1.3μm核壳颗粒的色谱柱可以使最大压力为1200 bar的UHPLC系统在最佳流速下操作。 因此,核壳颗粒在UHPLC系统的应用在面临巨大机遇的同时也面临着巨大的挑战。
2.3 亚2μm实心二氧化硅微球
由于多孔硅胶填料的孔径一般约为30nm,在一些常规的有机分析中,传质阻力的影响较大,存在较大的分析局限性。另外,当前研究表明,实心核颗粒可通过减小Van Deemter方程中的3个参数来提高色谱性能。即实心核颗粒填充更均匀—减小涡流扩散系数;更小的颗粒孔隙率降低轴向扩散—减小纵向扩散系数;实心核颗粒可提高热传递,减缓径向温度梯度—减小传质阻抗系数。因此,表面无孔并且具有较高机械强度的无机二氧化硅微球成功应用到UHPLC柱填料,成为研究的热点。到目前为止,具有不同粒径的单分散二氧化硅颗粒可以通过不同的合成方法进行制备,常用的方法有微乳液方法[19],溶胶-凝胶法[20,21]和Stöber方法[22,23]等。 传统的Stöber法利用硅醇盐如原硅酸四乙酯(TEOS)在碱性催化剂的条件下进行快速的水解缩合反应,形成二氧化硅微球,但是得到的硅球粒径一般小于1μm,并且反应时间长也可能会导致种子粒子聚集和二次粒子的生成,从而导致多分散粒子并将影响的材料的性质。
本课题组在亚2μm UHPLC色谱柱填料的制备上取得了较大的进步,并成功应用到UHPLC的分离中。于冰、薛蕾等[24]首先通过对传统的Stöber法进行改进,成功的制备出单分散性良好,粒径在1~2μm之间的无孔二氧化硅微球,即将其中TEOS的乙醇溶液连续滴加至含有氯化钾、水、乙醇和氨水的反应混合溶液中,在室温下,搅拌反应6h后离心,洗涤,干燥即得到二氧化硅微球。如图2所示,文章考察了TEOS用量对二氧化硅微球粒径和单分散性的影响;并对其进行表面的修饰后用作UHPLC色谱柱填料,对C60和C70实现了基线分离。
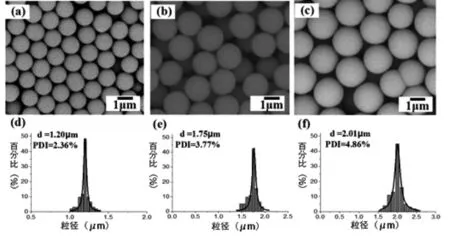
图2 TEOS的量对二氧化硅微球粒径的影响[24](a)(d). 2.00g; (b)(e). 3.95 g; (c)(f). 6.00 g.
结合本实验室先前制备SiO2微球的工作,虽然SiO2微球的粒径以及单分散性均符合UHPLC对色谱柱填料的要求,但是存在的问题是单次制取的SiO2微球的产量较低。因此在后续的工作中,于冰、田超等对以前的方法做了进一步的改善,即先将氯化钾、水、乙醇、氨水和TEOS混合反应一段时间后,再把TEOS的乙醇分散液连续滴加至混合溶液中。虽然只是在原有混合液中添加了TEOS,但合成出的二氧化硅微球的单分散性更好,产量大大提高,为后续的填柱工作较少了工作量。并且改进后的方法合成出的二氧化硅微球的粒径由1~2μm可控变为1-3μm可控,从而为UHPLC色谱柱的填料提供了更多的选择。此工作也考察了氨水等因素对微球形貌的影响(图3所示),并首次使用感光性材料对硅球表面进行修饰改性,成功的应用到UHPLC的分离中。

图3 氨水的量对二氧化硅微球粒径的影响(a)(d). 4.5mL; (b)(e). 3 mL; (c)(f). 1.5 mL.
3 UHPLC的应用
超高效液相色谱技术是分离科学中的一个全新类别,它最显著的特点是超高分析速度,超高灵敏度,超高分离度,减少溶剂消耗。由于超高效液相色谱柱及色谱柱填料的多元化发展,近年来UHPLC在药物分析(如天然产物中药物成分的提取)、食品分析(如食品中农药残留的检测)、生化分析(如蛋白质、多肽、代谢组学等)以及环境分析(如水中微囊藻毒素的检测)等多个领域具有实际应用价值。
3.1 药物分析
目前对药物分析进行检测的方法主要有高效液相色谱法(HPLC)和液相色谱-质谱法(LC-MS/MS)。但是对于复杂的药物,传统检测相对困难。Davy Guillarme 等[25]人对比了HPLC和UHPLC两种方法在药物分析检测中的应用。如图4所示,UHPLC方法对药物分析检测具有较高的灵敏度,稳定性,并且分析速度是传统HPLC方法的10倍。

图4 UHPLC和HPLC对12种药物的分离比较[25](a).HPLC条件:XBridge C18 柱,5μm,流速1 mL / min,注射量,20μL,总运行时间,45 min; (b).UHPLC条件:ACQUITY BEH C18柱,1.7μm,流速 0.61mL / min,注射量,1.4μL,总运行时间,5.1min。
近年来,随着生活水平的提高,人们也追求更高的生活质量,保健品行业也随之迅猛发展。例如减肥类保健品,降血糖类保健品以及抗抑郁类保健品越来越被人类所需要,但一些不良商家为了获取高额利益,在保健品中添加非法药物来提高疗效。王静文等[26]利用超高效相色谱法同时测定减肥类保健品中非法添加的20多种非法化学药物,在相应的浓度范围内,25种非法化学药物的质量浓度和峰面积呈现出较好的线性关系,定量检出限在0.5~5.0ng的范围内,通过选取合适的流动相以及色谱条件,可快速的同时将化学药物分析检测出来。勾新磊等[27]利用超高效液相色谱-串联质谱(UHPLC-MS/MS) 分析方法可将保健品中9种抗抑郁类组分快速分离,通过改善流动相的比例缩短了分析时间,在 0.5/1.0/1.5μg/L不同水平下平均回收率为77.7%~100.8%。从而进一步证实超高效液相色谱-质谱联用技术能应用于保健品中非法化学组分的定量检测。
如今,天然产物成分的提取以及中药药物的组成分析越来越受到人们的关注。但是天然产物以及中药是个复杂且未知的体系,要想推动中药药学的进一步发展与应用,有必要建立一系列成熟的方法对其成分进行精确的分析与检测。因此,具有更高分离效能,更高灵敏度的超高效液相色谱的出现与应用,在中药和天然产物的分离分析发挥了重要的作用。
Deng Ting等[28]采用吸附吸头固相萃取(PT-SPE)和UHPLC-MS/MS结合的技术对新鲜植物中的油菜素内酯(BRS)进行分离和检测。该方法首次实现500μg新鲜植物样品中BRS的测定,并且衍生化试剂BTBA将在其他顺式二醇化合物的分析中得到应用。 Zhang ChenXue等[29]利用UHPLC-Q-TOF-MS/MS与指纹图谱相结合的方法对传统血清类中药-Sanziguben的有效成分进行分离和测定。该方法分析时间比HPLC法更短,快速检测到血液有Sanziguben药理活性成分没食子酸和柯里拉京的存在,进一步对Sanziguben的药性做出评估,同时该方法可作为中国传统医药或者中国复方药物质量评估的重要参考。Li Ping等[30]利用UHPLC-QTOF-MS/MS的技术对藤黄科植物-岭南山竹子各部分的药用成分进行分析测定。该方法从岭南山竹子的叶、枝和水果的提取物中分离检测到40种化学组分,其中15种化学物质是首次从该植物中发现。另外,将不同部位提取物中的化学成分在体外做了细胞毒性和抗氧化实验,来比较不同部位提取物中化学组分的生物活性,从而为有效快速的筛选植物不同部位的生物活性成分奠定了良好的基础。钟艳梅等[31]建立了UHPLC/Q-TOF MS快速鉴定白术生药材中多种化学成分的方法。此方法采用ESI正离子模式,在40min内,样品中的化学成分得到了良好的分离,出现了24个峰信号,鉴定了其中20种化学成分,为进一步研究白术药用物质奠定了基础。
超高效液相色谱法与液质联用方法的出现,不仅是实现喹诺酮类药物、四环素类药物等有效的检测的方法,还是对日渐兴起的保健品进行有效检测的途径。另外,天然产物中有效物质的提取一直困扰着分析研究者,但是Deng Ting、Li Ping等通过液质联用的方法对复杂的天然产物和中药成分进行了有效的分离检测,我们可以相信液质联用法在以后传统药物的分析、中医药有效成分的提取和新药的开发方面都将发挥着关键作用。
3.2 食品分析
民以食为天,食品安全问题一直是世界各国人民关注的焦点,尤其是农作物中的农药残留以及食品中人工合成的添加剂。虽然传统的液相色谱法和气相色谱法在食品分析领域有一定的应用,但仍需建立更加快速、灵敏的检测方法。近年来超高效液相色谱的出现为检测农药残留等提供了新的途径。
Heyuan Jiang[32]等报道了UHPLC法和HPLC法分离绿茶中FOG化合物。如图5所示,UHPLC法能在10min内对绿茶中18种FOG化合物实现有效的分离,而传统的HPLC法则需要50多分钟,分析速度得到大大提升。蒋黎艳等[33]采取超高效液相色谱-串联质谱法对柑橘中的5种链格孢霉毒素进行了快速的分析与检测。首先将样品用改进的后的QuEChERS方法进行萃取,5种物质均实现完好的分离,通过多反应模式监测,5种毒素的回收率在71%~112%,相对标准偏差为1.1%~9.9%,达到了柑橘类水果的检测标准。刘真真等[34]选取磁性纳米材料对样品进行快速的前处理,之后与UHPLC-MS技术相结合,快速有效地对猕猴桃中的52种农药残留及多种相关代谢物进行定量分析。其目标化合物在2~250μg/L有良好的线性关系,更进一步证明超高效液相色谱在水果农药残留检测中的作用不可或缺,有较好的应用前景。Yin ZhiQiang等[35]采用多残留检测机制和UHPLC-MS/MS技术相结合的方法实现了对猪肉中残留的210种药物的分离和检测。与常规的定量方法相比,该方法有效,经济,检测范围广,可以应用于大批量样品的快速筛选,对食品的安全监测有重要意义。Antoni Delpino-Rius等[36]采用UHPLC-MS/MS法对新鲜水果和商业化果汁中的类胡萝卜素进行了分析和检测。该方法在不仅样品提取速度快,而且减少了溶剂的消耗。另外,在短短17min的色谱分离分析中,高达27种类胡萝卜素从新鲜的苹果,桃和梨获取,从而与商业化果汁中检测出的类胡萝卜素进行比较,对商业化果汁的安全和营养价值做出评估。Katrina Campbell等[37]采用UHPLC-MS/MS技术对花生、玉米等食品中的黄曲霉毒素进行分析和检测。与之前的检测方法相比,该方法不仅能快速对食物中的黄曲霉毒素进行筛选分离,而且显著降低了分析检测的成本。另外,该方法具有较高的准确度和精密度,适用于监管部门对进出口食物中黄曲霉毒素的定量分析。Sunyoung Kim等[38]UHPLC/ESI-MS/MS的方法系统的研究了3种不同的菌株在大蒜发酵的过程中所产生有机硫化合物成分的含量变化。此研究方法显示出了11中分析物良好的线性关系(R≥0.995),平均的回收率为81.63%,因此能对有机硫化物进行有效的检测,这对发酵大蒜的食品生产商选择合适的菌株发酵有良好的指导意义。
超高效液相色谱在食品分析方面表现出越来越重要的地位,尤其是在传统花生玉米农作物和蔬菜水果农药残留方面的检测。近年来国家越来越重视食品安全,提高人民生活质量,越来越多分析研究者的研究集中在食品中有害物质的快速分离与检测,不仅给国家食品检测提供了更多有效的途径,也对食品市场秩序的维护起到促进作用。总之,分析研究者应不断改善超高效液相色法在食品分析中的应用,将食品安全分析检测始终作为有意义的研究科学。

图5 UHPLC(下)和HPLC(上)分离绿茶中FOG化合物[32]
3.3 生化与代谢组分分析
随着分析仪器与技术的快速发展,生物化学分析以及生命体中代谢组分的研究已经成为了生命科学研究的一大热点。
SAnne M. Evans[39]等报道了UHPLC与HPLC法对人血浆小分子提取物的分离。如图6所示,UHPLC方法的分析速度更快,因此更能有效应用于生化与代谢组分分析。Eva Hényková等[40]采用超高效液相色谱-电喷雾串联质谱法(UHPLC-ESI-MS/MS)对L-色氨酸(L-TRP)和其在人血清和脑脊液(CSF)中的16种代谢产物进行定量分析,并且涵盖了L-TRP分解代谢的主要和次要路线。该方法在UHPLC分离中峰型较窄,分离度较高,能在24h以内对100个样品进行精确分析。Liu Haiyan等[41]采用UHPLC-MS/MS法对大鼠血浆中的elbasvir(ELB)进行定量分析。该方法用氘化ELB作为样品的内标物,并采用简单的蛋白质沉淀法对样品进行预处理。该法所需要的大鼠血浆量较少,分离速度快,可在3min内完成对ELB的分离检测,另外有较高的灵敏度和准确度,在大鼠的药代动力学研究中有较好的适用性。Wang Haidong等[42]利用UHPLC-MS/MS法首次对人体血浆中屈昔多巴进行定量分析。该方法的分离速度快,所需要的人体血浆样品量较少(仅需10μL),另外,该方法基质干扰较小,稳定性较高,并成功应用于屈昔多巴在人体中药代动力学研究。R. Rezk Mamdouh 等[43]采用简单的液-液萃取技术对人血浆样品进行预处理,用UHPLC-MS/MS法对样品中雷迪帕韦(LD)和索非布韦(SF)进行定性分析。该方法具有较高的灵敏度和精确度,并且分析速度较快,每次分析时间约为2min,每天可对400多个血浆样本进行分析,提供了一种大规模分析检测SF和LD含量的途径。P. Feliciano Rodrigo等[44]采用微固相萃取法结合UHPLC-Q-TOF MS技术对人血浆和尿液中的酚类代谢产物进行快速的分析和检测。该方法具有较好的重现性和稳定性,在食用蔓越莓汁等苯酚含量丰富的食物后,该方法可在人血浆和尿液中对其代谢产物进行精确的定量检测。
通过分析研究者在生化和代谢组分方面的研究来看,超高效液相色谱法凭借其超快速,超灵敏等优势越来越多的被应用。超高效液相色谱法不仅能有效的检测到生物体内的化学物质,还能对生物体内复杂的代谢组分实现分离检测,为生命科学中疾病病理研究和生物学系统探究等相关领域的进一步发展奠定了坚实的基础。

图6 UHPLC和HPLC对人血浆小分子提取物的分离比较[39](a).HPLC方法;(b).UHPLC方法
3.4 环境分析
近年来随着人口数量的急剧增长和工农业的快速发展,环境污染问题愈来愈严峻,尤其是短缺水资源中含有各类新兴重金属污染物和有机污染物,而且含量极低。由于环境本身就是一个复杂的综合体系,污染物质相互作用后变得更为复杂,因此需要采用高灵敏度、高精确度、高选择性的检测方法来对环境中的污染物进行检测。
刘玉等[45]采用QuEChERS-UHPLC-MS/ MS联用技术对土壤中的3种三硝基酚类的污染物残留进行了快速的分析,并采用ESI负离子模式和多反应模式(MRM)检测对这三种酚类的结构进行了定性分析。总之,该方法在简化预处理步骤的同时,简便快捷,也进一步证实UHPLC在土壤污染检测方面不可或缺的作用。张明等[46]采用固相萃取-UHPLC-电喷雾串联三重四级质谱的方法对水中的16种全氟有机化合物的高通量检测。通过对色谱和质谱条件的双重优化,在梯度洗脱下7min可实现对16种物质的分离,而且呈现出较好的线性关系,相关系数为0.9987~0.9999,检出限为0.06~0.46ng/L,因此具有较高的灵敏度和稳定性,可适用于水样中全氟有机化合物的检测。邱盼子等[47]基于先前的工作,致力于建立一种系统检测水中抗生素的方法。他们采取UHPLC-MS联用的技术,通过对样品的快速前处理,即改变不同萃取条件,在多反应监测模式下对水中的抗生素进行定性定量分析。该方法可实际应用到制药厂废水中相关物质的检查,并且进一步证实UHPLC在检测水中抗生素方面有着重大意义。Shi Zhihong等[48]采用石墨烯固相萃取技术与UHPLC-MS/MS技术结合的方法对环境水样中氨基甲酸酯类农药残留进行分析检测。该方法可对湖水、河水等环境水样进行预处理,并对水样品中的六种氨基甲酸酯类农药残留进行快速的分离,并成功应于环境水样中农药残留的检测,保障水质的安全。Andrea Speltini等[49]采用UHPLC-ESI-MS/MS技术对环境堆肥中氟喹诺酮类药物(FQS)进行分析检测。与之前文献中报道的方法相比,该方法操作简单,分析快速,环保且成本低廉,在实际堆肥样品中氟喹诺酮类药物的检测中有较好的回收率和较高的精密度,相对标准偏差小于15%。因此,该方法适用于环境堆肥中氟喹诺酮类药物的测定,从而为判断堆肥中抗生素是否完全去除提供了依据。Zhang Hongna 等[50]采用UHPLC-MS / MS对土壤-植物的污泥系统中氟调聚物醇(FTOHs)降解产物的分析测定。该方法对土壤-植物复杂系统中FTOHs及其降解产物的测定具有较高的回收率和较好的重现性,对研究FTOHs及其降解产物在其他复杂环境体系中的检测提供了有效的途径。Pekar Heidi等[51]采用UHPLC-MS/MS技术对环境源水域和饮用水中的藻类毒素(如类毒素-α、微囊藻毒素等)进行分析检测。该方法可同时对环境水域和饮用水中的22种藻类毒素进行分离检测,并且该方法有较好的稳定性和重现性,以及有较少基体效应的干扰。因此,该方法可以对环境水域藻类毒素进行大规模的精确检测。
高效液相色谱法在环境分析领域研究中的应用集中在土壤污染物、水污染物和空气污染物的分离检测。通过分析工作者的研究来看,高效液相色谱法能有效实现对土壤中污染物和废水中的抗生素等污染物的分离检测。在环境日益恶化的今天,我们应不断完善高效液相色谱法在环境分析中应用,对环境中的污染物实现强有力的分析检测,为环境的治理和保护提供强有力的保障和支持。
3.5 其他方面的分析
超高效液相色谱不仅在环境分析、生化和代谢物分析、食品分析和药物分析等方面发挥着越来越重要的作用,而且在其他领域(如化妆品类分析、食品包装材料及纺织品分析)也扮演着不可或缺的角色。近年来,化妆品种类越来越多,其化妆品中所添加的化学物质是否对人体存在危害,其安全性能的指标也成为消费者最为关注的焦点。
陈静等[52]采用了超高效液相色谱法同时测定了化妆品中环丙沙星、沙拉沙星等19种喹诺酮类抗生素。其方法的回收率在75.5%~105.1%,相对标准偏差为0.4%~1.1%,各种喹诺酮类抗生素的检出限为1.2~14.7mg/kg。通过与传统的液相色谱法以及LC-MS/MS法进行分离检测的比较,结果表明,UHPLC法能同时对19种物质实现很好的分离,分析时间更短,所需要样品量更少,因此适合于化妆品的实际检测。牛增元等[53]在先前工作的基础上,同样采用了UHPLC-线性离子阱/静电场轨道阱组合式高分辨质谱法,对化妆品中89种禁用的化学物质进行快速的筛选和定性分析。结果表明化合物有较好的线性关系,线性相关系数R2大于0.99,不同添加水平下的平均回收率在60%~117%之间,相对标准偏差小于13%。此方法具有较好的稳定性和可靠性,为化妆品中更多化学物质的检测奠定了良好的基础。钱晓燕等[54]采用了固相萃取(SPE)-UHPLC- MS/MS相结合的方法对化妆品中常见的12种的着色剂进行系统的分析检测。通过对色谱条件的优化,12种着色剂可在6min内达到完全分离,并保持良好的峰形,测定的加标回收率为60.8%~118.0%,相对标准偏差为2.3%~10.8%。因此该方法能定量分析各类化妆品中的着色剂。
近年来,高效液相色谱法在化妆品有害物质的分析检测领域发挥着重要作用。高效液相色谱法不仅能实现化妆品中喹诺酮类抗生素的分离,还实现对市售化妆品中的几十种禁用的化学物质快速的分析。总之,高效液相色谱法逐渐成为化妆品实际检测的有效手段,为市场的有效监管提供了保障。因此,高效液相色谱法在未来各种各样实际样品检测的研究中都将扮演着重要角色。
4 结论与展望
综上所述,近十年来超高效液相色谱技术(UHPLC)不仅在在色谱柱方面,还是色谱柱填料方面都取得较大进步。粒径分布较好的小粒径填料(1-3μm)的发展是推动UHPLC快速发展的原动力。另外,分析研究者们更基于理论基础的研究对超高效液相色谱的原理进行进一步完善,延伸了液相色谱柱的应用范围。UHPLC在分析应用上面与传统的液相色谱技术(HPLC)相比,有其独特的优势所在。例如:分离能力超强、灵敏度超高、溶剂需要量较少和分析速度超快等优点。另外UHPLC可实现与HPLC简单方便的转换,与质谱和核磁具有良好的接入口,能与质谱串联进而达到对复杂体系的分析和检测。目前,UHPLC-MS联用技术广泛的应用于食品分析、生化分析、药物分析和环境分析等方面,对复杂体系中的复杂样品进行快速准确的分析检测,达到令人满意的结果,也为后续分析检测工作奠定了良好的基础。因此,UHPLC与其他仪器的联用的方法,能够满足一些复杂基质中痕量物质的分析,在以后的实际应用中有广阔得前景。UHPLC虽取得了较快的发展,但是在分析应用上仍存在一些缺陷。这些缺陷并不是仪器自身设备性能的问题,而是在对UHPLC分析的需求越来越多,市场所供应的不同分离机制的小颗粒填料较少,不能完全满足一些行业特殊的分析要求,另外与其联用配套的相应仪器设施的发展也不健全,急需改善。因此,对后续的UHPLC分析者,在制备多元化的色谱柱填料和建立多种仪器联用的分析方法方面提出了更高的要求。
[1]Novakova L, Matysova L, Solich P. Advantages of application of UPLC in pharmaceutical analysis[J]. Talanta, 2006, 68(3): 908-918.
[2]Nguyen D T T, Guillarme D, Rudaz S, et al. Chromatographic behaviour and comparison of column packed with sub-2μm stationary phases in liquid chromatography[J]. Journal of Chromatography A, 2006, 1128(1): 105-113.
[3]Swartz M E. UPLCTM: an introduction and review[J]. Journal of Liquid Chromatography amp; Related Technologies, 2005, 28(7-8): 1253-1263.
[4]安蓉, 薄美萍. 超高效液相色谱与质谱联用技术改善药残和代谢物分析的结果质量[J]. 现代科学仪器, 2006, 6(1): 20-23.
[5]Van Deemter J J, Zuiderweg F J, Klinkenberg A. Longitudinal diffusion and resistance to mass transfer as causes of nonideality in chromatography[J]. Chemical Engineering Science, 1956, 5(6): 271-289.
[6]甘宾宾, 蔡卓, 蒋世琼,等. 超高效液相色谱在现代分析检验中的应用进展[J]. 中国卫生检验杂志, 2008, 18(5):955-957.
[7]戴朝政. 超高效液相色谱塔板高度方程的推导[J]. 色谱, 2015(5):535-540.
[8]Wyndham K D, O'Gara J E, Walter T H, et al. Characterization and Evaluation of C18 HPLC Stationary Phases Based on Ethyl-Bridged Hybrid Organic/Inorganic Particles[J]. Analytical Chemistry, 2003, 75(24):6781-6788.
[9]Waters.CSH (表面带电杂化颗粒) 技术. http://www.waters.com/waters/zh_CN/CSH-(Charged-Surface-Hybrid)-Technology/nav.htm?cid=134618101amp; locale=zh_CN. 2016.10.0.
[10]Waters.HSS(高强度硅胶颗粒)技术. http://www. waters.com/waters/zh_CN/HSS-(High-Strength-Silica)Technology/nav.htm?cid=134618105amp;locale=zh_CN. 2016.10.01.
[11]Walter T H, Andrews R W. Recent innovations in UHPLC columns and instrumentation[J]. TrAC Trends in Analytical Chemistry, 2014, 63: 14-20.
[12]DeStefano J J, Langlois T J, Kirkland J J. Characteristics of superficially-porous silica particles for fast HPLC: some performance comparisons with sub-2-um particles[J]. Journal of chromatographic science, 2008, 46(3): 254-260.
[13]Qu Q, Min Y, Zhang L, et al. Silica Microspheres with Fibrous Shells: Synthesis and Application in HPLC[J]. Analytical chemistry, 2015, 87(19): 9631-9638.
[14]Omamogho J O, Glennon J D. Comparison between the efficiencies of sub-2um C18 particles packed in narrow bore columns[J]. Analytical chemistry, 2011, 83(5): 1547-1556.
[15]Omamogho J O, Hanrahan J P, Tobin J, et al. Structural variation of solid core and thickness of porous shell of 1.7 μm core-shell silica particles on chromatographic performance: Narrow bore columns[J]. Journal of Chromatography A, 2011, 1218(15): 1942-1953.
[16]Sanchez A C, Friedlander G, Fekete S, et al. Pushing the performance limits of reversed-phase ultra high performance liquid chromatography with 1.3 μm core-shell particles[J]. Journal of Chromatography A, 2013, 1311: 90-97.
[17]Gritti F, Guiochon G. Rapid development of core-shell column technology: Accurate measurements of the intrinsic column efficiency of narrow-bore columns packed with 4.6 down to 1.3 μm superficially porous particles[J]. Journal of Chromatography A, 2014, 1333: 60-69.
[18]Fekete S, Guillarme D. Kinetic evaluation of new generation of column packed with 1.3 μm core-shell particles[J]. Journal of Chromatography A, 2013, 1308: 104-113.
[19]Bagwe R P, Yang C, And L R H, et al. Optimization of Dye-Doped Silica Nanoparticles Prepared Using a Reverse Microemulsion Method[J]. Langmuir the Acs Journal of Surfaces amp; Colloids, 2004, 20(19):8336-42.
[20]Cheng P, Zheng M, Jin Y, et al. Preparation and characterization of silica-doped titania photocatalyst through sol-gel method[J]. Materials Letters, 2003, 57(20):2989-2994.
[21]Chu X, Chung W I, Schmidt L D. Sintering of Sol—Gel-Prepared Submicrometer Particles Studied by Transmission Electron Microscopy[J]. Journal of the American Ceramic Society, 1993, 76(8):2115-2118.
[22]Stöber W, Fink A, Bohn E. Controlled growth of monodisperse silica spheres in the micron size range[J]. Journal of colloid and interface science, 1968, 26(1): 62-69.
[23]Nakabayashi H, Yamada A, Noba M, et al. Electrolyte-added one-pot synthesis for producing monodisperse, micrometer-sized silica particles up to 7 μm[J]. Langmuir, 2010, 26(10): 7512-7515.
[24]Yu B, Cong H, Xue L, et al. Synthesis and modification of monodisperse silica microspheres for UPLC separation of C 60 and C 70[J]. Analytical Methods, 2016, 8(4): 919-924.
[25]Guillarme D, Nguyen D T T, Rudaz S, et al. Method transfer for fast liquid chromatography in pharmaceutical analysis: Application to short columns packed with small particle. Part II: Gradient experiments[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2008, 68(2): 430-440.
[26]王静文, 黄湘鹭, 曹进,等. 超高效液相色谱法同时测定减肥类保健食品中非法添加的25种药物[J]. 色谱, 2014, 32(2):151-156.
[27]勾新磊, 高峡, 胡光辉,等. 超高效液相色谱-串联质谱法同时测定中成药和保健品中9种抗抑郁药物[J]. 色谱, 2014(8):822-826.
[28]Deng T, Wu D, Duan C, et al. Ultrasensitive quantification of endogenous brassinosteroids in milligram fresh plant with a quaternary ammonium derivatization reagent by pipette-tip solid-phase extraction coupled with ultra-high-performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2016,1456:105-112.
[29]Zhang C, Lian R, Mahmoodurrahman M, et al. Serum pharmacochemistry for tracking bioactive components by UPLC-Q-TOF-MS/MS combined chromatographic fingerprint for quality assessment of Sanziguben Granule[J]. Journal of Chromatography B, 2016, 1029: 128-136.
[30]Li P, AnandhiSenthilkumar H, Wu S, et al. Comparative UPLC-QTOF-MS-based metabolomics and bioactivities analyses of Garcinia oblongifolia[J]. Journal of Chromatography B, 2016, 1011: 179-195.
[31]钟艳梅, 冯毅凡, 郭姣. 基于UPLC/Q-TOF MS技术的白术药材化学成分快速识别研究[J]. 质谱学报, 2015, 36(1):72-77.
[32]Jiang H, Engelhardt U H, Thräne C, et al. Determination of flavonol glycosides in green tea, oolong tea and black tea by UHPLC compared to HPLC[J]. Food chemistry, 2015, 183: 30-35.
[33]蒋黎艳, 赵其阳, 龚蕾,等. 超高效液相色谱串联质谱法快速检测柑橘中的5种链格孢霉毒素[J]. 分析化学, 2015, 43(12):1851-1858.
[34]刘真真, 齐沛沛, 王新全,等. 磁纳米材料净化-超高效液相色谱-串联质谱测定猕猴桃中多农药残留[J]. 色谱, 2016, 34(8):762-772.
[35]Yin Z, Chai T, Mu P, et al. Multi-residue determination of 210 drugs in pork by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2016, 1463: 49-59.
[36]Delpino-Rius A, Eras J, Marsol-Vall A, et al. Ultra performance liquid chromatography analysis to study the changes in the carotenoid profile of commercial monovarietal fruit juices[J]. Journal of Chromatography A, 2014, 1331: 90-99.
[37]Campbell K, Cavalcante A L F, Galvin-King P, et al. Evaluation of an alternative spectroscopic approach for aflatoxin analysis: Comparative analysis of food and feed samples with UPLC-MS/MS[J]. Sensors and Actuators B: Chemical, 2017, 239: 1087-1097.
[38]Kim S, Park S L, Lee S, et al. UPLC/ESI-MS/MS analysis of compositional changes for organosulfur compounds in garlic (Allium sativum L.) during fermentation[J]. Food Chemistry, 2016, 211: 555-559.
[39]Evans A M, DeHaven C D, Barrett T, et al. Integrated, nontargeted ultrahigh performance liquid chromatography/electrospray ionization tandem mass spectrometry platform for the identification and relative quantification of the small-molecule complement of biological systems[J]. Analytical chemistry, 2009, 81(16): 6656-6667.
[40]Hényková E, Vránová H P, Amakorová P, et al. Stable isotope dilution ultra-high performance liquid chromatography-tandem mass spectrometry quantitative profiling of tryptophan-related neuroactive substances in human serum and cerebrospinal fluid[J]. Journal of Chromatography A, 2016, 1437: 145-157.
[41]Liu H, Xu H, Song W, et al. Validated UPLC/MS/MS assay for quantitative bioanalysis of elbasvir in rat plasma and application to pharmacokinetic study[J]. Journal of Chromatography B, 2016, 1015: 150-156.
[42]Wang H, Yang G, Zhou J, et al. Development and validation of a UPLC-MS/MS method for quantitation of droxidopa in human plasma: Application to a pharmacokinetic study[J]. Journal of Chromatography B, 2016,1027:234.
[43]Rezk M R, Bendas E R, Basalious E B, et al. Quantification of sofosbuvir and ledipasvir in human plasma by UPLC-MS/MS method: Application to fasting and fed bioequivalence studies[J]. Journal of Chromatography B, 2016,1028:63-70.
[44]Feliciano R P, Mecha E, Bronze M R, et al. Development and validation of a high-throughput micro solid-phase extraction method coupled with ultra-high-performance liquid chromatography-quadrupole time-of-flight mass spectrometry for rapid identification and quantification of phenolic metabolites in human plasma and urine[J]. Journal of Chromatography A, 2016, 1464: 21-31.
[45]刘玉, 张同来, 杨利,等. QuEChERS-超高效液相色谱串联质谱法测定土壤中三硝基酚类物质[J]. 分析化学, 2014(8):1183-1188.
[46]张明, 唐访良, 俞雅雲,等. 固相萃取-超高效液相色谱-电喷雾串联质谱法同时测定地表水中16种全氟有机化合物[J]. 色谱, 2014, 32(5):472-476.
[47]邱盼子, 郭欣妍, 王娜,等. 超高效液相色谱-串联质谱法同时测定制药废水中10种抗生素[J]. 色谱, 2015(7):722-729.
[48]Shi Z, Hu J, Li Q, et al. Graphene based solid phase extraction combined with ultra high performance liquid chromatography-tandem mass spectrometry for carbamate pesticides analysis in environmental water samples[J]. Journal of Chromatography A, 2014, 1355: 219-227.
[49]Speltini A, Sturini M, Maraschi F, et al. Fluoroquinolone residues in compost by green enhanced microwave-assisted extraction followed by ultra performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2015, 1410: 44-50.
[50]Zhang H, Wen B, Hu X, et al. Determination of fluorotelomer alcohols and their degradation products in biosolids-amended soils and plants using ultra-high performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2015, 1404: 72-80.
[51]Pekar H, Westerberg E, Bruno O, et al. Fast, rugged and sensitive ultra high pressure liquid chromatography tandem mass spectrometry method for analysis of cyanotoxins in raw water and drinking water—First findings of anatoxins, cylindrospermopsins and microcystin variants in Swedish source waters and infiltration ponds[J]. Journal of Chromatography A, 2016, 1429: 265-276.
[52]陈静, 郑荣, 季申,等. 超高效液相色谱法同时测定化妆品中的19种喹诺酮类抗生素[J]. 分析化学, 2013, 41(6):931-935.
[53]牛增元, 罗忻, 王凤美,等. UPLC-LTQ/Orbitrap MS快速筛查确证化妆品中89种禁用物质[J]. 质谱学报, 2016, 37(3):201-212.
[54]钱晓燕, 刘海山, 朱晓雨,等. 固相萃取/超高效液相色谱-串联质谱法测定化妆品中12种合成着色剂[J]. 分析测试学报, 2014, 33(5):527-532.
Developmentofultra-highperformanceliquidchromatographyanditsapplicationinthefieldofanalysis.
ZhangShuai1,CongHailin1,2,YuBing1,2*
(1.InstitueofBiomedicalMaterialsandEngineering,CollegeofChemistryandChemicalEngineering,QingdaoUniversity,Qingdao266071,China; 2.LaboratoryforNewFiberMaterialsandModernTextile,GrowingBaseforStateKeyLaboratory,CollegeofMaterialsScienceandEngineering,QingdaoUniversity,Qingdao266071,China)
In recent years, ultra-high performance liquid chromatography with ultra-fast, ultra-sensitive and other advantages has attracted more and more people's attention. During the improvement on the UHPLC theories, a series of breakthroughs have been made for the research of column packing. With the development of the UHPLC and the emergence of the UHPLC-MS technology, great theoretical significance and practical value as well as the broad prospects have been showed in the fields of food analysis, environmental analysis, biochemical analysis, drug analysis, etc.. In this paper, the development of ultra-high performance liquid chromatography column and its application in multiple fields were reviewed.
ultra-high performance liquid chromatography (UHPLC) column; ultra-high performance liquid chromatography-mass spectrometry; column packing material; separation and analysis
国家自然科学基金(21375069,21574072,21675091);山东省重点研发项目(2016GGX102028,2016GGX102039);山东省高等学校科技计划项目(J15LC20);青岛市民生科技计划项目(166257nsh).
10.3969/j.issn.1001-232x.2017.06.002
2016-12-12
张帅,硕士,主要工作是色谱分析,E-mail:434490540@qq.com。
于冰,博士,副教授,主要研究方向为色谱,E-mail:yubingqdu@163.com。
