玉米赤霉烯酮降解酶在马克斯克鲁维酵母中的表达及高产菌株的诱变筛选
2017-12-14王壬丰周峻岗胡小健徐天宇
王壬丰,周峻岗,胡小健,徐天宇,吕 红
(1. 复旦大学 生命科学学院 遗传工程国家重点实验室,上海 200438; 2. 上海工业菌株工程技术研究中心,上海 200438;3. 上海天复生物科技有限公司,上海 200438)
玉米赤霉烯酮降解酶在马克斯克鲁维酵母中的表达及高产菌株的诱变筛选
王壬丰1,2,周峻岗2,3,胡小健1,2,徐天宇1,2,吕 红1,2
(1. 复旦大学 生命科学学院 遗传工程国家重点实验室,上海 200438; 2. 上海工业菌株工程技术研究中心,上海 200438;3. 上海天复生物科技有限公司,上海 200438)
玉米赤霉烯酮(Zearalenone,ZEN)是镰刀菌属霉菌产生的一种霉菌毒素,常见于霉变的玉米、小麦等谷物中.研究发现,来源于粉红黏帚霉(Gliocladiumroseum)的α/β水解酶ZHD101能够断裂ZEN的内酯键,破坏ZEN的毒性.本文利用食品安全级的马克斯克鲁维酵母(Kluyveromycesmarxianus)重组分泌表达了ZHD101,发酵液上清中的表达产物具有水解ZEN的活性.利用UV和60Co-γ联合诱变方法,提高了ZHD101在马克斯克鲁维酵母中的表达水平.高效液相色谱(HPLC)分析表明,重组菌株分泌表达的ZHD101酶蛋白既能水解标准品ZEN,又能在较温和的条件下水解发霉玉米样本中的ZEN,结果表明该重组菌株表达的玉米赤霉烯酮降解酶ZHD101,可应用于发霉玉米的脱毒处理.
玉米赤霉烯酮; 玉米赤霉烯酮降解酶; 马克斯克鲁维酵母
玉米赤霉烯酮(Zearalenone,ZEN)是一种具有2,4-二羟基苯甲酸内酯结构的非甾类霉菌毒素,化学名为6-(10-羟基-6-氧基-11-碳烯基)-β-雷锁酸内酯,最初由Stob等从发霉的玉米中分离而得名[1].目前已发现的ZEN及其衍生物有11种之多,主要由镰刀菌属霉菌(如Fusariumculmorum,Fusariumgraminearum等)产生,是玉米、小麦、大麦等小颗粒谷物作物的常见污染毒素[2-3].其结构与哺乳动物的β-雌二醇激素相似,可竞争性结合雌激素受体ERs且活性不受甲胎蛋白抑制,进而扰乱E2-依赖的信号通路并导致E2-靶器官结构或功能的异常而影响家畜的发育与繁殖,对畜牧业造成巨大的经济损失[4].进一步研究表明,ZEN的毒性,会引起靶细胞DNA损伤和染色体畸变,还可以诱导细胞膜脂质过氧化损伤、细胞凋亡和免疫抑制[5-7].而ZEN及其衍生物通过食物链进入人体,将增大罹患肝癌、乳腺癌等恶性肿瘤的风险,危害人类健康[8].
目前针对ZEN的脱毒方法大致可分为物理法、化学法和生物酶解法,但由于天然ZEN及其衍生物的结构相对稳定,常规化学试剂或高温高压处理的策略存在一定的局限性,且潜伏着耗能大、环境二次污染严重等问题[9-10];尽管物理吸附法能够很大程度地去除污染谷物中的霉菌毒素,但并不能从本质上解决毒素降解的问题,且成本较高[11].相比之下,生物酶解法具有高效、特异性强、绿色环保等优势,是霉菌毒素降解的研究热点.目前已报道有多种微生物具有降解ZEN的能力,其中粉红黏帚霉(Gliocladiumroseum)来源的α/β水解酶ZHD101可断裂ZEN大环上的内酯键,形成1-(3,5-二羟苯基)-10’-羟基-1’反式十一碳烯-6’-酮产物,该产物尚未发现类雌激素效应[12-13].
本研究中,我们构建了马克斯克鲁维酵母(Kluyveromycesmarxianus)分泌表达ZHD101的重组菌株,并通过UV和60Co-γ联合诱变、HPLC筛选,获得了质粒稳定、ZHD101分泌表达量提高的重组突变株.该突变株分泌表达的ZHD101酶液具有较高的水解ZEN的能力,能够在较温和的反应条件下水解霉变玉米样本中的ZEN,研究结果可为发霉谷物的脱毒处理提供参考.
1 材料与方法
1.1 材 料
马克斯克鲁维酵母尿嘧啶缺陷菌株K.marxianusFIM-1(uraΔ)、大肠杆菌EscherichiacoliTOP-10、马克斯克鲁维酵母表达质粒pUKD-N112、赤霉烯酮水解酶ZHD101重组大肠杆菌表达载体PET-28b-zhd101均由本室前期构建和保存.赤霉烯酮标准品(Z2121-25MG)购自Sigma公司.His标签单抗Mouse anti-His-Tag单克隆抗体购自Abmart公司(Cat M30111M),二抗HRP-Goat anti-Mouse IgG(H+L)HSA购自KPL公司(Cat 074-1806).其他试剂为国产分析纯或色谱纯.
1.2 方 法
1.2.1 ZHD101重组表达质粒的构建
根据粉红黏帚霉(Gliocladiumroseum)中赤霉烯酮水解酶zhd101基因序列(GenBank KR363960.1),设计合成特异性扩增引物: YB-zhd101-F(5’-TTACAAGAGAGACGGTGACCCCGGGATGCGCACTCGTAGC-ACAATCT-3’)和YB-zhd101-R(5’-CAAAGCTTGCGGCCTTAAGCGGCCGCTCAGTGGTGGTGGTGGTG-GTG-3’),在反向引物中增加了6×His编码序列,便于重组蛋白的纯化与检测.以pET-28b-zhd101模板,通过PCR扩增zhd101 DNA片段,扩增产物经琼脂糖凝胶电泳回收,然后与SmaⅠ和NotⅠ双酶切的pUKD-N112片段,采用Gibson Assembly的同源重组方法(NEB公司,E2611S/L),将目的片段连接到K.marxianus表达载体pUKD-N112上,并转化E.coliTOP-10感受态细胞,挑取阳性克隆,测序鉴定,获得含zhd101的重组表达质粒pUKD-N112-zhd101.
1.2.2 ZHD101在马克斯克鲁维酵母中的表达
利用醋酸锂转化的方法[14],将重组表达质粒pUKD-N112-zhd101转化马克斯克鲁维酵母FIM-1(uraΔ)菌,转化产物涂布SD-Ura平板(Yeast nitrogen base w/o amino acids 6.7g/L, Glucose 20g/L, 10×Amino acids supplement without uracil 0.69g/L, Agar 20g/L),30℃培养2d.以YB-zhd101-F和YB-zhd101-R为引物,利用PCR方法对SD-Ura平板上的克隆进行鉴定,获得阳性克隆,命名为FIM/N112-zhd101-M0(菌株M0).随机挑取3个阳性克隆,接种50mL YD培养基(Yeast extract 20g/L, Glucose 20g/L)中,30℃培养72h,离心,取发酵液上清,用Western blot方法检测发酵液上清中ZHD101的蛋白表达.Western blot的抗体用Mouse anti-His-Tag(1∶3000).
1.2.3 薄层层析法(TLC)分析
用甲醇配制5mg/mL的ZEN储液,然后用50mmol/L pH 9.0 Gly-NaOH缓冲液配制成50ng/μL的ZEN底物工作液.取10μL重组菌株M0发酵上清液与90μL底物工作液混合,37℃反应后加入100μL乙腈终止反应,加入200μL乙酸乙酯充分震荡15min,12000r/min离心5min,吸上层乙酸乙酯相于新的EP管中,挥发干燥后用20μL乙醇溶解.取5μL乙醇重溶后的反应产物用TLC检测,展开剂为石油醚/丙酮/乙酸乙酯(体积比5∶4∶1),层析结束后吹干,并在紫外灯下观察薄层硅胶板.
1.2.4 重组菌株的诱变与筛选
取对数生长期的FIM/N112-zhd101-M0细胞,在紫外诱变炉(CL-1000 ΜLtraviolet Crosslinker)中照射30min,随后在30℃,220r/min摇床避光培养30min,4℃避光静置6~8h,再次UV诱变、避光恢复培养30min.取100μL经历两次连续UV诱变的菌液,转接至新鲜的YD培养基中,摇床培养至对数生长期,重复上述步骤,即每天2次UV诱变,连续5d.随后,再进行60Co-γ辐射处理1h,辐射剂量14.49kGy.取60Co-γ辐射处理前后的菌液,梯度稀释并涂布YEPD平板,30℃倒置培养3d后统计菌落数并根据公式计算60Co-γ辐射致死率.
γ辐射致死率=(1-诱变后活菌数/诱变前活菌数)×100%
(1)
诱变后的菌悬液涂布SD-ura平板,挑取克隆接种于0.7mL YD培养基/孔的24孔板中,30℃培养72h,用HPLC方法检测培养上清液中ZHD101的活性,筛选ZHD101高表达的突变株M1.
1.2.5 质粒稳定性分析
重组菌株FIM/N112-zhd101-M0和突变株M1的单菌落,分别接种于2mL YD培养基中,30℃,220r/min摇床培养过夜.按1∶5000转接至新鲜培养基中,于30℃,220r/min摇床连续培养20h(约为10代),按1∶5000转接至新鲜培养基中,继续培养,连续转接4次(约为40代).每10代的酵母细胞,适当稀释后分别涂布YEPD及YEPD+5FOA平板,30℃倒置培养2d.在含有5FOA的平板上能够生长的克隆,表示质粒丢失.用YEPD平板上生长的克隆减去5FOA平板上生长的克隆,再除以YEPD平板上生长的克隆,获得每10代重组酵母的质粒稳定性,如公式2所示.
质粒相对稳定性(%)=(1-5FOA平板上的菌落数YEPD平板上的菌落数)×100%.
(2)
1.2.6 高效液相色谱法(HPLC)分析
取10μL重组菌株M0发酵上清液,与90μL 50ng/μL ZEN底物工作液混合,37℃反应一定时间后加入100μL乙腈终止反应,4℃,14000r/min离心15min,取上清液进行HPLC检测.HPLC检测选用Agilent XDB-C18色谱柱(250mm×4.6mm,5μm),检测波长为240nm,色谱流动相条件: 0~8min(甲醇20%~80%);8~12min(甲醇80%);12~16min(甲醇80%~20%);流速为1mL/min.
1.2.7 发霉玉米中的ZEN降解效果分析
称取2g发霉玉米,经研磨粉碎后加入20mL重组菌株M0发酵上清液,充分混匀,放置室温过夜,加20mL乙腈溶液(V乙腈/V水=85∶15),充分震荡混匀过夜,离心,取上清液1mL,冻干后加入300μL乙腈重溶后过滤,滤液用HPLC检测ZEN含量.HPLC检测采用Agilent XDB-C18色谱柱(250mm×4.6mm,5μm),紫外检测波长为240nm,流动相条件为70%甲醇,流速为0.8mL/min.
2 结果与分析
2.1 ZHD101在马克斯克鲁维酵母中的表达及活性检测
重组表达载体pUKD-N112-zhd101转化K.marxianusFIM-1(uraΔ)后,转化子用引物YB-zhd101-F和YB-zhd101-R PCR筛选,结果如图1(a)所示,转化子中含有质粒pUKD-N112-zhd101,能够扩增出大小约850bp的条带.

图1 ZHD101重组表达马克斯克鲁维酵母菌株的构建及分泌表达分析Fig.1 Recombination and identification of the K.marxianus strain expressing ZHD101(a) FIM/N112-zhd101重组菌M0的PCR验证;(b) Western blot检测重组表达菌株发酵液上清中的ZHD101表达;(c) TLC分析发酵上清液中ZEN水解ZEN的活性.NC: 阴性对照组,WT为含空载质粒FIM-1(uraΔ)的发酵液上清.
重组菌M0经摇瓶培养72h后,离心收集发酵液上清,利用zhd101蛋白C端融合的6×His标签,Western blot检测上清中ZHD101蛋白表达,结果发现重组菌M0的上清中有大小约31kDa的杂交条带,大小与ZHD101预测分子量一致(图1(b)),表明重组菌株M0能够分泌表达ZHD101.
同时,用TLC分析发酵液上清中的ZHD101水解ZEN的活性(图1(c)).用M0发酵液上清与ZEN混合反应,随反应时间延长,ZEN的量逐渐减少,反应120min后降解完全,而在对照组WT中,ZEN的量没有明显变化,说明重组菌株M0能够分泌发酵表达赤霉烯酮降解酶ZHD101.
2.2 ZHD101高效分泌表达的K.marxianus菌株诱变筛选
为了进一步提高ZHD101的表达量,用UV和60Co-γ联合诱变的方法,对重组菌株FIM/N112-zhd101-M0进行诱变,60Co-γ诱变的致死率为99.97%.随后,利用24孔板微量培养与HPLC相结合的方法,筛选了4×103个突变菌株(图2(a)),获得了1株ZEN水解活性显著提高的突变菌株FIM/N112-zhd101-M1(M1菌株).M1发酵液上清的ZEN水解率明显高于M0,反应2h ZEN水解率为42%,而相同条件下反应M0水解率仅为13%,ZEN水解活力提高了2倍以上,从保留时间6min处的产物峰也可以发现M1菌株的ZEN水解率也明显高于M0(图2(b),(c)).通过PCR扩增出M1菌株中的zhd101基因并测序,发现该突变株中zhd101基因并未发生突变,说明突变株M1发酵上清液水解ZEN活力的提高,是由于该菌株ZHD101的分泌表达量提高引起的.
进一步分析比较了突变菌株与出发菌株的质粒稳定性,结果如图2(d)所示,菌株M0在培养过程中质粒丢失率较高,培养第10代后,质粒丢失率达20%左右,到30代时质粒丢失率已经高达80%以上.而突变菌株M1在培养的40代内,都没有检测到质粒的丢失.这一结果提示了诱变筛选后ZHD101表达分泌量的提高,可能与其质粒稳定性有关.而质粒稳定性提高的分子机制,还需要进一步研究.


图2 ZHD101高效表达突变株的筛选与鉴定Fig.2 High-throughput screening and verification for the mutant characterized by effectively expression of ZHD101(a) ZHD101高效分泌表达的K.marxianus突变株的筛选,热谱图展示了诱变后各克隆发酵液上清的ZEN水解能力;(b) HPLC比较了M0与M1发酵液上清的ZEN水解能力(WT为阴性对照组),ZEN为标准品图谱,0h、1h、2h、6h分别为反应对应时间后的样品检测图谱;(c) 利用ZEN峰面积定量得到M0和M1分泌表达的ZHD101的降解ZEN的效率;(d) 重组菌株M0及高产突变菌株M1中表达质粒的稳定性分析.
2.3 马克斯克鲁维酵母重组表达的ZHD101降解发霉玉米ZEN的效果分析
赤霉烯酮是玉米、小麦、大麦等小颗粒谷物作物的污染毒素,其中霉变玉米的检出率高达45%.为了检测重组表达的ZHD101对霉变玉米中ZEN的脱毒效果,我们用M1菌株的发酵上清液(粗酶液)直接作用发霉玉米.每克霉变玉米中加入10mL的ZHD101粗酶液,充分反应12h后,用液相色谱HPLC检测ZEN的残留.结果显示,保留时间12min的ZEN吸收峰在反应12h后基本消失(图3),而对照组K.marxianusFIM-1(uraΔ)(WT)发酵上清液处理霉变玉米后,其ZEN的含量并未发生变化,说明马克斯克鲁维酵母重组制备的ZHD101可用于去除发霉玉米中的ZEN.
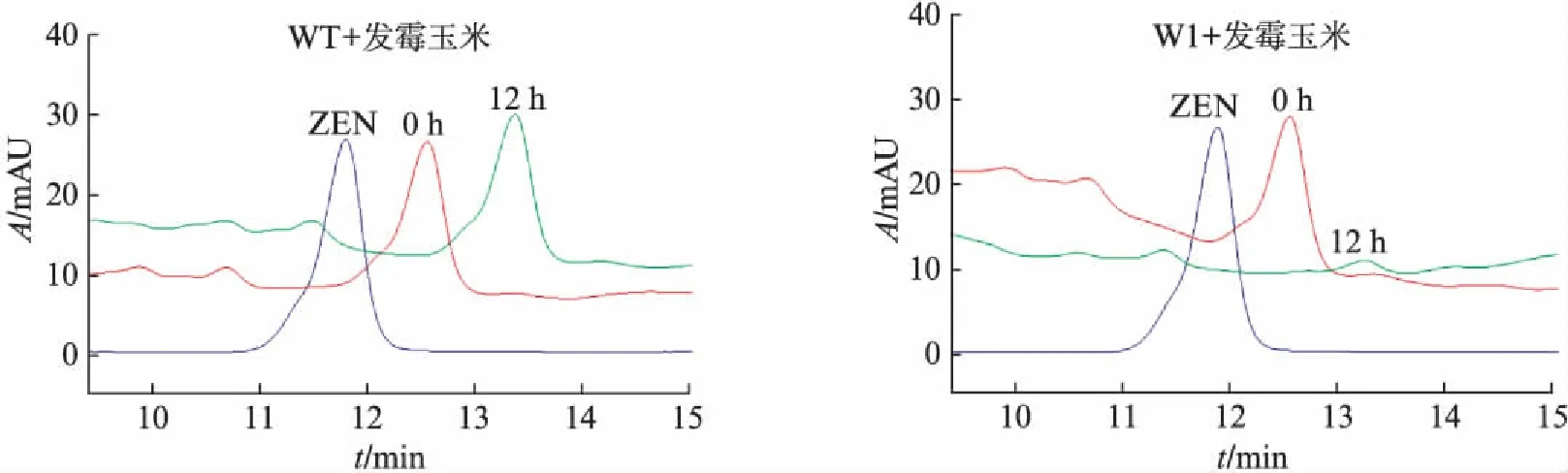
图3 HPLC检测重组蛋白ZHD101对发霉玉米样本中的ZEN的水解活性Fig.3 HPLC analysis to assess the ZHD101 derived detoxification of ZEN in the moldy cornHPLC分析突变株FIM/N112-zhd101-M1(M1)发酵液上清对发霉玉米样本中的ZEN的水解效果(WT为转入空载质粒的阴性对照组),ZEN为标准品图谱,0h、12h分别为反应对应时间后的样品检测图谱.
3 讨 论
据统计,全球约72%的饲料或饲料原料被霉菌毒素单独或联合污染,其中,由禾谷镰刀菌次级代谢产生的玉米赤霉烯酮(ZEN)是主要污染物[2,15].ZEN的化学结构类似于哺乳动物β-雌二醇,可在体内被还原为类雌激素活性更强的α-玉米赤霉烯醇(α-Zearalanol, α-ZEL)和低活性的β-玉米赤霉烯醇(β-Zearalanol, β-ZEL)两种非对称立体异构体.尽管机体内的ZEN及代谢物可在尿苷二磷酸葡糖醛酸转移酶的催化下与葡糖醛酸结合为共轭化合物,并随尿或胆汁排出体外,但其类雌激素活性依旧会扰乱机体内稳态,影响靶器官或组织的结构与生理机能.临床研究表明,ZEN可导致细胞DNA损伤和染色体畸变、生物膜脂质过氧化和免疫抑制等毒性,甚至随食物链进入人体诱发多种恶性肿瘤,严重威胁着人类的健康与社会的发展[16].为此,人们尝试利用转基因技术,将脱毒基因导入到谷物作物中,获得了具有ZEN抗性的水稻和玉米植株,降低赤霉烯酮污染风险[17-19].
粉红黏帚霉G.roseum内酯水解酶ZHD101可在较为温和的条件下催化ZEN水解为无雌激素效应的羟基酮,这无疑为实现霉菌毒素的生物脱毒提供了一种可能[12,17].该赤霉烯酮降解酶已经在大肠杆菌、酿酒酵母等表达系统实现了重组表达[18-20].本研究采用食品安全级GRAS(Generally Recognized as Safe)马克斯克鲁维酵母作为表达宿主菌,构建了分泌表达ZHD101的重组菌,实现了ZHD101分泌表达,且表达出的ZHD101能够水解ZEN.在此基础上,为了提高ZHD101酶蛋白的表达水平,对其进行了UV和60Co-γ联合诱变处理和筛选,获得了一株发酵液上清ZEN水解活力提高3倍以上的突变株,且从突变株扩增的zhd101基因序列未发生突变,提示水解能力的提高主要是ZHD101蛋白表达分泌量的提高所引起的.此外,我们发现该突变株中的质粒经40代后仍然保持稳定,推测ZHD101蛋白产量的提升可能与其质粒稳定性有关,但具体分子机制还需通过更深入的基因组重测序和比较基因组学分析进行揭示.
利用突变株M1制备的ZHD101粗酶液对发霉玉米样本中的ZEN表现出较理想的水解效果,未来可考虑应用于对污染谷物的规模化的脱毒处理,具有安全、环保的特征.尽管ZHD101通过将ZEN大环上的内酯键断裂,产生无雌激素活性的水解产物,但是如何将该水解产物完全降解成小分子物质,还需要寻找新的降解酶,与ZHD101协同作用,实现ZEN的完全降解.
致谢: 感谢华东理工大学牟伯中教授在60Co-γ辐射诱变实验上的帮助与指导.
[1] STOB M, BALDWIN R S, TUITE J,etal. Isolation of an anabolic, uterotrophic compound from corn infected withGibberellazeae[J].Nature, 1962,196(4861): 1318.
[2] STREIT E, NAEHRER K, RODRIGUES I,etal. Mycotoxin occurrence in feed and feed raw materials worldwide: long-term analysis with special focus on Europe and Asia [J].JournaloftheScienceofFoodandAgriculture, 2013,93(12): 2892-2899.
[3] BERTUZZI T, CAMARDO LEGGIERI M, BATTILANI P,etal. Co-occurrence of type A and B trichothecenes and zearalenone in wheat grown in northern Italy over the years 2009—2011 [J].FoodAdditivesamp;ContaminantsPartB-Surveillance, 2014,7(4): 273-281.
[4] ZATECKA E, DED L, ELZEINOVA F,etal. Effect of zearalenone on reproductive parameters and expression of selected testicular genes in mice [J].ReproductiveToxicology, 2014,45: 20-30.
[5] MINERVINI F, LACALANDRA G M, FILANNINO A,etal. Effects of in vitro exposure to natural levels of zearalenone and its derivatives on chromatin structure stability in equine spermatozoa [J].Theriogenology, 2010,73(3): 392-403.
[6] KOUADIO J H, MOBIO T A, BAUDRIMONT I,etal. Comparative study of cytotoxicity and oxidative stress induced by deoxynivalenol, zearalenone or fumonisin B1 in human intestinal cell line Caco-2 [J].Toxicology, 2005,213(1-2): 56-65.
[7] JIA Z, LIU M, QU Z,etal. Toxic effects of zearalenone on oxidative stress, inflammatory cytokines, biochemical and pathological changes induced by this toxin in the kidney of pregnant rats [J].EnvironmentalToxicologyandPharmacology, 2014,37(2): 580-591.
[8] YU Z L, ZHANG L S, WU D S,etal. Anti-apoptotic action of zearalenone in MCF-7 cells [J].EcotoxicologyandEnvironmentalSafety, 2005,62(3): 441-446.
[9] ABD ALLA E. Zearalenone: Incidence, toxigenic fungi and chemical decontamination in Egyptian cereals [J].Nahrung-Food, 1997,41(6): 362-365.
[10] BULLERMAN L B, BIANCHINI A. Stability of mycotoxins during food processing [J].InternationalJournalofFoodMicrobiology, 2007,119(1-2): 140-146.
[11] AVANTAGGIATO G, HAVENAAR R, VISCONTI A. Evaluation of the intestinal absorption of deoxynivalenol and nivalenol by an in vitro gastrointestinal model, and the binding efficacy of activated carbon and other adsorbent materials [J].FoodandChemicalToxicology, 2004,42(5): 817-824.
[12] TAKAHASHI-ANDO N, KIMURA M, KAKEYA H,etal. A novel lactonohydrolase responsible for the detoxification of zearalenone: Enzyme purification and gene cloning [J].BiochemicalJournal, 2002,365(1): 1-6.
[13] TAKAHASHI-ANDO N, OHSATO S, SHIBATA T,etal. Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene from Clonostachys rosea [J].AppliedandEnvironmentalMicrobiology, 2004,70(6): 3239-3245.
[14] ANTUNES D F, DE SOUZA C G, DE MORAIS M A. A simple and rapid method for lithium acetate-mediated transformation ofKluyveromycesmarxianuscells [J].WorldJournalofMicrobiologyamp;Biotechnology, 2000,16(7): 653-654.
[15] SEMPERE FERRE F. Worldwide occurrence of mycotoxins in rice [J]. Food Control, 2016,62: 291-298.
[16] ABASSI H, AYED-BOUSSEMA I, SHIRLEY S,etal. The mycotoxin zearalenone enhances cell proliferation, colony formation and promotes cell migration in the human colon carcinoma cell line HCT116 [J].ToxicologyLetters, 2016,254: 1-7.
[17] UTERMARK J, KARLOVSKY P. Role of zearalenone lactonase in protection ofGliocladiumroseumfrom fungitoxic effects of the mycotoxin zearalenone [J].AppliedandEnvironmentalMicrobiology, 2007,73(2): 637-642.
[18] HIGA-NISHshIYAMA A, TAKAHASHI-ANDO N, SHIMIZU T,etal. A model transgenic cereal plant with detoxification activity for the estrogenic mycotoxin zearalenone [J].TransgenicResearch, 2005,14(5): 713-717.
[19] IGAWA T, TAKAHASHI-ANDO N, OCHIAI N,etal. Reduced contamination by theFusariummycotoxin zearalenone in maize kernels through genetic modification with a detoxification gene [J].AppliedandEnvironmentalMicrobiology, 2007,73(5): 1622-1629.
[20] TAKAHASHI-ANDO N, TOKAI T, HAMAMOTO H,etal. Efficient decontamination of zearalenone, the mycotoxin of cereal pathogen, by transgenic yeasts through the expression of a synthetic lactonohydrolase gene [J].AppliedMicrobiologyandBiotechnology, 2005,67(6): 838-844.
ExpressionofZHD101inKluyveromycesmarxianusandtheMutationBreedingofHigh-FieldStrain
WANGRenfeng1,2,ZHOUJungang2,3,HUXiaojian1,2,XUTianyu1,2,LÜHong1,2
(1.StateKeyLaboratoryofGeneticEngineering,SchoolofLifeSciences,FudanUniversity,Shanghai, 200438,China;2.ShanghaiEngineeringResearchCenterofIndustrialMicroorganisms,Shanghai, 200438,China;3.ShanghaiTianfuBiologicalTechnologyCo.,LTD,Shanghai, 200438,China)
Zearalenone(ZEN), a nonsteroid estrogenic mycotoxin, produced by numerous Fusarium species in several moldy cereals, causes hyperestrogenic syndrome and homeostasis disorder of livestock and poses genotoxicity and carcinogenicity in mammals and humans. ZHD101 is a lactone hydrolase fromG.roseumthat could convert ZEN to a far less estrogenic product by hydrolyzing the lactone bond. In this study, we cloned and expressed the zhd101 gene in the GRAS(Generally Recognized as Safe)yeastK.marxianusfor producing the ZHD101 hydrolase in vitro. To elevate the expression of heterologous zhd101 in the recombinant, the UV-60Co-γ irradiation mutagenesis was introduced and a mutant possessed tripled hydrolytic activity and high plasmid stability was isolated using a high-throughput screening system. The detoxification capability of the recombinant ZHD101 was further investigated using the moldy corn. HPLC analysis showed that ZHD101 lactonase from the FIM/N112-zhd101-M1 mutant could hydrolyze ZEN in the moldy corn samples completely after 12h incubation at room temperature, suggesting that the recombinantK.marxianusstrain could be applied to the detoxification of moldy cereals.
Zearalenone; ZHD101;Kluyveromycesmarianus
0427-7104(2017)04-0431-07
2016-08-02
国家高技术研究发展计划项目(2013AA102803B,2014AA021301);上海市科委基地项目(13DZ2252000)
王壬丰(1991—),男,硕士研究生;吕 红,女,教授,通信联系人,E-mail: honglv@fudan.edu.cn.
Q814.9
A
