RP-HPLC法同时测定消化胶囊中厚朴酚与和厚朴酚的含量
2017-12-14张顺平
张顺平
RP-HPLC法同时测定消化胶囊中厚朴酚与和厚朴酚的含量
张顺平
目的 建立同时测定消化胶囊中厚朴酚与和厚朴酚含量的反向-高效液相色谱法。方法 采用高效液相色谱仪。 色谱柱:Amethyst C18-H(200 mm×4.6 mm,5 μm),流动相为乙腈-水-冰醋酸(60∶38∶2,V/V/V),流速为1.0 ml/min,柱温为30℃,检测波长为294 nm。结果 厚朴酚进样量在0.1048~2.0960 μg范围内线性关系良好(r=1.0000),平均回收率(n=6)为 98.72%(RSD=0.26%);和厚朴酚进样量在 0.1014~2.0276 μg范围内线性关系良好(r=1.0000),平均回收率(n=6)为96.73%(RSD=0.69%)。结论 建立的反向-高效液相色谱法准确、快捷,简便,结果稳定,可用于消化胶囊的含量测定。
消化胶囊;厚朴酚;和厚朴酚;反向-高效液相色谱法;含量测定
消化胶囊是由炒厚朴、木香、炒枳壳等九味药,经过粉碎、过筛、混合后制得,具有消食、健胃、除满的功效。用于治疗胸腹胀满、食欲不化、呕吐腹泻腹痛等症状患者。消化胶囊是曲靖市第一人民医院传统医院制剂,其质量标准[1]中未建立同时测定这两个成分的方法。由于处方中的炒厚朴含有厚朴酚与和厚朴酚,根据相关资料[2],该试验建立同时测定消化胶囊中厚朴酚与和厚朴酚的RP-HPLC法。该方法简便,准确,专属性强,重复性好,可用于该制剂的质量控制。
1 仪器与试药
Agilent1200型高效液相色谱仪,(包括G1311A四元泵,G1329A ALS自动进样器,G1316A TCC柱温箱,G1315D VWD检测器);KQ-300UDB型双频数控超声清洗器 (昆山市超声仪器有限公司);METTLE MS205DU电子天平(上海梅特勒-托利多仪器有限公司);一体式超纯水仪(PURELAB Flex 3,英国 ELGA 公司)。
对照品厚朴酚 (批号110729-200412,含量100%)、和厚朴酚 (批号 110730-201313,含量99.1%)均购于中国食品药品检定研究院;消化胶囊(云南省曲靖市第一人民医院,规格为每粒装0.28 g,医院制剂,批号 20150102、20150112、20150131);乙腈为色谱纯,甲醇为分析纯,冰醋酸为分析纯,水为超纯水。
2 色谱条件
色谱柱:Amethyst C18-H(200 mm×4.6,5 μm);流动相:乙腈-水-冰醋酸(60∶38∶2,V/V/V),流速:1.0 ml/min;柱温:30℃;检测波长:294 nm;进样量:10 μl。
3 溶液制备
3.1 混合对照品溶液 精密称取厚朴酚、和厚朴酚对照品适量,置100 ml容量瓶中,加甲醇使溶解并稀释至刻度,摇匀,制成每1 ml各含0.1 mg的混合溶液,即得。
3.2 供试品溶液 取样品内容物,混匀,取约0.67g,精密称定,置25 ml容量瓶中,加甲醇适量,超声处理(功率 500 W,频率 40 kHz)40 min,放冷,加甲醇至刻度,摇匀,滤过,取续滤液用0.45 μm微孔滤膜滤过,即得。
3.3 阴性样品溶液 按处方及工艺制备缺炒厚朴药材的阴性样品 (由云南省曲靖第一人民医院提供),再按“3.2”项下方法制备阴性样品溶液。
4 方法
4.1 专属性试验 分别精密吸取供试品溶液、混合对照品溶液和阴性样品溶液各10 μl,在上述色谱条件下,注入液相色谱仪,记录色谱图,结果详见图1。结果可见,在与对照品色谱峰相应的位置上样品具有相同保留时间的色谱峰,阴性样品在对应位置无吸收,供试品中主峰与其相邻色谱峰均能达到基线分离,对本品中厚朴酚与和厚朴酚的测定无干扰。
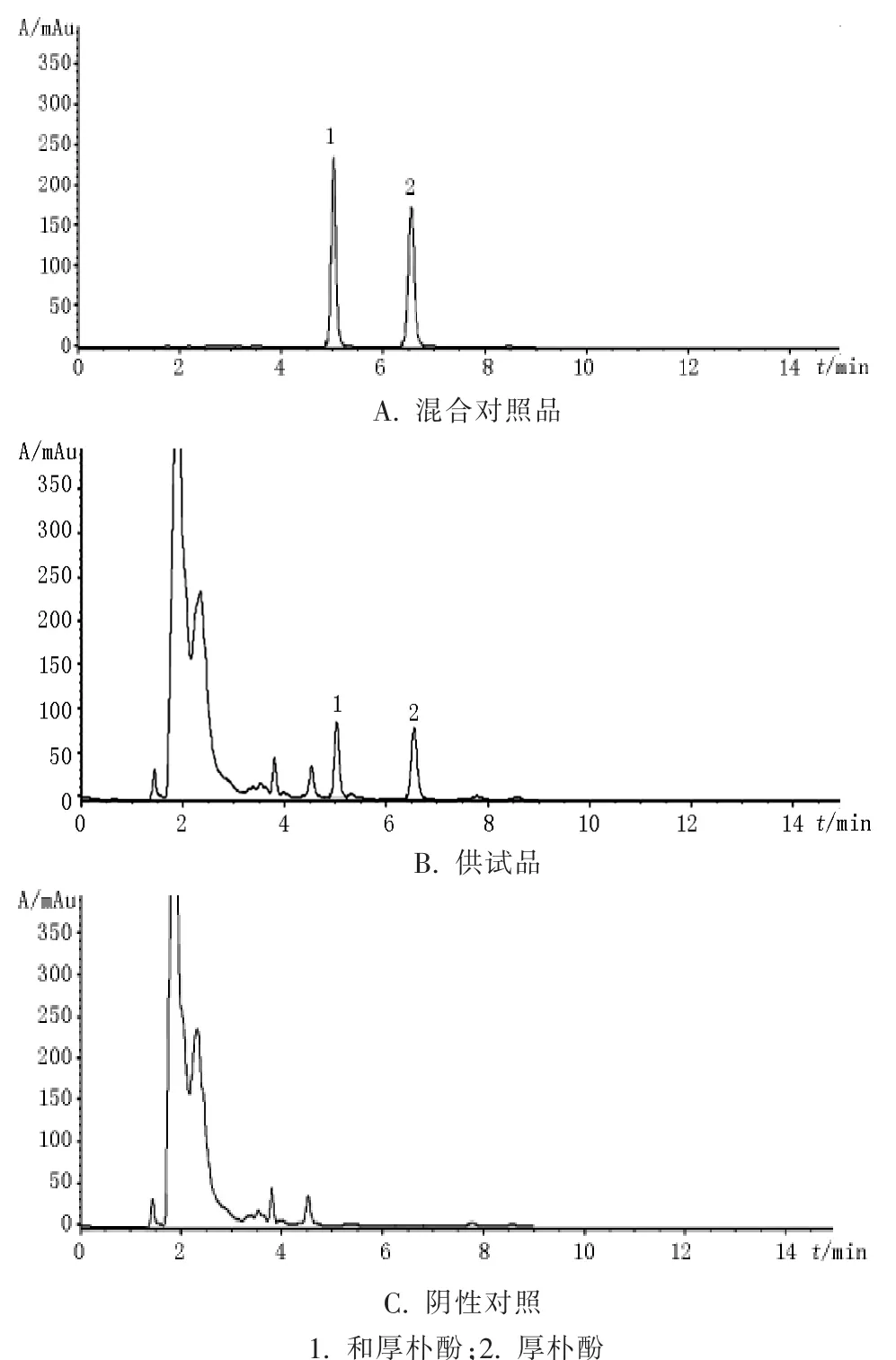
图1 高效液相色谱图
4.2 线性关系 精密吸取“3.1”项下的混合对照品溶液 1、2、4、6、8、10、20 μl, 分别重复进样测定3次,记录峰面积。以进样量X(μg)为横坐标(厚朴酚:0.1048、0.2096、0.4192、0.6288、0.8384、1.0480、2.0960; 和厚朴酚 :0.1014、0.2028、0.4055、0.6083、0.8110、1.0138、2.0276),峰面积平均值(Y)为纵坐标(厚朴酚:151.5、292.5、580.9、870.5、1160.2、1452.8、2924.1;和厚朴酚:168.6、325.3、648.2、920.2、1294.5、1620.6、3250.5),绘制标准曲线,计算厚朴酚、和厚朴酚的回归方程:

结果表明,厚朴酚进样量在0.1048~2.0960 μg范围内,和厚朴酚进样量在0.1014~2.0276 μg范围内线性关系良好。
4.3 精密度 精密吸取“4.1”项下的混合对照品溶液10 μl,在上述色谱条件下连续进样6次,记录峰面积。结果厚朴酚、和厚朴酚峰面积的RSD分别为0.32%、0.29%,表明仪器精密度良好。
4.4 稳定性试验 取同一供试品溶液 (样品批号20150131),在同一色谱条件下,分别于配置后0、2、4、8、12、24 h进样测定,记录峰面积。 结果厚朴酚、和厚朴酚峰面积的RSD分别为0.52%、0.41%。表面供试品溶液在24 h内稳定。
4.5 重复性试验 取同一批样品(批号:20150131)研细,精密称取6份,每份约0.67 g。按“3.2”项下的方法制备供试品溶液,照上述色谱条件进样10 μl测定,记录峰面积。结果测得每1 g样品中含厚朴酚1.7913 mg,RSD为0.38%;含和厚朴酚1.3670 mg,RSD=0.28%。
4.6 回收率试验 取同一批样品(批号:20150131)研细,精密称取6份,每份约0.34 g,每份均精密加入按 “3.1”项下的方法制备的混合对照品溶液10.0 ml,分别按“3.2”项下的方法制备供试品溶液,按上述色谱条件进样测定,记录峰面积,计算回收率,结果见表 1、2。
4.7 样品含量测定 取样品3批每批三份适量,分别按“3.2”项下的方法制备供试品溶液,按上述色谱条件测定,记录峰面积,以外标法计算样品中厚朴酚、和厚朴酚的含量,结果见表3、4。

表1 厚朴酚回收率试验结果(n=6)

表2 和厚朴酚回收率试验结果(n=6)
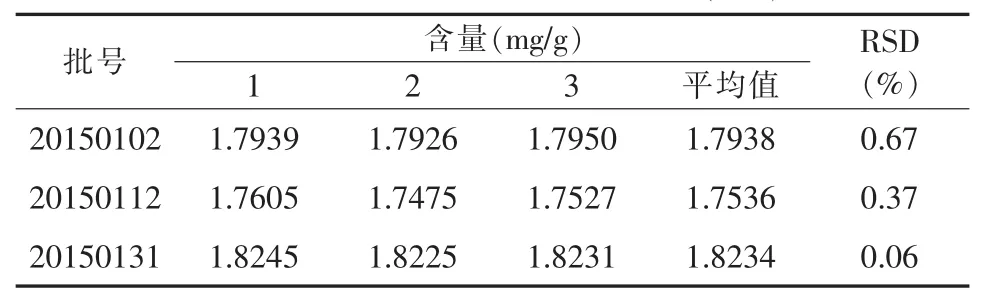
表3 样品中厚朴酚含量测定结果(n=3)

表4 样品中和厚朴酚含量测定结果(n=3)
5 讨论
5.1 定量分析对象及分析物的确定 炒厚朴为处方中的君药,目前尚无有关含量测定的相关报道。因此,该试验选取方中的炒厚朴主药进行定量分析研究;而厚朴酚与和厚朴酚作为厚朴的主药药用成分的定量分析已有相关报道[3,4],测定其成分更能有效控制其质量。
5.2 提取条件的确定 试验中曾采用三种提取方法进行提取:第一种用乙醇提取后直接进样分析;第二种将样品置于索氏提取器中,加甲醇适量加热回流提取3 h后,将提取液进样分析[2];第三种用甲醇提取后,直接进样分析[2]。结果,第二、三种提取方法均能达到良好的分离效果,从节约时间及经济成本出发,最终选择了甲醇提取后直接进样分析。
5.3 流动相的确定 参考中国药典及相关文献中厚朴酚、和厚朴酚的含量测定报道[2,5],分别采用甲醇∶水(22∶78,V/V) 与乙腈-水-冰醋酸(60∶38∶2,V/V/V)进行考察,结果发现采用乙腈-水-冰醋酸(60∶38∶2,V/V/V)保留时间合适且各成分获得较好的分离。
[1]云南省食品药品监督管理局.云南医院制剂标准[S].滇ZJGF/2005-543.
[2] 中国药典委员会.中国药典.2015年版:一部[S].2015:251,1204,1205.
[3]芦金清.中药厚朴的化学成分及临床研究[J].中医药学报,1989(5):39-42.
[4]殷帅文,何旭梅,朗峰祥,等.厚朴化学成分和药理作用研究概况[J].贵州农业科学,2007,35(6):133-135.
[5]邢俊波,贾恒明.HPLC法测定养胃软胶囊中厚朴酚、和厚朴酚的含量[J].中国中医药信息杂志,2008(1):55-56.
统计表的设计内容
1.表题。置于表身的上方,应简单明了,高度概括表的主题。
2.线条。通常用三线表,根据纵标目分层需要,表头可用短线分隔,最多不超过两层。如有合计(或总计)项,可不用短横线分隔。不用纵线、其他横线和左上角分标目斜线。
3.纵标目。也称表头,是统管由上到下各项数据的条目,可用短线分隔,最多不超过两层。
4.横标目。是统管由左至右各项数据的条目,根据分级需要,下一级条目应比上一级条目缩进1个字距,不超过两级;转行条目也应缩进1个字距,以与非转行条目区别。
5.分组研究统计表纵、横标目。最好以分组名称为纵标目,以各比较指标或观察项目为横标目,各级数据按比较指标或观察项目由上至下排,以便于各组的“纵向联系”和组间的“横向比较”,各组观察对象数分别写在分组名称后的圆括号内。
6.计量单位符号。全表数据为一种单位符号的,可统一写在表题的相应文字后的圆括号内;全表数据为多种单位符号的,可分别写在相应标目后的圆括号内。
7.数据。数字通常按小数点对齐,小数点后保留数位应尽可能一致;均数±标准差以符号“±”对齐。
8.显著性检验结果标注。应在有显著性的数值上角加注“*”号,表示差异有显著性(P<0.05),不标注表示无显著性差异(P>0.05)。
9.注释。对表设计或内容上的未尽问题,可在应加注的相应处加注其他符号或数码,注释文字,包括对显著性检验结果标注的文字说明,全部放在表的底线以下,不直接列入表内。
10.特殊情况的处理。应以表述内容为目的,合理地机动处理。如同一组数据的单位符号不一致时,单位符号可分别加在数据后;多角度数据显著性比较符号“*”不够时,可另选其他符号,如符号“#”、“▲”等。
Simultaneous determination of Honokiol and Magnolol in Xiaohua capsules by RP-HPLC ZHANG
Shun-ping.Qujing City's Inspection Center for Food and Drug,Qujing,Yunnan 655000,China
Objective To establish an HPLC method for the determination of Honokiol and Magnolol in Xiaohua capsules.Methods HPLC method was adopted.The determination was performed on Amethyst C18-H(200mm×4.6mm,5μm)column with mobile phaseconsisted of acetonitrile-phosphoric acid-water (60∶38∶2,V/V/V)at the flow rate of 1.0ml/min.The column temperature was 30℃,and the detectionwavelength was set at 294nm.Results Good linearity was shown in the range of 0.1048-2.0960μg for Honokiol with the average recovery of 98.72%(RSD=0.26%,n=6).0.1014-2.0276μg for Magnolol with the average recovery of 96.73%(RSD=0.69%,n=6).Conclusion The RP-HPLC method is accurate,rapid and simple one,which can be used for the determination of Xiaohua capsules.
Xiaohua capsule;Honokiol;Magnolol;RP-HPLC;Content determination
R286
A
10.14172/j.issn1671-4008.2017.10.029
655000云南曲靖,云南省曲靖市食品药品检验检测中心(张顺平)
[2017-03-31 收稿,2017-04-23 修回] [本文编辑:吴 蓉]
摘自《医学论文与书稿编写技巧》
