进口植物油脂中农药残留检测的前处理方法研究
2017-12-13张云青孟祥龙唐秀范广宇徐文科
张云青,孟祥龙,唐秀,范广宇,徐文科
(连云港出入境检验检疫局,江苏连云港222042)
进口植物油脂中农药残留检测的前处理方法研究
张云青,孟祥龙,唐秀,范广宇,徐文科
(连云港出入境检验检疫局,江苏连云港222042)
通过对进口植物油脂的前处理方法研究,即对传统的液液萃取方法进行改进,结合QuEChERS法、固相萃取法、优化后的GPC凝胶3种净化方法分析比较,发现QuEChERS法效果更理想,有效解决了油脂对农残测定的干扰问题,通过对油脂样品3个添加水平的6个平行样品分析,该方法的线性范围:0.02 mg/L~1.0 mg/L,油脂9项农残检出限及定量限范围分别为:0.01 μg/kg~0.65 μg/kg,0.04 μg/kg~2.16 μg/kg,本方法相关指标均满足检测要求,适用于进口油脂快速检测。
气相色谱-质谱法(GC-MS);农药残留;进口油脂
我国是世界第一植物油消费大国,由于在油料作物的种植过程中大量施用农药,以及在加工过程中溶剂提取、高温加热、吸附剂的加入都可能导致残留在油料种子中的农药分解、吸附[1],使得食用植物油中的农药残留问题日益严重,随着农业科技与经济水平的提高,人民在满足自身消费需求的同时,也越来越关注植物油中的农药残留问题,国际食品法典委员会(CodexAlimentariusCommission,简称 CAC)、世界卫生组织(World Health Organization简称WHO)、联合国粮食及农业组织(Food and Agriculture Organization简称FAO)、欧盟、美国、日本等对植物油中的农药残留均有严格的规定。已经于2017年6月实施的GB 2763-2016《食品安全国家标准食品中农药残留最大限量》对棉籽油、花生油、菜籽油、棕榈油等农药残留限量都做了明确规定[2],因此,研究建立准确有效、同时能检测植物油中多种农药的检测方法非常重要。
植物油中农残检测的关键是要去除其中的油脂大分子物质,不进行净化处理或净化不彻底会严重污染气质联用仪的色谱柱,缩短其使用寿命[3],所以植物油脂的前处理至关重要,目前植物油中农药残留检测的前处理方法主要有液液萃取冷冻脱脂法[4]、QuECh-ERS 法、固相萃取法[5-6]、GPC 法等[7]。
冷冻脱脂法耗时较长,固相萃取净化方法不能很好地同时兼顾多种目标农药且固相萃取小柱价格高、操作步骤多,凝胶色谱法仪器昂贵,样品处理耗时较长,不利于大量样品快速测定。QuEChERS法是一种分散固相萃取方法,其因快速、简单、廉价、有效、可靠和安全而得名[8],已被广泛用于蔬菜、水果、茶叶[9-11]等样品中农药残留的前处理过程,但在植物油中的应用研究还不多。本研究以液液萃取结合QuEChERS法及固相萃取法、GPC凝胶净化处理方法作为前处理手段,对传统的液液萃取方法加以改进,辅以气质联用仪建立植物油脂中9种主要农药残留的最佳检测方法,并用于进口植物油脂的农药检测。
1 材料与方法
1.1 仪器
GC/MS 7890-5975 气相色谱/质谱联用仪(EI)、HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm)、GC/MS 7890-5975C气相色谱/质谱联用仪(NCI)、HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm):美国 Agilent公司;XW-80A旋涡混合器:上海青浦沪西仪器厂;旋转蒸发仪:德国 Heidolph公司;氮吹仪(OA-SYS):美国Organomation公司;GPC 凝胶净化设备(ULTRA 10836):德国海道夫公司;TDL-40C台式离心机:上海安亭公司;固相萃取装置;分液漏斗。
1.2 材料
乐果、腐霉利、七氯、倍硫磷、顺-氯丹、反-氯丹、α-硫丹、β-硫丹及硫丹硫酸盐标准溶液(均为100 μg/mL):农业部环境保护科研监测所;有机溶剂均为色谱纯;PSA固相萃取粉末、C18固相萃取吸附剂、中性氧化铝柱(6 mL/1 g):美国 Agilent公司。
1.3 方法
1.3.1 标准溶液配制
分别准确移取100 μL的100 μg/mL的几种标准溶液混合,用丙酮稀释到1 mg/L的标准储备液,然后用丙酮进一步稀释成一系列的标准溶液。
1.3.2 油脂样品前处理
1.3.2.1 改进的液液萃取法提取
准确称取1.00 g植物油样品,加入10 mL乙腈饱和的正己烷溶剂充分溶解,倒入分液漏斗中,在分液漏斗中加入正己烷饱和的乙腈溶剂15 mL提取,下层乙腈层经加入少许无水硫酸钠的漏斗过滤于平底烧瓶中,如此重复提取3次于平底烧瓶中,旋转蒸发器蒸发近干,水浴温度设为38℃,待转移。
1.3.2.2 油脂样品净化
QuEChERS法:将1.3.2.1平底烧瓶中残渣用丙酮淋洗,每次用1.5 mL,共转移4次,转移液收集于10 mL的试管中,把收集到的液体置于38℃的水浴中氮气吹至近干,用丙酮定容至1.0 mL置于漩涡混合器中摇匀后分别添加0.1 g PSA粉末和0.10 g C18粉末后充分漩涡混合30 s后,离心5 min,转速3 500 r/min,吸取上层样液装瓶。
固相萃取法:将中性氧化铝中先后加入1.5 mL丙酮-正己烷(3∶7,体积比)试剂和5 mL左右正己烷试剂进行活化,用1.5 mL丙酮-正己烷(1∶2,体积比)试剂转移1.3.2.1中平底烧瓶中的残渣,重复3次,上样后再用10 mL丙酮-正己烷(3∶7,体积比)进行洗脱,洗脱液在39℃条件下浓缩至近干,用1 mL丙酮定容,离心后装瓶上机。
1.3.3 GPC凝胶净化方法
准确称取1.00 g植物油样品,加入10 mL环己烷/乙酸乙酯(1∶1,体积比),漩涡混匀,过 0.22 μm 滤膜后入GPC仪中净化,以Bio-Beads S-X3填料,柱长45cm,流速5mL/min,预洗时间 1050s,选择收集 1050 s~1 850 s的流出组分,使用自动浓缩功能将样品定量浓缩到2 mL,装瓶,供GC-MS测定。
2 结果与讨论
2.1 仪器方法选择
经过多次上机对比,GC/MS 7890-5975气相色谱/质谱联用仪(EI)对于乐果、腐霉利、氯丹、倍硫磷、七氯几种农药灵敏度高,定性能力强,最终选取进样口温度250℃,流速1 mL/min,柱温程序初温50℃,辅助通道温度280℃,进样量1 μL,不分流进样,柱子:HP-5MS(30 m×0.25 mm,0.25 μm),升温程序:50 ℃保持2 min,以20℃/min速度升至180℃,再以10℃/min升至240℃,保持4 min。
离子源:EI,离子源温度150℃,四级杆温度150℃,发射电流34.6 μA,溶剂延迟6 min;载气:高纯氦气,GC/MS 7890-5975C气相色谱/质谱联用仪(CI)对于含电负性基团的农药有很高的灵敏度,定性能力和抗干扰能力强,适合于三种硫丹类农药的检测。经过多次上机比较选取进样口温度250℃,流速1 mL/min,辅助通道温度280℃,进样量1 μL,不分流进样,反应气高纯CH4;升温程序:80℃保持1 min,以30℃/min速度升至130℃,再以10℃/min升至260℃,保持1 min。
根据各种农药全扫描质谱图及谱库检索确定各种农药的定量离子及定性离子见表1。
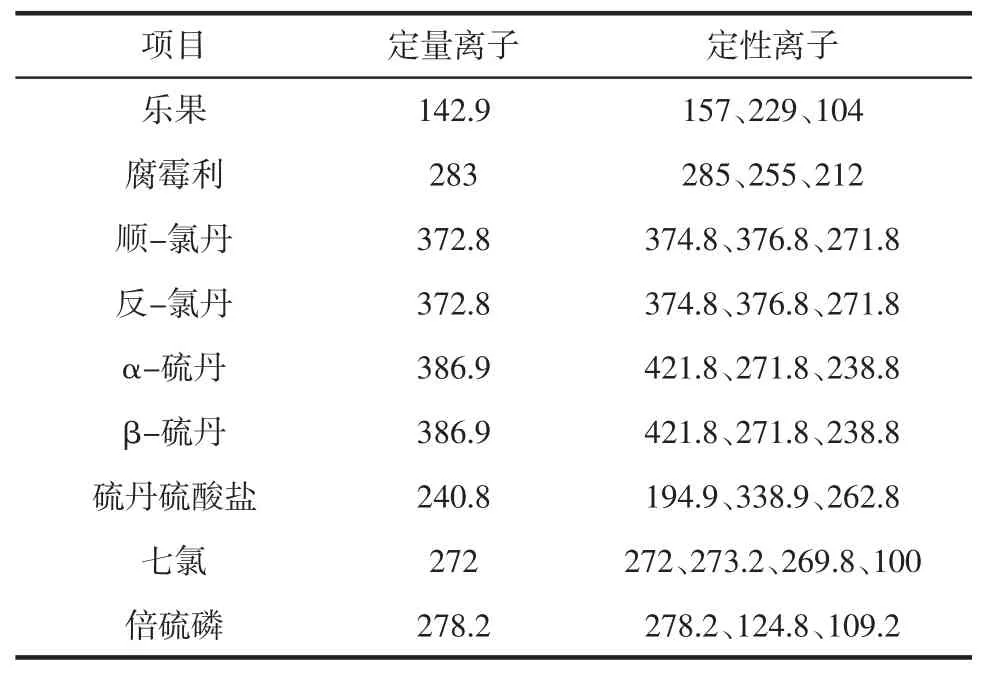
表1 各种农药的定量及定性离子Table 1 Characteristic fragment and Quantitative fragment of pesticides
2.2 提取溶剂的选择
前处理试验常用的溶剂主要有乙腈,正己烷,乙酸乙酯,由于乙腈在提取过程中溶解的油脂较少,相应的减少了基质干扰,而选择由正己烷饱和的乙腈溶液是为了减少已经溶于正己烷的油脂成分进入乙腈层,减少油脂干扰。
2.3 QuEChERS法固相萃取剂的选择
QuEChERS法采用乙腈为提取剂,PSA作净化剂去除基质干扰物质,已经被广泛用于水果蔬菜样品的前处理。而油脂类基质更为复杂,脂质含量较高,需要必要的除脂过程。C18粉末能够去除非极性物质,故本研究考察了PSA及C18不同用量的净化效果。最后选择了PSA用量100 mg,见图1,同理,最终确定C18用量为100 mg。
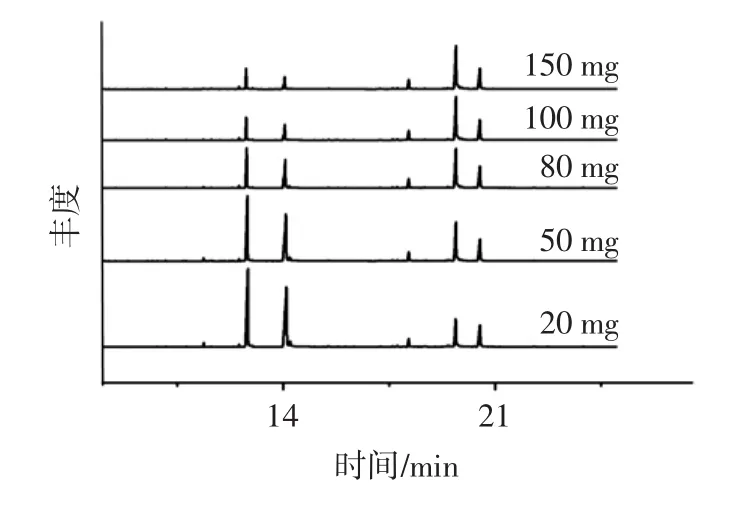
图1 PSA用量对基线的影响Fig.1 Effect of dosage of the PSA on baseline
2.4 GPC样品采集时间的选择
本研究考察了GPC最佳时间切割点的选择[12-13],0~1 000 s之间每 200 秒收集一份样品,1 000 s~2 000 s之间每50秒收集一份样品,共收集25份样品,分别上机进行气质联用仪检测,结果表明,第1 050秒以后的收集液中开始检出农药成分,而第1 850秒以后没有农药成分检出,所以本方法选择GPC收集时间为1 050 s~1 850 s。
2.5 洗脱溶剂选择
以丙酮和正己烷的混合溶液为洗脱剂,分别配制丙酮和正己烷的体积比为 1 ∶9、2 ∶8、3 ∶7、4 ∶6、5 ∶5的混合溶剂,其数据见表2。

表2 洗脱溶剂的影响Table 2 Effect of elution solvent
表2结果显示,丙酮和正己烷体积比为3∶7时回收率达到最大,因此,最终选用丙酮与正己烷体积比为3∶7的混合溶剂为洗脱剂。
2.6 前处理方法对比
采用3种处理方式,分别为改进的液液萃取法结合QuEChERS法、固相萃取法和优化后的GPC凝胶净化方法,通过加标回收来比较提取效果。在每种提取试验中,每种方法处理3个加标样品和1个基质标样,加标量50 μg/kg,采取3种不同的净化方法的添加回收数据见表3。
3种提取方式平均回收率均在75%以上,固相萃取法平均回收率87.9%,RSD为7.2%;QuEChERS法平均回收率86.9%,RSD为5.8%;GPC凝胶净化方法平均回收率为77.5%,RSD为7.4%。相对来说前两种处理方法回收率较高,效果较佳,比GPC凝胶净化方法处理效果好,同时,QuEChERS法比固相萃取法RSD低且除杂效果明显较好,见图2,A代表固相萃取法空白样品基线,B代表QuEChERS法空白样品基线,因此,综合比较选用改进的液液萃取结合QuEChERS法。

表3 9种农药不同前处理方式对比数据Table 3 Comparison of data of different methods of pretreatment of nine pesticides
2.7 标准曲线、回收率、精密度、检出限
准确配制质量浓度分别为 0.02、0.05、0.1、0.2、0.5、1.0 mg/L的农药标准溶液,在“2.1”条件下进行测定,以吸收峰面积(A)对质量浓度(ρ,mg/L)作标准曲线,得到各农药的线性方程。结果表明:9种农药在0.02 mg/L~1.00 mg/L范围内线性关系良好,相关系数为 0.997 6~0.999 8。在 2 g(精确到 0.01 g)精炼棕榈硬脂中分别加入0.04、0.1、0.4 mL混合标准储备液(1.0 mg/L),按“1.3.2”中 QuEChERS法进行检测,平行试验6次,计算各农药的平均回收率及相对标准偏差(数据见表4),9种农药的平均回收率78.1%~93.6%,相对标准偏差为1.9%~9.9%,以3倍信噪比设定方法检出限,10倍信噪比设定定量下限,9种农药方法检出限和定量下限分别为 0.01 μg/kg~0.65 μg/kg 和0.04 μg/kg~2.16 μg/kg。试验结果表明,本方法可以满足进口植物油中9种农药残留分析的要求,见表4。
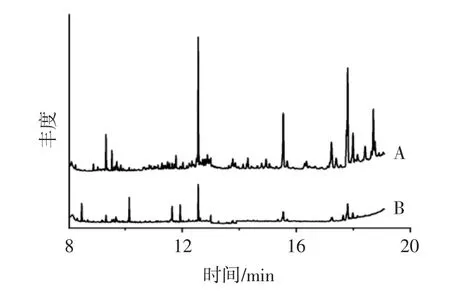
图2 棕榈硬脂空白样品经2种方法净化后的总离子流色谱图Fig.2 Total ion current chromatogram of blank refined after purification by two methods
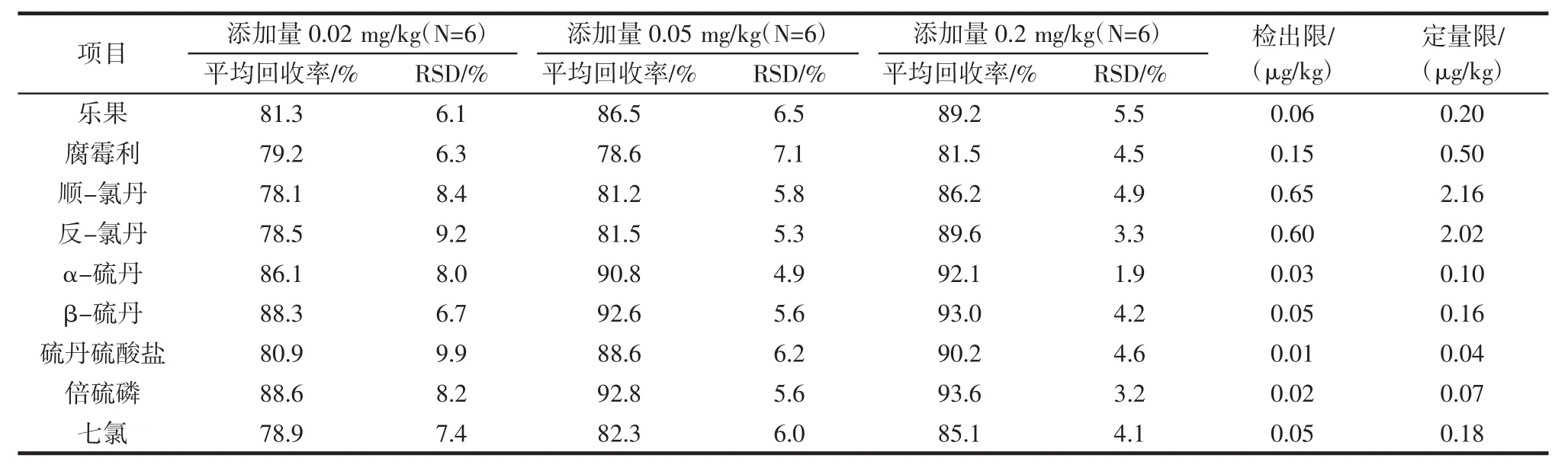
表4 9种农药的回收率、精密度、检出限与定量限Table 4 Recovery,Precision,LOD and LOQ of nine pesticides
3 结论
通过对油脂前处理常用的3种方法分别进行优化或改进后,并比较3种方法的处理效果,发现QuECh-ERS净化方法较好,回收率较高,RSD较小,净化效果较好,从而建立油脂的农残检测QuEChERS方法,即通过液液分配提取、转移、定容、净化、离心等过程,最后通过气质联用仪进行分析,该方法能去除大量的油脂干扰,耗时较短,方法重现性好,能满足进口油脂的农残检测要求。
[1]程景,李培斌,张文,等.基质固相分散-气相色谱法测定植物油中多种拟除虫菊酯类及有机磷类农药残留[J].中国油料作物学报,2008,30(3):346-352
[2]国家卫生和计划生育委员会,中华人民共和国农业部,国家食品药品监督管理总局.GB 2763-2016食品安全国家标准食品中农药最大残留限量[S].北京:中国标准出版社,2016
[3]郭岚,谢明勇,鄢爱平,等.GPC-GC-MS对食用植物油中多种类型农药残留的同步测定[J].分析测试学报,2009,28(1):67-71
[4]徐娟,王岚,黄华军,等.低温冷冻及分散固相萃取净化-超高效液相色谱-串联质谱法的测定植物油中104种农药残留[J].色谱,2015,33(3):242-249
[5]韩丽,郭德华,邓晓军,等.气相色谱-负离子化学电离质谱法测定水产品中残留的硫丹及其代谢物[J].色谱,2007,25(6):902-906
[6]陈树兵,俞雪钧,樊苑牧,等.冷冻去脂-固相萃取-气相色谱法快速测定水产品中硫丹、硫丹硫酸酯和溴氰菊酯残留量[J].分析试验室,2008,27(4):80-83
[7]GILLESPIEAM,DALYSL,GILVYDISDM,et al.Multi column solid-phase extraction cleanup of ganophosphorus and organochlorine pesticide residues in vegetable oils and butter fat[J].JAOACInt,1995,78(2):431-437
[8]Wilkowska A,Biziuk M.Determination of pesticide residues in food matrices using the QuEChERS methodology[J].Food Chem,2011,125(3):803-812
[9]叶江雷,金贵蛾,庄婉蛾,等.分散固相萃取净化茶叶中20种农药残留量的GC-μECD测定分析试验室[J].分析试验室,2011,30(10):115-119
[10]赵祥梅,董英,王和生.QuEChERS法在农产品农药残留物检测中的应用研究进展[J].中国检验卫生杂志,2008,18(5):952-954
[11]Lopes R P,de Freitas Passos EE,de Alkimim Filho JF,et al.Development and validation of a method for the determination of sulfonamides in animal feed by modified QuEChERS and LC-MS/MS analysis[J].Food Control,2012,28(1):192-198
[12]王兴宁,蔡秋.凝胶渗透色谱-固相萃取净化-气相色谱-串联质谱法测定茶叶中33种农药的残留量[J].理化检验-化学分册,2011,47(4):412-416
[13]孙汉文,康占省,李辉.凝胶渗透色谱-固相萃取净化-超快速液相色谱-串联质谱法检测牛肉中9种类固醇激素残留[J].分析化学,2010,38(9:):1272-1276
The Study on Pretreatment Methods for Determination of Pesticide Residues of Imported Plant Oils
ZHANG Yun-qing,MENG Xiang-long,TANG Xiu,FAN Guang-yu,XU Wen-ke
(Lianyungang Entry-exit Inspection and Quarantine Bureau,Lianyungang 222042,Jiangsu,China)
This study pay attention to the pretreatment methods of imported plant oils,comparing improved method of liquid-liquid traditional extraction combined with QuEChERS method,solid-phase extraction method to optimize GPC purification method,it showed that the QuEChERS method was more acceptable,assisted by the cold defatted method which can effectively solves of the problem of oil interference on determination of pesticide residues,by analyzing three addition levels of six parallel samples of plant oil,the linear range was:0.02 mg/L-1.0 mg/L.The range of nine oil pesticide LOD and LOQ was 0.01 μg/kg-0.65 μg/kg,0.04 μg/kg-2.16 μg/kg respectively,thus detection requirement was satisfied by related indexes of this method,suitable for rapid detection of imported oil.
gas chromatography-mass spectrometry(GC-MS);pesticide residue;imported oil
10.3969/j.issn.1005-6521.2017.24.033
张云青(1987—),女(汉),助理工程师,学士,主要从事进出口食品中农药残留检测工作。
2017-03-09
