HPLC法同时测定妇乐颗粒中4种成分的含量
2017-12-13罗晓霞曾偲偲祁龙凯广东省中医院药学部广州500广州中医药大学中药学院广州50006
罗晓霞,曾偲偲,祁龙凯(.广东省中医院药学部,广州500;.广州中医药大学中药学院,广州50006)
HPLC法同时测定妇乐颗粒中4种成分的含量
罗晓霞1*,曾偲偲1,祁龙凯2(1.广东省中医院药学部,广州510120;2.广州中医药大学中药学院,广州510006)
目的:建立同时测定妇乐颗粒中没食子酸、绿原酸、芍药苷、丹皮酚含量的方法。方法:采用高效液相色谱法。色谱柱为月旭XB-C18,流动相为甲醇-0.05%磷酸溶液(梯度洗脱),流速为1.0 mL/min,检测波长为270 nm(没食子酸、丹皮酚)、325 nm(绿原酸)、230 nm(芍药苷),柱温为30℃,进样量为10 μL。结果:没食子酸、绿原酸、芍药苷和丹皮酚检测进样量线性范围分别为0.076 2~1.524 μg(r=0.999 7)、0.037 6~0.751 μg(r=0.999 9)、0.030 3~0.606 μg(r=0.999 7)、0.020 6~0.412 μg(r=0.999 8);定量限分别为0.353、0.276、0.421、0.540 μg/mL,检测限分别为0.121、0.104、0.148、0.186 μg/mL;精密度、稳定性、重复性试验的RSD≤2.04%;加样回收率分别为95.24%~100.47%(RSD=1.59%,n=9)、99.49%~103.70%(RSD=2.27%,n=9)、96.27%~101.09%(RSD=1.94%,n=9)、95.05%~98.90%(RSD=1.22%,n=9)。结论:该方法操作简单、结果准确、重复性良好,可用于妇乐颗粒中没食子酸、绿原酸、芍药苷、丹皮酚含量的同时测定。
妇乐颗粒;高效液相色谱法;没食子酸;绿原酸;芍药苷;丹皮酚;含量
妇乐颗粒是由忍冬藤、大血藤、牡丹皮、赤芍、川楝子、熟大黄等中药制成的复方制剂,具有清热凉血、化瘀止痛的功效;常用于瘀热蕴结所致的带下病,症见带下量多、色黄,小腹疼痛,慢性盆腔炎见上述证候者,为妇科常用药[1]。目前妇乐颗粒收载于2015年版《中国药典》(一部)[1]及部颁标准《卫生部药品标准·中药成方制剂》(第18册)[2];前者仅要求测定大黄中大黄素和大黄酚的含量,后者也只要求测定牡丹皮中丹皮酚的含量,两者均缺乏对忍冬藤主要活性成分绿原酸[3],大血藤主要活性成分没食子酸、绿原酸等[4-5],赤芍、牡丹皮主要活性成分没食子酸、芍药苷、丹皮酚等的测定[6-9]。因此,笔者采用高效液相色谱法(HPLC)建立了测定妇乐颗粒中没食子酸、绿原酸、芍药苷、丹皮酚含量的方法,以期为完善该制剂的质量控制提供参考。
1 材料
1.1 仪器
E2695型HPLC仪,包括2998二级管阵列检测器(美国Waters公司);BP211D型电子分析天平(德国Sartorius公司);KQ-200型超声波清洗器(昆山市超声仪器有限公司);Milli-Q型超纯水机(德国Merck公司)。
1.2 药品与试剂
妇乐颗粒(湖北襄阳隆中药业集团有限公司,批号:151018、160404、160820、160918,规格:6 g/袋);没食子酸对照品(批号:110831-201630)、绿原酸对照品(批号:110753-201716)、芍药苷对照品(批号:110736-201640)、丹皮酚对照品(批号:110708-201407)均购自中国食品药品检定研究院,纯度均≥98.0%;甲醇和磷酸均为色谱纯,其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 色谱条件
色谱柱:月旭XB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.05%磷酸溶液(B),梯度洗脱(0~8 min,5%→11%A;8~18 min,11%→13%A;18~19 min,13%→15%A;19~27 min,15%→18%A;27~28 min,18%→53%A;28~38 min,53%→60%A);流速:1.0 mL/min;检测波长:270 nm(没食子酸、丹皮酚)、325 nm(绿原酸)、230 nm(芍药苷);柱温:30℃;进样量:10 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液 取没食子酸、绿原酸、芍药苷和丹皮酚对照品各适量,精密称定,置于同一100 mL量瓶中,加甲醇溶解并定容,制成每1 mL含没食子酸152.4 μg、绿原酸75.1 μg、芍药苷60.6 μg、丹皮酚 41.2 μg的混合对照品溶液。
2.2.2 供试品溶液 取样品1袋,置于研钵中,研成细粉,真空干燥过夜后,精密称取样品粉末1.0 g,至于50 mL具塞锥形瓶中,加入甲醇25 mL,超声(功率:150 W,频率:40 kHz,下同)处理20 min,放冷后用甲醇补足减失的质量,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.3 阴性对照溶液 按样品的制备工艺和处方比例,制备分别缺大血藤、赤芍、牡丹皮,缺忍冬藤、大血藤,缺赤芍、牡丹皮的阴性样品,再按“2.2.2”项下方法制备阴性对照溶液,即得。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和阴性对照溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,在该色谱条件下,各成分均能达到基线分离,分离度>1.5;理论板数以没食子酸峰计为5 500,保留时间为6.948 min。结果表明,其他成分对测定无干扰。

图1 高效液相色谱图Fig 1 HPLC chromatograms
2.4 线性关系考察
取“2.2.1”项下混合对照品溶液0.5、1.0、2.5、5.0、10 μL,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归。回归方程与线性范围见表1。
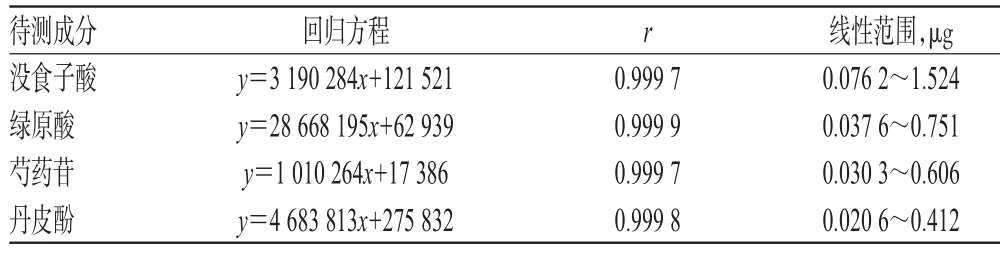
表1 回归方程与线性范围Tab 1 Regression equations and linear ranges
2.5 定量限(LOQ)与检测限(LOD)考察
取“2.2.1”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。当信噪比为10∶1时,得LOQ;当信噪比为3∶1时,得LOD。结果,没食子酸、绿原酸、芍药苷和丹皮酚的LOQ分别为 0.353、0.276、0.421、0.540 μg/mL,LOD 分别为0.121、0.104、0.148、0.186 μg/mL。
2.6 精密度试验
取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积。结果,没食子酸、绿原酸、芍药苷和丹皮酚峰面积的RSD分别为1.27%、0.85%、1.04%、0.98%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下供试品溶液(批号:151018)适量,分别于室温下放置0、2、4、8、16、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,食子酸、绿原酸、芍药苷和丹皮酚峰面积的RSD分别为1.39%、1.02%、1.50%、1.85%(n=6),表明供试品溶液在24 h内稳定性良好。
2.8 重复性试验
取样品(批号:151018)适量,共6份,每份约1.0 g,精密称定,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量。结果,没食子酸、绿原酸、芍药苷和丹皮酚的含量平均值分别为 3.41、1.03、0.64、0.36 mg/g,RSD 分别为1.68%、2.04%、1.81%、1.70%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取样品(批号:151018)适量,共9份,每份约0.5 g,精密称定,分别置于50 mL具塞锥形瓶中,各加入低、中、高质量的待测成分对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。

表2 加样回收率试验结果(n=9)Tab 2 Result of recovery tests(n=9)
2.10 样品含量测定
取4批样品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,结果见表3。

表3 样品含量测定结果(n=3,mg/g)Tab 3 Result of contents determination of samples(n=3,mg/g)
3 讨论
3.1 流动相的选择
笔者曾考察了甲醇-水、甲醇-0.4%磷酸溶液和甲醇-0.05%磷酸溶液为本试验的流动相体系对色谱分离的影响。结果,当采用甲醇-0.05%磷酸溶液为流动相进行梯度洗脱时,待测成分达到基线分离,峰形良好,且分析时间短,故选择上述溶液为流动相。
3.2 检测波长的选择
通过二极管阵列检测器在210~400 nm波长范围内进行扫描发现,没食子酸丹皮酚在270 nm波长处、绿原酸在325 nm波长处、芍药苷在230 nm波长处分别具有最大吸收峰,故采用波长切换技术最终确定本试验的检测波长为270 nm(0~10 min,没食子酸)、325 nm(10~20 min,绿原酸)、230 nm(20~30 min,芍药苷)、270 nm(30~43 min,丹皮酚)。
3.3 提取溶剂的选择
笔者曾考察了水、50%甲醇溶液、75%甲醇溶液、甲醇作为提取溶剂进行超声提取时待测成分的提取效果。结果发现,50%甲醇溶液、75%甲醇溶液、甲醇溶液3种提取溶剂的提取效果无明显差异,但50%甲醇和75%甲醇溶液较难过滤,故采用甲醇作为提取溶剂。
综上所述,本方法操作简单、结果准确、重复性良好,可用于妇乐颗粒中没食子酸、绿原酸、芍药苷、丹皮酚含量的同时测定。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:896-897.
[2]卫生部.卫生部颁药品标准:中药成方制剂:第18册[S].WS3-B-3403-98.
[3]于晓,李松涛,刘建升,等.RP-HPLC法同时测定忍冬藤中绿原酸、马钱苷、芍药苷含量的研究[J].山东农业科学,2015,47(9):124-126、145.
[4]刘晓涵,祁龙凯.UPLC法同时测定大血藤中4种成分的含量[J].中药新药与临床药理,2016,27(5):689-692.
[5]马瑞丽,于小凤,徐秀泉,等.大血藤的化学成分及药理作用研究进展[J].中国野生植物资源,2012,31(6):1-5.
[6]陆小华,马骁,王建,等.赤芍的化学成分和药理作用研究进展[J].中草药,2015,46(4):595-602.
[7]邓开英,朱必越,朱照静.改良RP-HPLC法同时测定牡丹皮药材中芍药苷和丹皮酚的含量[J].中国药房,2013,24(15):1406-1408.
[8]范旭航,马天成,沈旭,等.UPLC法测定不同产地不同部位牡丹皮中6种活性成分[J].中成药,2012,34(2):317-320.
[9]刘杰,陈琳,范彩荣,等.基于HPLC-DAD-Q-TOF-MS/MS的白芍和赤芍主要成分定性定量研究[J].中国中药杂志,2015,40(9):1762-1770.
Simultaneous Determination of 4 Components in Fule Granules by HPLC
LUO Xiaoxia1,ZENG Caicai1,QI Longkai2(1.Dept.of Pharmacy,Guangdong Provincial Hospital of TCM,Guangzhou 510120,China;2.College of TCM,Guangzhou University of TCM,Guangzhou 510006,China)
OBJECTIVE:To establish a method for simultaneous determination of gallic acid,chlorogenic acid,paeoniflorin and paeonol in Fule granules.METHODS:HPLC method was adopted.The determination was performed on Ultimate XB-C18column with mobile phase consisted of acetonitrile-0.05%phosphoric acid(gradient elution)at the flow rate of 1.0 mL/min.The detection wavelengths were 270 nm(gallic acid,paeonol),325 nm(chlorogenic acid)and 230 nm(paeoniflorin).The column temperature was 30 ℃,and sample size was 10 μL.RESULTS:The linear ranges of gallic acid,chlorogenic acid,paeoniflorin and paeonol were 0.076 2-1.524 μg(r=0.999 7),0.037 6-0.751 μg(r=0.999 9),0.030 3-0.606 μg(r=0.999 7),0.020 6-0.412 μg(r=0.999 8),respectively.The limits of quantification were 0.353,0.276,0.421,0.540 μg/mL,and the limits of detection were 0.121,0.104,0.148,0.186 μg/mL.RSDs of precision,stability and reproducibility tests were all no more than 2.04%.The recoveries were 95.24%-100.47%(RSD=1.59%,n=9),99.49%-103.70%(RSD=2.27%,n=9),96.27%-101.09%(RSD=1.94%,n=9),95.05%-98.89%(RSD=1.22%,n=9),respectively.CONCLUSIONS:The method is simple,accurate and reproducible,and can be used for the simultaneous determination of gallic acid,chlorogenic acid,paeoniflorin and paeonol in Fule granules.
Fule granules;HPLC;Gallic acid;Chlorogenic acid;Paeoniflorin;Paeonol;Content
R927.2
A
1001-0408(2017)33-4732-03
DOI 10.6039/j.issn.1001-0408.2017.33.34
*主管药师。研究方向:医院药学。E-mail:Yuerluo@qq.com
(编辑:刘 柳)
2017-06-07
2017-08-12)
