模拟外周静脉PICC置管联合5-FU对人脐静脉内皮细胞增殖及迁移的影响
2017-12-12赵艳杰王彦茹吴兰华陈玲赖丽君林素兰
赵艳杰,王彦茹,吴兰华,陈玲,赖丽君,林素兰
(新疆医科大学,乌鲁木齐830000)
模拟外周静脉PICC置管联合5-FU对人脐静脉内皮细胞增殖及迁移的影响
赵艳杰,王彦茹,吴兰华,陈玲,赖丽君,林素兰
(新疆医科大学,乌鲁木齐830000)
目的观察模拟外周静脉置入中心静脉导管(PICC)置管联合5-氟尿嘧啶(5-FU)对人脐静脉内皮细胞增殖和迁移的影响,探讨其损伤静脉内皮细胞的机制。方法将体外培养2~3代的人脐静脉内皮细胞随机分成对照组、PICC损伤组、5-FU损伤组、联合损伤组,对照组加入完全培养基,PICC损伤组模拟PICC置管损伤(把PICC导管切成小段,用消毒枪头对贴壁细胞进行划痕,与细胞一起培养),5-FU损伤组模拟5-FU外渗损伤(将5-FU配制成4 μL/mL溶液,与细胞一起培养),联合损伤组模拟PICC置管损伤+5-FU外渗损伤。培养0、5、10、30、60、120 min后,观察各组细胞形态变化,采用MTT比色法检测细胞增殖活性,ELISA法检测血管性假性血友病因子(vWF)表达水平;细胞划痕法诱导24 h后,观察各组细胞迁移能力。结果镜下观察对照组细胞形态为不规则的梭形,胞质饱满、排列紧密,各模拟组细胞形态均有不同程度的收缩、变圆、胞质皱缩,细胞脱落,模拟PICC置管损伤组细胞形态改变最轻,模拟PICC置管联合5-FU损伤组最为显著。与对照组比较,各模拟组细胞活性降低、细胞迁移能力降低,模拟PICC置管联合5-FU损伤组细胞活性、细胞迁移能力较其他各组均降低(P均<0.05)。各模拟组培养30 min后细胞培养上清液中vWF水平均明显升高,模拟PICC置管联合5-FU损伤组vWF水平较其他各组均升高(P均<0.05)。结论PICC置管联合5-FU能够损伤人脐静脉内皮细胞,降低细胞增殖活性,抑制细胞迁移;该作用可能与其刺激细胞产生vWF有关。
中心静脉导管;5-氟尿嘧啶;人脐静脉内皮细胞;血管性假性血友病因子;细胞增殖;细胞迁移;体外实验
目前,经外周静脉置入中心静脉导管(PICC)已广泛用于长期静脉输液、反复输入血制品、静脉高营养、化疗等患者。PICC在为临床治疗提供方便的同时,因反复置管、长期留置和护理不当等,会对患者的静脉血管壁造成机械性刺激[1],再加上化疗药物外渗,对血管造成严重损伤,常导致静脉血栓、静脉炎等相关并发症[2,3]。既往研究[4]表明,导管留置时间、血管损伤、内皮细胞凋亡三者呈正相关。血管内皮细胞是构成血管内膜层的主要成分,它能通过合成和释放多种血管活性因子,在血管的病理、生理中发挥重要作用[5]。血管性假性血友病因子(vWF)是鉴定内皮细胞受到刺激或损伤的特异性标志物,其表达量可反映内皮细胞损伤程度[6]。研究显示,PICC置管、5-氟尿嘧啶(5-FU)外渗会对血管造成严重损伤,但其机制尚不明确,而内皮细胞的病理生理功能又是血管损伤修复的第一步。2017年1~6月,我们通过体外培养人脐静脉内皮细胞,观察PICC置管联合5-FU对细胞活力、细胞迁移能力及细胞培养上清液中vWF表达水平的影响,探讨PICC、5-FU导致血管损伤的机制。
1 材料与方法
1.1 材料 人脐静脉内皮细胞EA.HY926细胞株购于上海拜力生物科技有限公司,高糖培养基(DMEM)、双抗、胰蛋白酶均购自美国Hyclone公司。胎牛血清购自美国Gibco公司。PICC导管购自美国巴德公司。5-FU购自上海旭东海普药业有限公司。96孔板购自美国康宁公司。四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司。CO2培养箱、酶标仪购自奥地利SUNEISE。
1.2 细胞培养与分组处理 将细胞用含有10%胎牛血清、5%双抗与DMEM的完全培养基,置于37 ℃、5% CO2培养箱中培养,待细胞生长到80%~90%融合时,加入0.25%胰蛋白酶消化传代,取2~3代用于实验。把PICC导管切割成均匀的1 mm小段,用10 μL消毒枪头对贴壁细胞进行划痕,与细胞一起培养来模拟PICC置管对血管的损伤。按人体表面积给药,将5-FU配制成4 μL/mL溶液,与细胞一起培养来模拟药物外渗对血管的损伤。将细胞分为4组,对照组加入完全培养基,PICC损伤组模拟PICC置管损伤,5-FU损伤组模拟5-FU外渗损伤,联合损伤组模拟PICC置管损伤+5-FU外渗损伤。
1.3 细胞增殖活性观察 采用MTT比色法。将EA.HY926细胞制成单细胞悬液,以100 μL/孔接种于96孔板。继续培养24 h,使细胞同步化,洗去未贴壁的细胞。将细胞分为4组,处理方法按1.2,每组设6个复孔。培养0、5、10、30、60、120 min后,加入5 g/L MTT 10 μL继续培养4 h,小心吸除并保留原培养液,用于vWF检测。再在各孔中加入150 μL DMSO,置于酶联免疫检测仪内,于490 nm波长处检测各孔的光密度(OD)值。通过OD值比较各模拟组与对照组细胞增殖活性的变化。
1.4 细胞迁移能力观察 采用划痕法。将EA.HY926细胞制成单细胞悬液,按2 mL/孔接种于6孔板。待细胞长满后,取消毒的200 μL枪头,垂直进行细胞划痕。PBS洗涤3次,去除划下的细胞。将细胞分为4组,处理方法按1.2。继续培养24 h后,用显微镜拍摄24 h时的细胞划痕图像(50×),用IPP软件计算细胞迁移率。
1.5 细胞培养上清液中vWF检测 取4组细胞培养上清液,用0.22 μm针式滤器抽滤,按照ELISA试剂盒说明书检测vWF水平。
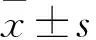
2 结果
2.1 各组细胞形态学比较 倒置相差显微镜下可见,对照组细胞呈不规则的梭形,细胞核呈椭圆或圆形,偶见双核,胞质饱满丰富,细胞边界清楚,细胞较多、密集,单层融合时呈典型的“铺路石”样。PICC损伤组多数细胞胞质饱满丰富,少数细胞收缩、变圆,细胞边界不清楚,间隙增宽,较少有细胞脱落。5-FU损伤组多数细胞胞质不甚饱满且不丰富,细胞收缩、变圆,细胞边界不清楚,间隙增宽,有较多细胞脱落。联合损伤组较多细胞胞质空瘪贫乏,细胞收缩、变圆,细胞边界不清楚,间隙增宽,随处可见细胞脱落。
2.2 各组细胞增殖活性比较 与对照组相比,PICC损伤组、5-FU损伤组、联合损伤组培养30、60、120 min后OD值减少(P均<0.05),联合损伤组OD值最低(P均<0.05)。见表1。

表1 各组不同时点细胞增殖活性比较
注:与对照组同时间点比较,*P<0.05。
2.3 各组细胞迁移能力比较 PICC损伤组、5-FU损伤组、联合损伤组、对照组的细胞迁移率分别为51.72%、21.57%、18.24%、75.94%,PICC损伤组、5-FU损伤组、联合损伤组细胞迁移率均较对照组下降(P均<0.05),其中联合损伤组细胞迁移率最低(P均<0.05)。
2.4 各组细胞培养上清液中vWF水平比较 诱导30 min时,PICC损伤组、5-FU损伤组、联合损伤组细胞培养上清液vWF水平均高于对照组,并达到峰值(P均<0.05);在5、10、60、120 min时各组细胞培养上清液vWF水平比较差异无统计学意义(P均>0.05)。见表2。
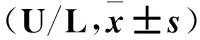
表2 各组不同时点细胞培养上清液中vWF水平比较
注:与对照组同时间点比较,*P<0.05。
3 讨论
PICC是由硅胶材料制成、标有刻度、可放射显影富有高弹性的输液导管,常用于需要持续输液、反复输入血液制品、静脉给予高营养、化疗等患者[7]。PICC在为临床提供方便、优质治疗的同时,也产生了诸多并发症,如静脉炎、静脉血栓等,增加了患者的痛苦甚至病死率[8]。5-FU属于化学制剂类广谱抗肿瘤药物,其不良反应较明显[9],静脉输注时一旦药物发生外渗可造成局部软组织、血管的炎症反应,使组织和血管损伤、溃烂,甚至导致功能障碍[10]。另外,成纤维细胞也受到损伤,使组织修复困难,加上炎性细胞产生的抑制作用,最终导致坏死的局部组织迁延不愈[11]。
静脉血栓、静脉炎是临床静脉输液导管引起的常见并发症[12]。这些并发症主要是由导管的机械性刺激和外渗药物的毒性引起。引起内皮损伤或功能障碍的病理刺激有两种,一种是血流或置入物对内皮层产生的剪切力、压力等机械力,另一种是由细菌内毒素、炎症因子等引起的生化改变。PICC反复置入和外渗5-FU药物的刺激对内皮细胞损伤的病理机制分别属于第一、第二种。PICC、5-FU可导致血管内皮细胞多种形式的功能失调,如形态的改变、血管内皮细胞增殖和迁移的抑制等,最终导致血管病变的发生。本研究结果显示,各模拟组细胞生长较慢,数量较少,单层融合时并没有出现典型的“铺路石”样,说明PICC、5-FU对EA.HY926细胞造成了损伤。MTT检测显示,同一组不同时间点测定的OD值减少,30、60、120 min时OD值与对照组比较有统计学差异,表明细胞的活性开始降低,30 min时PICC、5-FU对EA.HY926细胞造成了损伤;而30、60、120 min时,各模拟组间OD值比较差异无统计学意义,说明EA.HY926细胞并没有随着诱导时间的延长而加重损伤,这与既往研究血管内皮损伤呈时间依赖性相悖,可能与本实验导管留置时间间隔较短有关。而当PICC导管联合5-FU共同培养EA.HY926细胞时,同一时间点测得的OD值显著低于对照组;在细胞划痕实验中,当PICC导管联合5-FU共同培养EA.HY926细胞时,细胞迁移率最低。说明PICC导管联合5-FU使EA.HY926细胞功能失调,会抑制EA.HY926细胞的增殖和迁移,使其形态改变和功能异常,导致细胞损伤和细胞凋亡,进而使静脉血管发生病变。PICC导管作为异物置入血管,由于机械性刺激和留置会对EA.HY926细胞造成不同程度的损伤。5-FU主要通过其毒性作用于细胞代谢周期的各个阶段,通过影响细胞DNA和蛋白质的合成[13],引起严重的慢性组织反应、坏死。
既往研究表明,血管壁内皮细胞的损伤修复在血管壁的病理生理中有重要作用[14]。内皮细胞在受到刺激或损伤时,Weibel-Palade小体释放出vWF,vWF介导血小板聚集于损伤的血管内皮下,启动血栓引起血管并发症。有研究发现,在受到损伤或刺激的内皮细胞的溶解物及上清中,vWF的合成和释放均增加。本研究结果显示,各模拟组EA.HY926细胞培养上清液中vWF水平与对照组相比均有不同程度的升高,其中以联合损伤组升高最为明显,并在30 min时达到峰值,随后下降并趋于平稳,说明EA.HY926细胞在受到PICC、5-FU引起的损伤后,细胞Weibel-Palade小体快速释放vWF参与炎症反应,同时可推断PICC、5-FU是通过vWF造成EA.HY926细胞损伤。
综上所述,模拟PICC置管联合5-FU对内皮细胞造成了损伤,表现为影响细胞形态和对其生物功能的抑制,其机制可能与Weibel-Palade小体释放vWF造成细胞损伤有关。
[1] 张玲,徐丽.造血干细胞移植病人PICC导管最佳置管时间探讨[J].护理研究,2016,30(26):3313-3314.
[2] 赵芳,吴美妮,王冬冬,等.肘窝上3~10 cm外周静脉穿刺中心静脉置管的并发症[J].山东医药,2016,56(3):78-80.
[3] 马婷.全国部分三甲医院162个肿瘤科静脉治疗护理现状的调查分析[J].中华现代护理杂志,2015,8(17):2041-2044.
[4] 刘青焱.三种血管通道器材对静脉损伤的对比实验研究[D].成都:四川医科大学,2015.
[5] Lourenco SA, Ohara CV. Nurses′ knowledge about the insertion procedure for peripherally inserted central catheters in newborns[J]. Rev Lat Am Enfermagem, 2010,18(2):189-195.
[6] L′Azou B, Fernandez P, Bareille R, et al. In vitro endothelial cell susceptibility to xenobiotics: comparison of threecell types[J]. Cell Biol Toxicol, 2005,21(2):127-137.
[7] 尚静,王锐.两种静脉途径在直肠癌患者FolFox4化疗方案中的应用[J].中国医药导报,2017,14(8):167-170.
[8] Liem TK, Yanit KE, Moseley SE, et al. Peripherally inserted central catheter usage patterns and associated symptomatic upper extremity venous thrombosis[J]. J Vasc Surg, 2012,55(3):761-767.
[9]张书俊,王耿泽,刘建文.5-氟尿嘧啶为基础的化疗方案联合三维适形调强放疗用于进展期胃癌术后的临床观察[J].中国药房,2016,27(15):2062-2064.
[10] 黄荣,李梦帆,黄毅,等.深静脉血栓患者血清炎症因子水平与血管损伤程度的关系[J].山东医药,2016,56(44):58-60.
[11] 宋方,田茂波,黄晶,等.抑制干扰素诱导蛋白p204表达促进大鼠血管外膜成纤维细胞生长与迁移[J].中国动脉硬化杂志,2016,24(1):18-22.
[12] 王欣鹃,张志刚.国内有关PICC相关性静脉炎研究的文献计量学分析[J].护理研究,2016,30(25):3138-3141.
[13] 李大玉,梁大敏,束波,等.沉默DNA依赖蛋白激酶亚基对肝癌耐药细胞Bel-7402/5-FuDNA损伤修复功能的影响[J].中国现代医学杂志,2016,26(17):19-22.
[14] Michaelis UR. Mechanisms of endothelial cell migration[J]. Cell Mol Life Sci, 2014,71(21):4131-4148.
10.3969/j.issn.1002-266X.2017.42.013
R47
A
1002-266X(2017)42-0046-03
新疆维吾尔族自治区自然科学基金资助项目(2016D01C175)。
林素兰(E-mail: 2402745049@qq.com)
2017-07-28)
