过表达和敲除SLUG基因卵巢癌SKOV3细胞稳定株的建立
2017-12-12雷静赵然高茹辛灵彪刘欣
雷静,赵然,高茹,辛灵彪,刘欣
(天津医科大学,天津300070)
·论著·
过表达和敲除SLUG基因卵巢癌SKOV3细胞稳定株的建立
雷静,赵然,高茹,辛灵彪,刘欣
(天津医科大学,天津300070)
目的利用慢病毒载体和改良的CRISPR/Cas9基因编辑系统分别构建过表达和敲除SLUG基因的卵巢癌SKOV3细胞稳定株。方法①以质粒pCMV-Myc-SLUG为模板扩增出HA-SLUG基因,将其连接到慢病毒表达质粒pLVX-IRES-Hyg中。将此重组表达载体pLVX-HA-SLUG通过病毒感染法感染SKOV3细胞(实验组),以相同条件制备pLVX-IRES-Hyg空载体的慢病毒作为阴性对照,Western blotting法检测两组SLUG蛋白表达。②将一对能特异结合SLUG基因的sgRNA分别连接到载体PX462中,获得的一对重组质粒通过脂质体法共转染SKOV3细胞,筛选稳定株,挑取单克隆细胞(实验组),用Western blotting法检测SLUG蛋白表达,另设空白对照组,不加任何处理。结果①对挑取的单克隆菌液进行PCR扩增,阳性者提取质粒进行PCR和双酶切,两者验证正确后进行DNA测序鉴定,结果证实重组质粒构建成功。阴性对照组与实验组SLUG蛋白相对表达量分别为0.92±0.02和3.14±0.04,实验组SLUG蛋白表达高于阴性对照组(P<0.01)。②挑取4个单克隆细胞进行测定,SLUG蛋白的相对表达量分别为0.07±0.01、0.06±0.01、0.21±0.02、0.20±0.01,空白对照组为0.56±0.03。实验组SLUG蛋白相对表达量低于空白对照组(P均<0.01)。结论过表达和稳定敲除SLUG基因的SKOV3细胞株构建成功,为进一步探讨SLUG在卵巢癌中的作用提供了细胞模型。
SLUG基因;慢病毒载体;SKOV3细胞;卵巢癌;细胞模型
人类SLUG蛋白又称为Snai2,是Snail家族成员之一,最初在鸡胚的神经嵴和发育着的中胚层中被发现,是一种具有锌指结构的上皮-间质转化(EMT)转录因子。近年研究发现,SLUG在乳腺癌[1]、肺癌[2]、卵巢癌[3]和胰腺癌[4]等多种癌症中发挥着促癌作用。我们的前期研究证实,SLUG蛋白在卵巢癌中有表达上调的现象,但其具体作用机制尚不明了。本实验利用改良的CRISPR/Cas9基因编辑系统,通过将特异结合SLUG基因的一对单导RNA(sgRNA)插入到能表达Cas9n核酸切口酶的质粒pSpCas9n(BB)-2A-Puro(PX462)中,该表达质粒可实现靶向敲除目的基因,构建出敲除SLUG基因的卵巢癌SKOV3细胞稳定株。同时利用慢病毒(Lentivirus)载体在SKOV3细胞中建立稳定过表达SLUG蛋白的细胞株,为进一步探讨SLUG在卵巢癌中的作用机制提供必要的细胞模型。
1 材料与方法
1.1 材料 SKOV3细胞为本实验室所保存。质粒pCMV-Myc-SLUG由湘雅医学院向波教授馈赠。慢病毒表达质粒pLVX-IRES-Hyg(图1)、包装质粒1和2是由天津医科大学生物化学与分子生物学系石磊教授馈赠。真核细胞表达质粒pSpCas9n(BB)-2A-Puro(PX462)由天津医科大学细胞生物学系吴旭东教授惠赠。限制性内切酶BbsⅠ、XhoⅠ和BamHⅠ以及T4 DNA连接酶均购自Fermentas公司。去内毒素质粒提取试剂盒购自Omega公司。BCA蛋白浓度检测试剂盒购自Pierce公司。ECL Western 显色试剂盒购自碧云天公司。兔源抗SLUG单克隆抗体购自CST公司,鼠源抗β-actin单克隆抗体购自Sigma公司,辣根过氧化物酶标记的鼠源、兔源IgG二抗购自Fermentas公司。序列合成和基因测序由上海英潍捷基公司完成。
1.2 慢病毒重组质粒pLVX-HA-SLUG的构建与鉴定 针对SLUG基因设计含有XhoⅠ和BamHⅠ限制性内切酶位点的SLUG克隆引物,且在上游引物中添加HA标签,上游引物5′-GCCTCGAGATGTAC-CCATACGATGTTCCAGATTACGCTATGCCGCGCTCC-TTCCTGGT-3′,下游引物5′-CGGGATCCTCAGTGTGCTACACAGCA-3′,产物大小807 bp。以质粒pCMV-Myc-SLUG为模板PCR扩增出HA-SLUG基因片段。利用限制性内切酶XhoⅠ和BamHⅠ同时对HA-SLUG基因片段和慢病毒质粒pLVX-IRES-Hyg进行双酶切,并将两者的酶切产物进行连接。将连接后的产物转化大肠杆菌DH5α感受态细胞,接种于含氨苄青霉素的LB平板培养皿过夜,第2天挑取单克隆菌落。菌液PCR阳性者提取质粒,进行PCR和双酶切鉴定,鉴定正确的质粒进行DNA测序验证。
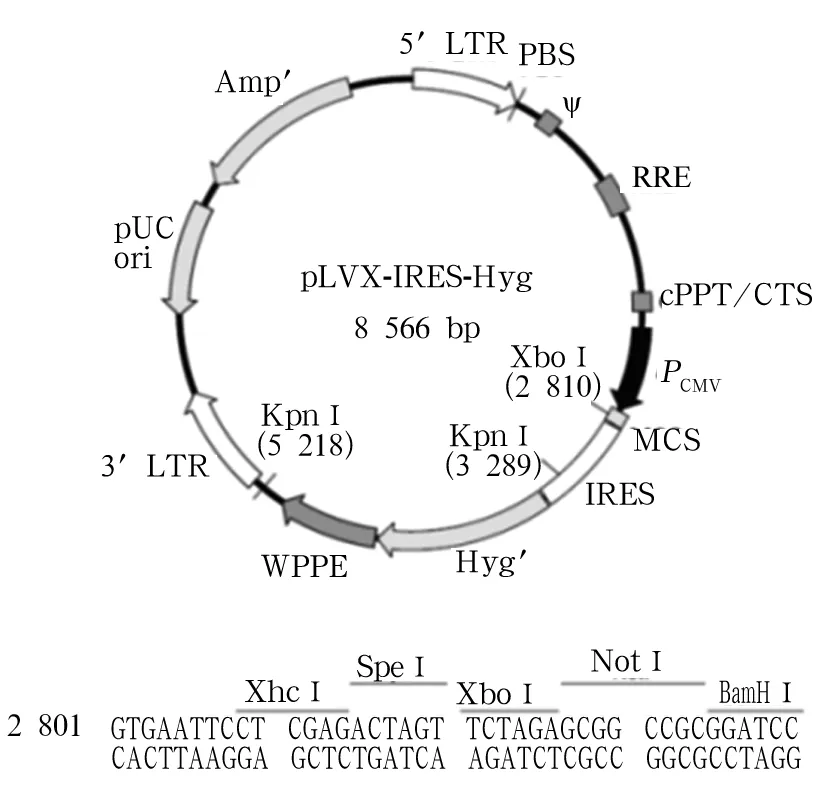
图1 慢病毒表达质粒pLVX-IRES-Hyg图谱
1.3 慢病毒包装 将包装质粒1、2和重组质粒pLVX-HA-SLUG以一定的比例加入到opti-MEM中混匀,另用opti-MEM将转染试剂PEI预混。室温静置后将两者混合。取出准备好的293T细胞,将质粒与转染试剂的混合液缓慢加入到培养基中。分别于24、48 h收集2次病毒备用。同时以相同条件制备pLVX-IRES-Hyg空载体的慢病毒作为阴性对照。
1.4 慢病毒感染SKOV3细胞并筛选稳定株 将获得的病毒感染SKOV3细胞,同时设置阴性对照组。48 h后用药物Hygromycin B进行筛选。待不做任何处理的空白对照组细胞全部死掉即停止加药,细胞长满后采用Western blotting法检测SLUG蛋白表达。
1.5 设计特异结合SLUG基因的sgRNA 在http://crispr.mit.edu/网站设计一对特异结合SLUG基因的sgRNA并对其进行修改:上游引物序列(sgRNA-A)5′-CACC-GCGGTAGTCCACACAGTGAT-3′及其互补链5′-AAAC-ATCACTGTGTGGACTACCGC-3′,下游引物序列(sgRNA-B)5′-CACC-G-TTCCACGCCCAGCTACCCAA-3′及其互补链5′-AAAC-TTGGGTAGCTGGGCGTGGAA-C-3′。将修改后的序列交由上海生物工程有限公司进行合成。
1.6 重组质粒PX462-sgRNA的构建及鉴定用限制性内切酶BbsⅠ将质粒PX462线性化并分别与sgRNA-A、sgRNA-B连接,将连接产物转化大肠杆菌DH5α感受态细胞,挑取单克隆摇菌并提取质粒,对质粒进行酶切和测序验证。
1.7 重组质粒PX462-sgRNA共转染SKOV3细胞并筛选稳定株 根据Lipofectamine®3000转染试剂的说明书,将重组质粒PX462-sgRNA-A、PX462-sgRNA-B共转染SKOV3细胞,48 h后用药物Puromycin进行筛选,直至未做任何处理的对照组细胞全部死掉即停止加药,待细胞长满后用Western blotting法检测SLUG蛋白表达。若SLUG表达显著降低则挑取单克隆菌落,筛选稳定敲除SLUG的细胞株。
2 结果
2.1 重组质粒pLVX-HA-SLUG的鉴定 对挑取的单克隆菌液进行PCR扩增(图2),阳性者提取质粒进行PCR和双酶切(图3、4),两者验证正确后进行DNA测序鉴定。结果均证实重组质粒构建成功。
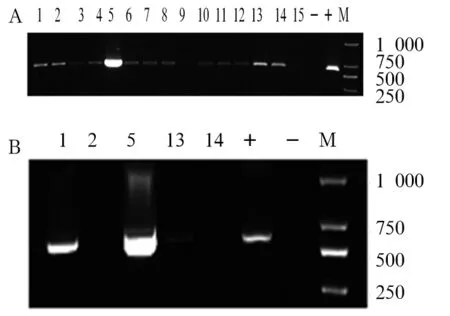
注:M:DNA aker;A:1~15为阳性克隆菌落PCR产物;B:1,2,5,13,14号为阳性克隆菌落PCR产物;-:阳性对照;+:阳性对照。
图2重组质粒pLVX-HA-SLUG菌落PCR鉴定
2.2 重组质粒pLVX-HA-SLUG感染SKOV3细胞效率的鉴定 将感染慢病毒质粒pLVX-HA-SLUG后的SKOV3细胞采用Western blotting法检测SLUG蛋白表达水平。结果显示,对照组与实验组SLUG蛋白相对表达量分别为0.92±0.02和3.14±0.04。实验组SLUG蛋白表达高于对照组(P<0.01)。说明SKOV3细胞过表达SLUG的稳定株构建成功。
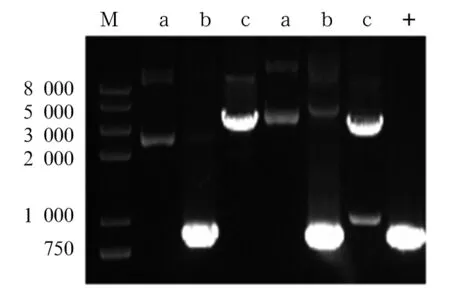
2.3 重组质粒PX462-sgRNA的鉴定 对重组质粒PX462-sgRNA-A、B进行酶切及测序验证(图5),结果表明质粒构建成功。
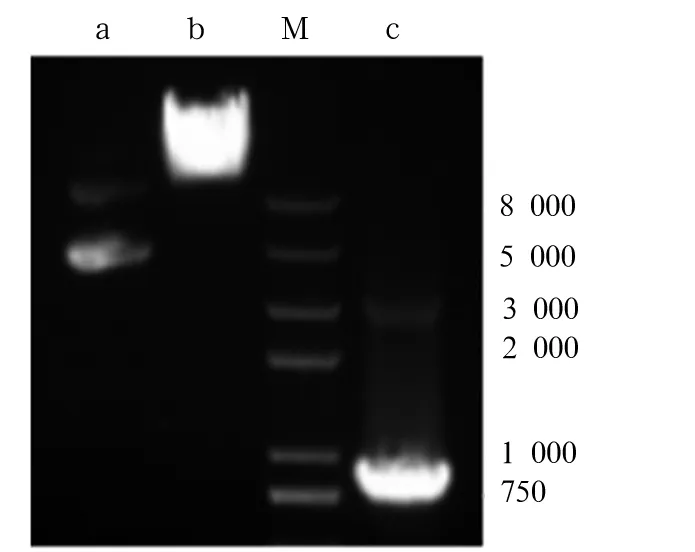
注:M:DNA Maker;a:质粒pLVX-IRES-Hyg;b:质粒pLVX-IRES-Hyg双酶切;c:PCR产物双酶切。
图3pLVX-IRES-Hyg双酶切鉴定
注:M:DNA Maker;a:重组质粒pLVX-HA-SLUG;b:重组质粒pLVX-HA-SLUGPCR产物;c:重组质粒pLVX-HA-SLUG双酶切;+:阳性对照。
图4重组质粒PCR、双酶切鉴定
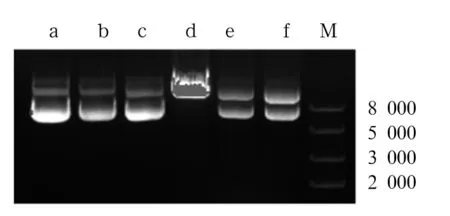
注:M:DNA Maker;a、d:质粒PX462及酶切;b、e:重组质粒PX462-sgRNA-A及酶切;c、f:重组质粒PX462-sgRNA-B及酶切。
图5重组质粒酶切鉴定
2.4 重组质粒PX462-sgRNA对SKOV3转染效率的鉴定 重组质粒PX462-sgRNA共转染SKOV3细胞后,通过Western blotting方法检测挑取的4个单克隆细胞SLUG蛋白的表达情况。结果显示,4个实验组SLUG蛋白相对表达量分别为0.07±0.01、0.06±0.01、0.21±0.02、0.20±0.01,对照组为0.56±0.03。实验组SLUG蛋白相对表达量低于对照组(P均<0.01)。结果证实稳定敲除SLUG蛋白的SKOV3细胞株构建成功。
3 讨论
SLUG蛋白是一种具有锌指结构的EMT的转录因子。锌指结构位于SLUG蛋白的C-末端,可与DNA的特异序列相结合,N-末端有介导转录抑制的SNAG结构域,可抑制靶基因的表达。已有文献报道,SLUG基因参与多种肿瘤的发生发展。2009年,Chou等[5]在肺腺癌中发现CLU通过调节ERK/SLUG通路最终导致肿瘤细胞EMT的发生。2011年,Vuoriluoto等[6]在对乳腺癌细胞的研究中发现异位表达的SLUG蛋白可调节波形蛋白、E-cadherin和β-catenin等EMT相关蛋白的表达进而诱导EMT的发生。2013年,Li等[7]在结肠癌细胞中发现FAM3B持续过表达可使SLUG的表达上调,进而促进肿瘤细胞的侵袭和迁移。除此之外,SLUG蛋白还可通过TGF-β/SMAD[8]、NF-κB/HIF-1α[9]和MAPK/PI3K[10]等多种信号转导途径直接或间接诱导某些肿瘤相关分子的表达,在肿瘤EMT进程以及癌细胞的侵袭[11]和迁移[4]等特性中起着非常重要的作用。
卵巢癌是女性生殖器官常见的恶性肿瘤之一,对女性的身体健康造成严重的威胁。近年来,随着社会的发展卵巢癌的发病率不断上升,且发病年龄越来越趋于年轻化。因此针对卵巢癌发生发展的机制研究显得尤为重要。我们前期研究已经证实SLUG蛋白在卵巢癌中有表达上调的现象,同时我们还发现SND1蛋白、波形蛋白、E-cadherin、Claudin1等肿瘤相关分子的表达与SLUG蛋白表达水平有关,表明其与卵巢癌的发生发展有着密切的关系。为了探讨SLUG在卵巢癌的发生发展中的作用及其与肿瘤相关分子的关系,我们首先通过慢病毒载体和改良的CRISPR/Cas9基因编辑系统在卵巢癌SKOV3细胞中分别构建了过表达和稳定敲除SLUG基因的细胞株,通过观察该蛋白对SKOV3细胞株增殖、侵袭和迁移能力的影响,进而对其在肿瘤转移中的作用机制进行深入研究,从而为抑制卵巢癌的侵袭和迁移提供新策略,为卵巢癌的防治提供新的突破点。
[1] Zhou W, Ni TK, Wronski A, et al. The SIRT2 deacetylase stabilizes slug to control malignancy of basal-like breast cancer[J]. Cell Rep,2016,17(5):1302-1317.
[2] Cui Z, Hu Y. MicroRNA-124 suppresses Slug-mediated lung cancer metastasis[J]. Eur Rev Med Pharmaco, 2016,20(18):3802-3811.
[3] Ha JH, Ward JD, Radhakrishnan R, et al. Lysophosphatidic acid stimulates epithelial to mesenchymal transition marker Slug/Snail2 in ovarian cancer cells via Galphai2, Src, and HIF1alpha signaling nexus[J]. Oncotarget, 2016,7(25):37664-37679.
[4] Liu Z, Zhang J, Hong G, et al. Propofol inhibits growth and invasion of pancreatic cancer cells through regulation of the miR-21/Slug signaling pathway[J]. Am J Transl Res, 2016,8(10):4120-4133.
[5] Chou TY, Chen WC, Lee AC, et al. Clusterin silencing in human lung adenocarcinoma cells induces a mesenchymal-to-epithelial transition through modulating the ERK/Slug pathway[J]. Cell Signal, 2009,21(5):704-711.
[6] Vuoriluoto K, Haugen H, Kiviluoto S, et al. Vimentin regulates EMT induction by Slug and oncogenic H-Ras and migration by governing Axl expression in breast cancer[J]. Oncogene, 2011,30(12):1436-1448.
[7] Li Z, Mou H, Wang T, et al. A non-secretory form of FAM3B promotes invasion and metastasis of human colon cancer cells by upregulating Slug expression[J]. Cancer Lett, 2013,328(2): 278-284.
[8] Dhasarathy A, Phadke D, Mav D, et al. The transcription factors snail and slug activate the transforming growth factor-beta signaling pathway in breast cancer[J]. PLoS one, 2011,6(10):11.
[9] Storci G, Sansone P, Mari S, et al. TNFalpha up-regulates SLUG via the NF-kappaB/HIF1alpha axis, which imparts breast cancer cells with a stem cell-like phenotype[J]. J Cell Physiol, 2010,225(3):682-691.
[10] Wang Y, Ngo VN, Marani M, et al. Critical role for transcriptional repressor Snail2 in transformation by oncogenic RAS in colorectal carcinoma cells[J]. Oncogene, 2010,29(33):4658-4670.
[11] Sheng L, Zhang S, Xu H. Effect of Slug-mediated down-regulation of E-cadherin on invasiveness and metastasis of anaplastic thyroid cancer cells[J]. Med Sci Monitor, 2017,23:138-143.
EstablishmentofovariancancerstableSKOV3celllineswithoverexpressionandknockoutofSLUGprotein
LEI Jing, ZHAO Ran, GAO Ru, XIN Lingbiao, LIU Xin
(Tianjin Medical University, Tianjin 300070, China)
ObjectiveTo establish the ovarian cancer stable SKOV3 cell lines with overexpression and knockout of SLUG protein by lentiviral vector and modified CRISPR/Cas9 gene editing system, respectively.Methods①The HA-SLUG gene cloned from plasmid pCMV-Myc-SLUG was inserted into lentiviral vector pLVX-IRES-Hyg. The recombinant plasmid pLVX-HA-SLUG was used to infect SKOV3 cells (experimental group). The lentivirus of pLVX-IRES-Hyg empty vector was prepared as the negative control group under the same conditions. The expression of SLUG protein was detected by Western blotting. ② A pair of sgRNAs specifically binding to SLUG gene was inserted into the vector PX462. The pair of recombinant plasmids was transfected into SKOV3 cells by Lipofectamine method. We screened the stable cells, and selected monoclonal cells as the experimental group. The expression of SLUG protein was detected by Western blotting. Meanwhile, and the blank control group without any treatment was set up.Results①PCR was performed on the extracted monoclonal bacteria, and the positive ones were extracted and identified by PCR and double digestion. The results showed that the recombinant plasmid was successfully constructed. The expression levels of SLUG protein in the negative control group and the experimental group were 0.92±0.02 and 3.14±0.04, respectively. The expression of SLUG protein in the experimental group was higher than that in the negative control group (P<0.01). ②The four positive monoclonal cells were measured. The relative expression levels of SLUG protein were 0.07±0.01, 0.06±0.01, 0.21±0.02 and 0.20±0.01, respectively, and that in the blank control group was 0.56±0.03. The relative expression of SLUG protein in the experimental group was lower than that in the blank control group (allP<0.01).ConclusionTwo stable SKOV3 cell lines with SLUG protein overexpression and knockout were constructed successfully, which provided the essential cell models for further study about the role of SLUG protein in human ovarian cancer.
SLUG gene; lentiviral vector; SKOV3 cells; ovarian carcinoma; cell model
10.3969/j.issn.1002-266X.2017.42.001
R737.31
A
1002-266X(2017)42-0001-04
天津市自然科学基金资助项目(17JCQNJC12600)。
雷静(1989-),女,硕士研究生,主要研究方向为医学生物化学与分子生物学。E-mail: xqytqz@163.com
刘欣(1969-),女,硕士生导师,副教授,主要研究方向为医学生物化学与分子生物学。E-mail: xinliu_0828@tmu.edu.cn
2017-05-01)
