固相萃取-气相色谱法测定黄酒中β-苯乙醇含量
2017-12-11芦智远张耀武李雪娟冯歆轶薛慧慧郭松年
芦智远,张耀武*,李雪娟,冯歆轶,薛慧慧,郭松年,刘 佳
固相萃取-气相色谱法测定黄酒中β-苯乙醇含量
芦智远,张耀武*,李雪娟,冯歆轶,薛慧慧,郭松年,刘 佳
(西安市产品质量监督检验院,陕西 西安 710065)
目的:建立黄酒中β-苯乙醇的固相萃取-气相色谱检测方法。方法:HLB型固相萃取小柱经活化、平衡后,对3.0 mL黄酒样品中的β-苯乙醇进行富集,依次以3.0 mL水、3.0 mL体积分数40%甲醇溶液淋洗小柱,用3.0 mL甲醇洗脱样品,用气相色谱-氢火焰离子化检测器对目标物进行检测,外标法定量。结果:β-苯乙醇在10.1~202.0 mg/L质量浓度范围内,线性相关系数(r)为0.999 9,检出限(RSN=3)和定量限(RSN=10)分别为0.9 mg/L和3.0 mg/L,回收率在95.5%~98.5%之间,相对标准偏差为1.1%~1.4%。结论:该方法具有操作便捷、结果准确的优点,同时有效降低了黄酒基质对气相色谱系统的污染,避免了酒样中水分对毛细管色谱柱的危害,适用于黄酒中β-苯乙醇的检测。
固相萃取;气相色谱;黄酒;β-苯乙醇
β-苯乙醇是在黄酒的酿造过程中,由酵母菌生长代谢产生的一种具有玫瑰花香的芳香高级醇[1-8],是黄酒中重要的高沸点香气成分,赋予了黄酒优雅、醇香的感官特征[9-14]。在GB/T 13662—2008《黄酒》中,对稻米黄酒中β-苯乙醇的含量制定了相应的指标要求,并采用气相色谱法,直接进样、内标法定量作为β-苯乙醇的分析方法。然而,黄酒中糖分、色素、极性组分等杂质含量较高,尤其是高糖分的甜型黄酒,未经处理直接进样的检测方法易污染气相色谱的进样系统和分离系统,杂峰也相对较多,同时,由于黄酒中大量的水分存在,在高柱温条件下,不但会造成色谱图基线漂移,更影响着色谱柱的使用寿命。目前黄酒中的β-苯乙醇的检测方法有分光光度法[15]、气相色谱法[16-23]、液相色谱法[24-26]、静态顶空气相色谱法[27]、气相色谱-质谱联用法[28]等,其中静态顶空气相色谱法和气相色谱-质谱联用法可以排除干扰,但是顶空进样器和气相色谱-质谱联用仪在基层检验机构和黄酒生产企业的普及程度相对较低,不利于方法的推广。本实验采用固相萃取-气相色谱法测定黄酒中β-苯乙醇含量,以固相萃取技术对黄酒进行净化除杂、置换溶剂、去除水分,用液相色谱仪分析比较固相萃取处理前后糖分的变化,评价固相萃取小柱对糖分的去除效果;用气相色谱仪对净化前后的黄酒样品进行分析比较,优化前处理条件,以期建立一套操作便捷、定量准确可靠的检测方法。
1 材料与方法
1.1 材料与试剂
市购6种常见的黄酒:传统型稻米干黄酒、传统型稻米半干黄酒、传统型稻米半甜黄酒、传统型稻米甜黄酒、清爽型稻米干黄酒、非稻米黄酒。
盐酸、氢氧化钠为分析纯,乙腈、乙醇为色谱纯;HLB固相萃取柱(200 mg,6 mL) 德国CNW公司;β-苯乙醇标准品(纯度98.7%) 美国Chem Service公司;葡萄糖标准品(纯度99.5%) 德国Dr.Ehrenstorfer GmbH公司。
β-苯乙醇标准溶液:移取200 μL标准品于100 mL容量瓶中,用体积分数15%的乙醇溶液充分溶解后定容至100 mL,配制成2 020.4 mg/L的标准储备液,再用15%的乙醇溶液将标准储备液稀释成10.1、20.2、60.6、101.0、202.0 mg/L的标准工作液;葡萄糖标准品溶液:称取4.0 g葡萄糖标准品于100 mL容量瓶中,加入60 mL水溶解,用乙腈定容至100 mL,配制成40.0 g/L的标准储备液,再用乙腈-水(40∶60,V/V)将标准储备液稀释成2.0、4.0、8.0、12.0、16.0 g/L的标准工作液。
1.2 仪器与设备
7890A气相色谱仪(配有氢焰离子化检测器和Rev.B.04.02[96]工作站) 美国安捷伦公司;LC-20AT高效液相色谱仪(配有示差折光检测器和Lcsolution 1.26 SP1工作站) 日本岛津公司;Milli-Q超纯水器 美国Millipore公司;固相萃取装置 美国Supelco公司。
1.3 方法
1.3.1 样品前处理
将HLB小柱安装在固相萃取装置上,依次加入3.0 mL甲醇、3.0 mL水,活化、平衡HLB小柱,然后移取3.0 mL黄酒样液过柱,控制流速不超过2 mL/min,然后加入3.0 mL水洗去残留在HLB小柱上的糖类等极性物质,再加入3.0 mL体积分数40%甲醇溶液淋洗非极性杂质,待淋洗液全部通过小柱后,加入3.0 mL甲醇,控制流速2 mL/min,收集洗脱液,混匀,过0.45 μm尼龙微孔滤膜供气相色谱分析。
1.3.2 糖分检测实验前处理
分别取黄酒样品和经过HLB小柱净化处理后的样品1.5 mL,加入3.0 mL 6 mol/L的盐酸溶液在68 ℃酸解20 min,将样品中的糖分酸解为葡萄糖,用20 g/100 mL NaOH溶液调至中性,加入6.0 mL乙腈,用水定容至15.0 mL,过0.45 μm尼龙微孔滤膜后,供液相色谱-示差折光检测器分析。
1.3.3 色谱条件
1.3.3.1 气相色谱条件
毛细色谱柱:CP-WAX 57 CB(25 m×0.25 mm,0.20 μm);进样口温度:230 ℃,分流比:30∶1;载气(N2)流速:1 mL/min;程序升温:起始温度50 ℃,保持4 min,以10 ℃/min的升温速率至110 ℃,再以7 ℃/min的升温速率至180 ℃保持2 min;氢火焰离子化检测器温度:280 ℃,尾吹(N2)流速:30 mL/min,氢气流速:50 mL/min,空气流速:400 mL/min;进样量:1 μL。
1.3.3.2 液相色谱条件
色谱柱:碳水化合物分析柱(SHISEIDO NH2 UG80)(4.6 mm×250 mm,5 μm);流动相:乙腈-水(77∶23,V/V);流速:1.0 mL/min;柱温:25 ℃;示差折光检测器温度:35 ℃;进样量:20 μL。
2 结果与分析
2.1 黄酒中β-苯乙醇在HLB小柱上的保留效果
由于黄酒中乙醇的存在,可能会影响β-苯乙醇在HLB小柱上的吸附保留。黄酒中乙醇体积分数一般在7%~18%之间,本实验分别以体积分数为7%、9%、11%、13%、15%、20%的乙醇溶液为溶剂,配制质量浓度为100 mg/L的β-苯乙醇溶液,HLB小柱经活化、平衡后,于6 份不同溶剂的β-苯乙醇溶液中分别取3 mL过柱,收集6 份样品流出液,测定流出液中β-苯乙醇的含量。结果发现,6 份流出液中均未检出β-苯乙醇,说明当乙醇体积分数不大于20%时,β-苯乙醇可以得到良好的保留。
2.2 淋洗液的确定
在正相操作时,常用的淋洗液包括乙酸乙酯、丙酮、正己烷、二氯甲烷等,HLB小柱是以N-乙烯基吡咯烷酮和二乙烯基苯为主要官能团的亲水亲脂型固相萃取小柱,在本实验中反相使用。常用的反相淋洗液主要有水-甲醇和水-乙腈两种体系,其中水是最易得、最廉价的极性淋洗液,而对于非极性淋洗液的选择,甲醇的毒性相对乙腈较小,价格也相对低廉,因此本实验优先使用甲醇水溶液作为非极性杂质的淋洗液。本实验以β-苯乙醇质量浓度为60.6 mg/L、溶剂为15%乙醇溶液的标准溶液为样本,固相萃取小柱经活化、平衡后,取3.0 mL标准溶液过柱,先用3.0 mL水淋洗极性组分,然后分别以3 mL体积分数为10%、20%、30%、40%、50%、60%、70%的甲醇溶液作为非极性杂质的淋洗液,考察不同甲醇体积分数的淋洗液对β-苯乙醇回收率的影响,淋洗液中甲醇体积分数对β-苯乙醇回收率的影响见图1。
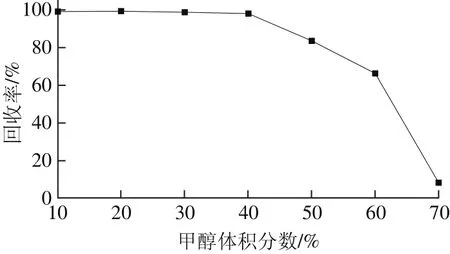
图1 淋洗液中甲醇体积分数对β-苯乙醇回收率的影响(n=3)Fig. 1 Effect of methanol concentration on the recovery of β-phenylethanol (n = 3)
当淋洗液中甲醇体积分数低于40%时,回收率为98.1%~99.4%;当淋洗液中甲醇体积分数达到50%时,有少量β-苯乙醇穿透固相萃取小柱;当淋洗液中甲醇体积分数大于50%时,目标物的流失速率加快;当甲醇体积分数升高至70%,回收率下降至8.3%。通过回收率实验发现,控制甲醇体积分数不超过40%,可以最大程度地淋洗非极性杂质。
2.3 洗脱体积的确定

图2 洗脱体积对β-苯乙醇回收率的影响(n=3)Fig. 2 Effect of eluent volume on the recovery of β-phenylethanol (n = 3)
洗脱是固相萃取技术中关系到目标物回收率的关键环节,洗脱液用量过大或过小都会对实验产生不利的影响。以15%乙醇溶液为溶剂,配制60.6 mg/L质量浓度的β-苯乙醇,固相萃取柱依次经活化、平衡、上样、淋洗除杂后,分别加入0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL甲醇考察不同体积的洗脱溶剂对回收率的影响。如图2所示,当洗脱体积小于2.5 mL时,回收率与洗脱体积成正比关系,当加入2.5 mL甲醇时回收率为98.7%,当洗脱体积提高至3.0 mL以上,回收率基本保持不变,说明此时β-苯乙醇已经完全洗脱,因此确定洗脱液甲醇的体积为3.0 mL。
2.4 固相萃取净化效果分析
2.4.1 液相色谱法对净化前后糖分的测定结果
GB/T 13662—2008[29]中,β-苯乙醇的检测采用直接进样、内标法定量的方法。由于黄酒中含有大量的糖分、色素等杂质,尤其是甜型黄酒的糖度高达100 g/L以上,对气相色谱系统的污染较为严重。以HLB小柱的亲脂基团二乙烯基苯固定目标物β-苯乙醇,以水为淋洗液,可以去除糖类及多数极性物质。本实验采用GB/T 18932.22—2003《蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法 液相色谱示差折光检测法》[30]分别测定未经净化处理的黄酒样品和经过HLB小柱处理后的样品中糖分的含量(以葡萄糖计),评价HLB小柱对糖分的去除效果。
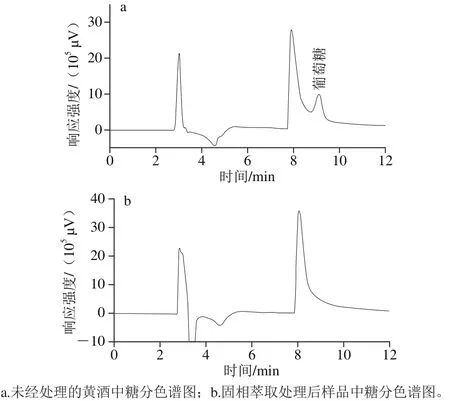
图3 糖分的去除效果Fig. 3 Chromatograms showing complete sugar removal by solid phase extraction
由图3可知,经过HLB小柱净化后,糖度由73.9 g/L降低到检出限(2.0 g/L)以下,说明糖分的去除效果良好。
2.4.2 气相色谱法对净化前后样品的测定结果
酒样采用直接进样的方式,气相色谱测定β-苯乙醇含量,由于杂质的干扰,其气相色谱图杂峰较多,基线漂移严重,对目标物定量分析易产生不利影响,见图4a。使用安捷伦Rev.B.04.02[96]工作站,设置1为最小峰面积,从7.5~24 min内共积分色谱峰31 个;经HLB小柱净化处理后,在相同时间段、相同阈值条件下,色谱峰数量由31 个减少至7 个,杂峰有效消除,基线相对平稳,目标物保留时间为18.413 min,峰形对称、尖锐,周围无干扰峰,整体色谱图得到了有效的改善,见图4b。
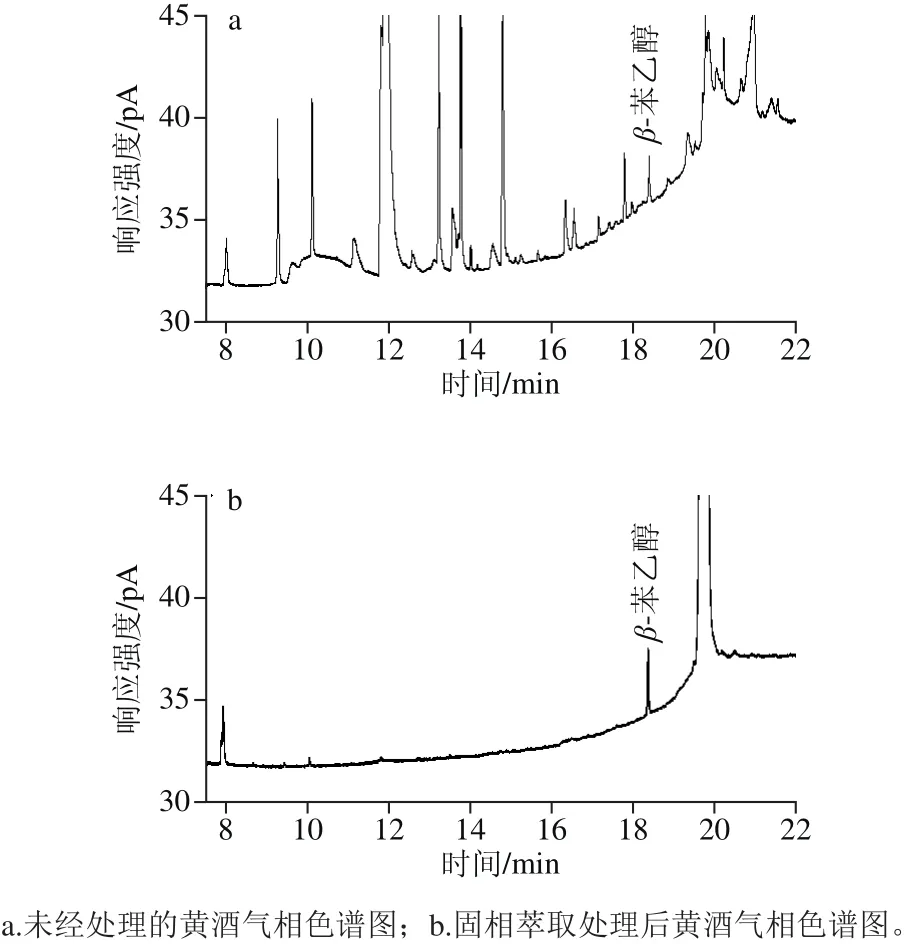
图4 固相萃取处理前后样品色谱对比图Fig. 4 Comparison of chromatograms of rice wine samples before and after solid phase extraction
2.5 方法学评价
2.5.1 线性范围、检出限与定量限
对质量浓度分别为10.1、20.2、60.6、101.0、202.0 mg/L的标准工作液按照1.3.3.1气相色谱法建立峰面积(y)与质量浓度(x,mg/L)的线性关系,结果表明,β-苯乙醇在10.1~202.0 mg/L质量浓度范围内线性良好,线性方程为y=0.459 4x+0.014 7,线性相关系数r为0.999 9。选取未检出β-苯乙醇的非稻米黄酒为空白基质,在5 mg/L的添加水平下,以信噪比等于3计算方法检出限,信噪比等于10计算定量限,得到本方法β-苯乙醇的检出限和定量限分别为0.9、3.0 mg/L。
2.5.2 回收率和精密度实验结果
在已知质量浓度为65.4 mg/L的黄酒样品中添加标准溶液(2 020.4 mg/L),配制成5.0、20.2、60.6 mg/L 3个水平的酒样,进行实际样品加标试验,分别采用本方法和GB/T 13662—2008方法测定β-苯乙醇,每个水平测定5 次,计算回收率及精密度。结果表明,本方法的平均回收率在95.5%~98.5%之间,相对标准偏差为1.1%~1.4%;国标方法的平均回收率在70.4%~135.2%之间,相对标准偏差为3.3%~8.4%。本方法与国标方法相比,检测结果基本一致,但是由于国标方法中样品未进行净化处理,杂质干扰和基线偏移等现象影响了目标峰的准确定量,因此国标方法的回收率不稳定,精密度也相对较差。回收率和精密度实验结果见表1。
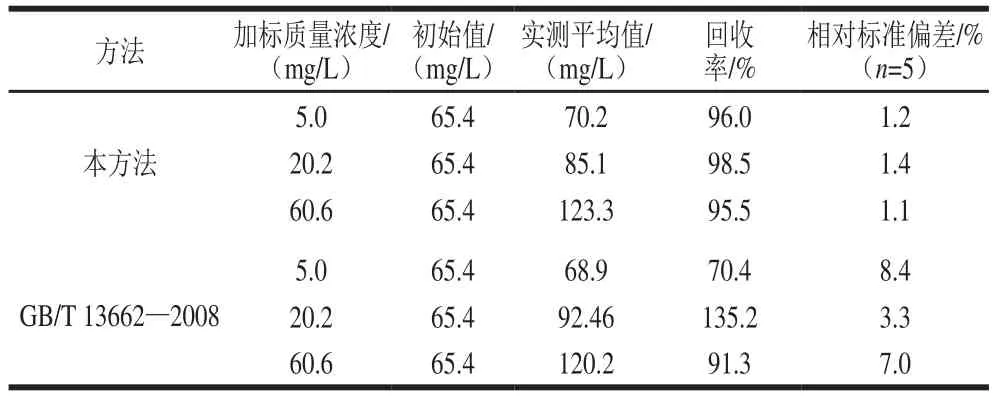
表1 不同方法测定黄酒中β-苯乙醇的回收率和精密度Table 1 Relative standard deviation (RSD) of β-phenylethanol in rice wine by different methods
2.5.3 样品检测结果
采用本实验建立的检测方法测定市售不同类型的黄酒中β-苯乙醇的含量,每个样品平行测定3 次,检测结果见表2。

表2 不同黄酒中β-苯乙醇的检测结果(n=3)Table 2 β-Phenylethanol concentrations of different rice wine samples (n= 3)
GB/T 13662—2008中按含糖量将黄酒分为干型黄酒、半干、半甜和甜型黄酒,干型是指黄酒中总糖不大于15.0 g/L(以葡萄糖计)。在发酵过程中,糖转化成了酒精,因此成品干型黄酒中糖含量低,酒精含量高,香味成分馥郁。结合样品的检测结果,也发现传统稻米干型(93.8 mg/L)和传统稻米半干型(96.3~114.7 mg/L)这两类发酵程度高的黄酒中β-苯乙醇的含量相对高于传统半甜型黄酒(65.4~74.8 mg/L)和传统甜型黄酒(48.2 mg/L);清爽型黄酒中β-苯乙醇质量浓度相对较低,为51.5 mg/L;在以食用酒精为主要原料,添加香辛料、黄酒、食品添加剂等配制而成的非稻米黄酒中,β-苯乙醇含量低于定量限,而以玉米为主要原料的非稻米黄酒中检出β-苯乙醇质量浓度为71.7 mg/L。
3 结 论
本实验采用固相萃取-气相色谱法测定黄酒中β-苯乙醇的含量,通过对样品的除杂、溶剂置换处理,有效去除了水分、糖分、色素等极性组分,有效降低了难挥发物对色谱系统的污染,减小了水分对色谱柱造成的危害。同时,该方法与GB/T 13662—2008相比,杂峰干扰和基线漂移对定量分析的影响得到了有效改善,提高了检测方法的精密度。考虑到目标物的挥发性,本实验未对HLB小柱洗脱液进行氮吹浓缩处理,从操作程序上缩短了前处理时间。该方法操作便捷,检出限低,结果准确可靠,适用于黄酒中β-苯乙醇的检测。
[1] STARK D, MUNCH T, SONNLEITNER B, et a1. Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomyces cerevisiae[J]. Biotechnology Progress, 2002, 18(3)∶514-523. DOI∶10.1021/bp020006n.
[2] ZHU Y J, ZHOU H T, HU Y H, et al. Antityrosinase and antimicrobial activities of 2-phenylethanol, 2-phenylacetaldehyde and 2-phenylacetic acid[J]. Food Chemistry, 2011, 124(1)∶ 298-302. DOI∶10.1016/j.foodchem.2010.06.036.
[3] ETSCHMANN M, BLUEMKE W, SELL D, et al. Biotechnological production of 2-phenylethanol[J]. Applied Microbiology &Biotechnology, 2002, 59(1)∶ 1-8. DOI∶10.1007/s00253-002-0992-x.
[4] SAKAI M, HIRATA H, SAYAMA H, et a1. Production of 2-phenylethanol in roses as the dominant floral scent compound from L-phenylalanine by two key enzymes, a PLP-dependent decarboxylase and a phenylacetaldehyde reductase[J]. Bioscience, Biotechnology,and Biochemistry, 2007, 71(10)∶ 2408-2419. DOI∶10.1271/bbb.70090.
[5] AKITAO, IDA T, OBATA T, et al. Mutants of saccharomyces cerevisiae producing a large quantity of β-phenylethyl acetate[J].Journal of Fermentation and Bioengineering, 1990, 69∶ 125-128.
[6] CHEN X M, KOBAYASHI H, SAKAI M, et al. Functional characterization of rose phenylacetaldehyde reductase (PAR),an enzyme involved in the biosynthesis of the scent compound 2-phenylethanol[J]. Journal of Plant Physiology, 2011, 168(2)∶ 88-95.DOI∶10.1016/j.jplph.2010.06.011.
[7] 梅建风, 陈虹. 生物转化法生成β-苯乙醇[J]. 微生物学通报, 2005,2(2)∶ 114-118.
[8] 黄亚东, 印伯星. 关于啤酒酵母产生苯乙醇的研究[J]. 酿酒科技,2003(5)∶ 62-63. DOI∶10.3969/j.issn.1001-9286.2003.05.020.
[9] LUO T, FAN W, XU Y. Characterization of volatile and semivolatile compounds in Chinese rice wines by headspace solid phase microextraetion followed by gas chromatography-mass spectrometry[J]. Journal of the Institute of Brewing, 2008, 114(2)∶172-179. DOI∶10.1002/j.2050-0416.2008.tb00323.x.
[10] ALBERTAZZI E, CARDILLO R, SERVI S, et al. Biogeneration of 2-phenylethanol and 2-phenylethylacetate important aroma components[J]. Biotechnology Letters, 1994, 16∶ 491-496.DOI∶10.1007/BF01023331.
[11] 陈双, 罗涛, 徐岩宰, 等. 我国黄酒酵母和酿酒原料对黄酒中β-苯乙醇含量的影响[J]. 中国酿造, 2009, 28(4)∶ 23-26.
[12] FABRE C E, BLANC P J, GOMA G. 2-Phenylethyl alcohol∶ anaroma profile[J]. Perfumer & Flavorist, 1998, 23∶ 43-45.
[13] 李家寿. 黄酒色、香、味成分来源浅析[J]. 酿酒科技, 2001(3)∶ 48-50.DOI∶10.3969/j.issn.1001-9286.2001.03.019.
[14] 鲍忠定, 许荣年. 黄酒香气成分的分析[J]. 酿酒科技, 1999(5)∶ 66-67.
[15] 陈虹, 梅建凤. 紫外分光光度法测定发酵液中的2-苯乙醇含量[J].食品与发酵工业, 2007, 33(4)∶ 134-136. DOI∶10.3321/j.issn∶0253-990X.2007.04.034.
[16] 赵阳, 丁春燕, 蔡良英. 外标法测定黄酒中β-苯乙醇的含量[J]. 食品工程, 2015(4)∶ 61-63. DOI∶10.3969/j.issn.1673-6044.2015.04.017.
[17] 尹桂豪, 吴月仙, 章程辉, 等. 气相色谱法测定黄酒中β-苯乙醇的含量[J]. 中国酿造, 2008, 27(17)∶ 74-75. DOI∶10.3969/j.issn.0254-5071.2008.09.027.
[18] 胡媛, 刘文民, 周艳明, 等. 固相微萃取-气相色谱法测定红葡萄酒中残留的有机磷农药[J]. 色谱, 2006, 24(3)∶ 290-293. DOI∶10.3321/j.issn∶1000-8713.2006.03.018.
[19] 赵玉玲. 用气相色谱法测定黄酒中β-苯乙醇分流比的选择研究[J]. 河南科技, 2017(5)∶ 140-141. DOI∶10.3969/j.issn.1003-5168.2017.05.055.
[20] 张倩, 寻思颖, 冯永渝, 等. 用气相色谱法测定饮料酒中β-苯乙醇含量的探讨[J]. 中国酿造, 2012, 31(7)∶ 149-151. DOI∶10.3969/j.issn.0254-5071.2012.07.041.
[21] 李博斌. 用溶剂萃取后测定β-苯乙醇的方法[J]. 中国黄酒, 2000(3)∶23-29.
[22] 赵修报, 唐育岐, 刘天明. β-苯乙醇的研究进展[J]. 中国酿造, 2011,30(8)∶ 1-4. DOI∶10.3969/j.issn.0254-5071.2011.08.001.
[23] 李诗铁, 寻思颖, 郝金竹, 等. 饮料酒中β-苯乙醇标准物质标准浓度的测量[J]. 中国计量, 2013(1)∶ 88-90. DOI∶10.16569/j.cnki.cn11-3720/t.2013.01.015.
[24] 陈青俊, 丁献荣, 汪庆旗, 等. 高效液相色谱-二极管阵列检测法测定黄酒中β-苯乙醇的含量[J]. 食品与发酵工业, 2007, 30(3)∶ 94-96.DOI∶10.3321/j.issn∶0253-990X.2004.03.022.
[25] 诸葛庆, 李博斌, 郑云峰, 等. 反相高效液相色谱法测定黄酒中的β-苯乙醇[J]. 食品科学, 2009, 30(14)∶ 175-177. DOI∶10.3321/j.issn∶1002-6630.2009.14.033.
[26] 刘东亚, 金征宇. RP-HPLC法测定发酵液中β-苯乙醇的研究[J]. 食品工业科技, 2006, 27(1)∶ 199-200. DOI∶10.3969/j.issn.1002-0306.2006.01.065.
[27] 芦智远, 韩巧艳, 徐忠. 静态顶空气相色谱法测定黄酒β-苯乙醇的含量[J]. 中国酿造, 2012, 31(11)∶ 167-168.
[28] WANI M A, SANJANA K, KUMAR D M, et al. GC-MS analysis reveals production of 2-phenylethanol from Aspergillus niger endophytic in rose[J]. Journal of Microbiology, 2010, 50(1)∶ 110-114.DOI∶10.1002/jobm.200900295.
[29] 国家质量监督检验检疫总局. 黄酒∶ GB/T 13662—2008[S]. 北京∶中国标准出版社, 2008∶ 14-16.
[30] 国家质量监督检验检疫总局. 蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法 液相色谱示差折光检测法∶ GB/T 18932.22—2003[S]. 北京∶ 中国标准出版社, 2003∶ 1-3.
Determination of β-Phenylethanol in Rice Wine by Solid Phase Extraction-Gas Chromatography
LU Zhiyuan, ZHANG Yaowu*, LI Xuejuan, FENG Xinyi, XUE Huihui, GUO Songnian, LIU Jia
(Xi’an Supervision & Inspection Institute of Product Quality, Xi’an 710065, China)
Objective∶ To establish a method for the determination of β-phenylethanol in rice wine by solid phase extraction(SPE)-gas chromatography (GC). Methods∶ β-Phenylethanol was enriched from 3.0 mL of rice wine with an activated and balanced HLB solid phase extraction column, which was washed with 3.0 mL of water and 3.0 mL of methanol-water (4∶6,V/V), and eluted with 3.0 mL of methanol. A gas chromatograph equipped with flame ionization detector (GC-FID) was used to analyze the target compounds. Results∶ In the concentration range of 10.1–202.0 mg/L, good linearity was achieved with a correlation coefficient (r) of 0.999 9. The limit of detection (LOD, RSN= 3) and the limit of quantification (LOQ, RSN= 10)were 0.9 and 3.0 mg/L, respectively. The recovery of β-phenylethanol was in the range of 95.5%-98.5%. The precision values expressed as relative standard deviations (RSDs) were 1.1%-1.4%. Conclusion∶ The method is simple, convenient,accurate and applicable to the determination of β-phenylethanol in rice wine and can effectively reduce the pollution of the gas chromatography system by rice wine matrix and prevent water in rice wine samples from bringing harm to the capillary column.
solid phase extraction (SPE); gas chromatography (GC); rice wine; β-phenylethanol
DOI∶10.7506/spkx1002-6630-201724034
TS207.3
A
1002-6630(2017)24-0213-05
芦智远, 张耀武, 李雪娟, 等. 固相萃取-气相色谱法测定黄酒中β-苯乙醇含量[J]. 食品科学, 2017, 38(24)∶ 213-217.DOI∶10.7506/spkx1002-6630-201724034. http∶//www.spkx.net.cn
LU Zhiyuan, ZHANG Yaowu, LI Xuejuan, et al. Determination of β-phenylethanol in rice wine by solid phase extractiongas chromatography[J]. Food Science, 2017, 38(24)∶ 213-217. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724034. http∶//www.spkx.net.cn
2016-12-27
国家质量监督检验检疫总局科技项目(2016QK109)
芦智远(1987—),男,工程师,硕士,研究方向为食品检验。E-mail:65651736@qq.com
*通信作者:张耀武(1972—),男,正高级工程师,硕士,研究方向为食品检验。E-mail:1009693925@qq.com
