基于谷胱甘肽识别系统的胶体金比色法快速检测水中重金属铅离子
2017-12-11陆剑锋潘道东
张 静,程 琳,林 琳,陆剑锋,潘道东,陈 伟,*
基于谷胱甘肽识别系统的胶体金比色法快速检测水中重金属铅离子
张 静1,程 琳1,林 琳1,陆剑锋1,潘道东2,陈 伟1,*
(1.合肥工业大学食品科学与工程学院,安徽 合肥 230041;2.宁波大学海洋学院,浙江 宁波 315211)
基于谷胱甘肽的胶体金比色法建立简单快速检测水中重金属铅离子的方法。利用谷胱甘肽能够抑制高浓度的盐溶液聚集,同时在加入Pb2+的情况下,又能够使胶体金发生聚集,从而使胶体金的颜色发生变化。在优化条件下,比色法检测铅离子的线性范围为10.36~1 036 ng/mL,检出限为2.072 ng/mL,加标回收率为99.1%~103.6%,相对标准偏差小于4%。该方法检测灵敏度高,稳定性和重复性较好,可作为测定水中重金属铅离子含量的快速检测方法。
谷胱甘肽;金纳米粒子;比色检测;铅离子
铅具有高代谢稳定性,是自然界中已知的分布最广、毒性最大的重金属污染物之一。铅通过饮食或呼吸等方式进入人体后,会对神经系统、骨髓造血机能、消化系统、生殖系统以及肾脏等造成伤害[1-4]。随着社会经济的发展,大量含有的重金属污染物的工业废水和生活污水排入自然水域中,致使自然水域中重金属含量升高,也造成农(水)产品中重金属的富集,会直接或间接危害人体健康。
近年来,由于自然水域的污染日益加剧,因此世界各国的学者专家研究了其中的各种重金属,开展了大量的检测和治理方法研究。目前获得广泛认可的方法主要有原子吸收光谱法[5-6]、电感耦合等离子质谱法[7-8]、原子荧光光谱法[9-10]等。其中电感耦合等离子质谱法、原子吸收光谱法检出限较优,部分检出元素为ng/L级,但是仪器本身价格昂贵,对环境条件要求高、操作复杂、成本高,因此现在多被用作标准测量。原子荧光光谱法多用于环境及食品中汞、砷等元素的分析和测定,但操作繁琐、费用较高。目前也有很多电化学[11-12]和比色法[13-14]检测重金属离子铅,虽然操作已经简单很多,但是都要用到脱氧核酶[15-17],因此重复性和稳定性较差,反应条件也比较难控制。上述方法还存在一个共同严重的问题:由于需要大型仪器的操作,只能在实验室内进行,不能用于现场测试,因此不能满足应急监测的要求。
基于谷胱甘肽[18-20]的胶体金比色法[21-25]已经被用于检测多种物质(如镉离子、汞离子、雌二醇等),该方法不但灵敏度高,而且所需样品(特别是水样)前处理步骤也较简易,因而得到广泛研究。谷胱甘肽能够抑制高浓度盐溶液下的胶体金溶液的聚集[26],当加入重金属离子铅时,铅离子能够和谷胱甘肽进行螯合[27],因而使金纳米粒子(gold nanoparticles,AuNPs)表面的谷胱甘肽减少,进而降低AuNPs的稳定性,使AuNPs在高浓度盐溶液下发生聚集,从而可以建立一种基于谷胱甘肽的胶体金比色法检测重金属Pb2+的方法。本实验无需化学改性和复杂的操作,就能实现高的选择性和好的灵敏度。因而此项检测技术的建立,为水中重金属铅的检测提供更加快速、灵敏的方法。
1 材料与方法
1.1 材料与试剂
氢氧化钠、氯化钠、硝酸铅、氯化镍六水化合物、氯化铁六水化合物、氯化钡、氯化锌、氯化铝、柠檬酸三钠、浓硝酸、浓盐酸 国药集团化学试剂有限公司;谷胱甘肽 生工生物工程(上海)股份有限公司;氯金酸三水化合物 百灵威科技有限公司;实验室用水为超纯水(>18 MΩ)。
1.2 仪器与设备
FC型酶标仪 美国Thermo Fisher公司;AL104分析天平 美国Mettler Toledo公司;EOS600D单反相机佳能光学设备有限公司;加热磁力搅拌器 德国IKA公司。
1.3 方法
1.3.1 15 nm和30 nm金纳米粒子的制备
金纳米粒子合成采用文献[28]报道的方法,取100 mL的锥形瓶先用水洗干净,用王水浸泡过夜后洗净烘干备用,然后在锥形瓶中加入50 mL超纯水和850 μL氯金酸溶液(5 g/L),在加热磁力搅拌器上加热至沸腾。沸腾后打开磁力搅拌器为1 500 r/min,并迅速加入一定量质量分数为1%的柠檬酸钠溶液(15 nm和30 nm金纳米粒子加入的柠檬酸钠溶液分别是1 000 μL和820 μL),溶液的颜色在2 min内会发生明显变化,至颜色不变后继续加热煮沸5 min使制得胶体金溶液更稳定;冷却后补水至原体积50 mL,在0~4 ℃条件下保存待用。将制备好的胶体金溶液分装至1 mL离心管中,在9 700 r/min条件下离心7 min,弃去部分上清液后浓缩至原来体积的1/10(0.1 mL),在0~4 ℃条件下保存待用。
1.3.2 金纳米粒子的表征
用紫外-可见分光光度计扫描制备的胶体金在波长400~800 nm的吸光度,根据最大吸收峰的位置估计胶体金的平均粒径及均一性,并以此验证AuNPs是否合成。
1.3.3 氯化钠溶液浓度的优化
在浓缩的胶体金溶液中加入浓度为0、5、10、20、30、40、50 mmol/L的氯化钠溶液,测定AuNPs的聚集程度,聚集程度用吸光度表示,根据结果选出使其聚集的最佳的氯化钠溶液浓度。
1.3.4 谷胱甘肽浓度的优化
在高浓度的氯化钠溶液中,谷胱甘肽能够阻止金纳米粒子的聚集,保持金纳米粒子的稳定,所以其浓度是一个必需优化的条件。分别取浓缩好的15 nm和30 nm胶体金按体积比1∶1混合,然后取50 μL加入96 孔板中,每8 个孔板为一组,共6 组,再在每组孔板中加入10 μL不同浓度的谷胱甘肽(0、5、10、50、100、150 μmol/L),振荡混匀,在室温下放置30 min,然后每组孔板中加入10 μL不同浓度的Pb2+(0、0.005、0.01、0.05、0.1、0.5、1、5 μmol/L),振荡混匀,最后在每个孔板中都加入10 μL 30 mmol/L氯化钠溶液,振荡混匀,观察颜色变化。扫描溶液400~800 nm的紫外-可见光谱,并以650 nm和526 nm波长处的吸光度比值(A650nm/A526nm)作为纵坐标,以Pb2+浓度为横坐标绘出变化曲线,对比不同浓度谷胱甘肽对实验的影响。
1.3.5 检测pH值优化
本实验会受到溶液pH值的影响,所以要对溶液pH值进行优化。分别取浓缩好的15 nm和30 nm胶体金按体积比1∶1混合,用不同pH值的磷酸盐缓冲溶液(phosphate buffered solution,PBS)将胶体金的pH值分别调节到5、6、7和8,再各取胶体金50 μL加入96 孔板中,每8 个孔板为一组,共4 组,然后在每组孔板中加入10 μL 50 μmol/L的谷胱甘肽溶液,振荡混匀,在室温放置30 min,每组孔板中加入10 μL不同浓度的Pb2+(0、0.005、0.01、0.05、0.1、0.5、1、5 μmol/L),振荡混匀,最后每个孔板中都加入10 μL 30 mmol/L氯化钠溶液,振荡混匀,观察颜色变化。扫描溶液400~800 nm的紫外-可见光谱,并以A650nm/A526nm作为纵坐标,以Pb2+浓度为横坐标绘出变化曲线,对比不同pH值对实验的影响。
1.3.6 标准曲线的建立和样品检测
分别取浓缩好的15 nm和30 nm胶体金按体积比1∶1混合,用PBS将胶体金的pH值调节到6,各取胶体金50 μL分别加入8 个96 孔板中,然后在每个孔板中加入10 μL 50 μmol/L的谷胱甘肽,振荡混匀,在室温放置30 min,孔板中各加入10 μL不同浓度的Pb2+(0、0.005、0.01、0.05、0.1、0.5、1、5 μmol/L),振荡混匀,最后每个孔板中都加入10 μL 30 mmol/L氯化钠溶液,振荡混匀,观察颜色变化。扫描溶液波长400~800 nm波长处的紫外-可见光谱,并以A650nm/A526nm作为纵坐标,以Pb2+浓度为横坐标绘出标准曲线。
1.3.7 特异性实验
通过比色法检测重金属Pb2+时,其他重金属也可能会对实验结果产生影响,所以本实验也验证了比色法检测重金属Pb2+的特异性。分别取浓缩好的15 nm和30 nm胶体金按体积比1∶1混合,用PBS将胶体金的pH值调节到6,再各取胶体金50 μL加入8 个96 孔板中,然后在每个孔板中加入10 μL 50 μmol/L的谷胱甘肽,振荡混匀,在室温下放置30 min,孔板中各加入10 μL不同的重金属离子溶液(Pb2+浓度为0.1 μmol/L;Fe3+、Ni2+、Zn2+、Al3+、Ba2+、Cd2+、Hg2+浓度均为1 μmol/L),振荡混匀,最后在每个孔板中加入10 μL 30 mmol/L氯化钠溶液,振荡混匀,观察颜色的变化。扫描溶液400~800 nm波长范围的紫外-可见光谱,并以A650nm/A526nm作为纵坐标,以不同重金属离子为横坐标绘出柱状图,对比不同金属离子对实验的影响。
1.3.8 加标回收率及精密度实验
选用自来水为研究对象,对样品1、2、3分别添加适量的0.05、0.10、0.5 μg/mL铅离子标准溶液,依照1.3.6节进行检测,计算加标回收率,分别对样品2、3平行测定5 次,计算相对标准偏差。
2 结果与分析
2.1 金纳米粒子表征结果
图1表示15 nm和30 nm不同粒径胶体金的颜色及波长400~800 nm的紫外-可见光谱图。用柠檬酸钠还原法制备的胶体金由于表面等离子共振而呈现透亮的红色,从图1插图可以看出,胶体金的粒径越大,使其表面等离子共振发生变化,使得胶体金的颜色有橙红变为酒红,并且导致紫外-可见光谱图中特征吸收峰向右移动,AuNPs的这种特征符合文献[29]的报道。从图1可以看出胶体金在520 nm左右波长处有明显的吸收峰,为胶体金的特征吸收峰,说明AuNPs基本合成成功。
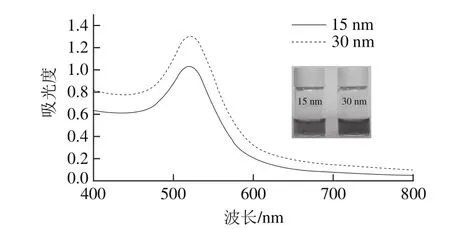
图1 AuNPs的紫外-可见吸收光谱Fig. 1 UV-visible absorption spectrum of synthesized gold nanoparticles
2.2 检测条件优化结果
2.2.1 氯化钠溶液浓度优化结果
要获得最佳的优化条件,首先进行氯化钠溶液浓度的优化。当氯化钠溶液加入到胶体金溶液中,从图2可以看出,随着氯化钠浓度的增加,在650 nm波长处的吸光度逐渐增大,这个新峰的出现就是由于胶体金发生聚集而产生的等离子共振变化而引起的[30],且AuNPs的特征峰向右偏移,因而选择A650nm/A526nm衡量AuNPs的聚集程度。低的A650nm/A526nm表明AuNPs在溶液中是分散的,高的A650nm/A526nm表明AuNPs已聚集。从图3可以看出,当氯化钠浓度为30 mmol/L时,A650nm/A526nm已达到较大的值,氯化钠浓度再增加时,其趋于平稳,因此选择氯化钠浓度为30 mmol/L,表明此时AuNPs已完全聚集。
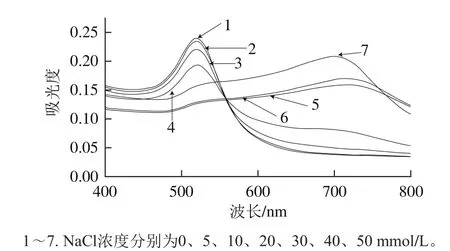
图2 在不同NaCl浓度条件下AuNPs紫外-可见吸收光谱Fig. 2 UV-visible absorption spectra of synthesized AuNPs in the presence of different concentrations of NaCl
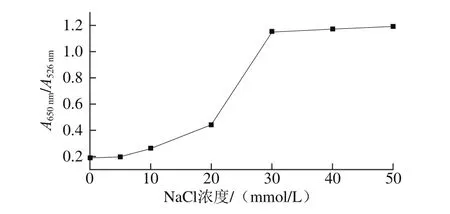
图3 对于不同NaCl浓度条件下AuNPs的A650nm/A526nm值Fig. 3 Plot of A650nm/A526nm ratio of AuNPs versus NaCl concentration
2.2.2 谷胱甘肽浓度优化结果
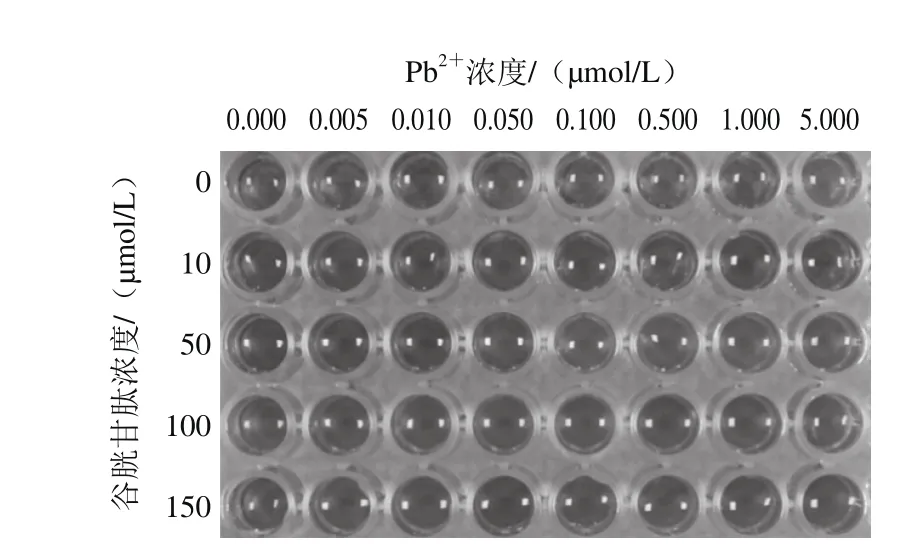
图4 在不同Pb2+浓度条件下对应的不同谷胱甘肽浓度的AuNPs的照片Fig. 4 Photographs of AuNPs in the presence of different concentrations of Pb2+ and GSH
由图4可见,在谷胱甘肽存在的条件下,当其浓度为10 μmol/L和50 μmol/L时,空白时AuNPs没有发生聚集,说明谷胱甘肽能够在高浓度盐溶液中抑制AuNPs的聚集。另外随着Pb2+浓度的增加,AuNPs的颜色逐渐发生了变化,并且在谷胱甘肽浓度为50 μmol/L的条件下,0.05 μmol/L的Pb2+即可被检测出来,而其他浓度的谷胱甘肽都没有达到如此高的灵敏度,因此选择50 μmol/L的谷胱甘肽作为下一步实验。图5是扫描图4中各孔400~800 nm的紫外-可见光谱图,以A650nm/A526nm作为纵坐标,以Pb2+浓度为横坐标做出的相关折线图。从图5可以看出,谷胱甘肽浓度为50 μmol/L时检测灵敏度最高,折线图变化范围最大。
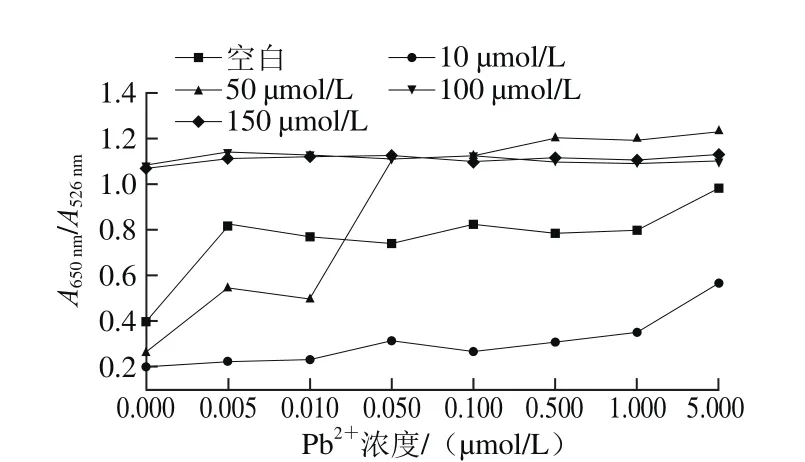
图5 在不同Pb2+浓度条件下对应的不同谷胱甘肽浓度的AuNPs的A650 nm/A526 nm值Fig. 5 Olot of A650nm/A526nm ratio of AuNPs in the presence of different concentrations of Pb2+ and GSH
2.2.3 检测pH值优化结果
AuNPs测定的灵敏度和稳定性与反应溶液的pH值有关,因此,为了最大程度地保持AuNPs反应速度和活性,必须确定测定的最佳pH值。从图6可以看出,在不同pH值的条件下,随着Pb2+浓度的增加,胶体金的颜色会发生变化。而且在pH 6时,可以检测出0.1 μmol/L的Pb2+,检测灵敏度比其他几组都要高,检测范围也高于其他组。因此,选择溶液pH 6作为接下来的试验条件。图7是扫描图6中各孔400~800 nm的紫外-可见光谱图后,以A650nm/A526nm作为纵坐标,以Pb2+浓度为横坐标做出的相关折线图。从图7可以看出,溶液pH 6时检测灵敏度最高。

图6 在不同Pb2+浓度条件下对应的不同pH值的AuNPs的照片Fig. 6 Photographs of AuNPs in the presence of different concentrations of Pb2+ at different pH values

图7 在不同Pb2+浓度条件下对应的不同pH值的AuNPs的A650nm/A526nm值Fig. 7 Plot of A650nm/A526nm ratio of AuNPs in the presence of different concentrations of Pb2+ at different pH values
2.3 标准曲线建立和样品检测结果

图8 在不同Pb2+浓度条件下AuNPs的照片Fig. 8 Photographs of AuNPs in the presence of different concentrations of Pb2+
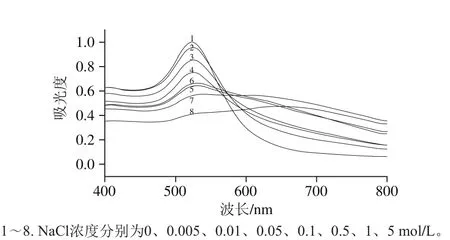
图9 在不同Pb2+浓度条件下AuNPs紫外-可见吸收光谱Fig. 9 UV-visible absorption spectra of AuNPs in the presence of different concentrations of Pb2+
从图8可以看出,胶体金的颜色随着Pb2+的增加,颜色从红色逐渐变为蓝色,甚至在0.1 μmol/L(2.072 ng/mL)的Pb2+存在时从红色变成暗紫色。因此,0.1 μmol/L(2.072 ng/mL)即为可视检测下限。应用紫外-可见光谱对检测结果进行半定量分析,结果见图9,随着Pb2+浓度的增加,胶体金的特征峰强度会逐渐减低,同时在650 nm左右位置出现的峰并越来越高。因此,用这两个峰的吸光度比值(A650nm/A526nm)绘制标准曲线来检测重金属Pb2+,并且随着Pb2+质量浓度从10.36~1 036 ng/mL变化而呈线性的关系(R2=0.997 4),其线性回归方程为y=0.291 52x+1.017 83,如图10所示。
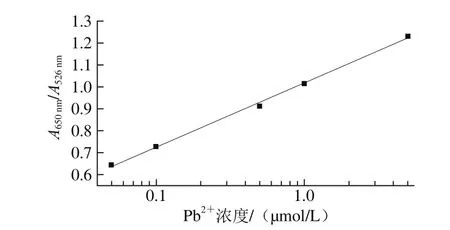
图10 Pb2+浓度与吸光度的线性相关性Fig. 10 Linear relationship between lead ion concentration and absorbance
2.4 特异性实验的结果

图11 特异性实验AuNPs照片Fig. 11 Photographs of AuNPs showing the specificity of the method
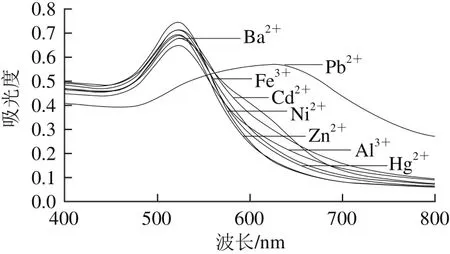
图12 特异性实验AuNPs紫外-可见吸收光谱Fig. 12 UV-visible absorption spectra showing the specificity of the method
从图11可以看出,1 μmol/L的其他金属离子都不会使胶体金颜色发生变化,而0.1 μmol/L的Pb2+即可使胶体金由红色变为暗紫色。从图12可以看出,其他离子的紫外-可见光谱几乎不变,而Pb2+的紫外-可见光谱图发生明显变化,可见只有Pb2+存在的情况下才会使得胶体金变色。图13是由图12紫外-可见光谱中A650nm/A526nm作为纵坐标,其他离子和Pb2+作为横坐标所做柱状图,可以看出只有Pb2+产生的信号特别大而其他离子的信号特别小,同样可以看出本实验具有较好的特异性。
2.5 加标回收率及精密度实验结果
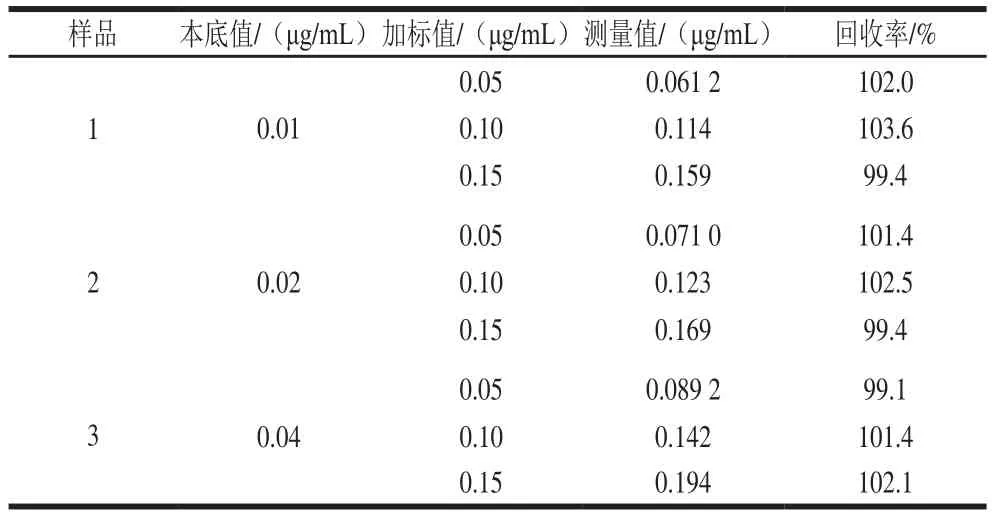
表1 加标回收率Table 1 Recoveries of lead ion from spiked samples
计算样品1、2、3的加标回收率结果如表1所示,回收率在99.1%~103.6%之间,分别对样品1、2、3平行测定5 次,计算方法的精密度。由表2可知,测定结果的相对标准偏差小于3%,分析方法准确可靠,精密度良好。
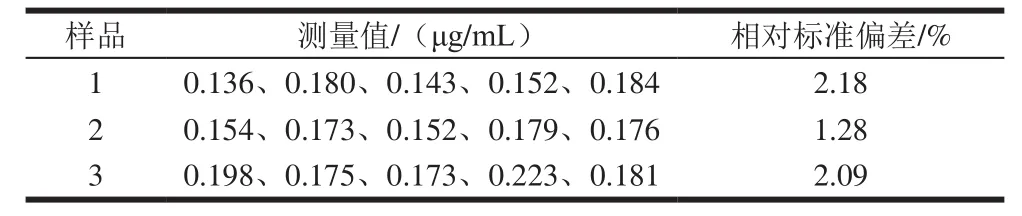
表2 精密度实验结果(n=5)Table 2 Precision of the method (n= 5)
3 结 论
实验建立了一种基于谷胱甘肽的胶体金比色法检测重金属离子铅,在实验优化出谷胱甘肽浓度为50 μmol/L,溶液pH 6的最佳条件下,得到标准曲线为y=0.291 52x+1.017 83,在10.36~1 036 ng/mL范围内线性良好,检出限可达2.072 ng/mL,重复性、稳定性和回收率较好,可以初步实现对水中重金属离子铅的检测。该方法应用在实际样品(自来水)的检测中,也可以得到预期的效果。此外,该方法操作简单,价格便宜,无需大型仪器,非常适宜作为简单快速的一步、现场检测重金属离子Pb2+。
[1] 樊祥, 伊雄海, 张继东, 等. 食品中铅的快速检测方法研究[J]. 现代仪器, 2010(6): 62-65. DOI:10.3969/j.issn.1672-7916.2010.06.021.
[2] ZHOU Q, LIN Y X, LIN Y P, et al. Highly sensitive electrochemical sensing platform for lead ion based on synergetic catalysis of DNAzyme and Au-Pd porous bimetallic nanostructures[J]. Biosensors &Bioelectronics, 2016, 78: 236-243. DOI:10.1016/j.bios.2015.11.055.
[3] LIU J W, LU Y. Accelerated color change of gold nanoparticles assembled by DNAzymes for simple and fast colorimetric Pb2+detection[J]. Journal of the American Chemical Society, 2004, 126(39):12298-122305. DOI:10.1021/ja046628h.
[4] 李猛, 张旭志, 崔毅, 等. 渔业海水中铅的快速定量检测方法[J]. 渔业科学进展, 2013, 34(5): 89-96. DOI:10.3969/j.issn.1000-7075.2013.05.014.
[5] OLSEN S, PESSENDA L C R, RIKA J, et al. Combination of flow injection analysis with flame atomic-absorption spectrophotometry:determination of trace amounts of heavy metals in polluted seawater[J].Analyst, 1983, 108: 905-917. DOI:10.1039/AN9830800905.
[6] RILEY J P, TAYLOR D. Chelating resins for the concentration of trace elements from sea water and their analytical use in conjunction with atomic absorption spectrophotometry[J]. Analytica Chimica Acta,1968, 40: 479-485. DOI:10.1016/S0003-2670(00)86764-1.
[7] BATTERHAM G J, MUNKSGAARD N C, PARRY D L.Determination of trace metals in seawater by inductively coupled plasma mass spectrometry after off-line dithiocarbamate solvent extraction[J]. Journal of Analytical Atomic Spectrometry, 1997,12(11): 1277-1280. DOI:10.1039/A704309K.
[8] BEAUCHEMIN D, MCLAREN J W, MYKYTIUK A P, et al.Determination of trace metals in an open ocean water reference material by inductively coupled plasma mass spectrometry[J]. Journal of Analytical Atomic Spectrometry, 1988, 3(2): 305-308. DOI:10.1039/ja9880300305.
[9] CHEM V, LECHNER J, DESROSIERS R, et al. Direct determination of dissolved and total thallium in lake waters by laser-excited atomic fluorescence spectrometry[J]. International Journal of Environmental Analytical Chemistry, 2006, 63(2): 153-165.DOI:10.1080/03067319608026261.
[10] BOL’SHOV M A, BOUTRON C F, ZYBIN A V. Determination of lead in Antarctic ice at the picogram-per-gram level by laser atomic fluorescence spectrometry[J]. Analytical Chemistry, 2002, 61(15):1758-1762. DOI:10.1021/ac00190a033.
[11] KWON S J, BARD A J. DNA Analysis by application of Pt nanoparticle electrochemical amplification with single label response[J]. Journal of the American Chemical Society, 2012, 134(26):10777-10779. DOI:10.1021/ja304074f.
[12] LIU H, KUZNETSOY A M, MASLIY A N, et al. Formation of Pb(Ⅲ) intermediates in the electrochemically controlled Pb(Ⅱ)/PbO2system[J]. Environmental Science & Technology, 2012, 46(3): 1430.DOI:10.1021/es203084n.
[13] SUN M T, YU H, ZHU H J, et al. Oxidative cleavage-based nearinfrared fluorescent probe for hypochlorous acid detection and myeloperoxidase activity evaluation[J]. Analytical Chemistry, 2014,86(1): 671-677. DOI:10.1021/ac403603r.
[14] LI T, WANG E, DONG S. Lead(Ⅱ)-induced allosteric G-quadruplex DNAzyme as a colorimetric and chemiluminescence sensor for highly sensitive and selective Pb2+detection[J]. Analytical Chemistry, 2010,82(4): 1515-1520. DOI:10.1021/ac902638v.
[15] ZHANG C, YANG J, JIANG S X, et al. DNAzyme-based logic gatemediated DNA self-assembly[J]. Nano Letters, 2015, 16(1): 736-741.DOI:10.1021/acs.nanolett.5b04608.
[16] SARAN R J, LIU Q W. A silver DNAzyme[J]. Analytical Chemistry,2016, 88: 4014-4020. DOI:10.1021/acs.analchem.6b00327.
[17] CHEN Y, COM R M. DNAzyme footprinting: detecting proteinaptamer complexation on surfaces by blocking DNAzyme cleavage activity[J]. Journal of the American Chemical Society, 2013, 135(6):2072-2075. DOI:10.1021/ja311367t.
[18] ZHOU L, PANG X Y, XIE C, et al. Chemical and enzymatic transformation of nimesulide to GSH conjugates through reductive and oxidative mechanism[J]. Chemical Research in Toxicology, 2015,28(12): 2267-2277. DOI:10.1021/acs.chemrestox.5b00290.
[19] TORTIGLIONE C, TINO Q A. Synthesis and biological assay of GSH functionalized fluorescent quantum dots for staining hydra vulgaris[J].Bioconjugate Chemistry, 2007, 18(3): 829-835. DOI:10.1021/bc060355t.
[20] DIOGO V V, TEIXEIRA V H, SANTOS H A F, et al. Conformational study of GSH and GSSG using constant-pH molecular dynamics simulations[J]. Journal of Physical Chemistry B, 2013, 117(25): 7507-7517. DOI:10.1021/jp401066v.
[21] DARBHA G K, SINGH A K, RAI U S, et al. Selective detection of mercury (Ⅱ) Ion using nonlinear optical properties of gold nanoparticles[J]. Journal of the American Chemical Society, 2008,130(25): 8038-8043. DOI:10.1021/ja801412b.
[22] ZHU Y Y, CAI Y L, ZHU Y B, et al. Highly sensitive colorimetric sensor for Hg2+, detection based on cationic polymer/DNA interaction[J]. Biosensors & Bioelectronics, 2015, 69: 174-178.DOI:10.1016/j.bios.2015.02.018.
[23] ALSAGER O A, KUMAR S, ZHU B C, et al. Ultrasensitive colorimetric detection of 17β-estradiol: the effect of shortening DNA aptamer sequences[J]. Analytical Chemistry, 2015, 87(8): 1716-1723.DOI:10.1021/acs.analchem.5b00335.
[24] SENER G, UZUN L, DENIZLI A. Colorimetric sensor array based on gold nanoparticles and amino acids for identification of toxic metal ions in water[J]. ACS Applied Materials & Interfaces, 2014, 6(21):18395-18400. DOI:10.1021/am5071283.
[25] YUNLEI X Y, WANG Z, SUN J S, et al. Colorimetric logic gates through molecular recognition and plasmonic nanoparticles[J]. Small,2014, 10(23): 4833-4838. DOI:10.1002/smll.201400479.
[26] GUO Y M, ZHANG Y, SHAO H W, et al. Label-Free colorimetric detection of cadmium ions in rice samples using gold nanoparticles[J].Analytical Chemistry, 2014, 86(17): 8530-8534. DOI:10.1021/ac502461r.
[27] ZHU D R, LI X K, LIU X, et al. Designing bifunctionalized gold nanoparticle for colorimetric detection of Pb2+, under physiological condition[J]. Biosensors & Bioelectronics, 2012, 31(1): 505-509.DOI:10.1016/j.bios.2011.11.026.
[28] SAHA K, AGASTI S S, KIM C, et al. Gold nanoparticles in chemical and biological sensing[J]. Chemical Reviews, 2012, 112(5): 2739-2779. DOI:10.1021/cr2001178.
[29] MUGISAWA M, SAWADA H. Architecture of linear arrays of fluorinated co-oligomeric nanocomposite-encapsulated gold nanoparticles: a new approach to the development of gold nanoparticles possessing an extremely red-shifted absorption characteristic[J]. Langmuir, 2008, 24(17): 9215-9218. DOI:/10.1021/la8015035.
[30] HUO Y, QI L, LV X J, et al. A sensitive aptasensor for colorimetric detection of adenosine triphosphate based on the protective effect of ATP-aptamer complexes on unmodified gold nanoparticles[J]. Biosensors &Bioelectronics, 2016, 78: 315-320. DOI:10.1016/j.bios.2015.11.043.
Gold Nanoparticles-Based Glutathione Recognition for Rapid Colorimetric Detection of Lead Ion in Water
ZHANG Jing1, CHENG Lin1, LIN Lin1, LU Jianfeng1, PAN Daodong2, CHEN Wei1,*
(1. College of Food Science and Engineering, Hefei University of Technology, Hefei 230041, China;2. School of Marin Sciences, Ningbo University, Ningbo 315211, China)
Herein a novel colorimetric method based upon gold nanoparticles (AuNPs) was developed for the detection of lead in water. The method was based on the fact that the presence of glutathione (GSH) can prevent the aggregation of AuNPs at a high concentration of NaCl solution, while addition of Pb2+to the solution will cause the aggregation of AuNPs, leading to changes in the color of AuNPs. Under the optimum conditions, the absorbance was found to be linearly proportional to the concentration of lead ion within the range of 10.36-1 036 ng/mL, with a limit of detection (LOD) of 2.072 ng/mL. The recoveries of Pb2+from spiked samples were 99.1%-103.6%, and the precision expressed as relative standard deviation was less than 4%. Moreover, this assay showed good sensitivity, stability and reproducibility and thus could be used for rapid detection of lead ion in water.
glutathione; gold nanoparticles; colorimetric detection; lead ion
DOI∶10.7506/spkx1002-6630-201724032
O661.1
A
1002-6630(2017)24-0202-06
张静, 程琳, 林琳, 等. 基于谷胱甘肽识别系统的胶体金比色法快速检测水中重金属铅离子[J]. 食品科学, 2017, 38(24):202-207.
10.7506/spkx1002-6630-201724032. http://www.spkx.net.cn
ZHANG Jing, CHENG Lin, LIN Lin, et al. Gold nanoparticles-based glutathione recognition for rapid colorimetric detection of lead ion in water[J]. Food Science, 2017, 38(24)∶ 202-207. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724032. http∶//www.spkx.net.cn
2016-11-30
“十二五”国家科技支撑计划项目(2015BAD17B02-3);安徽省水产产业技术体系项目(皖农科【2016】84号);
国家现代农业产业技术体系建设专项(CARS-48)
张静(1991—),女,硕士,主要从事水产品质量与安全监测研究。E-mail:1031832600@qq.com
*通信作者:陈伟(1982—),男,教授,博士,主要从事食品安全快速检测新方法研究。E-mail:chenweishnu@163.com
