牛樟芝液体发酵过程挥发性物质分析
2017-12-11徐萌萌黄志坚许正宏周哲敏丁重阳石贵阳
徐萌萌,黄志坚,王 寒,许正宏,周哲敏*,丁重阳,*,石贵阳
牛樟芝液体发酵过程挥发性物质分析
徐萌萌1,2,黄志坚3,王 寒3,许正宏1,2,周哲敏1,*,丁重阳1,2,*,石贵阳1,2
(1.江南大学生物工程学院,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.共鳞实业(深圳)有限公司,广州 深圳 518116)
目的:分析牛樟芝发酵液中挥发性物质在液体发酵过程中的动态变化并以此为依据进行统计分析。方法:采用顶空-固相微萃取-气相色谱-质谱技术对挥发性物质进行定性定量分析,并利用主成分分析和聚类分析对牛樟芝进行综合评价。结果:牛樟芝液体发酵过程中,不同阶段呈现出不同的香味,此过程共鉴定出50 种化合物,其中醇类10 种,酯类16 种。主成分分析结果表明,主成分1和主成分2的方差贡献率为62.786%,能够代表牛樟芝的主要挥发性物质;聚类分析结果表明,整个发酵过程随挥发性物质变化规律聚集为3类。结论:牛樟芝液体发酵过程产生的香味物质可以作为化妆品、食品等领域的重要天然资源,同时,挥发性物质的综合分析为将来对牛樟芝相关产品的质量评价、价值评估以及新产品开发提供了重要的技术指标。
牛樟芝;挥发性物质;顶空-固相微萃取-气相色谱-质谱
自上世纪90年代以来,牛樟芝因其具有很高的药食用价值,在人工栽培和液体发酵,活性物质及其生物活性方面得到了大量的研究[1]。近年来,牛樟芝所具有的令人愉悦的清香味道引起研究者的关注,何喆等[2]研究了牛樟芝固态平板培养和液态发酵中挥发性物质的组成区别;Lu Zhenming等[3]研究了牛樟芝深层培养过程中的挥发性物质;白岩岩等[4]研究了不同培养基、不同萃取方法对牛樟芝非极性挥发性物质的影响。这些挥发性的香味物质同样具有很多生物活性和用途,在食品以及化妆品领域具有很高的应用价值。但是,目前国内外对牛樟芝香味物质的研究中鲜见对液体发酵产生的挥发性物质在发酵过程中的动态变化进行检测分析和数据统计学的分析。本研究采用顶空-固相微萃取-气相色谱-质谱联用对牛樟芝液体发酵过程中挥发性物质进行定性定量分析,了解整个发酵过程中这些物质的变化规律;并对其进行主成分分析和聚类分析,了解牛樟芝液体发酵过程挥发性物质的动态变化情况,为牛樟芝香味物质的综合开发与应用提供理论支持。
1 材料与方法
1.1 材料与试剂
牛樟芝(Antrodia camphorata JMA01),于2015年由共鳞实业(深圳)有限公司提供,并保藏于江南大学粮食发酵工艺与技术国家工程实验室。
正丁醇(分析纯) 上海安谱实验科技股份有限公司;无水乙醇(分析纯) 山东西亚化学股份有限公司;C8~C40正构烷烃混合标准品 美国o2si公司。
1.2 仪器与设备
三重四极杆气相色谱-质谱联用仪 美国Thermo公司;顶空固相微萃取仪、二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取纤维美国Supelco公司。
1.3 方法
1.3.1 菌种培养
斜面培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L;种子液体培养基:麸皮10 g/L、玉米粉10 g/L、葡萄糖20 g/L;发酵摇瓶培养基:麸皮10 g/L、玉米粉10 g/L、葡萄糖20 g/L。
种子斜面:将4 ℃条件下保存的牛樟芝菌种活化,接种于PDA斜面培养基上,28 ℃培养20 d。
一级种子液体发酵:将4 ℃条件下保存的牛樟芝菌种活化,取1 cm2左右的小方块接种到液体种子培养基中。种子培养基摇瓶(250 mL)每瓶装液量80 mL,接种后于28 ℃、110 r/min条件下培养10 d。
二级摇瓶液体发酵:将生长好的一级种子液混合,均匀接种到500 mL摇瓶,每瓶装液量150 mL,接种量为10 mL,接种后于28 ℃、110 r/min条件下培养15 d。
1.3.2 样品预处理
发酵液10 000 r/min离心10 min获取上清液,精密取3.8 mL上清液,加入0.2 mL稀释好的内标色谱纯正丁醇,以培养基为空白对照,置于20 mL顶空瓶中,混合均匀,密封放置在顶空进样器上。进行顶空-固相微萃取-气相色谱-质谱进样分析,依据标准质谱检索库NIST进行检索比对鉴定,通过计算保留指数(retention index,RI)进一步精确定性,采用内标法计算各组分的相对含量。
1.3.3 顶空固相微萃取
萃取头在气相色谱的进样口老化至无杂峰,然后在55 ℃条件下萃取30 min。被吸附的挥发性化合物在气相色谱进样口250 ℃条件下解吸5 min,冲入气相色谱柱。同时启动仪器采集数据。
1.3.4 气相色谱检测条件
色谱柱:DB-WAX石英毛细柱(30 m×0.25 mm,0.25 µm);载气为氦气,流速1.2 mL/min;程序升温:40 ℃维持1 min,4 ℃/min升温至120 ℃,10 ℃/min升温至240 ℃,维持6 min。
1.3.5 质谱条件
电子电离源;接口温度250 ℃;电子电离源温度250 ℃;四极杆温度150 ℃;电子能量70 eV;质量扫描范围30~450 u。
1.3.6 正构烷烃混合标品气相色谱-质谱测定
将C8~C40正构烷烃混合标准品用色谱纯正己烷稀释,采用顶空-固相微萃取-气相色谱-质谱相同条件测定,得到每一种正构烷烃的保留时间。依据正构烷烃保留时间和总离子流图谱中鉴定出物质的保留时间,计算这些物质的RI。
2 结果与分析
2.1 挥发性物质结果分析
牛樟芝菌种整个液体发酵过程(每24h取样)部分样品气相色谱-质谱总离子流图谱,如图1所示。
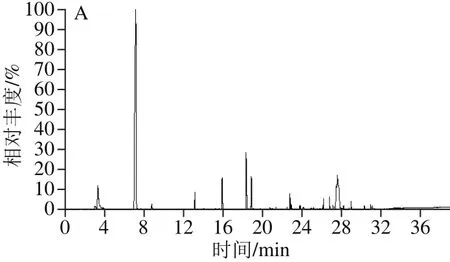
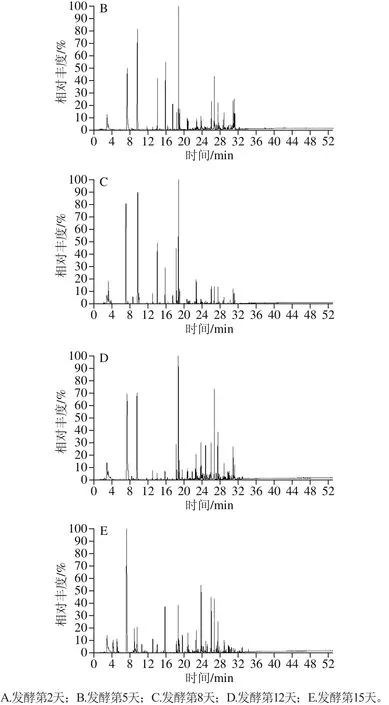
图1 挥发性物质气相色谱-质谱总离子流图Fig. 1 GC-MS total ion current chromatograms of volatile compounds
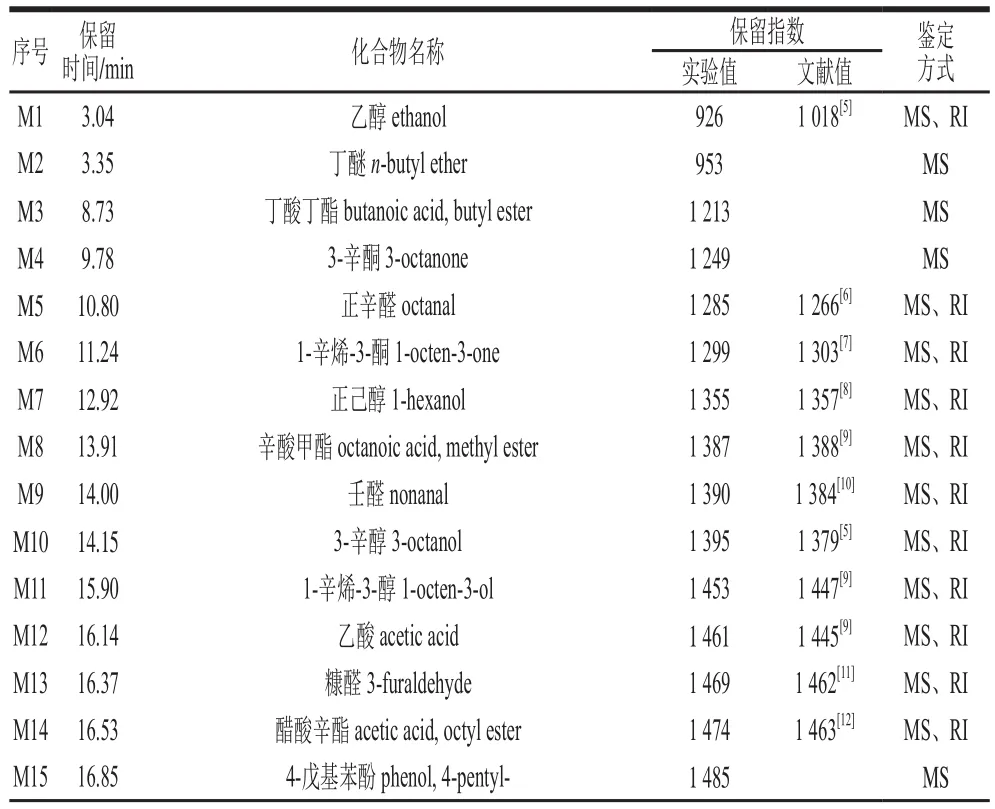
表1 牛樟芝发酵液主要挥发性物质组分Table 1 Major volatile compounds of Antrodia camphorata

续表1
对牛樟芝发酵液顶空-固相微萃取-气相色谱-质谱图谱进行分析,对挥发性物质进行标准质谱检索库NIST比对,分析各峰对应的匹配物,再通过RI比对进一步确认,共鉴定出50 种化合物,记为M1~M50,见表1。整个液体发酵过程主要鉴定出50 种挥发性物质,其中醇类和酯类化合物所占比例较高,醇类化合物10 种,包括乙醇、3-辛醇、1-辛烯-3-醇、正辛醇、反-2-辛烯-1-醇等;酯类化合物16 种,包括丁酸丁酯、苯甲酸乙酯、乙酸香叶酯、苯乙酸甲酯、苯乙酸乙酯等;这也是发酵过程中菌株呈香的主要物质来源。除此之外,萜烯类物质7 种、醛类化合物6 种、苯环类化合物4 种、酮类化合物2 种、烃类1 种、其他类化合物4 种。这些物质在发酵过程中的组成以及含量变化直接引起菌株香味品质的变化。
在所鉴定出的50 种挥发性物质中,多种物质都具有特征性的香气。其中,苯乙醇具有玫瑰、橙子香气[18];1-辛醇具有区别于玫瑰香型的香气[19];3-辛醇、1-辛烯-3-醇等具有蘑菇香味[2]。酯类物质一般具有令人愉悦的水果味香气和酒的香味[20],其中辛酸甲酯具有柑橘香味[19];一些内酯类物质包括丙位辛内酯、丙位癸内酯、丁位十二内酯、二氢-5-(2-辛烯基)-(3H)-呋喃酮具有香甜的水蜜桃香味[2];苯乙酸乙酯等呈现出一种蜜香[19]。在醛类化合物中癸醛、壬醛呈现出特有的油脂气味,略有柑橘甜橙样气味[19]。萜烯类化合物一般具有浓郁的香味,其中芳樟醇呈现出清香的木青气味,橙花叔醇呈现出轻柔的香甜气味,到稍微具有蔷薇气息[19]。α-松油醇呈现出丁香的香气[21]。这些物质产生的香味综合成为牛樟芝发酵液所具有的带有一定水蜜桃香味、浓郁而愉悦的独特气味品质。
与此同时,这些香味物质同样也具有一定的生物活性,如α-杜松醇有较强的杀螨活性[22],反-橙花叔醇可以抑制棒孢霉、白腐菌等微生物的生长[23],芳樟醇对多种植物病原真菌具有较强的抗菌活性[24],这使得牛樟芝发酵液综合应用于化妆品、食品和健康产业成为可能。
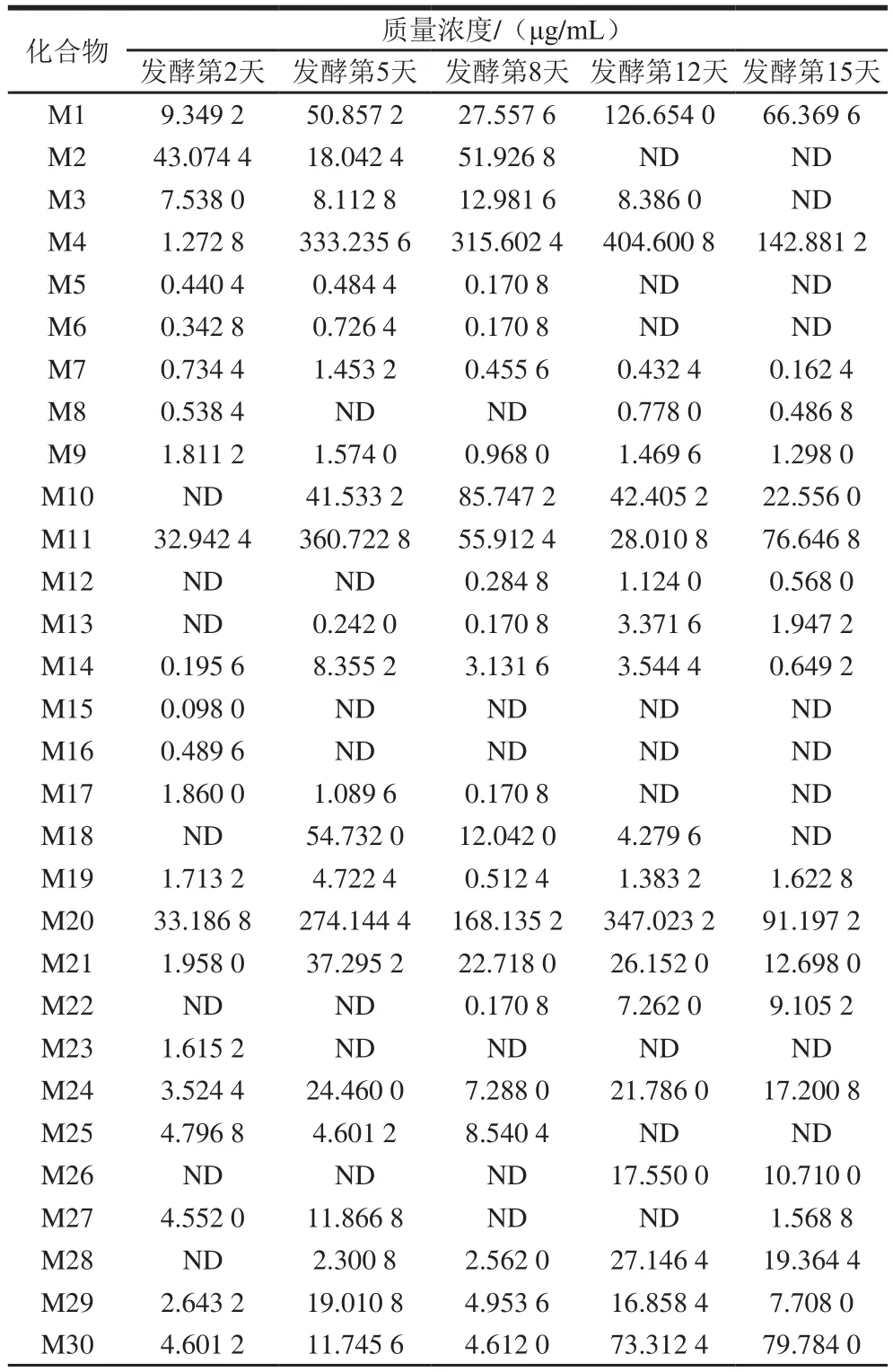
表2 液体发酵过程主要挥发性物质质量浓度变化Table 2 Changes in major volatile compounds during submerged fermentation

续表2
实验表明,空白培养基中挥发性物质种类极少且含量非常低(数据未列出),对发酵液中挥发性物质的检测分析无影响。由图1和表2可以看出,发酵前期,挥发性物质质量浓度低。发酵中期,物质种类十分丰富,部分物质质量浓度达到最大值,如发酵第5天主要检测出丁酸丁酯、3-辛酮、3-辛醇、1-辛烯-3-醇、芳樟醇、正辛醇等多种物质,正辛醇、乙酸香叶酯等物质质量浓度达到最大值;发酵第8天主要检测出丁酸丁酯、3-辛酮、3-辛醇、芳樟醇等物质。发酵后期,物质种类略有减少,部分物质质量浓度也大幅度下降,如正辛醛、1-辛烯-3-酮、反-2-辛烯-1-醇等;而一些酯类物质质量浓度达到最大值,如3-呋喃甲酸甲酯、苯甲酸乙酯等,其中苯乙酸乙酯、苯乙酸甲酯等物质质量浓度在第12天达到最大值;有一些物质已经降解或者被利用,检测不到,如壬酸甲酯。
2.2 牛樟芝发酵周期挥发性物质主成分分析和聚类分析
2.2.1 主成分分析结果
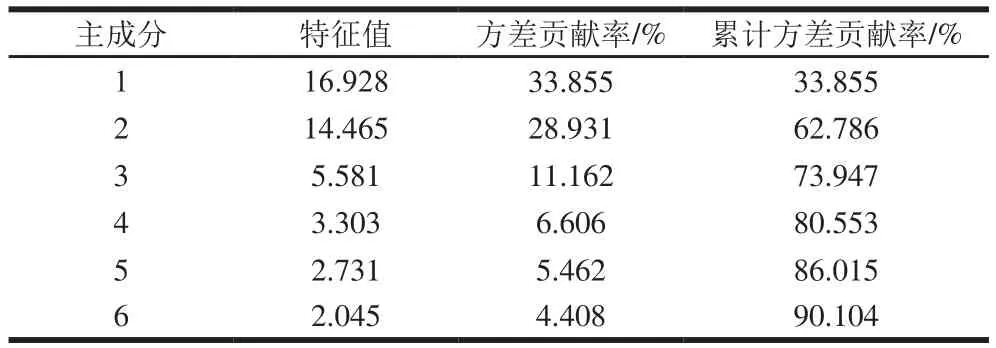
表3 6 个主成分的特征值、方差贡献率和累计方差贡献率Table 3 Eigenvalues, contribution rates and cumulative contribution rates of 6 principal components
对不同发酵时间的牛樟芝样品中挥发性物质的数据进行分析比较,进而进行主成分分析。即通过降维将原始所有变量用几个新的综合因子变量代表[25],这些综合因子变量可以代表大部分原始变量的信息,更直观全面了解原始数据变化规律[26]。
对不同发酵时期牛樟芝发酵液挥发性物质的质量浓度进行主成分分析,如表3所示。第1主成分方差贡献率为33.855%,第2主成分方差贡献率28.931%,主成分1和主成分2的累计方差贡献率为62.786%,已经能够代表绝大多数变量,因此选择这2个主成分代替原始50 个挥发性成分,进行降维分析。

图2 挥发性物质载荷图Fig. 2 Loading plot of volatile compounds
如图2所示,主成分载荷图里显示的成分载荷系数反映了牛樟芝发酵液中各种挥发性物质对各主成分的影响程度,成分载荷系数越大,说明该主成分对此变量的代表性越强,成分载荷系数的正负号表示挥发性物质对主成分影响的正负效应[27-28]。
第1主成分和第2主成分在所有成分中方差贡献率最高,其中起主要作用的是一些醇类、酯类物质,且这些物质在发酵过程中质量浓度呈现大幅度的变化。对第1主成分而言,M1、M4、M12、M20、M21、M22、M24、M26、M28、M29、M30、M31、M32、M33、M35、M37、M40、M42、M44、M47、M48、M50与其正相关;M2、M3、M16、M25、M36与其负相关。对第2主成分而言,M5、M7、M10、M11、M17、M18、M19、M20、M38、M39、M41、M43、M46、M49、M50与其呈正相关;M13、M22、M26、M28、M30、M32、M33、M34、M35、M42与其呈负相关。
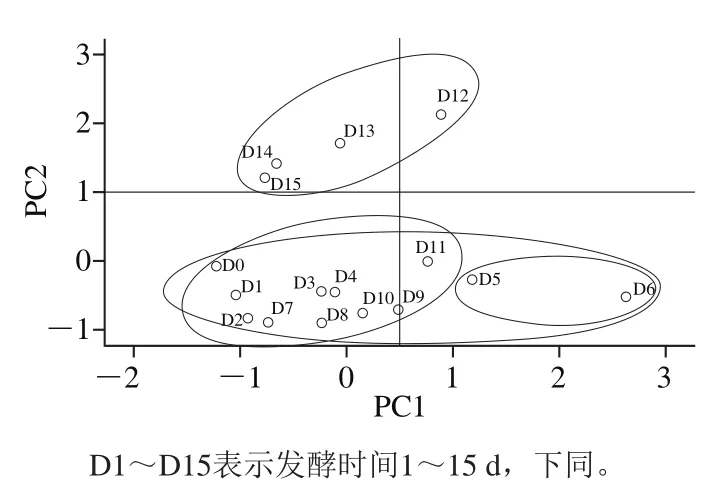
图3 主成分分析散点图Fig. 3 PCA scatter plot
以第1主成分为横坐标,第2主成分为纵坐标做主成分分析散点图,如图3所示。牛樟芝液体发酵过程随着挥发性物质的变化可以很明显的分为两类,即第1类:0~11 d,第2类:12~15 d,其中第1类中的5~6 d样品与其他样品相距较远,存在较大差别,这种变化主要是由主成分1引起。由图2、3总结出,对第1类(0~4 d,7~11 d)起决定作用的物质是十六酸乙酯、4-戊基苯酚、壬酸甲酯、癸酸甲酯、壬醛、2-乙基-2-甲基-正十三醇、丙位辛内酯、1-辛烯-3-酮、癸醛、丁醚、丁酸丁酯、3,8-二甲基癸烷;对第1类(5~6 d)起决定作用的物质是1,2-癸二醇、2,4-二叔丁基苯酚、1-辛烯-3-醇、1-辛烯-3-醇乙酸酯、苯甲醛、正辛醛、3-辛醇、丙位壬内酯、正己醇、4-乙基苄醇、丙位癸内酯、顺-二氢-5-(2-辛烯基)-(3H)-呋喃酮;对第2类(12~15 d)起决定作用的物质是辛酸甲酯、橙花醇、糠醛、苯乙酸乙酯、3-呋喃甲酸甲酯、反,反-2,4-癸二烯醛、苯甲酸乙酯、苯乙酸甲酯、α-松油醇、荜澄茄油烯醇。不同来源的样品聚集在不同象限,也代表不同发酵时间牛樟芝发酵液之间的“相似性”和“差异性”,这种“相似性”和“差异性”主要体现在以上这些物质上。通过牛樟芝挥发性成分的主成分分析基本可以较好地区分不同发酵时间段的发酵样品。
2.2.2 聚类分析结果
聚类分析是一种无监督模式的数据按照相互之间的相似性进行分类的方法。聚类分析的目标就是将元素之间相似性最大化的同时,突出数据之间的差异性[29-30]。将不同发酵时间的样品按照挥发性物质的相似度进行系统聚类分析,结果见图4。
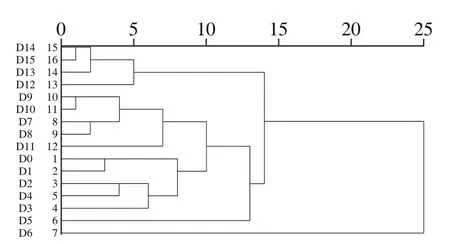
图4 系统聚类树状图Fig. 4 Dendrogram of cluster analysis
由图4可知,0~11 d聚为一大类,其中5~6 d聚为一小类,即发酵前期和发酵中期挥发性成分差别很小,但其中5~6 d差异较明显,使其单独聚类;12~15 d聚为一大类,即发酵后期与发酵前期和发酵中期能明显区分开。数据表明:整个液体发酵过程随挥发性物质变化聚集为3类,即第1类(0~4 d,7~11 d)、第2类(5~6 d)和第3类(12~15 d)。该结果也与主成分分析结果相似。说明在牛樟芝整个液体发酵过程中,挥发性物质是随着发酵时间呈现规律性变化,这样依据挥发性物质变化规律将牛樟芝发酵过程聚集为3 个时间段。鉴于牛樟芝是致香菌,这也是发酵过程中香气变化的直接物质基础,由此分析可以更加深入的了解牛樟芝菌种的香气变化,为牛樟芝在实践中的应用提供依据。利用主成分分析和聚类分析方法对不同发酵时间的牛樟芝发酵液进行分析,结果表明该方法可以很好地区分不同生长阶段的牛樟芝发酵样品。
3 结 论
本研究采用顶空-固相微萃取-气相色谱-质谱等技术对牛樟芝液体发酵过程中挥发性物质进行定性定量分析。结果表明,共鉴定出50 种化合物,其中醇类10 种,酯类16 种;进一步从统计学角度综合分析,发现这些挥发性物质对总挥发成分具有不同程度的贡献率,并根据发酵过程随挥发性物质的变化规律,对发酵过程进行了归类。这为将来开发以发酵液香味物质为基础的化妆品、食品及健康产业应用提供了依据。
[1] 陈菲, 刘训红, 杨念云, 等. 樟芝的研究概述[J]. 中药材, 2011, 34(11):1804-1808. DOI:10.13863/j.issn1001-4454.2011.11.012.
[2] 何喆, 陆震鸣, 许泓瑜, 等. 顶空固相微萃取-气质联用法测定樟芝菌丝体中挥发性化合物[J]. 中药材, 2011, 34(11): 1722-1725.DOI:10.13863/j.issn1001-4454.2011.11.031.
[3] LU Z M, TAO W Y, XU H Y, et al. Analysis of volatile compounds of Antrodia camphorata in submerged culture using headspace solidphase microextraction[J]. Food Chemistry, 2011, 127(2): 662-668.DOI:10.1016/j.foodchem.2010.12.111.
[4] 白岩岩, 贾薇, 张劲松. 樟芝发酵液挥发性物质提取方法及成分比较[J]. 食品科学, 2013, 34(24): 163-167. DOI:10.7506/spkx1002-6630-201324034.
[5] 夏亚男, 迟超逸, 郭洁, 等. GC-O-MS法对比3 种红枣白兰地的挥发性成分[J]. 中国酿造, 2014, 33(2): 119-124. DOI:10.3969/j.iss n.0254-5071.2014.02.030.
[6] 刘廷竹, 黄明泉, 邹青青, 等. GC-O与GC-MS结合分析竹荪牛肉香精中的挥发性成分[J]. 食品科学, 2016, 37(2): 92-98. DOI:10.7506/spkx1002-6630-201602016.
[7] 吕玉, 宋焕禄. 反应型牛肉香精中香味化合物的鉴定[J]. 食品工业科技, 2011(12): 106-109. DOI:10.13386/j.issn1002-0306.2011.12.069.
[8] 张劲, 秦晓媛, 杨莹, 等. 桂葡3号葡萄浆果特征香气成分分析[J]. 南方农业学报, 2015(5): 871-875. DOI:10.3969/j:issn.2095-1191.2015.5.87.
[9] 谢太理, 管敬喜, 杨莹, 等. 毛葡萄新品系G203的种质特点及酿酒品质的研究[J]. 中外葡萄与葡萄酒, 2015(1): 32-35. DOI:10.13414/j.cnki.zwpp.2015.01.006.
[10] 高婷婷, 孙洁雯, 杨克玉, 等. SDE-GC-MS分析鲜山楂果肉中的挥发性成分[J]. 食品科学技术学报, 2015, 33(3): 22-27. DOI:10.3969/j.issn.2095-6002.2015.03.005.
[11] 宋普. 白兰地陈酿过程中挥发性成分变化规律研究[D]. 烟台: 烟台大学, 2013.
[12] 曹长江. 孔府家白酒风味物质研究[D]. 无锡: 江南大学, 2014.
[13] 高婷婷, 杨绍祥, 刘玉平, 等. 陈皮挥发性成分的提取与分析[J].食品科学, 2014, 35(16): 114-119. DOI:10.7506/spkx1002-6630-201416022.
[14] 段艳, 郑福平, 杨梦云, 等. ASE-SAFE/GC-MS/GC-O法分析德州扒鸡风味化合物[J]. 中国食品学报, 2014, 14(4): 222-230.DOI:10.16429/j.1009-7848.2014.04.005.
[15] 李琴. 双孢蘑菇汤特征风味物质的鉴定及熬制过程风味物质释放规律研究[D]. 无锡: 江南大学, 2011.
[16] 魏长庆. 新疆胡麻油特征香气成分鉴别及其产生机制研究[D]. 无锡: 江南大学, 2015.
[17] 陈双. 中国黄酒挥发性组分及香气特征研究[D]. 无锡: 江南大学,2013.
[18] 陈双, 罗涛, 徐岩, 等. 我国黄酒酵母和酿酒原料对黄酒中拾β-苯乙醇含量的影响[J]. 中国酿造, 2009, 15(4): 23-26. DOI:10.3969/j.issn.0254-5071.2009.04.006.
[19] 于立志, 马永昆, 张龙, 等. GC-O-MS法检测句容产区巨峰葡萄香气成分分析[J]. 食品科学, 2015, 36(8): 196-200. DOI:10.7506/spkx1002-6630-201508036.
[20] 卢静茹, 林向阳, 张如, 等. HS-SPME-GC-MS联用分析美国巴旦木香气成分[J]. 食品科学, 2015, 36(2): 120-125. DOI:10.7506/spkx1002-6630-201502023.
[21] LIU H, JIA W, ZHANG J, et al. GC-MS and GC-olfactometry analysis of aroma compounds extracted from culture fluids of Antrodia camphorata[J]. World Journal of Microbiology and Biotechnology,2008, 24(8): 1599-1602. DOI:10.1007/s11274-007-9614-1.
[22] CHANG S T, CHEN P F, WANG S Y, et al. Antimite activity of essential oils and their constituents from Taiwania cryptomerioides[J].Journal of Medical Entomology, 2001, 38(3): 455-457.DOI:10.1603/0022-2585-38.3.455.
[23] 梁瑾, 王强. 大豆橙花叔醇合酶基因克隆及功能鉴定[J]. 中国油料作物学报, 2015, 37(6): 744-751.
[24] 苗建强, 王猛, 李秀环, 等. 五种挥发性化合物对土传病原真菌及线虫的生物活性[J]. 植物保护学报, 2012, 39(6): 561-566.
[25] PENG X, LI X, SHI X, et al. Evaluation of the aroma quality of Chinese traditional soy paste during storage based on principal component analysis[J]. Food Chemistry, 2014, 151(20): 532-538.DOI:10.1016/j.foodchem.2013.11.095.
[26] MOSDORF R, GÓRSKI G. Identification of two-phase flow patterns in minichannel based on RQA and PCA analysis[J]. International Journal of Heat & Mass Transfer, 2016, 96: 64-74. DOI:10.1016/j.ijhe atmasstransfer.2016.01.015.
[27] 龚媛, 王旭, 廖若宇, 等. 基于主成分分析的臭氧与紫外复合处理枸杞挥发性成分综合评价[J]. 食品工业科技, 2015, 36(18): 141-146.DOI:10.13386/j.issn1002-0306.2015.18.020.
[28] MILDNER-SZKUDLARZ S, JELEŃ H H. The potential of different techniques for volatile compounds analysis coupled with PCA for the detection of the adulteration of olive oil with hazelnut oil[J]. Food Chemistry, 2008, 110(3): 751-761. DOI:10.1016/j.foodchem.2008.02.053.
[29] WU Y, LÜ S, CHEN W, et al. Comparative analysis of volatiles difference of Yunnan sun-dried Pu-erh green tea from different tea mountains: Jingmai and Wuliang mountain by chemical fingerprint similarity combined with principal component analysis and cluster analysis[J]. Chemistry Central Journal, 2016, 10(1): 1-11.DOI:10.1186/s13065-016-0159-y.
[30] 董承光, 王娟, 周小凤, 等. 新疆陆地棉品种资源的主成分分析和聚类分析[J]. 西南农业学报, 2016, 29(8): 1798-1805. DOI:10.16213/j.cnki.scjas.2016.08.008.
Analysis of Volatile Compounds of Antrodia camphorata during Submerged Fermentation
XU Mengmeng1,2, HUANG Zhijian3, WANG Han3, XU Zhenghong1,2, ZHOU Zhemin1,*, DING Zhongyang1,2,*, SHI Guiyang1,2
(1. School of Biotechnology, Jiangnan University, Wuxi 214122, China;2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China;3. KYORI IND (SHENZHEN) Co. Ltd., Shenzhen 518116)
Objective: To analyze the change of volatile compounds in the fermentation broth during the submerged fermentation of Antrodia camphorata and further to conduct statistical analysis. Methods: Headspace solid phase microextraction combined with gas chromatography-mass spectrometry (HS-SPME-GC-MS) was applied to qualitatively and quantitatively analyze the volatile compounds. Principal component analysis (PCA) and cluster analysis (CA) were adopted to completely evaluate the volatile components of A. camphorata. Results: At different stages of the fermentation process, A. camphorata showed different aroma profiles and a total of 50 compounds were identified, including 10 alcohols and 16 esters. PCA results showed that the cumulative variance contribution rate of the first two principal components was 62.786%, which could represent the main volatile compounds of A. camphorate. CA results showed that the changes of volatile compounds in the whole fermentation process could be classified into three categories. Conclusion: The volatile compounds produced during the submerged fermentation process of A. camphorata could be used as an important natural resource in the fields of cosmetics and foodstuffs. Furthermore, the comprehensive analysis of volatile compounds could provide an important technical tool for evaluating the quality and value of A. camphorata-related products and developing new products in the future.
Antrodia camphorata; volatile compounds; headspace solid-phase microextraction-gas chromatography-mass spectrometry
10.7506/spkx1002-6630-201724025
TS201
A
1002-6630(2017)24-0159-06
徐萌萌, 黄志坚, 王寒, 等. 牛樟芝液体发酵过程挥发性物质分析[J]. 食品科学, 2017, 38(24): 159-164. DOI:10.7506/spkx1002-6630-201724025. http://www.spkx.net.cn
XU Mengmeng, HUANG Zhijian, WANG Han, et al. Analysis of volatile compounds of Antrodia camphorata during submerged fermentation[J]. Food Science, 2017, 38(24)∶ 159-164. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724025. http∶//www.spkx.net.cn
2017-01-13
徐萌萌(1990—),女,硕士研究生,研究方向为食药用真菌。E-mail:xmm900801@163.com
*通信作者:周哲敏(1969—),男,教授,博士,研究方向为酶学与酶工程。E-mail:zhemzhou@jiangnan.edu.cn
丁重阳(1975—),男,教授,博士,研究方向为发酵过程优化及食药用真菌生物技术。E-mail:zyding@jiangnan.edu.cn
