毛霉型豆豉后发酵阶段蛋白质水解产物的生成及影响因素
2017-12-11杨伊磊李梦丹陈力力蒋立文
杨伊磊,李梦丹,刘 金,陈力力,2,*,蒋立文,2,*
毛霉型豆豉后发酵阶段蛋白质水解产物的生成及影响因素
杨伊磊1,李梦丹1,刘 金1,陈力力1,2,*,蒋立文1,2,*
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、反相高效液相色谱等方法对毛霉型豆豉后发酵过程中蛋白质及其水解产物的变化情况进行研究,对各阶段蛋白质水解产物与不同因素指标的相关性进行分析,并采用API ZYM系统对毛霉所产胞外酶进行半定量检测。结果表明:蛋白质最终水解产物的分子质量主要集中在11~20 kD之间,后发酵0~7 d蛋白质分子质量下降迅速,且此阶段多肽成分发生较大改变,7~42 d主要引起的是多肽含量的变化;总酸含量与蛋白质水解物生成的相关性最高,相关系数为0.972,其次为褐变强度,再次为还原糖含量;API ZYM系统检测出毛霉可产生6 种胞外酶。
毛霉型豆豉;蛋白质;水解产物;API ZYM系统
毛霉型豆豉是利用毛霉进行纯种发酵的我国传统发酵豆制品,发酵分为制曲和后发酵两个阶段。在制曲阶段,毛霉大量生长繁殖,产生孢子,并分泌蛋白酶、脂肪酶、纤维素酶等酶系;后发酵阶段主要是依靠制曲过程中毛霉分泌产生的大量酶系在厌氧的条件下,通过食盐、白酒等作用进行复杂的生物化学反应,从而形成毛霉型豆豉特殊的风味[1-5]。目前国内外对毛霉型豆豉后发酵过程的工艺条件优化、理化指标的变化、微生态群落的动态变化已经有了部分的研究[6-10],但对后发酵过程中蛋白质水解产物的研究尚少,且不够深入。
蛋白质是生命的物质基础,人及动物从食品中获取蛋白质及其分解产物来构成自身的蛋白质,毛霉型豆豉作为一种大豆发酵制品,是优质蛋白的良好来源[11]。发酵豆制品在加工的过程中,蛋白质降解为大豆多肽及游离氨基酸,更加有利于人体的吸收利用。因此,深入研究毛霉型豆豉蛋白质及其水解产物的变化是有必要的。
本实验通过测定毛霉型豆豉后发酵不同阶段蛋白质及其水解产物的变化,并对该动态过程中不同的因素指标与蛋白质水解产物的相关性进行研究,分析影响蛋白质水解产物发生变化的因素,为评价豆豉品质、控制蛋白水解产物的生成以及豆豉蛋白源功能性食品的开发等提供理论支持。
1 材料与方法
1.1 材料与试剂
大豆购自湖南农业大学东之源超市;毛霉CGMCC8700由湖南农业大学食品科学和生物技术湖南省重点实验室提供。
黄豆粉琼脂培养基:8%黄豆粉、2%琼脂。
蛋白质Marker 天根生化科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘油、Tris、过硫酸铵、N,N,N’,N’-四甲基二乙胺(N,N,N’,N’-tetramethylethylenediamine,TEMED) 北京鼎国昌盛生物技术有限公司;乙腈、溴酚蓝、β-巯基乙醇、丙烯酰胺储存液、甘氨酸、考马斯亮蓝R-250、茚三酮、3,5-二硝基水杨酸 国药集团化学试剂公司;API ZYM试剂盒 法国梅里埃公司。
1.2 仪器与设备
LC-20AT高效液相色谱仪 日本岛津公司;DYCZ-28A型垂直电泳仪、DYY-8C型电泳仪电源 北京市六一仪器厂;HSJ通风柜 深圳市嘉鸿顺实业有限公司;HC-1016高速离心机 安徽中科中佳科学仪器有限公司;SB-5200DT超声波清洗机 宁波新芝生物科技股份有限公司;DZKW-D-2电热恒温水浴锅 北京市永光明医疗仪器有限公司;TP-100D电子天平 湘仪天平仪器设备有限公司。
1.3 方法
1.3.1 毛霉型豆豉的制作工艺流程
根据参考文献[11-12]制作毛霉型豆豉,其工艺流程如下所示:
黄豆→25 ℃浸泡12~16 h→121 ℃高压灭菌锅蒸煮20 min→摊凉接种毛霉1%→15 ℃前发酵64 h→加入9%的食盐、5%的白酒→入罐45 ℃后发酵→成品
每隔7 d取后发酵阶段的豆豉作为样品,直至42 d结束,样品冷冻真空干燥后备用。
1.3.2 蛋白质及水解产物含量测定
参照GB/T 5009.5—2010《食品中蛋白质的测定》中分光光度法测定蛋白质含量[11];采用甲醛滴定法[11]测定氨基酸态氮含量;采用茚三酮比色法[13]测定游离氨基酸总量。
1.3.3 蛋白质水解产物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDSPAGE)分析
参照文献[14-16]中的TCA-丙酮沉淀法提取豆豉样品中的蛋白质,并干燥。取上述干燥样品40 mg,加入400 μL ddH2O,600 μL 5×样品缓冲液超声波振荡20 min,静置1 h后沸水浴5 min,于10 000 r/min离心10 min,上清液即样液。采用SDS-PAGE垂直板电泳不连续系统,条件为:5%浓缩胶,12%分离胶,上样体积20 μL,先恒压130 V电泳至样品进入分离胶,然后恒压160 V。电泳结束后,经考马斯亮蓝R-250染色20 min后脱色,拍照记录结果。
1.3.4 蛋白质水解物的反相高效液相色谱分析[17]
准确称量0.500 g纯种发酵豆豉粉末,加入10 mL ddH2O,超声波提取1.5 h,然后在10 000 r/min条件下离心10 min,取上清液过0.45 μm水系滤头,于10 mL洁净试管中备用,此时样品溶液质量浓度为50 μg/μL。采用反相高效液相色谱分析,条件为:色谱柱Agilent C18柱(4.6 mm×250 mm);流动相:V(乙腈)∶V(水)=45∶55;检测波长:220 nm;流速:0.5 mL/min;柱温:30 ℃;进样量:10 μL。
1.3.5 豆豉后发酵过程指标测定
参照GB/T 5009.3—2010《食品中水分的测定》测定后发酵过程中水分含量[7];采用酸度计法[7]测定总酸含量;采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid spectrophotometry,DNS)比色法[7]测定还原糖含量;采用分光光度法[7]测定褐变强度。
1.3.6 API ZYM半定量测定酶活性
刮取黄豆粉琼脂培养基上生长茂盛、产生大量孢子的毛霉菌丝5 g,加入10 mL无菌生理盐水,常温条件下超声波处理1 h,过滤取滤液作为样液,在API ZYM试纸条的每孔中加入65 μL样液,放置10 min,然后每孔分别加1 滴ZYM A试剂(Tris缓冲液)和ZYM B试剂(坚牢兰B),然后暴露在强光下5 min,根据显色结果与标准半定量色板比较,记录结果。
1.4 数据处理
采用Excel 2010和SPSS 17.0软件对数据进行统计分析,并用Duncan’s法对各测定数据进行多重比较。
2 结果与分析
2.1 后发酵过程中蛋白质及水解产物的变化

表1 豆豉后发酵过程中蛋白质及其水解产物的变化Table 1 Changes in protein, amino acid nitrogen and free amino acid contents during the post-fermentation of douchi
对毛霉型豆豉后发酵过程中的蛋白质及其水解产物进行测定,结果如表1所示。氨基酸态氮含量可以反映出蛋白质的水解程度[18],豆豉在发酵过程中,蛋白质在蛋白酶、肽酶的协同作用下水解为水溶性低分子的含氮化合物,最终水解为游离氨基酸。因此氨基酸态氮和游离氨基酸的含量可以反映出蛋白质水解产物的变化情况。由表1可知,在后发酵过程中,毛霉型豆豉总蛋白的整体变化趋势是很小的,各阶段均无显著性,说明豆豉在后发酵过程中总氮含量维持着一种动态的平衡,非蛋白氮与蛋白氮之间进行了相互转化。氨基酸态氮和游离氨基酸的质量分数随着发酵时间的延长而增加,且0 d与7 d差异性显著,分别升高了156%和49%。这说明随着发酵过程的进行,大量的蛋白质被水解,在后发酵0~7 d阶段,由于前期制曲积累的蛋白酶、水解酶等的协同作用,水解了肽链之间的肽键,蛋白质被迅速分解为小分子蛋白和多肽,进而使游离的氨基酸释放出来[19]。而随着发酵的进一步进行,酶活力减弱,再加上部分游离氨基酸参与了美拉德反应,使得氨基酸态氮和游离氨基酸的含量增加幅度减弱,趋于平缓。
2.2 后发酵过程中蛋白质水解物分子质量的变化
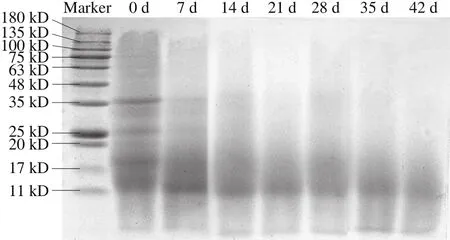
图1 豆豉后发酵不同阶段蛋白质分子质量的变化Fig. 1 Changes detected by SDS-PAGE in protein molecular weight during the post-fermentation of douchi
蛋白质水解作用贯穿了毛霉型豆豉发酵的全过程,选取后发酵不同阶段的样品进行电泳分析,由图1可知,随着后发酵过程的进行,分子质量在20 kD以上的蛋白质几乎已经完全水解,且发酵过程中蛋白质水解的最终产物的分子质量主要集中在11~20 kD之间。在后发酵0d时,分子质量35 kD附近出现的明显条带在发酵7 d后明显变淡,说明在后发酵开始阶段,由于前发酵阶段积累的蛋白酶的作用,大分子蛋白质被迅速降解,生成小分子蛋白、多肽和氨基酸,发酵7 d之后蛋白质降解速率明显变慢,这是因为随着发酵过程的进一步进行,毛霉生长过程中分泌的淀粉酶、脂肪酶使得大豆中的碳水化合物和脂肪分解成有机酸和脂肪酸,总酸含量快速增加,蛋白酶活力变弱,再加上白酒和食盐的添加,且隔绝了氧气,使得毛霉的生长受到抑制,蛋白酶活力大大降低。从图1可以看出,分子质量在11~20 kD区域条带并不清晰,但有明显的阴影区,这是因为在此区域的小分子蛋白质含量较多,而各种小分子蛋白质的分子质量又相近,这使得条带间并不易清晰辨别,从而形成了阴影区。
2.3 后发酵过程中蛋白质水解物多肽的变化

图2 豆豉后发酵不同阶段蛋白质水解物的变化Fig. 2 Changes analyzed by RP-LC in protein hydrolysates during the post-fermentation of douchi
为分析豆豉后发酵过程中多肽的变化情况,采用反相高效液相色谱法对后发酵不同阶段样品的蛋白水解物进行测定分析[20-21],从图2可以看出,后发酵0~7 d,出峰情况出现明显改变,保留时间提前,多肽成分有着明显变化,后发酵开始阶段(0 d)时,样品在保留时间至15 min开始出峰,其中有5 个峰的峰高较高,峰面积较大,说明此5 种多肽类化合物含量较多,在保留时间为41.66~43.715 min之间出的4个峰未完全分离开,可能是此4 种多肽组分的极性相似度较大造成的。后发酵至7 d时,出峰时间主要在3.715~5.378 min,且在保留时间为15.768 min时也出了一个峰,0~7 d阶段多肽的变化情况是由于前发酵阶段积累的蛋白酶等酶系的作用,大分子蛋白质迅速降解,多肽类种类发生了明显的变化。而在后发酵7~42 d阶段,多肽的种类几乎没有改变,而肽类化合物的含量出现变化,大部分多肽成分含量都有所增加,如在保留时间4.780 min出现的峰随着后发酵过程的进行,峰高明显增高,且峰面积增大,这说明7~42 d阶段大多是物质代谢引起的多肽含量的变化。
2.4 豆豉后发酵过程中的理化成分分析

表2 毛霉型豆豉后发酵不同阶段基本成分的变化Table 2 Changes in chemical components and browning intensity during the post-fermentation of Mucor- type douchi
由表2可知,在后发酵过程中,水分质量分数基本保持在55%左右,说明在后发酵过程中水分的变化是很小的;还原糖含量随着后发酵过程的进行逐渐增加,这是因为前发酵过程毛霉所分泌的糖化酶累积,分解成了大量的还原糖,而随着发酵时间的进一步延长,微生物分泌的糖化酶活力降低,且部分还原糖又参与美拉德反应,使得还原糖含量又有略微降低的趋势;总酸含量先迅速增加,随后趋于稳定,这是由于在后发酵的初始阶段,毛霉在前发酵生长过程中积累的淀粉酶、脂肪酶使得大豆中的碳水化合物和脂肪分解成有机酸和脂肪酸,从而使总酸含量快速增加,而随着发酵时间的延长,食盐和白酒的添加使得微生物生长受到抑制,酶活力大大降低,同时部分酸与醇类合成酯类使得酸度增长较慢甚至不再增加,这使得总酸的含量不再增加,而趋于稳定。豆豉的褐变主要集中在成熟阶段,随着后发酵时间的延长,褐变的程度越大,颜色越深,目前褐变的原因被认为有两种,一种是由于美拉德反应而引起,另一种认为是酶系褐变导致[22]。
2.5 不同因素与蛋白质水解产物生成的相关性
以毛霉型豆豉后发酵不同阶段蛋白质的水解产物(游离氨基酸总量指标)为纵坐标(y),再分别以水分、总酸、还原糖质量分数和褐变强度指标为横坐标(x)作散点图,如图3所示,再利用SPSS 17.0数据统计软件进行两个变量之间的相关性分析,并进行线性回归。利用Pearson相关系数对各指标与蛋白质水解产物的相关性进行评价,并利用双尾检验法评价显著水平,得到蛋白质水解物与各因素指标的相关性方程,结果如表3所示。
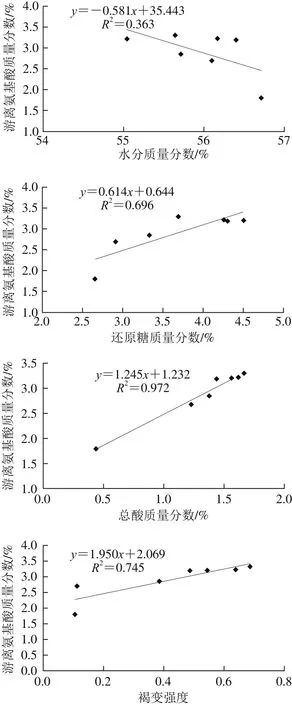
图3 各因素指标与蛋白质水解物的关系Fig. 3 Relationships between various chemical components as well as browning intensity and free amino acid content
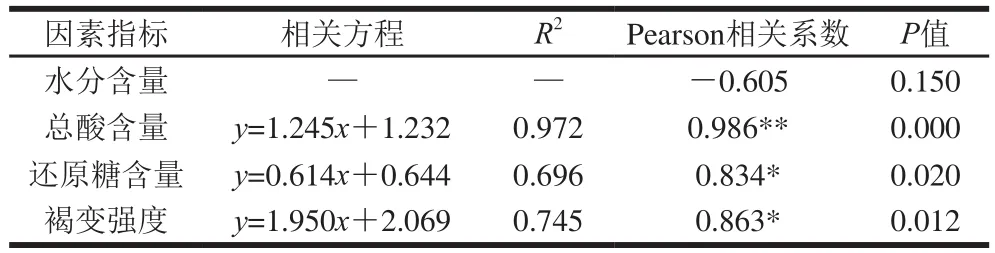
表3 各因素指标与蛋白质水解物的相关性Table 3 Correlations between various chemical components as well as browning intensity and free amino acid content
由图3和表3可知,在毛霉型豆豉后发酵过程中,水分含量与蛋白质水解物变化不具有相关性,总酸含量与蛋白质水解物具有极显著相关性,相关系数为0.972;还原糖含量、褐变强度与蛋白质水解物具有显著相关性,相关系数分别为0.834和0.863。说明总酸含量、还原糖含量、褐变强度指标都影响了蛋白质水解产物的生成,在一定范围内呈现正相关性,且总酸含量>褐变强度>还原糖含量。
2.6 API ZYM半定量测定毛霉所产胞外酶
由上述结果可知,毛霉型豆豉在后发酵过程的初始阶段(0~7 d)蛋白质水解产物快速生成,变化显著,分析其与毛霉菌种所产酶系密切相关,故采用API ZYM系统对毛霉菌种所产胞外酶进行半定量检测,结果如图4所示。

图4 API-ZYM系统测定结果Fig. 4 Detection of extracellular enzymes from Mucor by API-ZYM system
API ZYM系统可快速地对4 种酯酶、5 种蛋白(多肽)酶、2 种水解酶8 种糖发酵酶等19 种酶活性作出半定量分析[23-25],由图3可知,毛霉可分泌6 种胞外酶,包括2 种酯酶(碱性磷酸盐、酯酶C4),1 种蛋白酶(白氨酸芳胺酶),2 种水解酶(酸性磷酸盐、萘酚-AS-BI-磷酸水解酶),1 种糖发酵酶(N-乙酰葡萄糖胺酶)。其中白氨酸芳胺酶可水解某些氨基酸与芳香胺所形成的酰胺类化合物,能反映亮氨酸氨基肽酶的活力,而亮氨酸氨肽酶能从多肽链上游离的氨基末端(N端)由外向里逐个地把氨基酸切下,解除小肽的苦味[26-28],故毛霉所产的白氨酸芳胺酶为水解多肽,释放出游离氨基酸的主要蛋白酶;N-乙酰葡萄糖胺酶亦称几丁二糖酶,作用部位是底物寡糖链的非还原性末端,能降解几丁二塘,生成几丁质单糖——N-乙酰葡萄糖胺[29],由于N-乙酰葡萄糖胺酶的作用,会使得后发酵过程中还原糖含量增加,从而与游离氨基酸参与美拉德反应。碱性磷酸酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等;酸性磷酸酶是一种在酸性条件下催化磷酸单酯水解成为无机磷酸的水解酶[30]。酯酶是一种水解酶,优先水解短链脂肪酸,可在水分子的参与下,经由水解作用,将酯类切割成酸类与醇类。磷酸酶和酯酶均对蛋白质的水解起着间接作用。
3 结 论
毛霉型豆豉后发酵过程中,蛋白质快速水解的阶段要集中在后发酵初始阶段(0~7 d),蛋白质水解最终产物的分子质量主要集中在11~20 kD之间,0~7 d阶段蛋白质大分子迅速降解成小分子,且多肽成分发生较大改变,而7~42 d阶段主要引起多肽含量的变化;蛋白质水解物与不同因素指标的相关性研究表明,总酸、褐变程度、还原糖会影响蛋白质水解物的生成;通过API ZYM半定量检测系统检测出毛霉菌种在黄豆粉培养基中培养积累下来的胞外酶有6 种。
[1] 范琳. 毛霉型豆豉后发酵过程中微生态的变化及抗氧化性研究[D].长沙∶ 湖南农业大学, 2013.
[2] LI F J, YIN L J, LU X, et al. Changes in angiotensin Ⅰ-converting enzyme inhibitory activities during the ripening of douchi (a Chinese traditional soybean product) fermented by various starter cultures[J].International Journal of Food Properties, 2010, 13(3)∶ 512-524.DOI:10.1080/10942910802688176.
[3] LU H, ZHANG B B, WU Z H. Studies on Mucor racemosus fermentation to manufacture gamma-linolenic acid functional food douchi[J]. Food Science and Technology Research, 2010, 16(6)∶ 534-548. DOI:10.3136/fstr.16.543.
[4] FAN J, HU X, TAN S, et al. Isolation and characterisation of a novel angiotensin Ⅰ-converting enzyme-inhibitory peptide derived from douchi,a traditional Chinese fermented soybean food[J]. Journal of the Science of Food and Agriculture, 2009, 89(4)∶ 603-608. DOI:10.1002/jsfa.3482.
[5] CHEN K I, ERH M H, SU N W, et al. Soyfoods and soybean products∶from traditional use to modern applications[J]. Applied Microbiology and Biotechnology, 2012, 96(1)∶ 9-22. DOI:10.1007/s00253-012-4330-7.
[6] 索化夷, 赵欣, 骞宇, 等. 永川毛霉型豆豉在发酵过程中微生物总量与区系变化规律[J]. 食品科学, 2015, 36(19)∶ 124-131. DOI:10.7506/spkx1002-6630-201519022.
[7] 陈丹丹. 毛霉发酵豆制品在不同后发酵工艺条件下品质分析[D]. 南昌∶ 江西农业大学, 2012.
[8] 吴兰芳, 蒋爱民, 曲直, 等. 霉菌型黑豆豆豉的主要成分及其抗氧化活性研究[J]. 现代食品科技, 2013, 29(1)∶ 51-54. DOI:10.13982/j.mfst.1673-9078.2013.01.038.
[9] 胡会萍, 李秀娟, 黄贤刚. 传统豆豉微生物学研究综述[J]. 中国调味品, 2012(6)∶ 4-7; 13. DOI:10.3969/j.issn.1000-9973.2012.06.002.
[10] WANG L, YIN L, LI D, et al. Influences of processing and NaCl supplementation on isoflavone contents and composition during douchi manufacturing[J]. Food Chemistry, 2007, 101(3)∶ 1247-1253.DOI:10.1016/j.foodchem.2006.03.029.
[11] 房翠兰. 豆豉加工过程中蛋白质和膳食纤维生物学变化的研究[D].重庆∶ 西南大学, 2007.
[12] 杨勇, 詹永, 李征, 等. 快速发酵豆豉关键技术及问题讨论[J]. 现代食品科技, 2008(8)∶ 87-89. DOI:10.3969/j.issn.1673-9078.2008.08.022.
[13] 张雨浩. 黑色素快速产生阶段豆豉蛋白水解物参与黑色素形成机制研究[D]. 重庆∶ 西南大学, 2014.
[14] 索化夷, 骞宇, 阚建全. 传统发酵永川毛霉型豆豉蛋白质提取方法比较与降解规律研究[J]. 食品科学, 2013, 34(23)∶ 180-183.DOI:10.7506/spkx1002-6630-201323038.
[15] 管方方, 卢伟京, 许旭, 等. 大豆特征蛋白的SDS-PAGE研究[J]. 精细化工, 2015, 32(4)∶ 16. DOI:10.13550/j.jxhg.2015.04.016.
[16] SARAVANAN R S, ROSE J K C. A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J]. Proteomics, 2004, 4(9)∶ 2522-2532. DOI:10.1002/pmic.200300789.
[17] ZHANG Y H, MA L, WANG X. Correlation between protein hydrolysates and color during fermentation of Mucor-type douchi[J].International Journal of Food Properties, 2015, 18(12)∶ 2800-2812.DOI∶10.1080/10942912.2015.1013632.
[18] SHAPIRO A L, VIÑUELA E, MAIZEL J V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels[J]. Biochemical and Biophysical Research Communications, 1967, 28(5)∶ 815-820. DOI:10.1016/0006-291X(67)90391-9.
[19] 索化夷, 卢露, 吴佳敏, 等. 永川豆豉在传统发酵过程中基本成分及蛋白酶活性变化[J]. 食品科学, 2011, 32(1)∶ 177-180.
[20] 韩佳冬. 永川豆豉蛋白水解产物与黑色素形成机理的研究[D]. 重庆∶ 西南大学, 2013.
[21] 张雨浩, 马良, 周梦柔, 等. 永川豆豉发酵过程中蛋白水解作用与黑色素形成关系[J]. 食品科学, 2013, 34(19)∶ 195-199. DOI∶10.7506/spkx1002-6630-201319041.
[22] 孙森. 天然发酵豆豉后发酵过程的动态分析[D]. 济南∶ 山东轻工业学院, 2008.
[23] 董青生, 何雅丽, 陈宇. API-ZYM系统在部分真菌胞外酶种类分析中的应用[J]. 中国皮肤性病学杂志, 2011(9)∶ 727-728.
[24] KILCAWLEY K N, WILKINSON M G, FOX P F. Determination of key enzyme activities in commercial peptidase and lipase preparations from microbial or animal sources[J]. Enzyme and Microbial Technology, 2002, 31(3)∶ 310-320. DOI∶10.1016/S0141-0229(02)00136-9.
[25] BALDRIAN P, VOŘÍŠKOVÁ J, DOBIÁŠOVÁ P, et al. Production of extracellular enzymes and degradation of biopolymers by saprotrophic microfungi from the upper layers of forest soil[J]. Plant and Soil, 2011,338(1/2)∶ 111-125. DOI∶10.1007/s11104-010-0324-3.
[26] 潘进权. 毛霉亮氨酸氨肽酶的纯化及性质研究[J]. 食品科学, 2012,33(7)∶ 163-167.
[27] LI L, YANG Z Y, YANG X Q, et al. Debittering effect of Actino Mucor elegans peptidases on soybean protein hydrolysates[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(1)∶ 41-47.DOI∶10.1007/s10295-007-0264-y.
[28] 付静. A. elegans、A. oryzae和R. oligosporus肽酶系统及其脱苦机理的比较研究[D]. 广州∶ 华南理工大学, 2011.
[29] 王扬, 娄永江, 杨文鸽. 酶法制备几丁寡糖和壳寡糖研究现状与进展[J]. 东海海洋, 2001(4)∶ 40-45. DOI∶10.3969/j.issn.1001-909X.2001.04.007.
[30] 刘渊, 李喜焕, 孙星, 等. 磷胁迫下大豆酸性磷酸酶活性变化及磷效率基因型差异分析[J]. 植物遗传资源学报, 2012(4)∶ 521-528.DOI∶10.3969/j.issn.1672-1810.2012.04.003.
Formation of Protein Hydrolysate and Its Influencing Factors during the Post-Fermentation of Mucor-Type Douchi,a Chinese Traditional Fermented Soybean Product
YANG Yilei1, LI Mengdan1, LIU Jin1, CHEN Lili1,2,*, JIANG Liwen1,2,*
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China;2. Hunan Provincial Key Laboratory of Food Science and Biotechnology, Changsha 410128, China)
This study analyzed the change of protein and its hydrolysate during the post-fermentation of Mucor-type douchi by SDS-PAGE and reversed-phase liquid chromatography (RP-LC). The correlation of free amino acid content with different chemical components and browning intensity was analyzed, and the extracellular enzymes from Mucor were semi-quantitatively detected by the API ZYM system. The results showed that the molecular weight of the final protein hydrolysate was mainly distributed in the range of 11–20 kD. The molecular weight of proteins was reduced rapidly at the early stage (from day 0 to 7), and the polypeptide composition changed greatly. The polypeptide content changed from day 7 to 42. The formation of free amino acids had the highest correlation with the total acid content with a correlation coefficient of 0.972, followed sequentially by the browning intensity and reducing sugar. Using the API ZYM system we detected 6 extracellular enzymes from Mucor.
Mucor-type douchi; protein; hydrolysate; API ZYM system
DOI∶10.7506/spkx1002-6630-201724006
TS264
A
1002-6630(2017)24-0034-06
杨伊磊, 李梦丹, 刘金, 等. 毛霉型豆豉后发酵阶段蛋白质水解产物的生成及影响因素[J]. 食品科学, 2017, 38(24)∶34-39. DOI∶10.7506/spkx1002-6630-201724006. http∶//www.spkx.net.cn
YANG Yilei, LI Mengdan, LIU Jin, et al. Formation of protein hydrolysate and its influencing factors during the postfermentation of Mucor-type douchi, a Chinese traditional fermented soybean product[J]. Food Science, 2017, 38(24)∶ 34-39.(in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724006. http∶//www.spkx.net.cn
2016-11-15
国家自然科学基金面上项目(31371828)
杨伊磊(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:357705175@qq.com
*通信作者:陈力力(1962—),女,教授,博士,研究方向为食品生物技术。E-mail:chenlili001281@sina.com
蒋立文(1968—),男,教授,博士,研究方向为食品生物技术。E-mail:1024305380@qq.com
