韩国产芝麻酱油对AAPH诱发LLC-PK1细胞氧化应激的保护作用
2017-12-11易若琨宋家乐
赵 欣,易若琨,冯 霞,宋家乐*
(1.重庆第二师范学院生物与化学工程学院,重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,重庆 400067;2.桂林医学院公共卫生学院,食品卫生与营养学教研室,广西 桂林 541004;3.韩国釜山大学食品科学与营养学系,韩国 釜山 609-735)
韩国产芝麻酱油对AAPH诱发LLC-PK1细胞氧化应激的保护作用
赵 欣1,易若琨1,冯 霞1,宋家乐2,3,*
(1.重庆第二师范学院生物与化学工程学院,重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,重庆 400067;2.桂林医学院公共卫生学院,食品卫生与营养学教研室,广西 桂林 541004;3.韩国釜山大学食品科学与营养学系,韩国 釜山 609-735)
以芝麻酿造酱油乙醇提取物(ethanol extract sesame sauce,SSE)为研究对象,探讨其对1 mmol/L 2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)引发的LLC-PK1猪肾近曲小管上皮细胞氧化应激损伤的保护作用。方法:LLC-PK1细胞与不同质量浓度(10~100 μg/mL)的SSE预先共同培养24 h后,用含AAPH的DMEM培养液继续培养4 h建立细胞损伤模型。细胞存活率用四甲基偶氮唑蓝法检测,细胞内丙二醛(malondialdehyde,MDA)含量和总活性氧簇(reactive oxygen species,ROS)水平分别以硫代巴比妥酸比色法和2’,7’-二氢二氯荧光黄双乙酸钠探针法测定。细胞内过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)活力和谷胱甘肽(glutathione,GSH)含量按试剂盒说明书以比色法测定。结果表明,SSE预处理可以提高受损细胞存活率,降低细胞内总ROS水平和MDA含量。同时,SSE还能提高受损细胞内抗氧化酶(CAT、SOD、GSH-Px)及γ-GCS活力并提高细胞内GSH含量。实时荧光定量聚合酶链式反应分析也提示SSE能上调细胞内抗氧化物酶(CAT、SOD和GSH-Px)的mRNA表达量。此外,SSE可以通过提高细胞内源性抗氧化系统能力来降低细胞内MDA和ROS水平,并由此缓解AAPH对LLC-PK1细胞所造成的氧化应激损伤。
芝麻酱油;氧化损伤;抗氧化;LLC-PK1细胞
酱油是一种富含氨基酸、维生素、烟酸、钙和磷等多种营养成分的传统液体发酵食品[1]。通常酱油主要是以大豆等为原料,再辅以水、豆粕、淀粉、小麦、麸皮和食盐等经制曲、发酵、过滤、灭菌等过程酿制而成。研究发现,酱油具有抗氧化、抗癌、抗炎症、抗突变、降血压等功效[2-9]。相对于传统的黄豆酱油而言,芝麻酿造酱油则是一款以脱脂芝麻替代传统大豆进行酱油发酵的新型酱油调味品。其发酵工艺与传统的大豆酱油类似,目前在韩国市场上较受欢迎。
LLC-PK1细胞是一种常用于研究氧化应激损伤导致肾脏上皮细胞损伤的猪源细胞系[17]。为研究芝麻酿造酱油在对抗氧化应激损伤所致疾病方面潜在的预防保健功效,本研究以2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)处理猪肾近曲小管上皮LLC-PK1细胞构建细胞氧化损伤模型,探究芝麻酿造酱油对AAPH所致细胞氧化应激损伤的保护作用机制,为芝麻酿造酱油预防氧化应激引起的肾脏疾病提供一定的参考依据。
1 材料与方法
1.1 细胞株、材料与试剂
猪肾近曲上皮小管细胞系LLC-PK1由韩国釜山大学营养学系Kunyoung Park教授馈赠。
实验用芝麻酿造酱油为韩国Daesang食品株式会社制造,并由该公司中央研究所提供。取冷冻干燥后的酱油样品(约100 mg),按样品与提取试剂比例为1∶10(m/V)加入80%乙醇溶液,室温搅拌过夜提取后抽滤,该过程重复3 次后合并滤液。所得滤液经3 000×g离心15 min后弃渣收集上清液,经50 ℃真空减压旋转蒸发后,制备得到芝麻酱油乙醇提取物(ethanol extract from sesame sauce,SSE)并用二甲基亚砜(dimethyl sulfoxide,DMSO)配成质量浓度为20 mg/mL的储备液,-80 ℃贮存待用。
AAPH、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、2’,7’-二氢二氯荧光黄双乙酸钠(dichloro-dihydro-fluorescein diacetate,DCFH-DA)、青霉素-链霉素双抗 美国Sigma公司;DMEM细胞培养液、胎牛血清、Trizol试剂、Oligo(dT)18、RNase、dNTP、MLV逆转录酶 美国Invitrogen公司;ROX reference dye、SYBR Premix Ex TaqⅡ 日本Takara公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)试剂盒、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒南京建成生物工程研究所;其余试剂均为国产分析纯。
1.2 仪器与设备
EYELA N-1001S旋转蒸发仪 日本东京理化器械株式会社;MCO-15AC二氧化碳细胞培养箱 日本三洋公司;Centrifuge 5418R冷冻离心机 德国Eppendorf公司;ELx808酶标仪 美国Bio-Tek公司;QuantStudioTM6 Flex聚合酶链式反应(polymerase chain reaction,PCR)仪美国Thermo Fisher Scientif i c公司;FLUOstar OPTIMA荧光酶标仪 德国BMG公司。
1.3 方法
1.3.1 细胞培养及分组
LLC-PK1细胞以DMEM细胞培养液(含10%胎牛血清和1%青-链霉素双抗溶液)放置于37 ℃、5% CO2环境中湿化培养,每2 d换液一次。实验时细胞按1×104、2×105个/孔分别接种于96 孔和6 孔细胞培养板中。以DMEM培养液(含1 mmol/L AAPH)继续培养4 h制备氧化损伤细胞模型。氧化损伤模型细胞分别按1×104个/孔,每孔100 μL接种于96 孔板后,依前期研究,以不同质量浓度的SSE(10、50、100 μg/mL)继续培养24 h并进行后续实验[9]。未经过AAPH诱导处理的正常LLC-PK1细胞作为正常组。
1.3.2 MTT法测定细胞存活率
LLC-PK1细胞首先按前述分组处理并进行24 h连续培养后,弃去孔内培养基并加入终质量浓度为0.5 mg/mL的MTT溶液(100 μL)继续培养4 h。培养结束后弃上清液,每孔加入100 μL DMSO避光振荡30 min,测定OD490nm后按公式(1)计算细胞存活率。
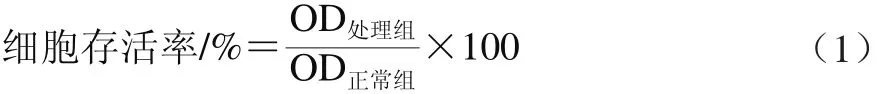
1.3.3 细胞内MDA含量的测定
细胞按照1.3.1节处理后,采用硫代巴比妥酸比色法测定细胞内MDA含量[18]。所有细胞经冷磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗后,用细胞刮刀进行收集并加入预冷的细胞裂解液裂解细胞。随后在5 mL的玻璃试管中依次加入500 μL细胞裂解上清液、质量分数为15%的三氯乙酸与0.67%硫代巴比妥酸混合溶液400 μL,充分混匀并在95 ℃水浴中保温20 min。冷却后,加入3 mL异丙醇提取色素并测定OD532nm,细胞总蛋白质量以蛋白质试剂盒定量。按照公式(2)计算MDA含量。

1.3.4 细胞内ROS含量的测定
在6 孔细胞培养板中按照1.3.1节方法处理细胞后,加入含20 μmol/L的DCFH-DA试剂的DMEM培养液37 ℃条件下孵育20 min,冷PBS清洗处理过的细胞2 次,在激发波长为485 nm,发射波长为530 nm的条件下用FLUOstar OPTIMA荧光酶标仪测定荧光强度,按照公式(3)计算ROS相对含量。

1.3.5 细胞内抗氧化酶活力、GSH含量和γ-GCS活力的测定
细胞按2×105个/孔接种于6 孔板,之后按1.3.1节方法进行处理。待处理结束后,取适量细胞裂解液,按SOD、CAT、GSH-Px、GSH和γ-GCS各自的测定试剂盒说明书步骤操作,酶活力以酶比活力(U/mg pro)表示,GSH含量和γ-GCS活力以μmol/mg pro表示,并用细胞总蛋白质含量作校正。
1.3.6 实时荧光定量PCR法检测SSE对LLC-PK1细胞相关抗氧化基因表达的影响
依照Trizol试剂说明书提取待测细胞内总RNA,经紫外法检测纯度后,调整各样品组的总RNA浓度至同一水平。取每组等量mRNA(2 μg)分别依次加入到含有Oligo(dT)18、RNase、dNTP和MLV酶各1 μL,5×buffer 10 μL的灭菌PCR试管中。在37 ℃ 120 min,99 ℃ 4 min,4 ℃ 3 min条件下合成cDNA。随后用实时荧光定量PCR法检测抗氧化物酶CAT、GSH-Px和SOD的mRNA表达量。在总反应体系中(20 μL)加入cDNA(2 μL)、上游和下游引物(10 μmol/L)各1 μL、SYBR Premix Ex Taq Ⅱ(2×) 10 μL、ROX reference dye(50×) 0.4 μL和灭菌双蒸水5.6 μL,充分混匀上述试剂后置于QuantStudioTM6 Flex PCR仪中进行反应。扩增反应条件为95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,共35 个循环;72 ℃ 5 min。每个基因cDNA样本平行扩增3 次,并取Ct值的均值,按照公式(4)对目的基因的表达量(F)进行计算。持家基因GAPDH作为内参。

式中:Ct1~4分别为检测样本中基因、检测样本中GAPDH、空白样本中基因、空白样本中GAPDH的Ct值。
1.4 数据统计分析
所有实验均重复3 次,结果以 ±s表示,利用SPSS 19.0统计软件分析,采用单因素方差分析进行数据统计分析,p<0.05为具有统计差异。
2 结果与分析
2.1 SSE对受损LLC-PK1细胞存活率的影响
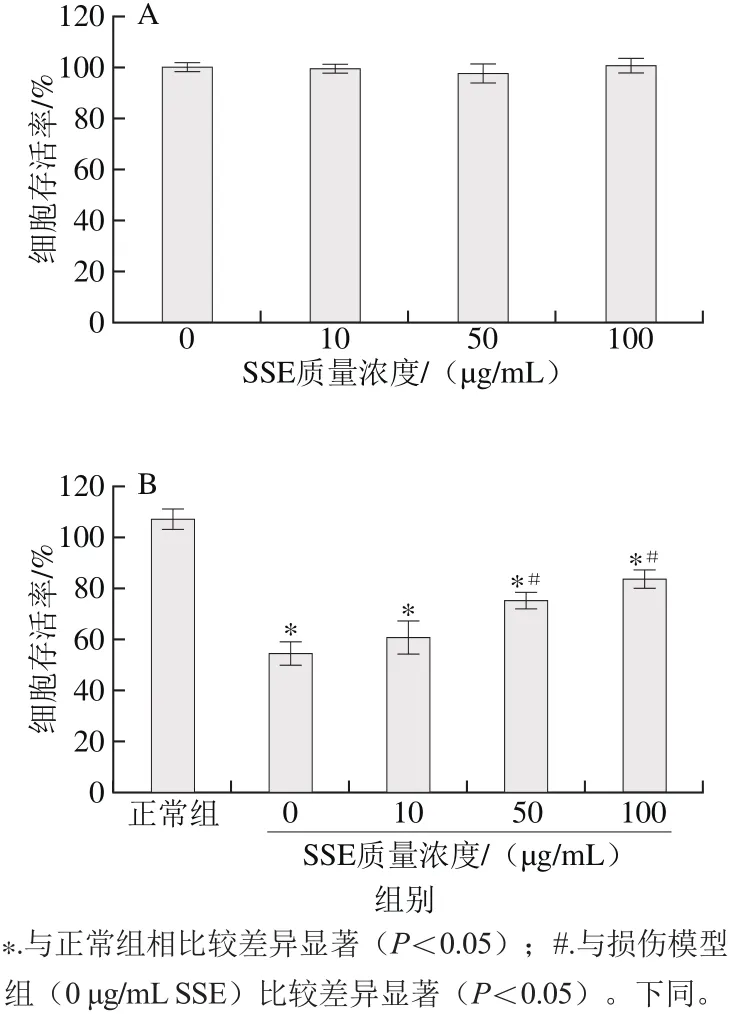
图1 SSE对受损LLC-PK1细胞存活率的影响(A)和对AAPH处理后细胞的保护效果(B)Fig. 1 Effect of SSE on cell viability in LLC-PK1 cells (A), and protective effects of SSE on AAPH treated LLC-PK1 cells (B)
如图1A所示,经质量浓度分别为10、50、100 μg/mL的SSE处理后,LLC-PK1细胞的存活率均超过90%。该结果提示SSE对LLC-PK1细胞无明显的细胞毒性作用。因此在后续的研究中,10、50、100 μg/mL为对细胞生存无影响的安全浓度。此外,相比正常组细胞而言,直接暴露于AAPH(1 mmol/L)4 h后可造成LLC-PK1细胞生存率显著下降(p<0.05)。而经不同质量浓度SSE处理24 h后,受损细胞的存活率较未处理细胞有所上升,且保护效果随SSE的质量浓度增加而增强,特别是在较高质量浓度处理时(50、100 μg/mL)保护效果显著(p<0.05)。
2.2 SSE对受损LLC-PK1细胞内MDA含量和ROS相对含量的影响
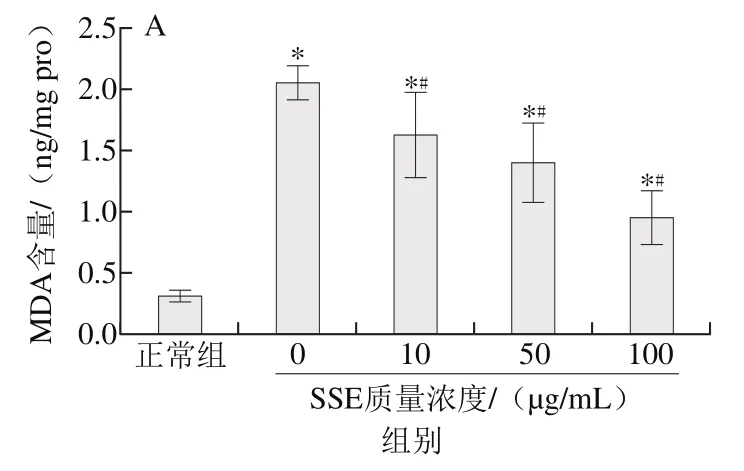

图2 SSE对受损LLC-PK1细胞内MDA含量(A)和ROS相对含量(B)的影响Fig. 2 Effect of SSE on the levels of MDA (A) and ROS (B) in LLC-PK1 cells exposed to AAPH
由图2可知,经1 mmol/L AAPH处理4 h后,LLC-PK1细胞内MDA的含量较正常细胞内MDA含量显著上升(p<0.05)。但在给予不同质量浓度SSE(10、50、100 μg/mL)后,细胞内MDA含量发生显著下降(p<0.05),在经100 μg/mL的SSE处理时,细胞内MDA含量最低。同时,AAPH处理还能造成LLC-PK1细胞内ROS水平显著升高(p<0.05)。而经过不同质量浓度SSE(10、50、100 μg/mL)处理24 h后,受损细胞内的ROS水平呈逐渐降低趋势。且SSE在100 μg/mL时,具有较强的ROS抑制能力。
2.3 SSE对受损LLC-PK1细胞内CAT、SOD和GSH-Px活力的影响

表1 SSE对受损LLC-PK1细胞CAT、SOD和GSH-Px活力的影响Table 1 Effect of SSE on the levels of CAT, SOD and GSH-Px activity in LLC-PK1 cells exposed to AAPH
如表1所示,AAPH造成LLC-PK1细胞内CAT、SOD和GSH-Px活力的降低。相反,经不同质量浓度SSE(10、50、100 μg/mL)处理24 h后,受损细胞内的抗氧化酶活力逐渐升高,与未经SSE处理的损伤模型组相比存在显著差异(p<0.05)。
2.4 SSE对受损LLC-PK1细胞内γ-GCS活力和GSH含量的影响
由图3可知,AAPH处理不仅能够明显抑制细胞内γ-GCS活力,同时还能造成细胞内GSH含量显著降低(p<0.05)。而经SSE(10、50、100 μg/mL)处理24 h后,受损的LLC-PK1细胞内γ-GCS活力逐渐增高。同时,细胞内GSH含量也得以恢复并呈增高趋势。且与损伤模型组相比,较高剂量的SSE(50、100 μg/mL)对受损的LLC-PK1细胞中γ-GCS活力和GSH含量的干预作用明显(p<0.05)。

图3 SSE对AAPH致损LLC-PK1细胞内GSH含量(A)和γ-GCS活力(B)的影响Fig. 3 Effect of SSE on the levels of GSH (A) and γ-GCS (B) in LLCPK1 cells exposed to AAPH
2.5 SSE对受损LLC-PK1细胞内SOD、GSH-Px和CAT基因表达水平的影响
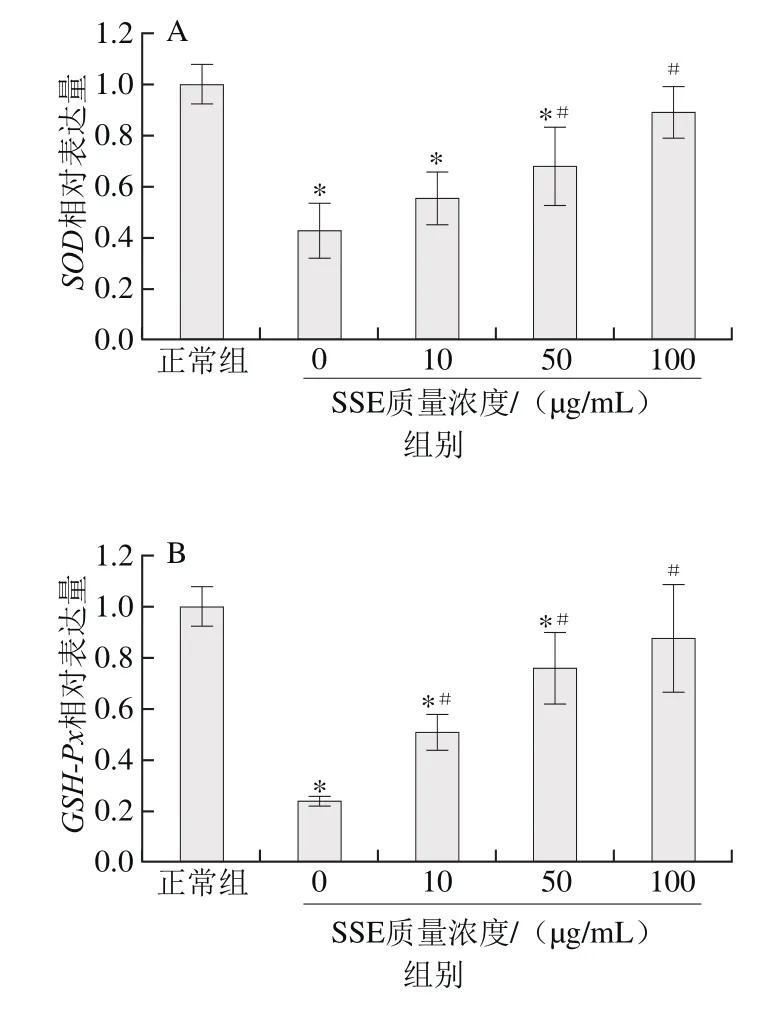

图 4 SSE对受损LLC-PK1细胞内SOD(A)、GSH-Px(B)和CAT(C)基因表达的影响Fig. 4 Effect of SSE on the gene expression of SOD (A) , GSH-Px (B)and CAT (C) in LLC-PK1 cells exposed to AAPH
由图4可知,通过实时荧光定量P C R分析发现,1 mmol/L的AAPH造成LLC-PK1细胞内SOD、GSH-Px和CAT这3 种主要内源性抗氧化物酶mRNA表达水平显著降低(p<0.05)。而由SSE处理后,受损LLC-PK1细胞中的内源性抗氧化酶SOD、GSH-Px和CAT基因的表达水平逐步增强。与损伤模型组相比,较高剂量(50、100 μg/mL)SSE对受损的LLC-PK1细胞中SOD、GSH-Px和CAT基因的表达水平干预作用明显(p<0.05)。
3 讨 论
ROS在机体内的过度蓄积常被认为是各类慢性疾病的重要致病要素之一。作为一种重要的自由基供体,偶氮类化合物AAPH可自发生成过氧自由基。而过氧自由基能造成细胞内DNA、蛋白质和脂类等生物大分子的损伤,导致细胞死亡。本研究发现,LLC-PK1细胞暴露于AAPH(1 mmol/L)后,细胞存活率明显下降。给予不同质量浓度的SSE处理24 h后,LLC-PK1细胞存活率较未经SSE处理的受损细胞明显增高(p<0.05)。同时,机体内部过量生成或者是蓄积的ROS还可导致细胞膜上的不饱和脂肪酸发生脂质过氧化反应,导致对细胞具有毒性作用的脂质过氧化产物MDA和4-羟基壬烯醛的大量生成[19-20]。因此,MDA常被作为一种衡量氧化应激对细胞造成损伤的标志物[21]。在受损的LLC-PK1细胞中,SSE处理可以降低受损细胞内总ROS水平并降低MDA含量。这可能是由于芝麻酱油中含有较为丰富的芝麻素(13 μg/g)和表芝麻素(13.7 μg/g)等具有强抗氧化能力的木脂素类化合物[22]。目前,也有相关的文献指出,给予适当的抗氧化剂可以降低由ROS引发的肾脏细胞的脂质过氧化程度,同时也有助于防止肾脏细胞发生氧化应激性损伤[23]。在临床研究中也提示,通过摄入富含抗氧化成分的膳食可以降低慢性肾脏疾病患者体内的氧化应激水平[24],并能够缓解慢性肾病患者向末期肾病的发展[17]。同时,抗氧化剂治疗还可以改善慢性肾病患者晚期透析时肾脏组织内过度的氧化应激所造成的组织损伤[25]。
在正常生理状态下,生命体中的内源性抗氧化物质如抗氧化酶(CAT、SOD、GSH-Px和GST)以及非酶性GSH可以有效地对抗氧化应激损伤对机体造成的伤害。例如,SOD可以将细胞内多余的超氧阴离子转化为H2O2,且生成的H2O2可以被CAT和GSH-Px转化为无害的水[26]。此外,GSH-Px还可以利用GSH作为底物来还原H2O2和烷氢过氧化物,并可将有机氢过氧化物(ROOH)还原为羟基化合物(ROH)[27]。同时,GST则可以协助GSH-Px清除体内过多的ROOH。本研究发现,经不同质量浓度SSE预先保护后,受损细胞内的主要抗氧化酶(CAT、SOD、GSH-Px)活力和γ-GCS含量升高,非酶抗氧化物质GSH含量也得到上升。提升CAT和SOD活力有助于防止氧化应激给LLC-PK1细胞所造成的损伤,并能抑制氧化应激对生物体细胞膜上脂类物质所造成的脂质过氧化反应,并可以缓解氧化应激损伤给细胞所带来的进一步损伤[28-30]。作为机体内的一种主要的非酶类抗氧化剂,GSH不仅可以直接通过GSH-Px还原毒性的脂质过氧化物和H2O2,还可以间接地抑制体内自由基链式反应,避免细胞因自由基所导致的损伤[26,30]。γ-GCS是GSH体内生物合成的限速酶,可促进GSH的合成。此外,芝麻酱油还能上调受损的LLC-PK1细胞中主要抗氧化酶mRNA的转录水平。通过增强细胞内CAT和GSH-Px的转录水平有助于提高细胞内总铜/锌超氧化物歧化酶(Cu/Zn SOD)的活性,可减缓细胞的氧化应激损伤[20,28-30]。本实验为芝麻酱油作为具有抗氧化能力的保健食品提供了一定的理论依据。但由于本次实验研究仅涉及到细胞层面的体外实验,而对于对芝麻酱油在氧化应激下保护细胞免受氧化损伤的具体分子生物学机制以及其在体内的抗氧化保护机制,还有待进一步的深入研究。
[1] 冯霞, 赵欣, 宋家乐. 传统酿造酱油的品质特性及其氨基酸组成研究[J]. 中国调味品, 2014, 39(2): 16-19. DOI:10.3969/j.issn.1000-9973.2014.02.004.
[2] 吕东津, 宋小焱, 梁姚顺. 酱油中的生理活性物质及其营养保健作用[J]. 中国酿造, 2004, 23(11): 31-33. DOI:10.3969/j.issn.0254-5071.2004.11.012.
[3] 袁圆, 鲁绯, 黄持都, 等. 酱油功能性研究最新进展[J]. 中国酿造,2010, 29(1): 1-4. DOI:10.3969/j.issn.0254-5071.2010.01.002.
[4] 宋家乐. 陈年酿造酱油的抗突变性及其抗癌活性[J]. 中国调味品,2011, 36(4): 14-17. DOI:10.3969/j.issn.1000-9973.2011.04.004.
[5] SONG J L, CHOI J H, SEO J H, et al. Antoxidative effects of fermented sesame sauce against hydrogen peroxide-inducedoxidative damage in LLC-PK1 porcine renal tubule cells[J]. Nutrition Research and Practice, 2014, 8(2): 138-145. DOI:10.4162/nrp.2014.8.2.138.
[6] 先宏, 魏文青, 李妍, 等. 三种品牌酱油对自由基的清除作用[J]. 食品科学, 2005, 26(7): 227-230. DOI:10.3321/j.issn:1002-6630.2005.07.056.
[7] 宋家乐, 邵林楠. 不同年份韩国传统酿造酱油的抗氧化能力[J]. 中国酿造, 2011, 30(2): 85-88. DOI:10.3969/j.issn.0254-5071.2011.02.026.
[8] 郭彩华, 林丽, 陈昭华, 等. 黑酱油类黑素的提取、光谱性质及功能[J].食品科学, 2012, 33(11): 89-93.
[9] 宋家乐, 李贵节, 赵欣. 竹盐酿造酱油对H2O2诱发LLC-PK1细胞氧化损伤的保护作用[J]. 食品科学, 2015, 36(9): 176-180.DOI:10.7506/spkx1002-6630-201509032.
[10] POULIANITI K P, KALTSATOU A, MITROU G I, et al. Systemic redox imbalance in chronic kidney disease: a systematic review[J].Oxidative Medicine and Cellular Longevity, 2016, 2016: 8598253.DOI:10.1155/2016/8598253.
[11] SUNDARAM S P M, NAGARAJAN S, DEVI A J M. Chronic kidney disease: effect of oxidative stress[J]. Chinese Journal of Biology,2014(1): 1-6. DOI:10.1155/2014/216210.
[12] SALAHUDEEN A K, CLARK E C, NATH K. Hydrogen peroxideinduced renal injury: a protective role for pyruvate in vitro and in vivo[J]. Journal of Clinical Investigation, 1991, 88: 1886-1893.DOI:10.1172/JCI115511.
[13] SALAHUDEEN A K. Role of lipid peroxidation in H2O2-induced renal epithelial (LLC-PK1) cell injury[J]. American Journal of Physiology,1995, 268: F30-F38.
[14] NATH K A, SALAHUDEEN A K. Autoxidation of cysteine generates hydrogen peroxide: cytotoxicity and attenuation by pyruvate[J].American Journal of Physiology, 1993, 264: F306-F314.
[15] JUN M, VENKATARAMAN V, RAZAVIAN M, et al. Antioxidants in the prevention of renal disease[J]. Cochrane Database of Systematic Reviews, 2012, 10: CD008176. DOI:10.1002/14651858.CD008176.pub2.
[16] HATANO T, KAGAWA H, YASUHARA T, et al. Two new flavonoids and other constituents in licorice root: their relative astringency and radical scavenging effects[J]. Chemical Pharmaceutical Bulletin, 1988, 36: 2090-2097. DOI:10.1248/cpb.36.2090.
[17] YU C H, LIU Z Y, SUN L S, et al. Effect of danof l oxacin on reactive oxygen species production, lipid peroxidation and antioxidant enzyme activities in kidney tubular epithelial cell line, LLC-PK1[J]. Basic& Clinical Pharmacology & Toxicology, 2013, 113(6): 377-384.DOI:10.1111/bcpt.12110.
[18] FRAGA C G, LEIBOVITZ B E, TAPPEL A L. Lipid peroxidation measured as thiobarbituric acid-reactive substances in tissue slices: characterization and comparison with homogenates and microsomes[J]. Free Radical Biology and Medicine, 1988, 4(3): 155-161. DOI:10.1016/0891-5849(88)90023-8.
[19] DONG J, RAMACHANDIRAN S, TIKOO K, et al. EGFR-independent activation of p38 MAPK and EGFR-dependent activation of ERK1/2 are required for ROS-induced renal cell death[J]. American Journal of Physiology. Renal Physiology, 2004, 287(5): F1049-F1058.DOI:10.1152/ajprenal.00132.2004.
[20] KHAN S R. Hyperoxaluria-induced oxidative stress and antioxidants for renal protection[J]. Urological Research, 2005, 33(5): 349-357.DOI:10.1007/s00240-005-0492-4.
[21] SHERIDAN A M, FITZPATRICK S, WANG C, et al. Lipid peroxidation contributes to hydrogen peroxide induced cytotoxicity in renal epithelial cells[J]. Kidney International, 1996, 49(1): 88-93.DOI:10.1038/ki.1996.12.
[22] SONG J L. Anticancer effects of fermented sesame sauce[D]. Busan:Pusan National University, 2012: 45.
[23] SMALL D M, COOMBES J S, BENNETT N, et al. Oxidative stress,anti-oxidant therapies and chronic kidney disease[J]. Nephrology,2012, 17(4): 311-321. DOI:10.1111/j.1440-1797.2012.01572.x.
[24] SAHNI N, GUPTA K L, RANA S V, et al. Intake of antioxidants and their status in chronic kidney disease patients[J]. Journal of Renal Nutrition, 2012, 22(4): 389-399. DOI:10.1053/j.jrn.2011.09.002.
[25] CHAUHAN S S, OIHA S, MAHMOOD A. Modulation of lipid peroxidation and antioxidant defense systems in rat intestine by subchronic fluoride and ethanol administration[J]. Alcohol, 2011,45(7): 663-672. DOI:10.1016/j.alcohol.2010.10.008.
[26] HALLIWELL B. Reactive species and antioxidants. redox biology is a fundamental theme of aerobic life[J]. Plant Physiology, 2006, 141(2):312-322. DOI:10.1104/pp.106.077073.
[27] THAMILSELVAN S, BYER K J, HACKETT R L, et al. Free radical scavengers, catalase and superoxide dismutase provide protection from oxalate-associated injury to LLC-PK 1 and MDCK cells[J]. The Journal of Urology, 2000, 164(1): 224-229. DOI:10.1016/S0022-5347(05)67499-X.
[28] TBAHRITI H F, KADDOUS A, BOUCHENAK M, et al. Effect of different stages of chronic kidney disease and renal replacement therapies on oxidant-antioxidant balance in uremic patients[J].Biochemistry Research International, 2013, 2013: 358985.DOI:10.1155/2013/358985.
[29] ABDOLLAHI M, RANJBAR A, SHADNIA S, et al. Pesticides and oxidative stress: a review[J]. Medical Science Review, 2004, 10(6): 141-147.
[30] ARULSELVAN P, FARD M T, TAN W S, et al. Role of antioxidants and natural products in inf l ammation[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 5276130. DOI:10.1155/2016/5276130.
Protective Effect of Korean Sesame Sauce on AAPH-Induced Oxidative Stress in LLC-PK1 Cells
ZHAO Xin1, YI Ruokun1, FENG Xia1, SONG Jiale2,3,*
(1. Chongqing Collaborative Innovation Center for Functional Food, Chongqing Engineering Research Center of Functional Food, Chongqing Engineering Laboratory for Research and Development of Functional Food, College of Biological and Chemical Engineering, Chongqing University of Education, Chongqing 400067, China;2. Department of Food Hygiene and Nutrition, School of Public Health, Guilin Medical University, Guilin 541004, China;3. Department of Food Science and Nutrition, Pusan National University, Busan 609-735, Korea)
The present study aimed to investigate the protective effect of ethanol extract from sesame sauce (SSE) on 2,2’-azobis(2-methylpropionamidine) dihydrochloride (AAPH)-induced oxidative stress in pig renal epithelial LLC-PK1 cells.LLC-PK1 cells were incubated with different concentrations of SSE (10–100 μg/mL) for 24 h, and then exposed to AAPH(1 mmol/L) for 4 h. Cell viability was determined by methyl thiazolyl tetrazolium assay. The levels of malondialdehyde (MDA)and reactive oxygen species (ROS) were determined by thiobarbituric acid reactive substances assay (TBARS) and DCFHDA assay, respectively. The activities of cellular antioxidant enzymes including catalase (CAT), superoxide dismutase (SOD),glutathione peroxidase (GSH-Px), glutathione S-transferase (GST), γ-glutamylcysteine synthetase (γ-GCS) and glutathione(GSH) were measured by colorimetric assay. In addition, the mRNA levels of these antioxidant enzymes (SOD,GSH-Px and CAT) were determined by quantitative real-time polymerase chain reaction assay. SSE was able to increase cell viability, and decrease ROS and MDA level, as well as increase the activities and mRNA expressionof antioxidant enzymes (CAT、SOD and GSH-Px) compared with the control group. SSE treatment also increased the activity of γ-GCS and GSH levels in AAPH-treated LLC-PK1 cells. These results suggested that SSE showed a protective effect against AAPH-induced oxidative stress in LLC-PK1 cells through inhibiting lipid peroxidation,deceasing ROS levels, and increasing the activity of the endogenous antioxidant system.
sesame sauce; oxidative damage; antioxidant; LLC-PK1 cells
2016-09-09
重庆高校创新团队建设计划资助项目(CXTDX201601040);
重庆市工程技术研究中心建设项目(cstc2015yfpt_gcjsyjzx0027)
赵欣(1981—),男,教授,博士,研究方向为食品营养学和食品化学。E-mail:zhaoxin@cque.edu.cn
*通信作者:宋家乐(1983—),男,副教授,博士,研究方向为分子营养学和功能性食品学。E-mail:songjiale@glmc.edu.cn
10.7506/spkx1002-6630-201723034
TS201.4
A
1002-6630(2017)23-0213-06引文格式:
赵欣, 易若琨, 冯霞, 等. 韩国产芝麻酱油对AAPH诱发LLC-PK1细胞氧化应激的保护作用[J]. 食品科学, 2017, 38(23):213-218.
10.7506/spkx1002-6630-201723034. http://www.spkx.net.cn
ZHAO Xin, YI Ruokun, FENG Xia, et al. Protective effect of Korean sesame sauce on AAPH-induced oxidative stress in LLC-PK1 cells[J]. Food Science, 2017, 38(23): 213-218. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723034. http://www.spkx.net.cn
