基于转录组学技术探究新琼四糖对过度疲劳性肠道损伤的保护作用
2017-12-11毛相朝薛长湖唐庆娟
宋 佳,张 娜,李 晶,毛相朝,薛长湖,唐庆娟
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
基于转录组学技术探究新琼四糖对过度疲劳性肠道损伤的保护作用
宋 佳,张 娜,李 晶,毛相朝,薛长湖,唐庆娟*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
目的:运用转录组学探究新琼四糖对过度疲劳性肠道损伤的保护作用。方法:雄性BALB/c小鼠被随机分为正常组、力竭运动组、阳性对照低聚果糖组和新琼四糖干预组,连续喂养16 d后,取小鼠结肠组织,应用RNA-seq技术对结肠组织RNA进行完全测序,并对测序结果进行分析。结果:过度疲劳引起小鼠结肠肿瘤标志物Zfp521和Zmynd8等锌指蛋白表达量极显著增加(p<0.01)、抑癌因子Casz1、Zfp346等的表达显著降低(p<0.05),新琼四糖可缓解过度疲劳造成的肠道损伤,下调肿瘤相关锌指蛋白的表达,上调抑癌锌指蛋白的表达。结论:新琼四糖可保护肠道、缓解过度疲劳引发的肠道损伤、预防肿瘤的发生。
新琼四糖;过度疲劳;锌指蛋白;RNA-seq;低聚果糖
现代人生活工作压力大,过度劳累且缺少充分休息已成为常态。过度疲劳损伤器官组织、降低机体免疫力[1],尤其会破坏肠道微环境稳态、损伤肠道组织屏障、增加患病风险性。缓解过劳损伤,保障健康,已成为社会关注热点。在众多保健方法中,食疗更健康、温和,因此,功能食品研究便快速发展起来。
传统的功能食品开发方法具有研究深入、目标明确的优势,但是其所涉及的功能面窄、开发效率低下。基于功能性食品均是通过影响组织或细胞的基因转录、蛋白代谢水平等生理活动实现其保健功效的本质,研究者通过整体把握生物体内所发生的事件、事件间的相关性及其对所涉及生物过程的意义,便能发现活性物质的营养功效。转录组学分析技术是实现这一目的有效工具。通过研究活细胞在某一功能状态下所含mRNA的类型和拷贝数[2],研究者能从RNA水平上诠释组织或细胞内的生物过程及其所执行的功能。转录组学分析技术早已应用于医学、食品等研究领域,为探究食品功能的作用机理提供了有效指导,但极少用于发掘活性物质的新功能。
低聚糖是关注度极高的功能性成分,具有益生元功能,可改善肠道菌群带来降血脂、降胆固醇、增强免疫力等多种功效[3]。新琼寡糖(neoagarooligosaccharides),是海藻中提取的多糖——琼胶,降解而来的低聚糖[4],利于人体吸收。新琼寡糖的功能性研究刚刚起步,被认为是一种有效的益生元[5],有探索潜力。近年来,新琼寡糖的制备工艺逐步得到提升,开发新琼寡糖的新功能具有重要意义。
本研究以力竭运动小鼠构建过度疲劳模型,以公认的益生元——低聚果糖为阳性对照,采用转录组技术探究新琼四糖对过度疲劳性肠道损伤的保护作用。锌指蛋白是一类具有手指状结构域的转录因子,参与细胞代谢、生长发育等多项功能,在肿瘤发生和机体免疫异常方面是有效的指示标志物[6]。过度疲劳引发体内多种肿瘤标志锌指蛋白表达异常增加,本实验研究新琼四糖对肿瘤标志蛋白表达的影响,探究其保护机体、预防结肠肿瘤发生的功效,为功能食品研究提供新思路,并为新琼四糖的开发利用提供参考。
1 材料与方法
1.1 动物、材料与试剂
BALB/c小鼠(SPF级,雄性,4~6 周龄,体质量18~22 g) 北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001)。
低聚果糖(纯度>9 5%)、焦碳酸二乙酯(diethylpyrocarbonate,DEPC)处理水 北京索莱宝科技有限公司;RNAase-free DNase Ⅰ 日本宝生物有限公司;乙醇、异丙醇(均为化学纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Nanodrop 2000c超微量分光光度计 美国Agilent公司;Miseq测序平台 美国Illumina公司;YLS-10B小鼠转轮式疲劳仪 山东医学科学院;薄层层析板 德国Merck公司;基质辅助激光解吸飞行时间(matrix-assisted laser desorption/ionization-time of fl ight,MALDI-TOF)质谱仪美国AB SCIEX公司;超导傅里叶变换核磁共振(nuclear magnetic resonance,NMR)波谱仪 德国Bruker公司。
1.3 方法
1.3.1 动物分组及模型建立
雄性BALB/c小鼠适应性喂养1 周,按体质量随机分为4 组,每组8 只,即正常组(N)、模型组(M,即力竭运动小鼠)、阳性对照低聚果糖组(FOS)、新琼四糖组(NAT)。小鼠自由摄食,室内温度保持21~24 ℃,相对湿度达到40%~55%,空气流通,每日光照时间达12 h。正常组灌胃后自由活动,不做过度疲劳干预;模型组、低聚果糖组和新琼四糖组,利用小鼠转轮式疲劳仪给予力竭运动,转速20 r/min,首日运动3 h,次日运动2 h,连续运动2 d,间歇5 d。按照相同的力竭运动计划持续16 d(3 次运动)。低聚果糖组和新琼四糖组在处理周期16 d内分别灌胃150 mg/(kg·d)的低聚果糖和新琼四糖,模型组同正常组均灌胃等量生理盐水。
1.3.2 琼脂糖制备
琼脂糖由本课题组自行制备[7]。首先提取到琼胶酶的基因,将其与质粒pET-21(a+)构建重组表达载体,转化大肠杆菌Escherichia coli BL21,实现琼胶酶基因的重组原核表达,制备获得重组琼胶酶agWH50A。琼胶酶和0.2%低熔点琼脂糖混合,加入50 mmol/L KH2PO4-NaOH缓冲液(pH 7.0),于30 ℃孵育12~48 h。对不同时间点下的酶解液进行薄层色谱分析,结果表明,反应仅产生一种寡糖产物。再对酶解液进行4 ℃离心,去除多余琼胶酶,取上清液冻干即得寡糖粉末。对纯化的寡糖粉末以2,5-二羟基苯甲酸为辅助基质进行MALDI-TOF检测,得其分子质量为653 D,与四糖分子质量相吻合(四糖630 D+Na+23 D,以及四糖630 D+K+39 D),证明是四糖。13C NMR分析显示在化学位移δ 93、97处有显著信号,结合文献[8]推断四糖的还原末端为半乳糖,上述两处信号分别对应半乳糖游离异头碳的α-、β-构象,由此表明所得寡糖为新琼寡糖。
1.3.3 提取结肠组织RNA
取小鼠结肠组织(约0.1 g),加入1 mL Trizol试剂,进行匀浆处理,匀浆液转入EP管并静置5 min后,加入0.2 mL氯仿(纯度≥99.0%)充分混匀,静置10 min以沉淀蛋白。之后4 ℃、12 000 r/min离心15 min,转移上清液至新EP管中,加入与上清液等体积的异丙醇溶液,充分混匀,室温放置10 min以沉淀RNA。4 ℃、12 000 r/min离心10 min后弃上清液,沉淀加入1 mL 75%的预冷乙醇,用灭酶枪头温和吹打进行清洗。4 ℃、10 000 r/min离心5 min后吸弃上清液,沉淀于室温条件下静置晾干。根据沉淀产量添加适量DEPC处理水,充分溶解沉淀,即得到总RNA样品。采用超微量分光光度计检测RNA样品含量,进行琼脂糖凝胶电泳检测RNA样品纯度。
1.3.4 RNA-seq测序技术
1.3.4.1 RNA纯化、文库构建及测序
RNA-seq测序参照文献[9]的方法略有调整。采用Trizol试剂将组织中的全部RNA片段提出后,加入RNAase-free DNaseⅠ去除其中可能污染的基因组DNA。磁珠法提取mRNA并打碎成片段,经反转录酶和随机引物合成双链cDNA。依据Illumina工作手册构建mRNA-seq文库。测序在Illumina HiSeq2000平台上进行,得到140 bp双末端进行读长。
1.3.4.2 基因拼接注释
原始读长中去除含有载体或测序引物、含有多个N和低质量的读长。通过Trinity进行序列拼接。每个亚组分中最长的转录本,被称之为unigene,用于功能注释。4 组所有拼接得到的unigene,通过非冗余蛋白质数据库(nonredundant protein database)、非冗余序列(nonredundant nucleotide sequences)和SwissProt,运用BLAST算法以E值10-5为限搜索,同时在真核生物的同源蛋白数据库以E值10-3为限进行查找。Pfam蛋白家族聚类通过HMMER 3.0进行。每个基因模型的GO聚类和KEGG聚类分别通过BLAST2GOv2.5、KASS和KEGG自动注释服务器完成。
1.3.4.3 基因表达分析
每个样品中的单个基因无冗余读长,通过和Trinity转录本进行比对,以RSEM为准则对匹配的读长总量进行统计。经PRKM法筛选得到的匹配读长,通过归一化计算处理,得到全部基因丰度。读长总量采用TMM法均一,组间差异表达分析采用DEGseq软件进行分析。GO和KO丰度分析均基于已识别的差异表达基因。
2 结果与分析
2.1 RNA质量控制
采用1.3.3节方法提取各组小鼠结肠组织RNA,各组OD260nm与OD280nm比值均介于1.9~2.2之间。4 组RNA琼脂糖凝胶电泳图谱由图1可知,28S亚基和18S亚基条带清晰,且各组RIN值均大于8,表明RNA完整,可用作转录组学测序分析。测序文库构建过程中,RNA均被打碎成(142.00±5.00)bp的片段(正常组(142.30±32.60)bp、模型组(1 4 5.6 0±3 2.7 0)b p、低聚果糖组(144.90±33.20)bp、新琼四糖组(145.50±32.60)bp,均小于200 bp),可实现深度测序。采用DESeq2换算系数对原始读取数量进行标准化制作MA图(图2),统计各组基因的表达情况。MA图用来图形化展示基因表达谱的数据,数据被转换成M和A的值,M为log2(fold change),其中fold change指两组表达量的比值变化,A为平均表达值。MA图以M作为y轴,A作为x轴,图中每个点代表一个基因。由图2可知,模型组对正常组小鼠的每个基因平均标准化counts的变化值,模型组引起基因差异表达数量较大,1 053 个基因显著变化。
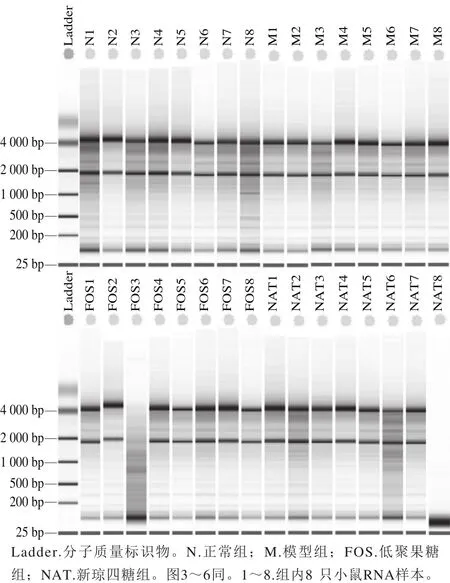
图1 各组小鼠结肠提取的RNA琼胶糖凝胶电泳结果Fig. 1 Agarose gel electrophoresis of total colon RNA from all mouse groups

图2 模型组对正常组小鼠的基因MA图Fig. 2 MA plot of M vs N
2.2 过度疲劳对肠道基因表达的影响
分析过度疲劳小鼠结肠组织的转录组学结果,研究基因表达情况。通过和基因文库进行比对,模型组中18 804 个表达基因的名称及功能得到确认。其中2 987 个基因显著表达(p<0.05),44.66%基因表达上调(fold change≥1.10,其中22.67%的基因fold change>1.2),35.99%的基因表达下调(fold change≤0.90,其中5.79%基因fold change<0.8)。在众多基因中,有89 个基因确定为锌指蛋白家族基因(p<0.05,|1-fold change|≥0.05),为显著表达中所含个体最多的一类蛋白(表2)。其中,有20 个锌指蛋白功能集中在肿瘤相关方面(图3c,p<0.05),12 个锌指蛋白促进肿瘤增殖或在肿瘤细胞中表达量增加[10-19,28-29](图3c,以下称肿瘤正相关蛋白),6 个锌指蛋白可抑制肿瘤增殖或在肿瘤细胞中表达下调[20-25](图3c),2 个锌指蛋白可能与肿瘤有关,表达的改变尚不明确或因环境而变[26-27]。通过比较模型组和低聚糖(包括低聚果糖组和新琼四糖组,后同)组结果发现,低聚糖引起的模型组中表达量改变的基因个体,和模型组对正常组基因引起表达改变的基因个体有重合(图3a,p<0.05,|1-fold change|≥0.05),进一步对比发现,模型组中上调的基因,在低聚糖组中会发生下调;模型组中下调的基因在低聚糖组中会发生上调(图3b,p<0.05,|1-fold change|≥0.05)。因而提出过度疲劳引发肿瘤相关的锌指蛋白表达的改变,低聚糖通过影响此类蛋白的表达保护机体。在低聚果糖组中,25 种显著变化的锌指蛋白中有9 种,即Zfp521、Zfr、Zmynd8、Zbtb38、Zfp345、Zfp13、Zfp503、Zfp512、Zmat2均涉及肿瘤发生(图3b)。锌指蛋白Zfp521,在小鼠B细胞过表达会导致血癌的发生[10],模型组中其表达上调1.2 倍(P=0.004)。Kuroyanagi等[11]发现Zmynd8可促进斑马鱼前列腺肿瘤中的血管生成,Lin Xiao等[12]将肿瘤特异性内皮细胞体外培养,发现脱离肿瘤环境的细胞中仍存在Zfp503的过表达,认为Zfp503可作为哺乳动物癌症的稳定信号,孟莹莹等[13]发现ZBTB38在卵巢浆液性囊腺癌等癌症中有较高程度的扩增。上述2 种锌指蛋白Zmynd8和Zfp503,模型组中其表达量均上调(P值分别为7.56×10-5和0.009),上调程度均为1.20 倍。

表2 模型组小鼠结肠中表达显著的蛋白Table 2 Top ten proteins signif i cantly differentially expressed in colon tissues of model mice

图3 各组结肠基因表达韦恩图及热图Fig. 3 Venn map and heat map showing gene expression in colon tissues from different groups
新琼四糖组中,11 种显著变化的锌指蛋白涉及肿瘤增殖、神经传递、T细胞免疫等多种功能,其中有5 种,即Zmynd12、Zfp521、Zmynd8、Zfr、Zbtb7c锌指蛋白与肿瘤形成相关。模型组中,前3 种锌指蛋白显著过表达,上调程度分别为1.23、1.20 倍和1.20 倍。对于这些在模型组中表达显著增加的肿瘤正相关锌指蛋白,新琼四糖和低聚果糖都表现出抑制或缓解增加的作用,提示它们可能具有抵抗肿瘤发生的功效,值得进一步研究。
2.3 转录组分析技术预测低聚糖功能特性的可行性分析
如图3b所示,低聚果糖的加入抑制了肿瘤正相关锌指蛋白的转录表达。锌指蛋白Zfp345、Zfp13、Zfp503、Zfp521、Zmat2、Zbtb38、Zfr、Zmynd8表达量均显著降低(p<0.05),且相较于模型组,表达量下降不低于10%(图4和图3b)。Zfp521是编码一种含有N端转录抑制基序的转录因子,在软骨细胞中间接靶向Cyclin D1,推动细胞周期由G1期进入到S期。锌指蛋白Zfr[17],作为一种哺乳动物体内高保留的RNA-binding转录因子,也可作用于细胞周期蛋白Cyclin A、Cyclin D1促进细胞增殖、肿瘤生长。
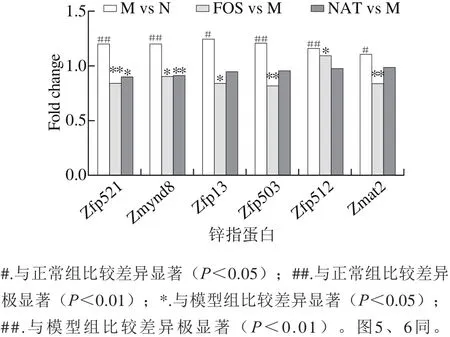
图 4 低聚果糖和新琼四糖对肿瘤增殖相关的锌指蛋白表达的影响Fig. 4 Effect of FOS and NAT on the expression of zinc fi nger proteins related to tumor proliferation
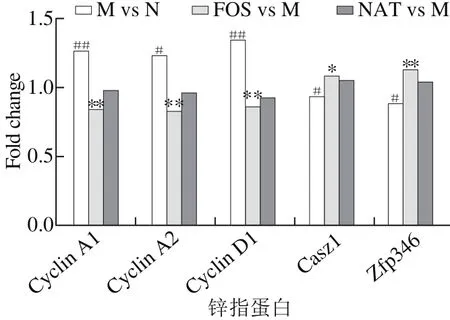
图5 低聚果糖和新琼四糖对抑癌因子及周期蛋白表达的调控作用Fig. 5 Effect of FOS and NAT on the expression of tumor suppressors and cyclin proteins
如图5所示,模型组Cyclin A1、Cyclin A2、Cyclin D1表达显著上调(fold change分别为1.25、1.22、1.33,p<0.05,p<0.01),在低聚果糖组其表达均与模型组相比极显著降低(fold change分别为 0.84、0.82、0.86,p<0.01)。该结果提示,低聚果糖可能通过影响锌指蛋白,间接抑制细胞周期蛋白表达,延缓细胞进程,从而降低肿瘤发生风险。此外,低聚果糖对抑癌因子有促表达作用。Casz1和Zfp346是重要的抑癌锌指蛋白转录因子。在成神经细胞瘤中,Casz1通过抑制肿瘤细胞生长和转移,激活其分化成正常功能细胞,而减少细胞的数量,阻止其扩散[20]。模型组中Casz1的表达显著降低(p<0.05),显著上调Casz1蛋白的表达(P=4.99×10-3)。Zfp346,又称为JAZ[21],通过介导细胞周期阻滞和凋亡来抑制癌细胞增长。细胞周期蛋白是与真核细胞的细胞周期呈同步周期性浓度升降的蛋白质,包括S期周期蛋白Cyclin A,G1期周期蛋白Cyclin C、Cyclin D、Cyclin E和M期周期蛋白Cyclin B。Yang Mingli等[22]发现JAZ抑制了A型周期蛋白,但对E型周期蛋白和D型周期蛋白没有显著影响。Dallal等[10]则发现Zfp521敲除后D型周期蛋白表达减少,肿瘤症状减轻。低聚果糖降低了Zfp346、Cyclin A、Cyclin D(图5)周期蛋白的表达,但对Cyclin E型周期蛋白(数据未显示)没有显著影响。
2.4 新琼四糖对锌指蛋白基因表达的影响
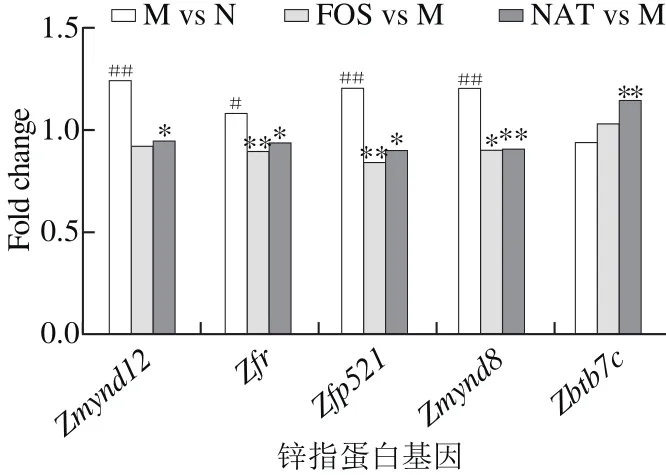
图6 低聚果糖和新琼四糖对锌指蛋白基因表达的影响Fig. 6 Effect of FOS and NAT on the expression of zinc fi nger proteins
由图6可知,与低聚果糖组相似,锌指蛋白基因Zfp521、Zmynd8、Zfr在新琼四糖组中与模型组相比也呈现显著下调趋势(fold change分别为0.88、0.89、0.92,p<0.05,p<0.01)。Zmynd12为转录因子,在细胞异化生成肿瘤时过表达[16],模型组基因表达量为正常组的1.23 倍(p<0.01)。新琼四糖组与模型组相比其表达显著降低(fold change为0.93,p<0.05 )。除此之外,对于其他肿瘤正相关锌指蛋白均有下调的影响趋势(图4),同时增加了抑癌因子的表达。抑癌因子Casz1和Zfp346的表达上调,细胞周期蛋白Cyclin D1表达明显被抑制(fold change为0.91),对Cyclin A1、Cyclin A2也起到抑制效果(图5)。
3 讨 论
本实验采用小鼠力竭运动模拟过度疲劳损伤,运用转录组学技术提取基因信息。通过对基因表达变化信息的分析,从获得的众多数据中,锁定锌指蛋白,发现多种结肠组织肿瘤标志物锌指蛋白表达异常。锌指蛋白作为转录因子,可以激活相关靶基因的表达,执行相应功能。模型组中促进肿瘤发生或肿瘤细胞中表达显著增加的一类锌指蛋白表达的一致性增加,提示组织内细胞增殖活动加强,肿瘤发生风险性增加。低聚果糖是功能丰富的低聚糖,已有文献证明其有减肥、抗炎等众多功效[3],本实验中,以低聚果糖作为样本,进行转录组学功能预测分析方法的建立。转录组结果表明,低聚果糖通过抑制肿瘤增殖锌指蛋白Zfp345、Zfp13、Zfp503、Zfp521、Zmat2、Zbtb38、Zfr、Zmynd8的表达,激活抑癌因子基因Casz1和Zfp346表达,调控细胞周期蛋白和细胞分化进程,而减少细胞数量,延缓肿瘤增殖趋向,展现了其对肿瘤的抵抗潜力。而此前有文献证明其确有抗肿瘤、抗癌功效[30-32]。这提示转录组学方法可用于预测活性物质的功能,低聚果糖功能预测结果和文献[30-32]成果相吻合便是很好的佐证。
新琼四糖作为一种新型益生元,其功能尚未完全阐明,用转录组学分析技术对其进行功能性研究发现其对显著增加的肿瘤正相关锌指蛋白Zfp521、Zmynd8和Zfr等有明显的抑制作用,并且同样促进了抑癌因子Casz1、Zfp346表达量的增加,降低肿瘤发生风险性,起到有效预防保护作用。为确定此功效及作用机制,仍需要进一步的实验研究。此外,新琼四糖也引起炎症等锌指蛋白表达的改变,提示其可能具有抗炎功效。
综上所述,本研究尝试建立转录组技术辅助功能成分功效预测新方法,为功能食品研究提供了技术参考。采用此方法对新琼四糖进行功能预测,发现其对过度疲劳引发的肠道损伤具有保护作用,预防肿瘤的发生,挖掘新琼四糖的潜在价值,为未来的研究提供方向。
[1] 郭婷婷. 过度疲劳状态下连续负重游泳大鼠心肌Bax、Bcl-2、LDH-2变化规律的研究[D]. 成都: 成都体育学院, 2015: 9-16.
[2] 陈梅丽. 转录组学研究人肿瘤细胞的表达调控机制和大熊猫基因组重注释[D]. 北京: 中国科学院北京基因组研究所, 2013: 15-25.
[3] 陈臣. 植物乳杆菌ST-Ⅲ全基因组序列分析及其对低聚果糖代谢通路的解析[D]. 无锡: 江南大学, 2014: 16-19.
[4] 胡斌. 新琼寡糖的益生元效应研究[D]. 青岛: 中国海洋大学, 2006:1-15. DOI:10.7666/d.y989172.
[5] 刘美英, 梅建凤, 易喻, 等. 琼胶寡糖生物活性的研究进展[J]. 药物生物技术, 2008, 15(6): 493-496. DOI:10.3969/j.issn.1005-8915.2008.06.019.
[6] 李荣平, 李伟毅. 锌指蛋白在免疫学研究中的进展[J]. 免疫学杂志,2009, 25(3): 357-360. DOI:10.13431/j.cnki.immunol.j.20090096.
[7] LIU N, MAO X, DU Z, et al. Cloning and characterisation of a novel neoagarotetraose-forming-β-agarase, AgWH50A from Agarivorans gilvus WH0801[J]. Carbohydrate Research, 2014, 388: 147-151.DOI:10.1016/j.carres.2014.02.019.
[8] LAHAYE M, YAPHE W, VIET M T P, et al.13C-NMR spectroscopic investigation of methylated and charged agarose oligosaccharides and polysaccharides[J]. Carbohydrate Research, 1989, 190(2): 249-265.DOI:10.1016/0008-6215(89)84129-1.
[9] SUN Z, CHEN Y, DU J, et al. Elevated CO2improves lipid accumulation by increasing carbon metabolism in Chlorella sorokiniana[J]. Plant Biotechnology Journal, 2015, 14(2): 557-566.DOI:10.1111/pbi.12398.
[10] DALLAL S A, WOLTON K, HENTGES K E. Zfp521, promotes B-cell viability and cyclinD1, gene expression in a B cell culture system[J]. Leukemia Research, 2016, 46: 10-17. DOI:10.1016/j.leukres.2016.03.013.
[11] KUROYANAGI J, SHIMADA Y, ZHANG B, et al. Zinc finger MYND-type containing 8 promotes tumour angiogenesis via induction of vascular endothelial growth factor-A expression[J]. FEBS Letters,2015, 589(7): 870-870. DOI:10.1016/j.febslet.2014.07.033.
[12] LIN Xiao, HARRELL J C, PEROU C M, et al. Identification of a stable molecular signature in mammary tumor endothelial cells that persists in vitro[J]. Angiogenesis, 2014, 17(3): 1-8. DOI:10.1007/s10456-013-9409-y.
[13] 孟莹莹, 许兴智, 廖蓟. 转录因子ZBTB家族与肿瘤[J]. 生命科学,2015, 27(4): 477-485. DOI:10.13376/j.cbls/2015062.
[14] SUN M P, THORNTON A, VU L P, et al. IKZF2, a novel target of MSI2 RNA-binding protein plays an oncogenic role in myeloid leukemia[J]. Blood, 2015, 126(23): 440.
[15] TAMURA K, FURIHATA M, TSUNODA T, et al. Molecular features of hormone-refractory prostate cancer cells by genome-wide gene expression profiles[J]. Cancer Research, 2007, 67(11): 5117-5125.DOI:10.1158/0008-5472.CAN-06-4040.
[16] CHAUHAN L, JENKINS G D, BHISE N, et al. Genome-wide association analysis identif i ed splicing single nucleotide polymorphism in CFLAR predictive of triptolide chemo-sensitivity[J]. BMC Genomics, 2015, 16(1): 1-18. DOI:10.1186/s12864-015-1614-1.
[17] ZHAO X L, CHEN M, TAN S. Knockdown of ZFR suppresses cell proliferation and invasion of human pancreatic cancer[J]. Biological Research, 2016, 49: 26. DOI:10.1186/s40659-016-0086-3.
[18] LEE D, WALSH M J, AGUILO F, et al. ZNF217/ZFP217 meets chromatin and RNA[J]. Trends in Biochemical Sciences, 2016, 41(12):986. DOI:10.1016/j.tibs.2016.07.013.
[19] CHUDNOVSKY Y, KIM D, ZHENG S Y, et al. ZFHX4 interacts with the NuRD core member CHD4 and regulates the glioblastoma tumorinitiating cell state[J]. Cell Reports, 2014, 6(2): 313-324. DOI:10.1016/j.celrep.2013.12.032.
[20] LIU Z, YANG X, LI Z, et al. CASZ1, a candidate tumor-suppressor gene, suppresses neuroblastoma tumor growth through reprogramming gene expression[J]. Cell Death and Differentiation, 2011, 18(7): 1174-1183. DOI:10.1038/cdd.2010.187.
[21] YANG M, WU S, SU X, et al. JAZ mediates G1 cell-cycle arrest and apoptosis by positively regulating p53 transcriptional activity[J]. Blood, 2006, 108(13): 4136-4145. DOI:10.1182/blood-2006-06-029645.
[22] YANG Mingli, WU Song, JIA Jinghua, et al. JAZ mediates G1 cell cycle arrest by interacting with and inhibiting E2F1[J]. Cell Cycle,2011, 10(14): 2390-2399. DOI:10.4161/cc.10.14.16587.
[23] 刘悦芳. 原发性肝癌发生、发展相关基因的研究[D]. 南京: 南京医科大学, 2008: 22-128. DOI:10.7666/d.y1331518.
[24] YESTEVELASCO M, MAO X, GROSE R, et al. Identification of ZDHHC14 as a novel human tumour suppressor gene[J]. The Journal of Pathology, 2014, 232(5): 566-577. DOI:10.1002/path.4327.
[25] WONG J C, GOKGOZ N, ALON N, et al. Cloning and mutation analysis of ZFP276 as a candidate tumor suppressor in breast cancer[J].Journal of Human Genetics, 2003, 48(12): 668-671. DOI:10.1007/s10038-003-0088-1.
[26] 成红霞. ZBTB蛋白家族成员-ZBTB9的生物学功能初探[D]. 苏州:苏州大学, 2012: 1-7. DOI:10.7666/d.y2134070.
[27] TAN L P, SEINEN E, DUNS G, et al. A high throughput experimental approach to identify miRNA targets in human cells[J]. Nucleic Acids Research, 2009, 37(20): 137. DOI:10.1093/nar/gkp715.
[28] YANG L, ZHANG L, WU Q, et al. Unbiased screening for transcriptional targets of ZKSCAN3 identifies integrin β4 and vascular endothelial growth factor as downstream targets[J]. Journal of Biological Chemistry,2008, 283(50): 35295-35304. DOI:10.1074/jbc.M806965200.
[29] CHENG W S, TAO H, HU E P, et al. Both genes and lncRNAs can be used as biomarkers of prostate cancer by using high throughput sequencing data[J]. European Review for Medical and Pharmacological Sciences, 2014, 18(22): 3504-3510.
[30] HUXLEY R R, WOODWARD M, CLIFTON P. The epidemiologic evidence and potential biological mechanisms for a protective effect of dietary fi ber on the risk of colorectal cancer[J]. Current Nutrition Reports, 2013, 2(1): 63-70. DOI:10.1007/s13668-012-0030-2.
[31] BRUNO-BARCENA J M, AZCARATE-PERIL M A. Galactooligosaccharides and colorectal cancer: feeding our intestinal probiome[J]. Journal of Functional Foods, 2015, 12(12): 92-108.DOI:10.1016/j.jff.2014.10.029.
[32] PIERRE F, PERRIN P, CHAMP M, et al. Short-chain fructo-oligosaccharides reduce the occurrence of colon tumors and develop gut-associated lymphoid tissue in min mice[J]. Cancer Research, 1997, 57(2): 225-228.
Protective Effect of Neoagarotetraose against Over-Exhaustion-Induced Gut Injury in Mice Revealed by RNA-Seq
SONG Jia, ZHANG Na, LI Jing, MAO Xiangzhao, XUE Changhu, TANG Qingjuan*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Purpose: To explore the protective effect of neoagarotetraose against over-exhaustion-induced gut injury by RNA-seq analysis. Methods: Male BALB/c mice were randomly divided into normal control group,over-exhaustion model group (both the groups were gavaged with saline), over-exhaustion plus fructooligosaccharide (FOS)group (positive control), and over-exhaustion plus neoagarotetraose (NAT) group. After sixteen days of administration,colon tissues from the mice in each group were collected, and then RNA was extracted for RNA-seq analysis. Results:Over-exhaustion resulted in signif i cantly increased expression of zinc fi nger proteins Zfp521 and Zmynd8, associated with inflammation and tumor proliferation (P < 0.01), and significantly reduced expression of tumor suppressors Casz1 and Zfp346 (P < 0.05). NAT could relieve over-exhaustion-induced gut injury by downregulating the expression of zinc fi nger proteins related to tumor proliferation and upregulating the expression of tumor-suppressing zinc fi nger proteins. Conclusion:NAT can protect against over-exhaustion-induced gut injury in mice and prevent the occurrence of tumors.
neoagarotetraose; over-exhaustion; zinc fi nger protein; RNA-seq; fructooligosaccharide
10.7506/spkx1002-6630-201723022
TS201.4
A
1002-6630(2017)23-0135-06
宋佳, 张娜, 李晶, 等. 基于转录组学技术探究新琼四糖对过度疲劳性肠道损伤的保护作用[J]. 食品科学, 2017, 38(23):135-140.
10.7506/spkx1002-6630-201723022. http://www.spkx.net.cn
SONG Jia, ZHANG Na, LI Jing, et al. Protective effect of neoagarotetraose against over-exhaustion-induced gut injury in mice revealed by RNA-seq[J]. Food Science, 2017, 38(23): 135-140. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723022. http://www.spkx.net.cn
2016-10-03
国家自然科学基金面上项目(31271923);国家自然科学基金联合基金项目(U1406402)
宋佳(1992—),女,硕士研究生,研究方向为食品营养学。E-mail:nianhua_letter@163.com
*通信作者:唐庆娟(1971—),女,教授,博士,研究方向为食品营养学。E-mail:tangqingjuan@ouc.edu.cn
