脉冲强光对枯草芽孢杆菌NG-2灭活机理
2017-12-11徐雯钗袁勇军张瑞雪赵思敏陈秋平
管 峰,徐雯钗,袁勇军,张瑞雪,赵思敏,陈秋平
(浙江万里学院生物与环境学院,浙江 宁波 315100)
脉冲强光对枯草芽孢杆菌NG-2灭活机理
管 峰,徐雯钗,袁勇军*,张瑞雪,赵思敏,陈秋平
(浙江万里学院生物与环境学院,浙江 宁波 315100)
采用脉冲强光对枯草芽孢杆菌NG-2及芽孢进行灭活并研究其机理。在脉冲强光辐照枯草芽孢杆菌NG-2菌体及其芽孢后,利用扫描电子显微镜和透射电子显微镜观察形态特征变化,利用紫外分光光度法测定细胞内物质含量,利用荧光光谱法检测细胞内Ca2+浓度和非特异性酯酶活力。结果表明,辐照距离为5 cm,闪照频率为5次/s,辐照15 s时,脉冲强光对NG-2菌体及其芽孢灭活率超过50%;辐照40 s时,脉冲强光对NG-2菌体及其芽孢灭活率超过99.98%。辐照枯草芽孢杆菌及芽孢后菌体结构损伤,芽孢壁破裂,细胞内核酸、蛋白质、Ca2+和2,6-吡啶二羧酸含量显著减少,非特异性酯酶活力降低,研究结果为脉冲强光对枯草芽孢杆菌及芽孢灭活机理提供理论依据。
脉冲强光;枯草芽孢杆菌;芽孢;灭活机理
细菌灭活是食品加工过程的重要工序,食品工业中采用的细菌灭活方法主要有加热灭活和非加热灭活两大类。目前,在我国使用较多的为加热灭活,传统的低温灭活不能将食品中的微生物(特别是耐热的芽孢杆菌)全部杀灭,而高温灭活又会破坏食品中的营养成分和食品的天然特性,并且往往伴随着大量能量的消耗[1]。为更大限度保持食品的固有营养成分、质构、色泽和新鲜程度,冷灭活技术便应运而生,如超高压、脉冲强光、电离辐射、紫外线、微波、超声波、磁场等[2]。近年来,脉冲强光作为一种新型的细菌灭活技术,广泛应用于食品的解冻、干燥、烘焙以及灭酶等[3]。芽孢杆菌是一种难以被灭活的微生物种类,目前对芽孢杆菌的灭活方法研究除了传统的热灭活外,还有臭氧[4]、大气压等离子体射流[5]和脉冲磁场[6]等方法。鉴于传统灭菌处理在食品加工过程中的局限性,脉冲强光是食品加工中方便简单、成本较为低廉的灭菌方法。
脉冲强光技术是一种能在极短时间内放射强烈的近似太阳光光谱(200~1 100 nm),但强度强于太阳光,能杀灭固体表面、气体和透明液体中微生物的新型冷灭活技术[7]。此技术具有能耗少、安全无残留、灭活效率高等优点,1996年已被美国食品与药品监督管理局允许使用于食品加工上(剂量小于12 J/cm2)[8]。该技术可有效地保持食品质量,降低食品中微生物的数量从而延长食品的保质期。目前有关其对微生物致死效果的研究较多,对细菌[9]、酵母菌[10]、霉菌[11]和病毒[12]灭活效果上国内外均有资料报道,而对灭活机理的报道较少。本研究选择枯草芽孢杆菌进行实验,利用扫描电子显微镜、透射电子显微镜、紫外扫描、荧光扫描等方法,通过研究细胞膜损伤及非特异性酯酶活力和2,6-吡啶二羧酸(diethyl 2,6-pyridinedicarboxylate,DPA)含量,初步探讨脉冲强光对枯草芽孢杆菌NG-2及芽孢的灭活作用,为其灭活机理提供理论依据。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌NG-2由浙江万里学院生物与环境学院食品微生物实验室从商业腐败年糕中分离、鉴定并保存[13]。
营养肉汤培养基 杭州微生物试剂有限公司;Ca2+荧光探针(Fluo-3/AM) 上海碧云天生物技术有限公司;二乙酸荧光素(fluorescein diacetate,FDA)、DPA美国Sigma-Aldrich公司;D-Hanks平衡缓冲液 上海钰博生物科技有限公司;二甲基亚砜、戊二醛、丙酮、抗坏血酸、硫酸亚铁铵、无水乙酸钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
UV-1750紫外分光光度计 日本岛津公司;5804R台式高速冷冻离心机 德国Eppendorf公司;F-380荧光光谱仪 天津港东科技发展股份有限公司;S-3400N扫描电子显微镜、H-7650透射电子显微镜 日本日立公司;ZWZ-Y1-D2脉冲强光设备 宁波中物光电杀菌技术有限公司。
1.3 方法
1.3.1 菌体和芽孢悬液制备
无菌操作条件下,将已活化的菌体加入至营养肉汤培养基中,于37 ℃、120 r/min条件下摇床培养24 h,离心(4 ℃、5 000 r/min、15 min)后取沉淀,用0.85 g/L生理盐水洗2~3 次并重悬浮,制得菌体悬液(1.0×106CFU/mL),备用。将活化的菌体加入至营养肉汤培养基中,于37 ℃、120 r/min条件下摇床培养48 h,离心后取沉淀芽孢染色显微镜检查,芽孢含量达到100%后,用无菌生理盐水制备成芽孢悬液(1.0×106CFU/mL),备用。
1.3.2 脉冲强光辐照处理
脉冲强光设备由抛光不锈钢制成,并配备有一个用金属外壳围绕的处理室,处理室中备有2 盏氙气灯和1 个位于中心的挡板。脉冲强光光源参数:灯管总长400 mm;极距380 mm;直径8 mm;最小设置闪照频率1 次/s;紫外区能量占总能量21.1%,其中UVA占6.2%,UVB占7.8%,UVC占7.1%。距离灯管中心13 cm处的单次脉冲剂量为150 mJ/cm2;紫外线峰值247 nm;辐照度615.0 W/cm2;脉冲宽度234 ms。
将2.0 mL菌体悬液或芽孢悬液移入无菌空培养皿中,立即进行脉冲强光辐照处理(辐照距离5 cm、固定闪照频率5 次/s、单次辐照剂量3.6 J/cm2)。分别研究辐照时间为5、10、15、20、25、30 s和40 s时,其对菌体和芽孢灭活率的影响,以未进行脉冲强光辐照处理组为对照组。实验设3 个平行,以平均值报告结果。
1.3.3 胞内物质泄漏量的测定
采用紫外扫描法进行蛋白质和核酸泄漏量的测定[14],以260 nm和280 nm波长处的吸光度分别表征核酸与蛋白质漏出相对含量,以无菌生理盐水做参比溶液;显微结构采用扫描电子显微镜观察,具体操作参照文献[15]进行,辐照时间为0 s和40 s;超微结构采用透射电子显微镜观察,具体操作参照文献[16]进行,辐照时间为0、10、20 s和40 s;使用荧光光谱仪测定枯草芽孢杆菌细胞内Ca2+浓度和胞内非特异性酯酶活力变化[17];采用分光光度法测定芽孢DPA含量[18]。
1.3.4 灭活率计算
采用平板菌落计数法进行菌落计数[19],按下式计算灭活率。

1.4 数据处理
采用SPSS 21.0软件对数据进行分析。采用SPSS 21.0软件中ANOVA方法对数据进行显著性分析,p<0.05表示有显著性差异。
2 结果与分析
2.1 辐照剂量对枯草芽孢杆菌的灭活效果

图1 辐照时间对枯草芽孢杆菌菌体及芽孢的灭活效果Fig. 1 Effect of fl ash time on B. subtilis cells and spores
从图1可知,脉冲强光对枯草芽孢杆菌菌体及芽孢均有很好的灭活效果,且灭活效果与辐照剂量存在量效关系。当辐照时间为15 s时,脉冲强光对NG-2菌体及其芽孢的灭活率超过50%;当辐照时间为40 s时,菌体细胞和芽孢总数分别减少6.0 lg(CFU/mL)和5.9 lg( CFU/mL),灭活率均超过99.98%。菌体细胞和芽孢初始总数相同,但在相同辐照时间下,芽孢残存量多于菌体细胞,表明芽孢相比于菌体对脉冲强光有更强的抵抗力,这和芽孢具有芽孢外壁、芽孢衣和芽孢皮层等特殊结构有关,也与江天宝[20]、Artíguez[21]等的研究中脉冲强光对细菌菌体杀伤作用强于芽孢的结果基本一致。
2.2 脉冲强光对枯草芽孢杆菌灭活机理研究
2.2.1 脉冲强光对枯草芽孢杆菌及其芽孢内生物大分子溢出物的影响
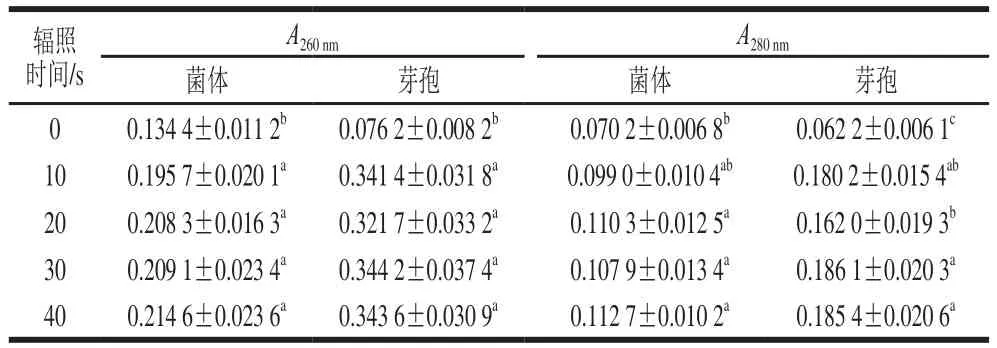
表1 脉冲强光处理后枯草芽孢杆菌及其芽孢内核酸和蛋白质等生物大分子溢出物的吸光度Table 1 Absorbance value of DNA and protein leaked from B. subtilis cells and spores treated by pulsed light
由表1可知,吸光度随辐照时间的延长而增大,说明核酸和蛋白质等胞内物质的外泄量随着辐照时间的延长而增加。相对于对照组,脉冲强光辐照超过10 s即可造成枯草芽孢杆菌细胞内核酸物质显著外泄,而细胞内蛋白质在辐照20 s后才显著外泄(p<0.05);脉冲强光辐照超过10 s可造成枯草芽孢杆菌芽孢内核酸和蛋白质均显著外泄(p<0.05)。
2.2.2 脉冲强光对枯草芽孢杆菌及其芽孢显微结构的影响由图2a、c可知,未经脉冲强光处理的菌体和芽孢形态均一,表面光滑,结构完整。由图2b可知,实验组菌体细胞较对照组出现萎缩,表面褶皱,形状不规则,细胞膜破裂;由图2d可知,实验组芽孢较对照组有凹陷现象,形状不规则,芽孢壁破裂,有的芽孢只有半个或多个壁结构。因此,脉冲强光对枯草芽孢杆菌及芽孢都能产生损伤作用。

图2 不同时间脉冲强光处理对枯草芽孢杆菌及其芽孢显微结构的影响Fig. 2 Effect of pulsed light on microstructure of B. subtilis cells and spores under scanning electron microscope
2.2.3 脉冲强光对枯草芽孢杆菌及其芽孢超微结构的影响

图3 不同时间脉冲强光处理对枯草芽孢杆菌菌体超微结构的影响Fig. 3 Effect of pulsed light on morphological structure of B. subtilis cells under transmission electron microscope
通过透射电子显微镜观察到对照组菌体(图3a)和芽孢(图4a)细胞壁和细胞膜均规则、完整、较光滑,且核质集中,内容物均匀分布。而处理组菌体(图3b~d)与芽孢(图4b~d)细胞壁和细胞膜均变薄、模糊不清,且内容物溶出,细胞内部变得松散,表明脉冲强光对枯草芽孢杆菌结构有一定损伤。
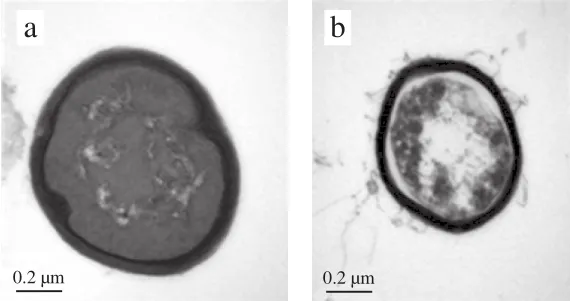
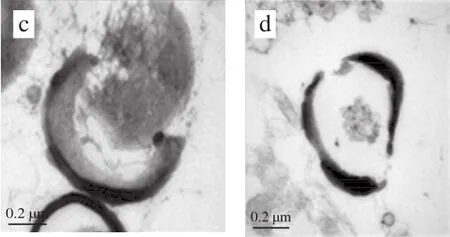
图 4 脉冲强光对枯草芽孢杆菌芽孢的形态影响Fig. 4 Effect of pulsed light on morphological structure of B. subtilis spores under transmission electron microscope
2.2.4 脉冲强光对枯草芽孢杆菌细胞内Ca2+浓度的影响
细胞内Ca2+浓度的变化能影响细胞的生理和生化状态[22],因此,采用荧光染料进行胞内Ca2+浓度和分布检测对于了解细胞生理活动具有重要意义。Fluo-3/AM是一种荧光量子产率很高、性能优良的双波长Ca2+荧光探针[23]。
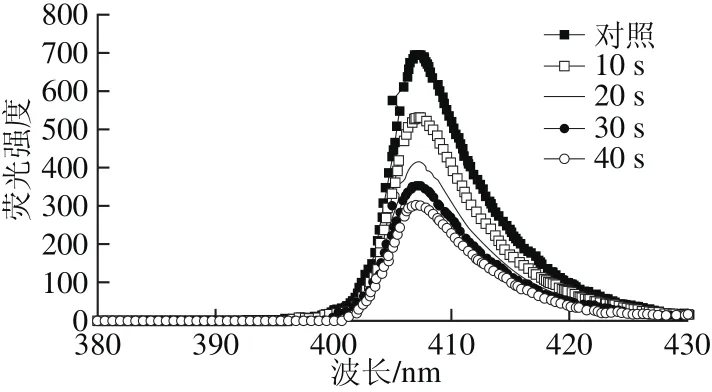
图5 脉冲强光处理后枯草芽孢杆菌胞内Ca2+结合Fluo-3/AM产生荧光强度的变化Fig. 5 Effect of pulsed light on the fl uorescence intensity of Ca2+binding by Fluo-3/AM in B. subtilis cells
由图5可知,脉冲强光改变枯草芽孢杆菌细胞膜通透性,导致细胞内Ca2+向细胞外泄漏,菌体内Fluo-3荧光强度随着脉冲强光辐射时间的延长而降低,说明非特异性酯酶将Fluo-3/AM水解并与胞内的Ca2+结合。结果表明,脉冲强光处理的菌体细胞膜通透性改变,这与脉冲强光对枯草芽孢杆菌及芽孢超微结构造成损伤的结果相一致,与钱静亚[6]的研究结果也一致。
2.2.5 脉冲强光对枯草芽孢杆菌菌体内非特异性酯酶活力的影响
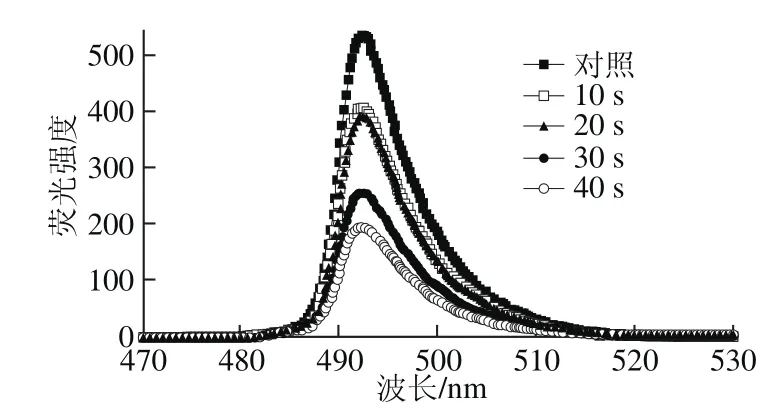
图6 脉冲强光处理后枯草芽孢杆菌胞内非特异性酯酶降解FDA产生荧光强度的变化Fig. 6 Effect of pulsed light on the fl uorescence intensity of FDA degradation by non-specif i c esterase in B. subtilis cells
FDA是荧光素与2 个醋酸根共轭形成的一种不带电荷的脂质性分子,可通过简单扩散进入细胞内。FDA进入细胞后可被细胞内的非特异性酯酶水解,释放出能发黄绿色荧光的荧光素分子。由图6可知,随着脉冲强光辐照时间的延长,非特异性酯酶活力逐渐下降,对进入细胞内的FDA分解能力减弱。综合比较图5、6发现,脉冲强光辐照后枯草芽孢杆菌胞内酯酶仍可以将Fluo-3/AM水解并与胞内的Ca2+结合,产生荧光信号。
2.2.6 辐照时间对DPA质量浓度的影响
硫酸亚铁铵是测定微量DPA的一种很好的显色剂,在pH 4.0~6.0的范围内,能与还原剂抗坏血酸反应,生成一种稳定的黄色复合物,在440 nm波长处有最大吸收峰,且黄色的深浅与DPA质量浓度呈良好的线性关系[24]。
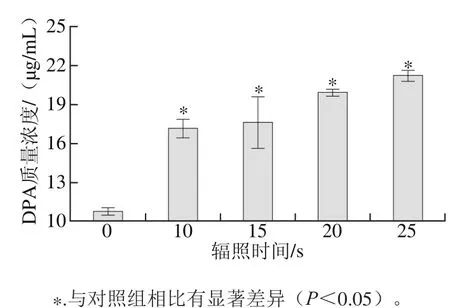
图7 脉冲强光对枯草芽孢杆菌DPA泄漏的影响Fig. 7 Effect of pulsed light on the leakage of DPA in B. subtilis cells
由图7可知,相对于辐照0 s,其他辐照时间对枯草芽孢杆菌芽孢结构造成明显损伤,随辐照时间的延长,DPA外泄量增加。辐照10 s时,外泄DPA的质量浓度是对照组的16.4倍;且在0~25 s内,外泄质DPA的质量浓度随辐照时间的延长而上升。这表明脉冲强光处理能破坏枯草芽孢杆菌芽孢结构,导致通透性屏障破坏从而显著增加芽孢内DPA的泄漏量,这个结果与微热协同超高压处理凝结芽孢杆菌和嗜热脂肪芽孢杆菌芽孢研究结果一致[25]。
3 讨 论
以枯草芽孢杆菌NG-2菌体及其芽孢为研究对象,采用扫描电子显微镜、透射电子显微镜观察和荧光检测等方法研究了脉冲强光对枯草芽孢杆菌NG-2菌体的灭活机理。结果表明,脉冲强光对枯草芽孢杆菌菌体及芽孢灭活效果显著,灭活效果与辐照时间存在时效关系,当辐照15 s时,脉冲强光对NG-2菌体及其芽孢灭活率超过50%;当辐照40 s时,灭活率超过99.98%。这与张佰清[26]、马凤鸣[27]等的研究结果是相一致的。
和传统采用的连续紫外光照灭活机理部分相同,脉冲强光对微生物的灭活机理可以通过光化学效应来解释,该效应主要是使微生物体内的DNA形成嘧啶二聚体,阻碍细胞复制与增殖[28]。在本研究中,通过扫描电子显微镜和透射电子显微镜都观察到,脉冲强光辐照会导致枯草芽孢杆菌及芽孢的结构和内容物发生损伤性变化,丰富了脉冲强光灭活的机理。Takeshita等[29]比较了脉冲强光与紫外处理后的酵母细胞受损情况,发现脉冲强光能破坏酵母细胞膜,从细胞内洗脱蛋白。张佰清等[30]用考马斯亮蓝染色法测定蛋白质漏出量,发现随着脉冲强度的增加,蛋白质漏出量增加。在本研究中,脉冲强光可以使枯草芽孢杆菌菌体和芽孢中核酸及蛋白质外泄到细胞外,并且辐照时间越长,外泄现象越明显。张佰清等[30]还对脉冲强光辐照后的大肠杆菌内两种抗氧化酶超氧化物歧化酶和过氧化氢酶进行活力检测,发现脉冲强光处理后两种酶活力均大幅降低。本研究发现脉冲强光使枯草芽孢杆菌内外源荧光物与Ca2+、DPA和非特异性酯酶反应产生的荧光强度减弱,说明脉冲强光会导致细胞内Ca2+和DPA外泄,也能使菌体非特异性酯酶活力降低,不仅损伤枯草芽孢杆菌细胞壁结构,还影响菌体正常的生理功能。
综上,本研究发现脉冲强光对枯草芽孢杆菌及芽孢有灭活作用,并且随着脉冲强光辐照时间的延长,灭活作用也增强。超显微结构显示脉冲强光辐照枯草芽孢杆菌及芽孢后可对其结构产生损伤作用,紫外光和荧光扫描也进一步说明脉冲强光可使枯草芽孢杆菌内核酸、蛋白质、DPA和Ca2+外泄到细胞外,且细胞内的非特异性酯酶活力随着辐照时间的延长而降低。
[1] GÓMEZ-LÓPEZ V M, RAGAERT P, DEBEVERE J, et al.Pulsed light for food decontamination: a review[J]. Trends in Food Science and Technology, 2007, 18(9): 464-473. DOI:10.1016/j.tifs.2007.03.010.
[2] 夏文水, 钟秋平. 食品冷杀菌技术研究进展[J]. 中国食品卫生杂志,2003, 15(6): 539-544. DOI:10.3969/j.issn.1004-8456.2003.06.022.
[3] CHIPLEY J R. Effects of microwave irradiation on microorganisms[J].Advances in Applied Microbiology, 1980, 26: 129-145. DOI:10.1016/S0065-2164(08)70333-2.
[4] 刘枫, 昌盛, 陈忠林. 臭氧灭活水中枯草芽孢杆菌的动力学[J]. 环境化学, 2016, 35(5): 858-864. DOI:10.7524/j.is sn.0254-6108.2016.05.2015122101.
[5] 沈洁, 程诚, 方世东, 等. 大气压等离子体射流对细菌芽孢灭活机理研究[J]. 真空科学与技术学报, 2013, 33(9): 888-892. DOI:10.3969/j.issn.1672-7126.2013.09.09.
[6] 钱静亚. 脉冲磁场对枯草芽孢杆菌的灭活作用及其机理研究[D]. 镇江: 江苏大学, 2013: 23-25.
[7] 王润. 食品辐照保藏技术对食品品质的影响以及安全性讨论[J]. 现代食品, 2015, 7(13): 56-58. DOI:10.3969/j.issn.1007-3582.2015.13.028.
[8] RAMOS-VILLARROEL A Y, MARTÍN-BELLOSO O, SOLIVAFORTUNY R. Combined effects of malic acid dip and pulsed light treatments on the inactivation of Listeria innocua and Escherichia coli on fresh-cut produce[J]. Food Control, 2015, 52: 112-118.DOI:10.1016/j.foodcont.2014.12.020.
[9] AYOUB J A, BERKOWITZ D, KENYON E M, et al. Continuous microwave sterilization of meat in flexible pouches[J]. Journal of Food Science, 2006, 39(2): 309-313. DOI:10.1111/j.1365-2621.1974.tb02882.x.
[10] TAKESHITA K, SHIBATO J, SAMESHIMA T, et al. Damage of yeast cells induced by pulsed light irradiation[J]. International Journal of Food Microbiology, 2003, 85(1): 151-158. DOI:10.1016/S0168-1605(02)00509-3.
[11] MAFTEI N A, RAMOS-VILLARROEL A Y, NICOLAU A I.Inf l uence of processing parameters on the pulsed-light inactivation of Penicillium expansum in apple juice[J]. Food Control, 2014, 41(2): 27-31. DOI:10.1016/j.foodcont.2013.12.023.
[12] YI J Y, LEE N H, CHUNG M S. Inactivation of bacteria and murine norovirus in untreated groundwater using a pilot-scale continuousflow intense pulsed light (IPL) system[J]. LWT-Food Science and Technology, 2016, 66: 108-113. DOI:10.1016/j.lwt.2015.10.027.
[13] 黄丽金, 朱建宏, 袁勇军. 真空包装年糕腐败菌分离、鉴定及脉冲强光灭活效果初探[J]. 食品科技, 2015, 40(4): 370-374.DOI:10.11726/j.issn.1001-7658.2016.11-1104-04.
[14] PANOZZO A, MANZOCCO L, LIPPE G, et al. Effect of pulsed light on structure and immunoreactivity of gluten[J]. Food Chemistry, 2016,194: 366-372. DOI:10.1016/j.foodchem.2015.08.042.
[15] 肖媛, 刘伟, 汪艳, 等. 生物样品的扫描电镜制样干燥方法[J]. 实验室研究与探索, 2013, 32(5): 45-53. DOI:10.3969/j.issn.1006-7167.2013.05.013.
[16] 曹剑波, 秦利鸿. 枯草芽孢杆菌的透射电镜观察[J]. 现代农业科学,2008, 15(2): 34-35. DOI:10.3969/j.issn.1001-8689.2004.08.002.
[17] 张均田, 李锡明, 石成璋, 等. 用Fura-2/AM测定细胞内游离钙浓度的方法[J]. 中国药学杂志, 1991, 26(11): 655-658. DOI:10.3969/j.issn.1003-4706.2002.02.002.
[18] NAGLER K, SETLOW P, REINEKE K, et al. Involvement of coat proteins in Bacillus subtilis spore germination in high-salinity environments[J]. Applied and Environmental Microbiology, 2015,81(19): 6725-6735. DOI:10.1128/AEM.01817-15.
[19] 卫生部. 食品安全国家标准 食品微生物学检验 菌落总数测定:GB 4789.2—2010[S]. 北京: 中国标准出版社, 2010.
[20] 江天宝. 脉冲强光对生理盐水中微生物杀灭效果的研究[J]. 海峡药学, 2009, 21(7): 97-100. DOI:10.3969/j.issn.1006-3765.2009.07.037.
[21] ARTÍGUEZ M L, DE MARTÍNEZ I M. Inactivation of spores and vegetative cells of Bacillus subtilis and Geobacillus stearothermophilus by pulsed light[J]. Innovative Food Science and Emerging Technologies, 2015, 28: 52-58. DOI:10.1016/j.ifset.2015.01.001.
[22] 刘志洪, 李文化, 沈萍, 等. Fura-2荧光探针研究Ca2+对大肠杆菌细胞的跨膜作用[J]. 化学学报, 2004, 62(4): 445-448. DOI:10.3321/j.issn:0567-7351.2004.04.021.
[23] BRUCE A, DENNIS B, ALEXANDER J. 基础细胞生物学—细胞分子生物学入门[M]. 上海: 科学出版社, 2002: 236-241.
[24] 沈萍. 微生物学[M]. 北京: 高等教育出版社, 2000: 51-57.
[25] 高瑀珑, 鞠兴荣, 吴定. 微热协同超高压处理杀灭芽孢杆菌芽孢效果的研究[J]. 食品科学, 2007, 28(3): 59-63. DOI:10.3321/j.issn:1002-6630.2007.03.009.
[26] 张佰清, 姜树才, 刘佳. 脉冲强光处理对金黄色葡萄球菌杀菌效果的研究[J]. 食品科技, 2009, 35(1): 253-255. DOI:10.13684/j.cnki.spkj.2009.01.040.
[27] 马凤鸣, 张佰清, 朱丽霞. 脉冲强光对大肠杆菌的杀菌实验研究[J]. 食品工业科技, 2008, 29(1): 74-76. DOI:10.13386/j.issn1002-0306.2008.01.044.
[28] 王镜岩. 生物化学[M]. 3版. 北京: 高等教育出版社, 2002: 106-108.
[29] TAKESHITA K, SHIBATO J, SAMESHIMA T, et al. Damage of yeast cells induced by pulsed light irradiation[J]. International Journal of Food Microbiology, 2003, 85(1): 151-158. DOI:10.1016/S0168-1605(02)00509-3.
[30] 张佰清, 郭佳佳. 脉冲强光对大肠杆菌细胞膜损伤及胞内酶活性的影响[J]. 食品与机械, 2010, 26(5): 62-64; 83. DOI:10.3969/j.issn.1003-5788.2010.05.017.
Inactivation and Mechanism of Bacillus subtilis NG-2 and Its Spores by Pulsed Light
GUAN Feng, XU Wenchai, YUAN Yongjun*, ZHANG Ruixue, ZHAO Simin, CHEN Qiuping
(College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China)
Pulsed light was used for the inactivation of Bacillus subtilis NG-2 and its spores. Morphological characteristics of the irradiated cells and spores were explored by scanning electron microscope and transmission electron microscope,the leakage of intracellular contents was determined by ultraviolet spectrophotometry, and intracellular calcium ion concentration and nonspecif i c esterase activity were investigated by fl uorescence spectroscopy. The results showed that the optimal pulsed light parameters were determined as 5 cm and 5 cycles/s for distance and fl ash frequency, respectively. Under the optimized conditions, the total number of bacterial colonies was killed by more than 50% and 99.98% at 15 and 40 s of irradiation time, respectively. The structures of the cell and spore wall were damaged, and intercellular nucleic acid, proteins,diethyl 2,6-pyridinedicarboxylate, Ca2+and non-specif i c esterase activity were decreased after irradiation. The fi ndings may provide a theoretical basis for the industrial application of pulsed light.
pulsed light; Bacillus subtilis; spore; inactivation mechanism
10.7506/spkx1002-6630-201723012
TS201.3
A
1002-6630(2017)23-0070-05引文格式:
管峰, 徐雯钗, 袁勇军, 等. 脉冲强光对枯草芽孢杆菌NG-2灭活机理[J]. 食品科学, 2017, 38(23): 70-74.
10.7506/spkx1002-6630-201723012. http://www.spkx.net.cn
GUAN Feng, XU Wenchai, YUAN Yongjun, et al. Inactivation and mechanism of Bacillus subtilis NG-2 and its spores by pulsed light[J]. Food Science, 2017, 38(23): 70-74. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723012. http://www.spkx.net.cn
2017-03-14
浙江省重中之重学科“生物工程”学生创新项目(CX2016012);宁波市高校院所研发投入补助项目(2011B22012);宁波市江北区农业项目(2012B04)
管峰(1985—),男,实验师,硕士,研究方向为食品质量安全控制。E-mail:guanfengxy@163.com
*通信作者:袁勇军(1976—),男,副教授,博士,研究方向为食品微生物与食品质量安全控制。
E-mail:yuan2007019@aliyun.com
