复合功能菌群的构建及其对铅锌胁迫下蓖麻种子萌发和铅锌积累的影响
2017-12-11李雁峰冯冲凌李科林彭天翊何淑娇
李雁峰 ,冯冲凌 ,李科林 ,彭天翊 ,何淑娇 ,张 欢 ,周 韬
(中南林业科技大学 a. 环境科学与工程学院;b. 生命科学与技术学院,湖南 长沙 410004)
复合功能菌群的构建及其对铅锌胁迫下蓖麻种子萌发和铅锌积累的影响
李雁峰a,冯冲凌a,李科林a,彭天翊a,何淑娇a,张 欢a,周 韬b
(中南林业科技大学 a. 环境科学与工程学院;b. 生命科学与技术学院,湖南 长沙 410004)
为了研究复合菌群对铅锌胁迫下蓖麻种子萌发的影响,以期为下一步微生物-蓖麻联合修复盆栽实验提供功能菌群和理论基础,从课题组内经菌肥改良后的植物根际土壤中筛选出根际促生菌,与课题组已有的菌株进行平板拮抗实验,优选测序并构建复合菌群。沙培实验考察复合菌群对铅锌胁迫下种子萌发的影响,收获后分别测定其萌发生长指标、扫描其根系形态、测定重金属富集量,并对其结果进行分析。筛选出了具有溶磷能力的真菌L14为尖孢镰刀菌Fusarium oxysporum,且与实验室两株耐性菌HA、J3构建的复合菌群相互无拮抗。该复合菌群接种到基质后,能在高浓度重金属胁迫下有效促进蓖麻种子萌发及幼苗生长,同时促进其根系对重金属的富集。其中,对Pb的累积量最大可提升38.6%,对Zn的累积量最大可提升25.2%。分析结果表明: 该复合菌群在铅锌胁迫下不仅能够促进蓖麻种子萌发及幼苗生长,还可以显著提高幼苗根系对重金属的吸收累积。
铅锌;复合菌群;蓖麻;种子萌发;富集
植物修复作为生物修复的手段,兼具了高效经济无污染等优点,在重金属污染治理实践中被广为应用[1-3]。然而,随着修复技术的发展,单一的植物修复已经不能满足人们的需求,研究人员通过引入根际微生物进行联合修复,大大提高了植物修复的效果。陈生涛等[4]通过对植物促生细菌Rhizobiumsp. W33协助不同植物吸收铜的研究,发现根瘤菌W33-黑麦草联合体系能够显著提升植物对重金属Cu的吸收,该促生菌能够在促使植物根部和地上部干重增加46.7% 和27.9%的同时,还使其Cu累积量分别增加25.5%和70.1%。Hazrat Ali[5]等通过总结得出,植物促生菌可以通过铁载体、溶磷作用及促进ACC脱氨酶合成来改善植物生长,增加生物量,从而辅助植物进行重金属污染环境修复。尽管有大量研究表明,微生物-植物联合修复体系可以有效提高植物修复的效果,但是,这些研究大都集中在单一菌株对植物的促进作用方面,关于复合功能菌群对植物修复的促进作用的研究较少见。
由多种微生物在一定环境下共生而成的复合功能菌群,往往聚集了各部分微生物的特征,对于一些结构非常复杂的污染物,其修复效果远高于单一微生物,从而在污染环境修复中显示出巨大的潜力[6]。Takashi Hirooka[7]等利用复合自养菌群对2,4-二硝基酚(2,4-DNP)进行降解,同时实现了对2,4-DNP与其二次污染物2-氨基-4-硝基苯酚(2-ANP)的完全去除,达到了理想的效果;Prakash K. Singh[8]等利用复合细菌群从煤中去除有害的微量金属,结果表明,该复合菌群去除了多达80%的Ni、Zn、Cd、Cu和Cr以及接近45%的Pb。这一系列的研究都说明,混合菌群能够高效全面的实现对污染环境的修复。
油料植物蓖麻Ricinus communistL.有着良好的适应性、重金属耐性及高产油率,常被应用在重金属污染土壤修复中[9,10]。然而,利用蓖麻进行修复时,高浓度的重金属离子会破坏植物的正常代谢,限制种子的萌发,从而对其生长生存和修复效果造成严重影响[11]。针对以上情况,本文以实现蓖麻种子在铅锌胁迫下高效萌发为目的,以蓖麻为供试植物,在课题组前期研究的基础上,将从菌肥改良后的根际土壤中筛选出的根际促生菌与实验室保藏的两株铅锌耐性菌株HA、J3混合[12-13];通过单因素实验,研究微生物菌群对重金属胁迫下蓖麻种子萌发的影响,考察接种复合菌群对蓖麻生物量、重金属富集及根系生长等情况的影响,探讨其对蓖麻种子萌发及幼苗生长的作用,以期为后续的大规模盆栽试验提供高效复合菌群及理论基础。
1 材料与方法
1.1 功能菌株来源
耐铅锌功能菌株来自本课题组由铅锌矿渣土与尾矿渣先锋植物黄精根际筛选获得的耐性菌株米曲霉Aspergillus oryzae-HA,虫生轮殖孢Verticillium insectorum-J3[12,13]。
植物根际促生菌筛选自本课题组内经过有机菌肥改良后长势良好的辣椒、向日葵根际土壤[14]。
1.2 培养基及试剂
牛肉膏蛋白胨培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,pH 7.4~7.6,去离子水1 000 mL。
孟加拉红培养基(g/L):蛋白胨5,葡萄糖 10,KH2PO41,MgSO4·7H2O 0.5, 孟 加 拉 红0.033,氯霉素0.1,去离子水1 000 mL。
无机磷培养基(NBRIP)参照文献[15]配置,改进CAS检测培养基参照文献[16]配置。
固体培养基另加15~20 g/L的琼脂。
Salkowski’s 显色剂:150 mL 浓硫酸溶于250 mL去离子水中,加入7.5 mL 0.5 mol/L的FeCl3·6H2O 溶液。
1.3 根际促生菌的筛选与促生能力测定
取辣椒、向日葵根际新鲜土样各10 g分别装于有100 mL无菌水的三角瓶振荡,制成土壤稀释液,取稀释液0.1 mL分别涂布于孟加拉红、牛肉膏蛋白胨培养基,28 ℃培养3 d后,挑选单菌落,按照真菌、细菌分别接种于孟加拉红培养基、牛肉膏蛋白胨培养基上继续培养。最后选取生长速度相对较快、菌落特征典型的真菌、细菌菌落进一步纯化。
1.3.1 产吲哚乙酸(IAA)能力测定
将分离纯化后的菌株接种于含100 mg/L色氨酸的牛肉膏蛋白胨培养基中,28 ℃摇床培养2 d。离心后取上清液1 mL与2 mL Sackowski’s显色剂充分混合,以加入1 mL(50 mg/L)的IAA的标准液作为阳性对照。于室温、避光条件下放置30 min后观察,颜色变红者表示能够产IAA。
1.3.2 溶磷能力测定
取活化后的各菌株菌悬液1 mL分别接入100 mL NBRIP培养基中,未接作为空白对照,于28 ℃摇床培养3 d,过滤后离心,取滤液用钼蓝法测上清液磷含量。
1.3.3 产铁载体能力测定
将待测菌株接种到牛肉膏蛋白胨固体培养基中培养3 d,待单菌落长出后,将灭菌后的改进CAS检测培养基冷却至60 ℃左右时,按每个平板10 mL倒入牛肉蛋白胨培养基中,放置1 h观察每个平板的颜色变化,并记录结果。根据菌落周围晕圈的大小,定性检测菌株分泌铁载体能力。
1.4 菌株间拮抗实验
在牛肉膏蛋白胨平板上,将挑选出的根际促生菌株与课题组已保存的2株菌进行相互对峙培养试验。用某一菌株通过平板中心划线接种,在该菌株划线接种的两侧划线接种另一菌株,保证划线接种时两菌株不相互接触。每个平板接种2株菌株,重复3次。置于28 ℃恒温培养箱中培养7 d后,观察菌株在平板上的拮抗作用。
1.5 根际促生菌的分子生物学鉴定
对上一步筛选出的菌株进行分子生物学鉴定,根据真菌分子系统发育谱,设计并合成ITS区通用引物:ITS1/ITS4,利用基因组DNA提取试剂盒提取DNA后,用引物扩增序列;PCR产物经长沙爱科博生物科技有限公司纯化测序;测序结果在http://www.ncbi.nlm.nih.gov进行在线查询分析,与GenBank 数据库中的已有序列进行BLAST 比对分析,利用Clustal 和MEGA软件,构建系统发育树。
1.6 种子萌发实验
以前一步实验为依据构建复合菌群,沙培实验考察其对蓖麻种子萌发的影响。供试种子为取自湖南林科院的湘篦8号,选取经烘干后的洁净河沙过目(Φ<1 mm),向240 mL组培罐中加入75 mL细沙。加入Pb(NO3)2、Zn(NO3)2溶液使其Pb2+、Zn2+浓度分别为0、100、200、400、600 mg/L,补充去离子水至总体积为100 mL并使沙子湿润,灭菌后待用。取制备好的复合菌液,在超净工作台中向基质中接种1 mL菌液,对照为不接菌,各重复6次。选干净饱满的蓖麻种子浸泡在25 ℃温水中催芽24 h,用1% NaClO消毒20 min后无菌水冲洗4~5次,待菌液渗入并搅拌均匀后,向每个组培罐中均匀铺入4粒种子,盖上透气盖后置人工气候箱中进行萌发实验。培养条件为温度(28±2 ℃),光照12 h/d,生长8 d后收获。
1.7 指标测定
测定其种子萌发相关指标(萌发率、根长株高、生物量)以及植物中重金属富集量,对其进行根系扫描并观察组织细胞切片。其中,萌发率、根长株高及生物量的测量方法为:
萌发率(%)=播种后第8天后全部萌发的种子数/供试种子数×100%;利用刻度为1 mm的直尺测定其主根长及株高;剪下的新鲜根系洗净后用WinRHIZO根系分析系统进行扫描分析。
用吸水纸将植物表面水分擦拭后,用天平称量其鲜重。将植株于105 ℃烘箱内杀青30 min,再于70 ℃下烘干至恒重,称取干质量。植物的各部分采用HNO3-HClO4消解法进行消解,用火焰原子吸收光谱仪测定其各部分的重金属富集量[17]。
1.8 数据处理
所有试验数据均采用Origin 8.0作图,使用Excel及SPSS 22.0进行数据处理。利用一般线性模型及多重比较(Duncan)方法对数据进行分析,差异显著水平为0.05。
2 结果与分析
2.1 根际促生菌的筛选及相关指标测定
在牛肉膏蛋白胨培养基及孟加拉红培养基上对菌肥改良后的根际土壤中微生物进行涂布初筛,共筛选出菌株32株。在初筛试验的基础上,选择菌落形态不同、长势良好的7株菌株根据促生性能进行复筛,各项指标如表1所示。其中,L11、L14菌株的溶磷能力相对较高但不产吲哚乙酸与铁载体;X8菌株产吲哚乙酸的能力较强且能够产铁载体,但是在其生长过程中需要消耗掉一定的水溶性磷;L6、L7有一定的产吲哚乙酸能力但溶磷能力相对较低。
微生物产生植物激素类物质如吲哚乙酸,能够促进细胞分裂和伸长以及新器官的分化和形成,从而促进植物的生长发育[18];其产生的铁载体作为三价铁螯合物,不仅可以满足微生物自身对铁离子的需求,同时还可以供给植物作为铁源吸收,从而促进植物生长[19];而溶磷作用,则是微生物通过产酸等机制将被固定的磷释放出来,使难溶态的磷变为可溶态的磷,以便植物吸收[20]。这一系列促生特性及其作用,可以有效缓解重金属等环境因子的胁迫,促进植物生长发育。根据结果,初步确定L6、L7、L11、L14与X8这5株菌进行下一步拮抗试验。

表1 菌株促生能力指标测定情况†Table 1 Ability of strains in promoting plant growth
2.2 菌株间拮抗实验
平板对峙培养结果表明,5株菌株中除了L6、L11与HA之间有一定的拮抗作用之外,其余菌株与J3、HA之间均没有相互抑制作用。根据性能,优选X8、L14两株根际促生菌,且X8、L14之间并无抑制作用,因而可作为复合菌群构建的可选菌株。
构建复合菌群,除了考虑其效果之外,不同菌种之间的相互作用也会对菌群的稳定及效果产生影响。Gaylarde[21]等将十多种真菌混合培养以构建复合菌群,结果发现仅剩下Ulocladium atrum及Penicillium purpurogenum两种真菌;分析表明,在混合培养过程中,这两种菌产生了抗真菌次级代谢产物从而抑制了其他真菌的生长。Knudsen[22]等人的研究则发现,某些真菌菌丝可以作为细菌运输载体,刺激细菌的分裂与生长;Gorkem Akinci[23]等用复合硫杆菌对重金属沉积物进行浸提,由于不同菌种的驯化效率差别以及菌种之间的拮抗作用,使得复合菌群的金属溶解率最终低于单一菌。不同菌株之间的相互作用往往会对菌株生长及其作用造成影响,无拮抗作用是复合菌群构建及功能发挥的重要前提。根据结果显示,本实验中的菌株组合经拮抗实验后并未表现出拮抗作用。
2.3 菌种鉴定
从菌株形态上观察,X8为细菌,L14为真菌。由于耐铅锌菌株均为真菌,因此本实验选取L14作为复配菌株。
对L14进行进一步测序鉴定,将其测序结果在NCBI数据库进行BLAST比对后,选取同源性相近的菌株,采用软件MEGA绘制系统发育树,由系统发育树图1可知,L14与Fusarium oxysporum的进化关系最近。经过BLAST比对,L14与Fusarium oxysporum的基因序列有100%的同源性。综上,可将根际促生真菌L14鉴定为尖孢镰刀菌(F. oxysporum)。
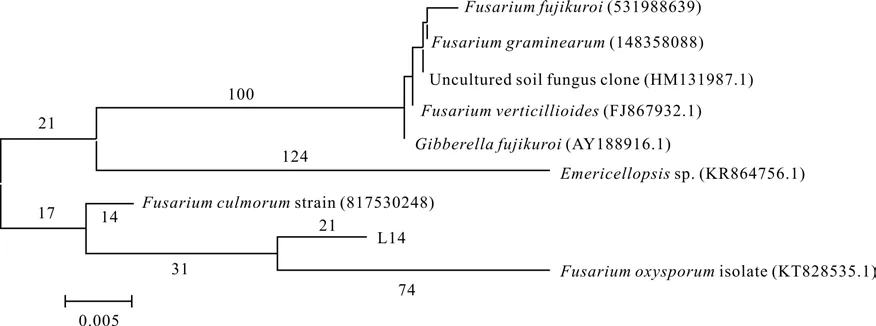
图1 L14菌株与相关菌株的系统发育树Fig.1 Phylogenetic tree of L14 and its relatives
2.4 重金属胁迫下复合菌群蓖麻种子萌发的影响
2.4.1 萌发指标
由图2可知,萌发率随着重金属浓度的升高而逐渐降低,这表明重金属胁迫会严重影响蓖麻种子的萌发;相比于不加菌组,加菌组对萌发率会有一定的提升作用,且这种提升作用会随着浓度的增加而增强。根长方面,除了100 mg/L浓度下加菌组略低于不加菌组,其他浓度下加菌组均优于不加菌组,在0和400 mg/L时差异显著;这表明该菌群可以有效促进根的生长,且在0和400 mg/L浓度下作用最为明显。株高方面,在低浓度(0~200 mg/L)下,加菌组与不加菌组差异不显著;在高浓度下,加菌组与不加菌组差异显著,该差异随着浓度增加而趋于显著;这表明该菌群可以在高浓度铅锌胁迫下有效促进植物生长,且随着浓度增加该促进作用愈趋明显。在鲜重与干质量方面,在100 mg/L这两项指标均达到最高,加菌组的鲜质量、干质量普遍大于不加菌组,且当浓度≥100 mg/L时,加菌组与不加菌组差异显著,该差异随着浓度增加而趋于显著。这表明,该菌群可以在铅锌胁迫下显著提高植物的生物量,且随着浓度增加该促进作用愈趋明显。
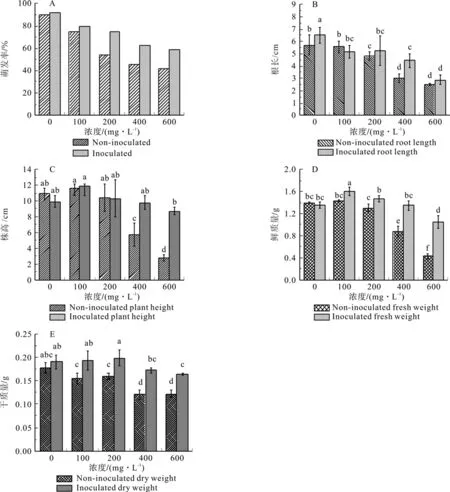
图2 复合菌群对蓖麻种子萌发及幼苗生长的影响Fig.2 Effects of microbial consortium on seed germination and seedling growth of Ricinus communis L.
一般研究认为,Pb积聚在植物周围会对植物产生毒害作用,影响种子萌发和植物生长;Zn虽然是生物体的必需元素,但高浓度的Zn也会对植物产生毒害作用[24]。又有研究表明,在低浓度条件下,部分重金属离子反而会对种子萌发及植物生长产生一定的促进作用[25]。故而在100 mg/L浓度下,蓖麻幼苗的根长、株高及生物量达到最大;超过该浓度后,随着浓度的提高,蓖麻种子萌发的各项指标都急剧下降。实验中,添加了复合菌群的组别相比于没有添加菌群的组别在各项指标上都有一定的提升,但在高浓度重金属胁迫下,这种提升十分明显,远大于低浓度下的提升效果。Radwan Smiar S等[26]指出,植物根际促生菌主要通过两种方式作用于植物,一是通过产生铁载体等物质改变重金属的生物有效性及转移性,促进或抑制植物对重金属的吸收;二是通过产生生长调节因子及酶类等提高植物养分吸收,促进植物生长。Chunyu Jiang[27]等研究还表明,某些耐性菌的接种能在不同程度上提高植物根际土壤水溶态、醋酸铵提取态重金属的活性,增强植物对重金属的吸收,从而促进植物生长。因而,该复合菌群对重金属胁迫,尤其是高浓度重金属胁迫下蓖麻种子萌发显著的促进作用,很有可能是根际促生菌与重金属耐性菌共同作用的结果。
2.4.2 根系形态
根据表2的相关结果可以发现,重金属浓度以及是否添加复合菌群对于蓖麻幼苗根系发育会产生重要的影响。其中,当Pb2+、Zn2+浓度为0~200 mg/L时,根系各项指标加菌组和不加菌组之间差异不显著;这表明在低浓度情况下,复合菌群的添加及重金属浓度的差异对植物根系发育的影响不大。当浓度为400~600 mg/L与时,加菌组和不加菌组的在总根长、根体积、根尖数三个指标上差异显著,这表明在高浓度重金属胁迫下,复合菌群对蓖麻幼苗根系发育的促进作用十分明显,能够在高浓度环境下有效提高蓖麻幼苗的根系发育能力。根系吸收面积的扩大,一方面可以增加植物对养分的获取来促进植物的生长,这也可能是本实验中加菌组蓖麻各项萌发指标得到提升的原因;另一方面,还可以促进植物对重金属的富集,提高宿主植物的抗逆性,提升植物修复效果[28]。

表2 复合菌群对蓖麻幼苗根系形态的影响†Table 2 Effects of microbial consortium on root morphology of Ricinus communis L. seedling
植物根系形态是一个重要的农学和生态学指标,根系形态直接反映了根系的生长状况。良好的根系形态不仅可以提高根系对土壤养分和水分的利用率,也是构建稳定生态群落的基础。植物根际微生物的活动,可以强烈影响金属形态及其在环境中的运输,从而促进根系发育,影响根系形态[29]。有研究进一步指出,这种对于非生物胁迫下植物根系发育及幼苗生长的有益效果,主要是这些微生物的活动导致植物根系中抗氧化活性增加的结果[30]。除此之外,复合菌群中的溶磷促生菌,也可能对植物根系发育产生了促进作用。钟传青等研究表明[31],具有溶磷特性的微生物可以通过产生柠檬酸、琥珀酸、乳酸以及乙酸等有机酸,螯合磷矿粉中的金属离子,从而使磷游离出来。溶磷菌通过该过程,将固定态磷转化为有效磷,以供植物吸收利用,从而促进植物根系生长。
2.5 铅锌在蓖麻幼苗不同器官的吸收累积
蓖麻幼苗根系及地上部重金属含量如图3所示,从图中可以看出,幼苗根部为铅锌的主要累积部位,在200 mg/L浓度下幼苗根部对Pb的最大累积达到1 050.68 mg/kg;由于Pb并非蓖麻生长的必需元素,且植物吸收后的Pb大部分固定在根部,固根部对Pb的吸收累积远大于地上部分。根据图3及其统计分析结果,加菌组根系对Pb的吸收有一定程度的提升(5.2%~38.6%),其中,在200、600 mg/L浓度下加菌组与不加菌组差异显著,在200 mg/L浓度下加菌组对Pb的累积量提升最大,达到了38.6%。在浓度为400 mg/L时,Pb的累积量相比于200 mg/L有明显下降,根据任继凯等人的研究[32],这可能是由于高浓度的Zn抑制了植物对Pb的吸收所致。
相比于Pb,植物地上部分对Zn的吸收明显较高,展现出了一定的向上运输能力,这可能与Zn为植物生长的必需元素有关。根据图3及其统计分析结果,相比于不加菌组,加菌组根系对Zn的吸收有一定程度的提升(12.1%~25.2%),其中在400 、600 mg/L浓度下加菌组与不加菌组差异显著,在400 mg/L浓度下加菌组对Zn的累积量提升最大,达到了25.2%。而在地上部分,除了极少浓度下茎、叶(0、200 mg/L浓度下茎以及100 mg/L浓度下叶)对Zn的吸收加菌组与不加菌组差异显著外,其余浓度下茎、叶对Zn的吸收加菌组与不加菌组差异均不显著。这表明,该菌群主要通过促进根系对重金属的富集来促进植物对重金属的富集,而对于其地上部分重金属富集的提升效果不明显。
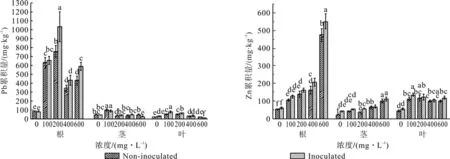
图3 蓖麻幼苗不同器官对重金属的吸收累积Fig.3 Accumulation of heavy metals on different organs of Ricinus communis L. seedling
这种提升,一方面可能与根际微生物尤其是耐性菌的接种对土壤中水溶态重金属活性的提升有关,另一方面,也可能与其促进了植物根系发育,从而增加了对重金属的吸收有关[27,33]。另有研究表明,植物根尖为吸收重金属的主要部位,根总长则决定了植物根系的吸收能力,它们都会对重金属的吸收累积起到关键作用[34-35];故表2中根总长、根尖数的显著差异,可能是根系中加菌组重金属富集量显著提升的直接原因。蓖麻幼苗对重金属的吸收累积结果表明,该复合菌群可以有效地促进铅锌胁迫下蓖麻种子的萌发及对重金属的富集,可以作为下一步功能菌群-植物联合修复的供试菌群对铅锌矿渣进行联合修复。
3 结论与讨论
3.1 结 论
虽然国内外有大量的关于植物-微生物联合修复重金属污染的报道,但鲜见对复合功能菌群与植物联合修复的报道。本实验以课题组前期工作为基础,从菌肥改良后的植物根系土壤中筛选出了溶磷真菌L14尖孢镰刀菌Fusarium oxysporum。经拮抗试验后与实验室另有的2株耐性真菌构建复合功能菌群,考查了其对铅锌胁迫下蓖麻种子萌发的影响。该复合菌群接种到基质后,能在高浓度重金属胁迫下有效促进蓖麻种子萌发及幼苗生长,同时促进其根系对重金属的富集。其中,对Pb的累积量最大可提升38.6%,对Zn的累积量最大可提升25.2%。分析结果表明,该复合菌群在铅锌胁迫下不仅能够促进蓖麻种子萌发及幼苗生长,还可以显著提高幼苗根系对重金属的吸收累积。
3.2 讨 论
已有研究表明,功能菌群中的微生物能够通过相互交流和分工行使不同的复杂功能,更加适应环境变化;基于其微生物群落生态学原理,功能菌群在增加植物生物量、提高生物修复效果等方面效果显著。长期以来,联合修复多采用单一细菌,其生长易受到营养物质和外界毒害作用的限制,故本实验采用了复合真菌作为供试微生物[36]。
事实上,已有研究人员对于微生物生物修复铅锌矿渣的效果进行了研究,易心钰等的研究指出,在纯铅锌矿渣上播种蓖麻种子后,20 d后其种子萌发率为70.83%,而平均干重为0.2 g/株;本实验中8 d后加菌组种子萌发率即便在高浓度(600 mg/L)重金属胁迫下,也能够达到60%以上的萌发率,而当重金属浓度≤200 mg/L时,萌发率更是达到了80%以上,其平均干重也接近0.2 g/株,考虑到生长时间的差异,该复合菌群的添加对于铅锌胁迫下蓖麻种子萌发的促进效果较为优秀。
重金属离子对于根生长的抑制、对根形态及根体积的改变,会对其富集重金属产生不利的影响;另一方面,土壤中重金属元素较低的生物利用度也会阻碍植物对重金属的吸收[25]。作为一种被广泛应用的重金属修复植物,蓖麻对重金属的富集能力有限,但耐性很强。实验中向蓖麻幼苗的根系中接种了同时具有促生能力和重金属耐性的复合菌群,不仅促进植物了生长,同时也增加幼苗对重金属的吸收,这与Wenhui Zhang[37]的研究结果相一致。另有研究指出[10],蓖麻在纯铅锌矿渣下对Pb的累积量可达778.09 mg/kg、对Zn的累积量可达803.43 mg/kg;而本研究中蓖麻对Pb最大累积量可达1146.06 mg/kg,对Zn的累积量最大可达810.19 mg/kg,对比而言,复合菌群的添加对于蓖麻富集铅锌的能力有一定的提升。
本实验直接将功能菌群接种到植物根系中,探究了功能菌群-植物联合修复的实际效果,此技术在生物修复领域鲜有报道,具有一定的创新。其实验结果不仅为下一步大规模盆栽实验提供了功能菌群,同时也为功能菌群-植物联合修复提供了理论支撑。但是,Jixiang Lin[38]等人的研究还进一步指出,根际微生物及其复合菌群的使用,还可以在其他非生物胁迫环境下促进植物根系的生长,诸如盐碱压力和氮沉积等,故而该复合菌群的更多特点还有待进一步研究。且本文是以种子萌发阶段的发育情况和重金属富集量为指标,来反映菌群对植物的影响及其原因,对挑选出的菌群进行初步的联合修复探究,并没有完整体现成熟植株在整个生长过程中受复合菌群影响而可能产生的情况。故该联合体系更多的功能和作用有待开展盆栽实验以作进一步检验。
[1]Tauqeer H M, Ali S, Rizwan M,et al.Phytoremediation of heavy metals by Alternanthera bettzickiana: Growth and physiological response[J]. Ecotoxicology and Environmental Safety, 2016, 126:138-146.
[2] Ali H, Khan E, Sajad M A. Phytoremediation of heavy metals—Concepts and applications[J]. Chemosphere. 2013, 91(7): 869-881.
[3]Chaney R L, Malik M, Li Y M, et al. Phytoremediation of soil metals[J]. Current Opinion in Biotechnology. 1997, 8(3): 279-284.
[4]陈生涛,何琳燕,李 娅,等. Rhizobium sp.W33对不同植物吸收铜和根际分泌物的影响[J]. 环境科学学报, 2014, 34(8):2077-2084.
[5]Ullah A, Heng S, Munis M F H,et al.Phytoremediation of heavy metals assisted by plant growth promoting (PGP) bacteria: A review[J]. Environmental and Experimental Botany, 2015, 117:28-40.
[6]Bertrand S, Bohni N, Schnee S,et al. Metabolite induction via microorganism co-culture: A potential way to enhance chemical diversity for drug discovery[J]. Biotechnology Advances, 2014,32(6): 1180-1204.
[7]Hirooka T, Nagase H, Hirata K,et al.Degradation of 2,4-dinitrophenol by a mixed culture of photoautotrophic microorganisms[J]. Biochemical Engineering Journal, 2006,29(1-2): 157-162.
[8]Singh P K, Singh A L, Kumar A,et al. Mixed bacterial consortium as an emerging tool to remove hazardous trace metals from coal[J]. Fuel, 2012, 102: 227-230.
[9]Bauddh K, Singh K, Singh B,et al.Ricinus communis: A robust plant for bio-energy and phytoremediation of toxic metals from contaminated soil[J]. Ecological Engineering, 2015, 84: 640-652.
[10] 易心钰,蒋丽娟,易诗明,等. 铅锌矿渣对蓖麻生长、重金属累积及其对矿质元素吸收的影响[J]. 中南林业科技大学学报,2017, 37(3): 116-122.
[11] 江行玉,赵可夫. 植物重金属伤害及其抗性机理[J]. 应用与环境生物学报, 2001,7(1): 92-99.
[12] 李 进,冯冲凌,李科林,等. 抗铅锌功能菌生长菌株和干菌体吸附Pb2+、Zn2+性能优化及机理分析[J].微生物学通报,2015, 42(7): 1224-1233.
[13] 廖 佳,冯冲凌,李科林,等. 耐性真菌HA吸附铅、锌的影响因素及吸附机理研究[J]. 微生物学通报,2015,42(2):254-263.
[14] 李韵诗. 铅锌矿区根际土壤专用有机菌肥改良机理与效应分析[D]. 长沙: 中南林业科技大学, 2015.
[15] Pérez E, Sulbarán M, Ball M M,et al. Isolation and characterization of mineral phosphate-solubilizing bacteria naturally colonizing a limonitic crust in the south-eastern Venezuelan region[J]. Soil Biology and Biochemistry. 2007,39(11): 2905-2914.
[16] 王卫星,周晓伦,李忠玲,等. CAS平板覆盖法检测氢氧化细菌铁载体[J]. 微生物学通报, 2014, 41(8): 1692-1697.
[17] Huang H, Yu N, Wang L,et al.The phytoremediation potential of bioenergy crop Ricinus communis for DDTs and cadmium cocontaminated soil[J]. Bioresource Technology, 2011, 102(23):11034-11038.
[18] 周建民,党 志,陈能场,等. 3-吲哚乙酸协同螯合剂强化植物提取重金属的研究[J]. 环境科学, 2007, 28(9): 2085-2088.
[19] Yu X, Ai C, Xin L,et al. The siderophore-producing bacterium,Bacillus subtilis CAS15, has a biocontrol effect on Fusarium wilt and promotes the growth of pepper[J]. European Journal of Soil Biology, 2011, 47(2): 138-145.
[20] 梅新兰,闪安琪,蒋 益,等. 适应玉米的溶磷细菌筛选及其对玉米生长的影响[J]. 土壤学报, 2016, 53(2): 502-509.
[21] Gaylarde C, Otlewska A, Celikkol-Aydin S,et al.Interactions between fungi of standard paint test method BS3900[J]. International Biodeterioration & Biodegradation,2015,104:411-418.
[22] Knudsen B E, Ellegaard-Jensen L, Albers C N,et al.Fungal hyphae stimulate bacterial degradation of 2,6-dichlorobenzamide(BAM)[J]. Environmental Pollution. 2013, 181: 122-127.
[23] Akinci G, Guven D E. Bioleaching of heavy metals contaminated sediment by pure and mixed cultures of Acidithiobacillus spp.[J].Desalination. 2011, 268(1-3): 221-226.
[24] Naik M M, Dubey S K. Lead resistant bacteria: Lead resistance mechanisms, their applications in lead bioremediation and biomonitoring[J]. Ecotoxicology and Environmental Safety,2013, 98: 1-7.
[25] 易心钰,蒋丽娟,刘 强. 不同铅锌含量的矿渣基质对蓖麻种子萌发和幼苗生长的影响[J]. 经济林研究, 2014,32(3):87-93.
[26] Radwan S S, Dashti N, El-Nemr I,et al.Hydrocarbon Utilization by Nodule Bacteria and Plant Growth-Promoting Rhizobacteria[J]. International Journal of Phytoremediation,2007, 9(6): 475-486.
[27] Jiang C, Sheng X, Qian M,et al. Isolation and characterization of a heavy metal-resistant Burkholderia sp. from heavy metalcontaminated paddy field soil and its potential in promoting plant growth and heavy metal accumulation in metal-polluted soil[J].Chemosphere, 2008, 72(2): 157-164.
[28] Göhre V, Paszkowski U. Contribution of the arbuscular mycorrhizal symbiosis to heavy metal phytoremediation[J].Planta, 2006, 223(6): 1115-1122.
[29] Sheng X, Xia J. Improvement of rape (Brassica napus) plant growth and cadmium uptake by cadmium-resistant bacteria[J].Chemosphere, 2006, 64(6): 1036-1042.
[30] Rajtor M, Piotrowska-Seget Z. Prospects for arbuscular mycorrhizal fungi (AMF) to assist in phytoremediation of soil hydrocarbon contaminants[J]. Chemosphere, 2016, 162: 105-116.
[31] 钟传青,黄为一. 磷细菌P17对不同来源磷矿粉的溶磷作用及机制[J]. 土壤学, 2004, 41(6): 931-937.
[32] 任继凯,陈清朗,陈灵芝,等. 土壤中镉、铅、锌及其相互作用对作物的影响[J]. 植物生态学与地植物学丛刊, 1982, 6(4):320-329.
[33] Li T, Yang X, Lu L,et al. Effects of zinc and cadmium interactions on root morphology and metal translocation in a hyperaccumulating species under hydroponic conditions[J].Journal of Hazardous Materials. 2009, 169(1-3): 734-741.
[34] Ma H, Evangelou M W H, Vontobel P,et al.Root growth and Zn uptake of three common crop plants in response to heterogeneity in soil texture and Zn distribution[J]. Environmental and Experimental Botany, 2016, 127: 45-54.
[35] 宋 婕. 黄瓜根尖边缘细胞对铜胁迫的响应机制研究[D]. 杭州: 浙江大学, 2014.
[36] Yang Q, Li C, Li H,et al.Degradation of synthetic reactive azo dyes and treatment of textile wastewater by a fungi consortium reactor[J]. Biochemical Engineering Journal,2009,43(3):225-230.
[37] Zhang W, Huang Z, He L,et al. Assessment of bacterial communities and characterization of lead-resistant bacteria in the rhizosphere soils of metal-tolerant Chenopodium ambrosioides grown on lead-zinc mine tailings[J]. Chemosphere, 2012, 87(10):1171-1178.
[38] Lin J, Wang Y, Sun S,et al.Effects of arbuscular mycorrhizal fungi on the growth, photosynthesis and photosynthetic pigments of Leymus chinensis seedlings under salt-alkali stress and nitrogen deposition[J]. Science of The Total Environment, 2017,576: 234-241.
[本文编校:吴 彬]
Construction of microbial consortium and its effects on seed germination and lead-zinc accumulation ofRicinus communisL. under lead-zinc stress
LI Yanfenga, FENG Chonglinga, LI Kelina, PENG Tianyia, HE Shujiaoa, ZHANG Huana, ZHOU Taob
(a. College of Environmental Science and Engineering; b. College of Life Sciences and Technology, Central South University of Forestry& Technology, Changsha 410004, Hunan, China)
In order to investigate the effects of lead-zinc resistant microbial consortium on seed germination ofRicinus communisL.which would be used to construct a functional microbial consortium for the further study ofRicinus communisL.-microbial remediation.The screened rhizospheric microorganisms in microbial fertilizer improved rhizosphere soil were carried out a plate antagonism test with the preserved strains in our laboratory for a gene sequence analysis to construct the functional microbial consortium. Moreover,a pot experiment of the seed ofRicinus communisL. under lead-zinc stress was conducted to analyze the effect of the germination percentage, growth indicators, heavy metal accumulation, and the root morphologyon the inoculation of microbial consortium. The obtained phosphate-solubilizing fungi L14 was identified asFusarium oxysporum. There is nonantagonistic effect among the microbial consortium composed by the screened fungi and the preserved 2 strains (HA, J3) strains in our laboratory. After inoculating into substrate, the microbial consortium can effectively promote seed germination and seedling growth ofRicinus communisL. under heavy metal stress of a high concentration. Meanwhile, the maximum accumulation of heavy metal in root can be increased by 38.6% for Pb as well as 25.2% for Zn. The microbial consortium not only could promote seed germination and seedling growth, but also obviously improve the root accumulation of heavy metal inRicinus communisL. seedling under lead-zinc stress.
Lead-zinc; Microbial consortium;Ricinus communisL.; Seed germination; Accumulation
S719;X172 文献标志码:A 文章编号:1673-923X(2017)10-0045-09
10.14067/j.cnki.1673-923x.2017.10.008
http: //qks.csuft.edu.cn
2016-07-04
湖南省重点研发计划(2016SK2045);湖南省研究生科研创新项目(CX2016B325);中南林业科技大学研究生科技创新基金(CX2016B11);湖南省高校重点实验室创新平台开放基金项目(10K82)
李雁峰,硕士研究生
李科林,教授,博士;E-mail:csfuklli@163.com
李雁峰,冯冲凌,李科林,等. 复合功能菌群的构建及其对铅锌胁迫下蓖麻种子萌发和铅锌积累的影响[J].中南林业科技大学学报,2017, 37(10): 45-53.
