可吸收防粘连液的生物安全性评价
2017-12-08郑紫燕张晓敏
张 岩,郑紫燕,张晓敏
·经验交流·
可吸收防粘连液的生物安全性评价
张 岩,郑紫燕,张晓敏
目的对可吸收防粘连液进行生物学安全性评价,为产品成功应用于临床提供依据。方法参照GB/T 16886《医疗器械生物学评价标准》的要求,对可吸收防粘连液进行热原试验、体外细胞毒性试验、迟发型超敏反应试验、急性全身毒性试验、溶血试验、鼠伤寒沙门氏菌回复突变试验(Ames试验)、体外哺乳动物细胞染色体畸变试验及小鼠淋巴瘤细胞基因突变试验(mLA试验)等生物相容性试验研究。结果可吸收防粘连液经热原检测最高升温0.1℃,无致热性,细胞毒性1级,急性全身毒性反应阴性,迟发型超敏反应阴性,遗传毒性检测均为阴性。以市售医用几丁糖为对照品,经动物血液学一般检验、生化检验,试验组与对照组相比无统计学差异(P>0.05),动物体重/脏器系数与对照组相比无统计学差异(P>0.05),结果显示无亚慢性全身毒性。结论可吸收防粘连液具有良好的生物相容性和生物学安全性,可为产品应用于临床提供依据。
可吸收防粘连液;褐藻寡糖;海藻酸钠;热原试验; 细胞毒性试验
可吸收防粘连液是由天然海洋植物褐藻经生物酶解反应提取的褐藻寡糖、海藻酸钠等高分子材料精制而成的液状胶体。研究表明,褐藻寡糖具有抗氧化、抑菌、抗肿瘤及增强免疫调节等生物活性[1-4]。海藻酸钠为天然高分子聚合物,生物相容性良好,可在体内降解,毒性低,来源广泛,作为药用辅料应用越来越广泛[5-6]。羧甲基纤维素钠对活性物质具有良好的包载能力,可用作针剂的乳化稳定剂和片剂的粘结剂,还可作为载体材料用于活性物质的控制释放,经实验证明还是可靠的抗癌药物载体[7]。本研究按照GB/T 16886《医疗器械生物学评价标准》的要求,采用细胞毒性试验、致敏试验、皮内刺激反应试验、急性全身毒性试验、溶血试验、遗传毒性试验、热原试验、植入试验及亚慢性毒性试验对可吸收防粘连液进行生物学安全性评价。
1 资料与方法
1.1 一般资料
1.1.1 动物:本试验于2015年3月在北京医疗器械监督检验中心开展,所用动物均由该单位提供。其中家兔3只,昆明小鼠5只,豚鼠30只,SD大鼠46只,雌雄不限。
1.1.2 试药:可吸收防粘连液[中英阿诺康(宁夏)生物科技有限公司生产,批号:15012901]。
1.2 实验方法
1.2.1 热原试验:将样品与生理盐水1∶2 比例稀释后,按照0.1 g/mL的比例,(37±1)℃条件下浸提(72±2)h,以无菌无热原的生理盐水为浸提介质,按照《中国药典》2010 版(二部)附录Ⅺ D 的方法进行测试,结果应无热原反应。
1.2.2 细胞毒性试验:将样品与生理盐水1∶2 比例稀释,取稀释液按照0.1 g/mL的比例,使用细胞完全培养基,在(37±1)℃条件下浸提24 h,按照 GB/T 16886.5-2003 中 8.2 浸提液试验规定 MTT 方法进行试验,结果应不>1级。
1.2.3 急性全身毒性试验:将样品与生理盐水1∶2比例稀释,取稀释液按照 0.1 g/mL 的比例,在生理盐水中(37±1)℃条件下浸提(72±2)h,按照 GB/T 16886.11-2011 中第五章规定试验方法,采用 A.8 尾静脉注射途径进行试验,结果应无急性全身毒性。
1.2.4 迟发型超敏反应试验:将样品与生理盐水1∶2比例稀释,取稀释液按照0.1 g/mL的比例,在生理盐水中(37±1)℃条件下浸提(72±2)h,按照 GB/T 16886.10-2005 中 7.4 最大剂量试验规定进行试验,根据GB/T 16886.10-2005 中 7.4.6 对试验结果进行评价,结果应无迟发型超敏反应。
1.2.5 遗传毒性试验
1.2.5.1 鼠伤寒沙门氏菌回复突变试验(Ames试验),将样品与生理盐水1∶2比例稀释,取稀释液按照0.1 g/mL的比例,分别以生理盐水和DMSO为浸提介质,(37±1)℃条件下浸提(72±2)h,按照 GB/T 16886.3-2008 中规定的方法进行试验,结果应为阴性。
1.2.5.2 体外哺乳动物细胞染色体畸变试验:将样品与生理盐水1∶2比例稀释,取稀释液按照0.1 g/mL的比例,以细胞完全培养基为浸提介质,(37±1)℃条件下浸提 24 h,根据GB/T 16886.3-2008 中规定的方法进行试验,结果应为阴性。
1.2.5.3 小鼠淋巴瘤细胞基因突变试验(mLA试验),将样品与生理盐水1∶2比例稀释,取稀释液按照0.1 g/mL的比例,以细胞完全培养基为浸提介质,(37±1)℃条件下浸提 24 h,根据 GB/T 16886.3-2008 中规定的方法进行试验,结果应为阴性。
1.2.6 溶血试验:按照GB/T 14233.2-2005 中第七章规定的方法进行试验,溶血率应不>5%。
1.2.7 植入试验:以大小适宜的PE软管作为载体,将样品附着其上,按照 GB/T 16886.6-1997 中第四章规定采用皮下组织植入方式进行试验,植入期为12周,与对照组相比,样品组应无明显局部生物学反应。
1.2.8 亚慢性毒性试验:将样品与生理盐水1∶2比例稀释,取稀释液按照0.1 g/mL的比例,以生理盐水为浸提介质,(37±1)℃条件下浸提(72±2)h,按照 GB/T 16886.11-2011 中第六章规定试验方法,采用 A.7 腹腔注射90 d方法进行试验,与对照组相比,样品组应无明显亚慢性毒性反应。

2 结果
2.1 热原试验:在3 h观察时间内,3只家兔体温升高值的总数在1.3 ℃以下,符合《中国药典》可接受的限度范围,试验材料无致热性。
2.2 细胞毒性试验:在本试验条件下,被检试验材料细胞毒性1级。
2.3 急性全身毒性试验:所有动物在整个试验观察过程中表现正常,没有出现死亡现象,体重均在可接受的范围内,表明被检试验材料急性全身毒性反应阴性。
2.4 迟发型超敏反应试验:动物经激发(24±2)h,去除敷贴后24 h和48 h分别观察试验组和对照组动物激发部位皮肤过敏情况,结果显示动物皮肤反应记分均为0分,即无皮肤红斑和水肿反应情况,表明可吸收防粘连液迟发型超敏反应阴性。
2.5 遗传毒性试验
2.5.1 鼠伤寒沙门氏菌回复突变试验(Ames试验):在本试验条件下,被检试验材料的生理盐水浸提液对鼠伤寒沙门氏菌TA97、TA98、TA100、TA102诱变阴性。
2.5.2 体外哺乳动物细胞染色体畸变试验:在本试验条件下,试验材料浸提液的染色体畸变率低于阴性对照组,试验结果阴性。
2.5.3 小鼠淋巴瘤细胞基因突变试验(mLA试验):在本试验条件下,被检样品小鼠淋巴瘤细胞(L5178Y)TK基因突变试验结果阴性,覆盖两个终点。
2.6 溶血试验:根据医疗器械预期临床用途和器械材料特性确定适宜的合格判定指标。按本试验检验医疗器械时,合格判定指标一般为溶血率应<5%。在本试验条件下,样品溶血率为3.5%,符合医疗器械的溶血试验要求。
2.7 植入试验:与对照组相比,样品在皮下植入 12 周后无明显局部生物学反应。
2.8 亚慢性毒性试验:动物血液学一般检验、生化检验,试验组与对照组相比无统计学差异(P>0.05),试验组大鼠丙氨酸氨基转移酶、碱性磷酸酶和钾浓度低于对照组,肌酐高于对照组,差异有统计学意义(P<0.05),但以上指标的结果在本试验室参考区间。动物体重/脏器系数与对照组相比差异无统计学意义(P>0.05),说明样品组无明显的亚慢性毒性反应,见表1-表3。
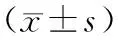
表1 2组动物血液学检验指标比较
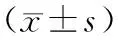
表2 2组动物血液学生化指标比较
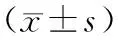
表3 2组动物体重/脏器系数比较
3 讨论
本研究按照GB/T 16886《医疗器械生物学评价标准》的要求,采用热原、细胞毒性、致敏、皮内刺激反应、急性全身毒性、溶血、遗传毒性(Ames试验、体外哺乳动物细胞染色体畸变试验和mLA试验)、植入及亚慢性全身毒性试验对制备的可吸收防粘连液进行生物学安全性评价。结果显示:在3 h观察时间内,3只家兔体温升高值的总数在1.3 ℃以下,符合《中国药典》可接受的限度范围,无致热性。在本试验条件下,可吸收防粘连液的细胞毒性1级,急性全身毒性反应阴性,迟发型超敏反应阴性,可吸收防粘连液的生理盐水浸提液对鼠伤寒沙门氏菌TA97、TA98、TA100、TA102诱变阴性,染色体畸变率低于阴性对照组,试验结果阴性。在本试验条件下,可吸收防粘连液对小鼠淋巴瘤细胞(L5178Y)TK基因突变试验结果阴性。在本试验条件下,样品溶血率为3.5%,符合医疗器械的溶血试验要求。 与对照组相比,样品在皮下植入 12 周后无明显局部生物学反应。动物血液学一般检验、生化检验,试验组与对照组相比无统计学差异(P>0.05),样品无亚慢性毒性,因此,结果证明可吸收防粘连液具有良好的生物相容性。
防粘连产品对人体应安全,不能对人体组织、血液、免疫等系统产生不良反应。产品所使用材料的生物相容性优劣是防粘连产品研究设计中首先考虑的重要问题。理想的防粘连产品应具有良好的生物相容性、自动黏附性、可降解吸收性、足够的体内存留时间、促进伤口愈合并将纤维组织增生降至最低程度等特性。可吸收防粘连液是由天然海洋植物褐藻经生物酶解反应提取的褐藻寡糖、海藻酸钠等高分子材料精制而成的液状胶体,适用于预防和减少盆腹腔粘连的发生。本研究结果表明,可吸收防粘连液具有良好的生物相容性,然而,要想将可吸收防粘连液应用于临床,还需进一步对其安全性进行验证。
[1] 孙丽萍,薛长湖,许家超,等.褐藻胶寡糖体外清除自由基活性的研究[J].中国海洋大学学报:自然科学版,2005,35(5):811-814.
[2] 王媛媛,郭文斌,王淑芳.褐藻寡糖的生物活性与应用研究进展[J].食品与发酵工业,2010,36(10):122-125.
[3] Hu Xiaoke,Jiang Xiaolu.Antitumour activities of alginate-derived oligosaccharides and their sulphated substitution derivatives[J].European Journal of Phycology,2004,39(1):67-71.
[4] 陈丽,张林维,薛婉立.褐藻寡糖的制备及抑菌性研究[J].中国饲料,2007(9):34-35,42.
[5] Jain D,Bar Shalom D.Alginate drug delivery systems:application in context of pharmaceutical and biomedical research[J].Drug Development and Industrial Pharmacy,2014,40(12):1576-1584.
[6] Tucu Demir z F,Acartürk F,Takka S,et al.Evaluation of alginate based mesalazine tablets for intestinal drug delivery[J].European Journal of Pharmaceutics and Biopharmaceutics:Official Journal of Arbeitsgemeinschaft Fur Pharmazeutische Verfahrenstechnik e.V,2007,67(2):491-497.
[7] 吴奥丽,郑利强.羧甲基纤维素钠凝胶载体的制备及其控制释放作用的研究[J].中国洗涤用品工业,2016(2):66-70.
R965.3
B
10.13621/j.1001-5949.2017.11.1025
中英阿诺康(宁夏)生物科技有限公司,宁夏 银川 750101
2017-09-19责任编辑马兴忠
