肝硬化患者小肠细菌过度生长及其外周血单个核细胞TLR4表达的变化
2017-12-07陈光耀韩际奥周东晓马英杰
陈光耀,韩际奥,周东晓,高 晓,马英杰
·肝硬化·
肝硬化患者小肠细菌过度生长及其外周血单个核细胞TLR4表达的变化
陈光耀,韩际奥,周东晓,高 晓,马英杰
目的探讨肝硬化患者小肠细菌过度生长(SIBO)和外周血单个核细胞表面TLR4表达的变化。方法采用乳果糖-氢呼气试验(LHBT)检测40例肝硬化患者和16例正常人小肠细菌生长情况,使用流式细胞仪检测外周血单个核细胞表面TLR4表达。结果肝硬化患者SIBO检出率为42.5%(17/40),显著高于正常人的6.3%(1/16,P<0.01);肝硬化患者外周血单个核细胞表面TLR4相对表达量为(23.4±11.4),显著高于正常人的【(14.4±5.2),P<0.05】;17例肝硬化SIBO阳性患者外周血单个核细胞表面TLR4表达为(30.2±12.3),显著高于23例肝硬化SIBO阴性患者【(19±8.6),P<0.05】。结论肝硬化患者存在较高的SIBO发生率,外周血单个核细胞表面TLR4表达上调,SIBO可能通过与TLR4的作用在肝硬化病情进展中发挥作用。
肝硬化;小肠细菌过度生长;内毒素;TOLL样受体4
Toll样受体(Toll-like receptors,TLRs)是一种重要的模式识别受体(pattern recognition receptor,PRR),其通过识别细菌、真菌、病毒等病原体相关结构成分(如糖类、脂类、多肽及核苷酸等),在激活先天免疫反应中起着举足轻重的作用[1]。目前,人体内发现的TLRs已有十余种,而TLR4是被发现的第一个亚型,其主要识别细菌内毒素即细胞壁脂多糖(lipopolysaccaride,LPS)。研究发现,LPS通过调节外周血单个核细胞表面TLR4的表达,参与肝硬化的发病及进展[2]。近些年,肝硬化患者小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)成为研究的热点,但其是否通过调节TLR4的表达参与肝硬化的发生发展过程,目前研究还较少。本文就肝硬化患者SIBO与外周血单个核细胞表面TLR4表达的关系进行了初步探讨,现将结果报告如下。
1 资料与方法
1.1 研究对象 2015年11月~2016年6月郑州市人民医院消化科收治的乙型肝炎肝硬化患者40例,男28例,女12例;平均年龄(56.6±10.5)岁。符合2015年中华医学会发布的慢性乙型肝炎防治指南的诊断标准[3]。排除其他病毒感染及肝癌患者,排除甲状腺疾病、糖尿病、功能性胃肠病等影响胃肠动力的疾病患者,排除近期使用过抗生素、抑酸剂、糖皮质激素及影响胃肠动力药物的患者。肝功能Child-Pugh A级12例,B级13例,C级15例。另选择同期来本院健康体检者16例,男10例,女6例;平均年龄(54.3±10.7)岁。受试者签署知情同意书。肝硬化患者与健康体检者性别和年龄差异无统计学意义(P>0.05),具有可比性。
1.2 SIBO的检测 使用氢气检测设备(英国Bedfont公司生产的EC60Gastrolyzer型)检测,氢气浓度以ppm表示,检测范围为0~500 ppm,灵敏度为1ppm,精度±5%。检测前一晚,受试者进食淀粉类食物,晚餐后至次日检查前空腹约14 h。晨起排便、刷牙后,服用少许温开水,以恢复肠道运动功能。检测前2 h和检测过程中,受试者不进行剧烈的活动或吸烟。先检测基础氢气浓度,然后给予乳果糖(杜密克,荷兰苏威制药)10 g和温开水250 ml口服。自口服乳果糖时间点算起,每隔I5 min检测1次氢气浓度,连续检测不少于2 h。以基础值超过20 ppm或口服杜密克后呼气氢浓度上升超过基础值12 ppm为SIBO阳性,反之为SIBO阴性。
1.3 外周血单个核细胞表面TLR4的检测 抽取上述研究对象外周血2 ml,注入抗凝管,保存于4℃冰箱中。对每例研究对象分别取标记为A和B的两只试管。首先,在B管中加入PE标记的鼠抗人TLR4(美国BD公司)10 μl,APC标记的鼠抗人CD14(美国 BD 公司)10 μl,再加抗凝全血 100 μ l,振荡、混匀。在A管中分别加入PE同型对照(美国BD公司)10 μl,APC标记的鼠抗人CD14(美国BD 公司)10 μl,抗凝血 100 μl,振荡混匀,室温避光孵育20 min。再在A管和B管中加入红细胞裂解液1 ml,混匀,避光10 min。离心,弃上清,加入洗涤液2 ml,再次离心,弃上清,再加入洗涤液1 ml。使用流式细胞仪(BD FACSCalibur),以 CD14(APC)标记并获取10000个CD14+单个核细胞,经CellQuest软件分析,作直方图,用平均荧光强度的几何均数(geometric mean fluorescence,GMF)表示TLR4的表达水平。
1.4 统计学处理 应用SPSS 19.0软件对数据进行分析,计量资料以(±s)表示,采用 t检验,计数资料以百分率(%)表示,采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 SIBO发生情况 在16例正常人中检出1例(6.3%)SIBO,在40例肝硬化患者中检出17例(42.5%)SIBO,两组差异显著(P<0.01);不同肝功能分级的肝硬化患者SIBO阳性率不同,Child A级与Child B/C级比,差异有统计学意义(x2=4.68,P=0.03,表 1)。

表1 肝硬化与正常人SIBO发生率(%)比较
2.2 外周血单个核细胞表面TLR4表达水平变化 肝硬化患者外周血单个核细胞表面TLR4水平显著高于正常人(P<0.05);肝硬化伴SIBO阳性患者外周血单个核细胞表面TLR4水平显著高于SIBO阴性组(P<0.05);肝硬化SIBO阴性患者外周血单个核细胞表面TLR4水平与正常人比,无统计学差异(P>0.05,表 2、图 1~3)。
表2 肝硬化与正常人外周血单个核细胞表面TLR4表达水平(±s)比较

表2 肝硬化与正常人外周血单个核细胞表面TLR4表达水平(±s)比较
与正常人比,①P<0.05;与肝硬化SIBO阴性患者比,②P<0.05
例数 TLR4(GMF)肝硬化 40 23.4±11.4①SIBO 阳性 17 30.2±12.3②SIBO阴性 23 19±8.6正常人 16 14.4±5.2

图1 正常人单个核细胞TLR4表达

图2 肝硬化SIBO阴性患者单个核细胞TLR4表达
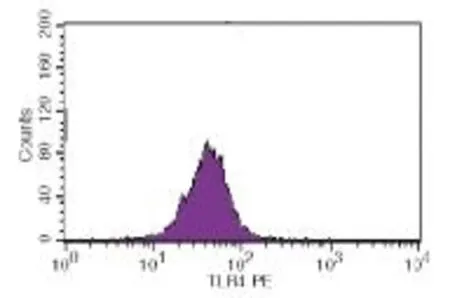
图3 肝硬化SIBO阳性患者单个核细胞TLR4表达
3 讨论
小肠在正常状态下是一种相对无菌的状态。但是,由于肝脏和胃肠道之间的各种病理生理环境的存在,肝硬化患者暴露于肠道生态失衡的风险较高。肝硬化患者肠蠕动减弱、胃液pH值升高、胆汁酸分泌减少等可能引起肠道菌群失调,结肠的细菌移向小肠,引起SIBO[4,5]。虽然空肠提取液培养被认为是诊断SIBO的“金标准”,但这种技术需要肠插管,患者耐受性差,并且部分菌种在实验室条件下无法培养。乳果糖氢呼气试验(lactulose hydrogen breath test,LHBT)、葡萄糖氢呼气试验(glucose hydrogen breath test,GHBT)是相对无创的,成本较低。但是,由于葡萄糖几乎都在小肠近段被吸收,所以GHBT难以检测出小肠远端的细菌过度生长[6],具有一定的局限性,而LHBT已在肝硬化患者SIBO的诊断中得到广泛的应用[7]。魏新朋等[8]用LHBT得出肝硬化伴SIBO的发生率为46.8%,Pande CA et al[9]发现肝硬化患者SIBO患病率可达49%。本研究通过对40例肝硬化患者和16例正常人进行LHBT检测,发现肝硬化患者SIBO阳性率为42.5%,与国内外数据相近,提示肝硬化患者具有较高的小肠细菌过度生长,且随着肝功能损伤程度加重,SIBO发生率升高。
肝硬化患者易发生SIBO,并且已经有文献表明SIBO 可导致或加重肝硬化患者内毒素血症[10,11],可能是肝硬化伴SIBO阳性时,肠道中大量有害的革兰氏阴性菌繁殖、裂解,释放大量内毒素,同时患者存在免疫功能低下,网状内皮系统解毒能力下降,以及肠道通透性增加等,造成内毒素易位至体循环,导致肠源性内毒素血症[12]。在内毒素血症形成以后,LPS通过引起肝细胞能量生成受阻,产生氧自由基而直接损伤肝细胞[13]。另外,作为LPS天然配体的TLR4,其在单个核细胞等非特异性免疫细胞大量表达。肝硬化时外周血TLR4水平可分为上调和下调两种情况。当存在持续的HBV感染时,可以抑制TLR4的表达及其功能发挥,引起TLR4表达下调[14],而当受外源性配体LPS刺激时,TLR4被激活,且其表达随LPS的提高而上调。LPS通过共同受体CD14和MD-2作用于外周血单个核细胞表面的TLR4,经MyD88依赖性信号途径和MyD88非依赖性信号途径,刺激启动信号级联反应,促进NF-κB信号通路的激活,造成不同的促炎症介质的产生,如 TNF-α、IL-6和 IL-1β 等[15],形成“第二次打击”[16],再次引起肝细胞损伤。
LPS参与TLR4介导的肝脏炎症-纤维化/肝硬化的形成过程[17],并且TLR4的表达与肝硬化患者LPS水平密切相关。SIBO与TLR4在肝硬化发病和进展中的关系尚不明确,我们就肝硬化患者SIBO与外周血TLR4表达关系展开研究。与正常人比较,我们发现肝硬化患者外周血单个核细胞表面TLR4的表达增加,且肝硬化SIBO阳性患者外周血单个核细胞表面TLR4表达水平高于肝硬化SIBO阴性患者,提示肝硬化患者TLR4的表达与SIBO密切相关。SIBO是造成肝硬化患者内毒素血症的重要因素。当肝硬化伴SIBO阳性时,可能引起或加重肝硬化患者的肠源性内毒素血症,内毒素进入血液增加,LPS导致外周血单个核细胞对其的应激和敏感度增加,从而引起TLR4表达的升高,以此来识别大量LPS。Steib et al[18]已证实TLR4受LPS刺激后表达增加,从而提高其对LPS的敏感性。高表达的TLR4识别LPS后,激活下游信号途径,诱导包括IL-6在内的大量炎性细胞因子的转录及释放,又反过来刺激外周血单个核细胞TLR4表达上调,两者相互影响[19],从而加速机体清除内毒素分子,减轻内毒素血症。Kapild et al[20]发现NASH相关肝硬化患者SIBO发病率较高,且合并SIBO的患者内毒素水平、TLR4表达显著升高。杨少奇等[21]发现乙型肝炎肝硬化患者外周血单个核细胞TLR4的表达明显高于正常人,并且内毒素水平与TLR 4的表达成正相关。Manigol et al[22]也证实了肝硬化患者体内高水平的内毒素和IL-6可引起TLR4表达上调。而肠道细菌过度生长和移位,又容易导致反复革兰氏阴性菌感染,使机体对内毒素产生耐受[23],也可能是少数肝硬化伴SIBO阳性患者外周血单个核细胞表面TLR4的表达无明显升高的原因。另外,不排除与TLR4基因多态性[24]有关。具体机制,尚需进一步探讨。
本研究将SIBO、LPS和TLR4与肝硬化的发生发展联系起来,发现肝硬化患者具有较高的小肠细菌过度生长和外周血单个核细胞表面TLR4的过度表达,且SIBO与LPS的配体TLR4上调相关。SIBO可能通过与TLR4的作用,促进和加重肝硬化的发生和发展。因此,开启针对微生物群或致病途径的新型干预,如调节肠道微生态,减少内毒素经肠道菌丛的释放和吸收,抑制TLR4信号传导等,具有重要的临床意义。
[1]Takeuchi O,Akira S.Pattern recognition receptors and inflammation.Cell,2010,140(6):805-820.
[2]王慧,杜文军,秦来英,等.Toll样受体4在慢性乙型肝炎病毒感染者外周血单个核细胞中的表达及意义.中华传染病杂志,2007,25(5):298-302.
[3]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2015年版).实用肝脏病杂志,2016,19(3):Ⅴ-ⅩⅩⅢ.
[4]Quigley EM,Stanton C,Murphy EF.The gut microbiota and the liver pathophysiological and clinical implications.J Hepatol,2013,58(5):1020-1027.
[5]Thalheimer U,De Iorio F,Capra F,et al.Altered intestinal function precedes the appearance of bacterial DNA in serum and ascites in patients with cirrhosis:a pilot study. Eur J Gastroenterol Hepatol,2010,22(10):1228-1234.
[6]赵东强,王泽宇,刘丽.小肠细菌过生长的研究进展.河北医科大学校报,2016,37(5):605-609.
[7]Romagnuolo J,Schiller D,Bailey RJ.Using breath tests wisely in a gastroenterology practice:an evidence-based review of indications and pitfalls in interpretation.Am J Gastroenterol,2002,97(5):1113-1126.
[8]魏新朋,韩际奥,马英杰,等.肝硬化患者病情与小肠细菌过度生长变化关系探讨.实用肝脏病杂志,2016,19(3):310-313.
[9]Pande CA,Kumar SK.Small-intestinal bacterial overgrowth in cirrhosis is related to the severity of liver disease.Aliment Pharmacol Ther,2009,29(12):1273-1281.
[10]Bauer TM,Schwacha H,Steinbruckner B,et al.Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia.Am J Gastroenterol,2002,97(9):2364-2370.
[11]王锦辉,陈旻湖,孙光裕,等.肝硬化患者小肠细菌过度生长与内毒素血症. 中华内科杂志,2002,41(7):459-461.
[12]周永健.肠道微生态与肝硬化.实用肝脏病杂志,2016,19(2):139-142.
[13]陶亮,龚环宇.肝硬化与肠源性内毒素血症关系的研究进展.中国感染控制杂志,2015,14(2):139-144.
[14]李春江,孙蕾,张敬凯,等.HBV感染者外周血 PBMC中TLR4 mRNA与病毒载量的相关性研究.中国微生态学杂志,2009,21(7):633-635.
[15]Seki E,Schnabl B.Role of innate immunity and the microbiota in liver fibrosis:crosstalk between the liver and gut.J Physiol,2012,590(3):447-458.
[16]宁蓓蓓,喻艳林.内毒素在重症肝炎肝损害中的研究进展.科技信息,2013,12(22):442-443.
[17]朱晓静,张峰,孔德松,等.脂多糖/Toll样受体4信号转导与肝纤维化的研究进展.中国药理学与毒理学杂志,2013,27(1):106-109.
[18]Steib CJ,Hatman AC,v HesIer C,et al.Intrapentoneal LPS amplifies ponal hypertension in rat liver fibrosis.Lab Invest,2010,90(7):1024-1032.
[19]阎双缓,陈翠英,王素平,等.乙型肝炎肝硬化患者外周血单个核细胞 Toll样受体 4 的变化. 实用肝脏病杂志,2012,15(5):447-448.
[20]Kapil S,Duseja A,Sharma BK,et al.Small intestinal bacterial overgrowth and toll-like receptorsignaling in patientswith non-alcoholic fatty liver disease.J Gastroenterol Hepatol,2016,31(1):213-221.
[21]杨少奇,王莉,黄睿,等.肝硬化患者外周血TLR-CD14表达及其与内毒素血症的关系.宁夏医科大学学报,2010,32(1):63-65.
[22]Manigold T,Bocker U,Hanck C,et al.Differential expression of toll-like receptors 2 and 4 in patients with liver cirrhosis.J Gastroenterol Hepatol,2003,15(3):275-282.
[23]潘勤聪,涂传涛,张顺财,等.乙肝肝硬化患者外周血单个核细胞Toll样受体2和4 mRNA表达及其意义.复旦学报(医学版),2009,36(1):120-123.
[24]Lorenz E,Mira JP,Frees KL,et a1.Relevance of mutations in the TLR4 receptor in patients with gram-negative septic shock.Arch Intern Med,2002,162(9):1028-1032.
(收稿:2017-01-05)
(本文编辑:陈从新)
Smallintestinalbacterialovergrowth and TLR4 expression on the surface ofperipheralblood mononuclearcellsin patientswith liver cirrhosis
Chen Guangyao,Han Ji’ao,Zhou Dongxiao,etal.DepartmentofGastroenterology,Digestive Disease Institute,People's Hospital,Affiliated to Xinxiang Medical College,Zhengzhou 450003,China
Objective To explore the prevalence of small intestinal bacterial overgrowth(SIBO)and the changes of Toll-like receptor 4(TLR-4)expression on the surface of peripheral blood mononuclear cells(PBMCs)in patients with liver cirrhosis.MethodsSIBO was detected by lactulose hydrogen breath test and TLR-4 expression was assayed by flow cytometry in 40 cirrhotics and 16 healthy persons.ResultsThe prevalence of SIBO in patients with liver cirrhosis was 42.5%,significantly higher than 6.3%in healthy people(P<0.01);the expression of TLR4 on the surface of PBMCs in patients with cirrhosis was(23.4±11.4),significantly higher than[(14.4 ±5.2),P<0.05]in the control;the expression of TLR4 in 17 cirrhotic patients with SIBO-positive was(30.2±12.3),significantly higher than[(19±8.6),P<0.05]in 23 with SIBO-negative.Conclusions The patients with liver cirrhosis have a high incidence of small intestinal bacterial overgrowth,and the expression of TLR4 on PBMCs increases,which might play an important role in the development of cirrhosis.
Liver cirrhosis;Small intestinal bacteria overgrowth;Endotoxin;Toll-like receptor 4
10.3969/j.issn.1672-5069.2017.06.022
450003郑州市 新乡医学院附属郑州人民医院消化科/郑州市消化疾病研究所
陈光耀,男,26岁,新乡医学院2015级硕士研究生。主要从事肠道微生态与消化道疾病防治研究 。E-mail:123053586@qq.com
马英杰,E-mail:mayingjie19@sina.com
