组蛋白去乙酰化酶抑制剂ACY1215对急性肝衰竭大鼠肝细胞线粒体的保护作用*
2017-12-07焦方舟张海月张文斌龚作炯
陈 倩,焦方舟,张海月,张文斌,刘 扬,龚作炯
组蛋白去乙酰化酶抑制剂ACY1215对急性肝衰竭大鼠肝细胞线粒体的保护作用*
陈 倩,焦方舟,张海月,张文斌,刘 扬,龚作炯
目的探讨ACY1215对急性肝衰竭大鼠肝细胞线粒体损伤的保护作用及其相关机制。方法24只SD大鼠被随机分为对照组、模型组和ACY1215处理组。以脂多糖(LPS)联合D-氨基半乳糖(D-Gal)注射建立急性肝衰竭大鼠模型,药物干预组在建立急性肝衰竭组前2 h给予ACY1215(10 mg·kg-1)注射。造模48 h后处死动物,在光镜及电镜下观察肝组织学变化,采用梯度离心法分离肝细胞线粒体,采用荧光酶标法测定线粒体膜通透性转换孔(MPTP),采用ELISA法测定线粒体细胞色素C(Cytc)含量,常规测定血清ALT、AST和总胆红素(TBil)水平。结果与模型组比,ACY1215处理组肝组织学破坏程度减轻,电镜显示肝细胞线粒体肿胀减轻;急性肝衰竭模型组大鼠血清 ALT、AST 和 TBIL 水平分别为(5114.1±252.6)U/L、(2909.8±31.7)U/L 和(97.6±1.4)μmol/L,均显著高于正常组大鼠的(56.0±4.4)U/L、(130.4±12.6)U/L 和(7.4±0.7)μmol(P均 <0.05),但处理组 ALT、AST 和 TBIL 水平均较模型组减低,分别为(799.4±11.2)U/L、(401.0±5.6)U/L 和(28.0±1.2)μmol/L(P均 <0.05);急性肝衰竭模型组大鼠MPTP相对荧光值(RFU)为(96822.0±16733.1)RFU/mgprot,较正常组大鼠的(156300.0±24043.3)RFU/mgprot显著升高(P<0.05),也显著高于处理组的(127150.0±12337.6)RFU/mgprot(P<0.05);模型组大鼠线粒体内 Cytc为(0.17±0.03)ng/mgprot,较正常组大鼠线粒体内的(0.39±0.10)ng/mgprot显著减少(P<0.05),也低于处理组的(0.32±0.06)ng/mgprot(P<0.05)。结论ACY1215对急性肝衰竭大鼠肝脏线粒体有一定的保护作用,其作用机制可能是通过抑制肝细胞线粒体MPTP的开放,从而减少了Cytc进入到细胞质内有关。
急性肝衰竭;线粒体;组蛋白去乙酰化抑制剂 ACY1215;大鼠
有研究发现,急性肝衰竭大鼠肝脏线粒体产能远低于正常大鼠[1,2]。线粒体膜通透性转换器(mitochondrial permeability transition,MPTP)是一种跨越线粒体内外膜的蛋白孔道,在正常生理条件下处于关闭状态。各种药物、氧化刺激、Ca+和pH值的变化可通过一定的途径使得MPTP开放,导致细胞色素C(Cytochrome C,Cytc)和细胞因子从线粒体漏入到胞质,从而损害肝细胞线粒体氧化磷酸化和能量代谢过程。肝细胞线粒体的损伤会进一步导致肝细胞呼吸功能受损,能量代谢失衡,最终导致细胞凋亡或坏死[3-5]。有研究发现,抗肿瘤药物去乙酰化组蛋白酶(histone deacetylase,HDAC)抑制剂对急性肝衰竭大鼠肝细胞有保护作用[6,7],但目前尚缺乏相关文献证实该类药物对肝细胞线粒体是否具有一定的保护作用。本研究观察了选择性VI类HDAC抑制剂ACY1215对急性肝衰竭大鼠的保护作用及对肝细胞线粒体的影响。
1 材料与方法
1.1 实验器材、药物与主要试剂 VICTOR3 1420型酶标仪购自芬兰PerkinElmer公司;HT7700电子显微镜购自日本HITACHI公司;脂多糖(LPS)和D-氨基半乳糖(D-Gal)均购自美国Sigma-Aldrich公司;ACY1215购自美国Selleck公司;组织线粒体分离试剂盒及BCA蛋白定量试剂盒购自武汉碧云天生物技术公司;GENMED纯化MPTP荧光检测试剂盒购自上海杰美基因公司;检测大鼠CYTC-C酶联免疫试剂盒购自南京建成生物工程研究所;10%中性福尔马林购自武汉谷歌生物科技有限公司。
1.2 急性肝衰竭大鼠模型的制备 取健康雄性SPF级SD大鼠24只,体质量(200~230)g,购自武汉大学动物实验中心。将大鼠随机分为正常组、模型组和ACY1215干预组,每组8只。实验前,所有大鼠适应喂养5 d。在干预组动物,在制备急性肝衰竭模型前 2 h,给予 ACY1215 10 mg·kg-1腹腔注射;在正常组大鼠,给予等量的生理盐水注射;在急性肝衰竭模型组,给予 D-Gal 400 mg·kg-1和 LPS 100 μg·kg-1腹腔注射。在造模后48 h,处死所有大鼠,收集每只大鼠血液和0.3×0.4×0.4 cm大鼠肝组织,固定于10% 中性甲醛溶液中,石蜡常规包埋,切片后行HE染色,光镜下观察。同时取约1 mm3大小的肝组织,置于2.5%戊二醛内固定30 min,行电镜标本制作,电镜下观察肝细胞线粒体形态变化。
1.3 血清生化指标检测 常规进行。
1.4 肝细胞线粒体的制备 取新鲜肝组织100 mg,PBS洗涤,加入预冷的线粒体分离试剂A液100 μl,冰浴上匀浆10次。在4℃ 600 g离心5 min,取上清液,11000 g再次离心10 min,得到的沉淀即为线粒体标本。
1.5 肝细胞线粒体MPTP相对荧光值(relative fluorescence unit,RFU)测定 采用荧光酶标仪检测钙黄绿素-AM,后者又称双甲亚胺二乙酸钠荧光素-乙酰氧基甲基酯([bis(bis-carboxymethy amino methyl fluorescein)-acetoxymeyhyl ester],易进入到细胞的线粒体内,后者可被线粒体内的内酯酶切离,产生具有荧光性强的钙黄绿素,被线粒体俘获。当MPTP处于开放状态时,钙黄绿素释放出线粒体外,再通过离心处理,荧光强度会减弱。故线粒体内钙黄绿素荧光的变化代表了MPTP的开放状态。具体的实验步骤按照GENMED纯化线粒体膜通道孔荧光检测试剂盒产品说明书进行。同时,每组对应的线粒体标本进行BCA蛋白定量,以校准单位线粒体蛋白浓度下MPTP开放情况。
1.6 肝细胞线粒体Cytc测定 在提取纯化线粒体后,在100 mg肝组织分离得到的线粒体样品中加入临用前添加了PMSF(终浓度1 mmol/L)的线粒体裂解液200 μl,裂解线粒体,采用ELISA法测定。1.7统计学处理 应用SPSS 16.0统计软件进行分析,计量资料以(±s)表示,采用 t检验,采用 Pearson相关分析。显著性差异取α=0.05,即以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠肝组织病理学变化 正常组大鼠肝小叶结构清楚,肝细胞排列整齐,肝细胞周围无炎性细胞浸润;急性肝衰竭大鼠肝小叶结构模糊,肝细胞大块坏死,周围可见炎性细胞浸润;ACY1215干预组大鼠肝小叶结构较清晰,较急性肝衰竭模型组肝细胞坏死明显减轻,且炎性细胞浸润亦明显减少(图1)。

图1 各组肝组织学表现(HE,200×)
2.2 各组大鼠肝组织超微结构的改变 正常组大鼠肝细胞线粒体内外膜完整,线粒体嵴结构清晰,连续性完整;急性肝衰竭大鼠肝细胞线粒体肿胀明显,内外膜连续性明显被破坏,线粒体嵴断裂且结构模糊;ACY1215干预组大鼠肝细胞线粒体肿胀较急性肝衰竭大鼠明显减轻,内外膜连续性较完整,线粒体嵴断裂明显减少,结构较清晰(图2)。
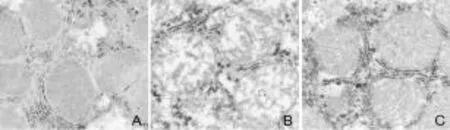
图2 各组大鼠肝组织超微结构的变化(1000×)
2.3 各组大鼠肝功能指标的变化 急性肝衰竭大鼠血清ALT、AST和TBIL水平较正常组大鼠显著升高,差异具有统计学意义(P<0.05);ACY1215 干预组大鼠血清ALT、AST和TBIL水平较模型组明显降低,差异具有统计学意义(P<0.05,表 1)。
表1 三组大鼠血清肝功能指标(±s)比较

表1 三组大鼠血清肝功能指标(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只数 ALT(U/L) AST(U/L) TBIL(μmol/L)正常组 8 56.0±4.4 130.4±12.6 7.4±0.7模型组 8 5114.1±252.6① 2909.8±31.7① 97.6±1.4①干预组 8 799.4±11.2①② 401.0±5.6①② 28.0±1.2①②
表2 三组大鼠肝组织线粒体蛋白浓度和线粒体MPTP开放情况(±s)比较

表2 三组大鼠肝组织线粒体蛋白浓度和线粒体MPTP开放情况(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只数 MPTP(RFU) 线粒体蛋白(mg/ml) MPTP校准(RFU/mgprot)正常组 8 796510.0±52067.5 5.2±0.5 156300.0±24043.3模型组 8 348580.0±55815.5① 3.6±0.5 96822.0±16733.1①干预组 8 551330.0±88355.3①② 4.3±0.4 127150.0±12337.6①②
2.4 各组大鼠肝组织线粒体蛋白浓度和线粒体MPTP开放情况比较 采用荧光酶标仪检测肝脏线粒体MPTP RFU值,其值越低,表示MPTP开放程度越高。急性肝衰竭大鼠MPTP水平较正常组大鼠显著降低,差异具有统计学意义(P<0.05);与急性肝衰竭模型组比,ACY1215干预组大鼠MPTP水平明显升高,差异具有统计学意义(P<0.05),但仍低于正常组大鼠,差异也具有统计学意义(P<0.05,表 2)。
2.5 三组大鼠肝脏线粒体蛋白浓度和线粒体内Cytc浓度比较 急性肝衰竭大鼠肝脏线粒体内Cytc水平较正常大鼠显著降低,差异具有统计学意义(P<0.05);与急性肝衰竭模型组比,ACY1215干预组大鼠肝脏线粒体内Cytc含量明显增高,差异具有统计学意义(P<0.05,表 3)。2.6 MPTP开放情况与线粒体内Cytc含量相关性分析 线粒体内的Cytc浓度变化与MPTP的开放程度呈负相关(r=0.603,P<0.05),表明随着线粒体MPTP开放增加,线粒体内Cytc含量随之减少。
表3 三组大鼠肝脏线粒体蛋白浓度和线粒体内Cytc浓度(±s)比较
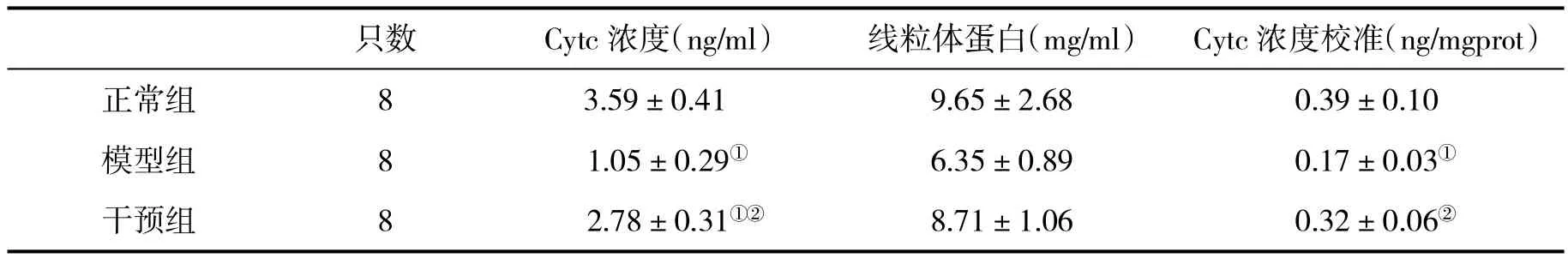
表3 三组大鼠肝脏线粒体蛋白浓度和线粒体内Cytc浓度(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只数 Cytc浓度(ng/ml) 线粒体蛋白(mg/ml) Cytc浓度校准(ng/mgprot)正常组 8 3.59±0.41 9.65±2.68 0.39±0.10模型组 8 1.05±0.29① 6.35±0.89 0.17±0.03①干预组 8 2.78±0.31①② 8.71±1.06 0.32±0.06②
3 讨论
组蛋白去乙酰化酶抑制剂作为一种新兴的抗肿瘤药物,在该研究领域已取得显著效果,特别是对多发性骨髓瘤、肺癌和肝癌等的治疗方面[8~13]。早先有研究探讨HDAC抑制剂TSA和MS-275对急性肝衰竭大鼠或小鼠的影响,发现该类药物可通过抑制相关炎症因子的释放等途径,达到改善肝脏功能和组织学的改变。本实验发现组蛋白去乙酰化酶抑制剂ACY1215对肝细胞具有保护作用,在形态学上观察的表现比较明显。电镜观察也证实对肝细胞的亚超微结构线粒体也可起到一定的保护作用。ACY1215干预的大鼠肝细胞线粒体肿胀情况及线粒体嵴损伤较急性肝衰竭组明显减轻,并且在一定程度上保护内外膜的完整性。作为线粒体功能障碍标志之一,伴随着Cytc释放入胞质,经过一系列途径激活Caspase-3,激活Caspase蛋白酶系统,已经成为一种经典的经线粒体凋亡途径[14,15]。Cytc作为线粒体呼吸链中不可缺少的电子传递体,其缺乏将影响线粒体能量的合成[16]。此外,在线粒体形态学改变的研究中,有报道称MPTP状态改变这一作用可使线粒体失极性以及氧化磷酸化解耦联而表现为极度肿胀[17]。武磊[18]等在研究HDAC抑制剂对大鼠应激性心肌损伤的保护作用时,发现HDAC抑制剂TSA可以抑制以线粒体介导的细胞凋亡为特征的线粒体损伤[19,20]。
[1]中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南.实用肝脏病杂志,2006,9(6):321-324.
[2]Chen LY,Yang B,Zhou L,et al.Promotion of mitochondrialenergy metabolism during hepatocyte apoptosis in a rat model of acute liverfailure.Mol Med Rep,2015,12(4):5035-5041.
[3]Crompton M.The mitochondrial permeability transition pore and its role in cell death.Biochem J,1999,341(2):233-249.
[4]Halestrap AP.The mitochondrial permeability transition:its molecular mechanism and role in reperfusion injury.Biochem Soc Symp,1999,66:181-203.
[5]Halestrap AP,McStay GP,Clarke SJ.The permeability transition pore complex:another view.Biochimie,2002,84(2-3):153-166.
[6]Zhang Q,Yang F,Li X,et al.Trichostatin A protects against intestinal injury in rats with acute liver failure.J Surg Res,2016,205(1):1-10.
[7]张海月,李讯,张倩,等.MS-275对急性肝衰竭小鼠肝脏的保护作用. 中华临床感染病杂志.2016,9(4):325-330.
[8]Bernal W,Auzinger G,Dhawan A,et al.Acute liver failure.Lancet,2010,376(9736):190-201.
[9]Cardoso FS,Marcelino P,Bagulho L,et al.Acute liver failure:An up-to-date approach.J Crit Care,2017,39:25-30.
[10]丁美,刘旭华,段钟平.D-氨基半乳糖/脂多糖诱导急性肝衰竭大鼠肝细胞凋亡的电镜观察.实用肝脏病杂志.2008,11(6):357-360.
[11]Laubach JP,San-Miguel JF,Hungria V,et al.Deacetylase inhibitors:an advance in myeloma therapy.Expert Rev Hematol,2017,1:1-9.
[12]Buurman R,Sandbothe M,Schlegelberger B,et al.HDAC inhibition activates the apoptosome via Apaf1 upregulation in hepatocellular carcinoma.Eur J Med Res,2016,21(1):26.
[13]Pan CH,ChangYF,Lee MS,et al.Vorinostat enhances the cisplatin-mediated anticancer effects in small cell lung cancer cells.BMC Cancer,2016,16(1):857.
[14]Nakagawa Y,Suzuki T,Kamimura H,et al.Role of mitochondrial membrane permeability transition in N-nitrosofenfluramine-induced cell injury in rat hepatocytes.Eur J Pharmacol,2006,529(1-3):33-39.
[15]Joza N,Susin SA,Daugas E,et al.Essential role of the mitochondrial apoptosis-inducing factor in programmed cell death.Nature,2001,410(6828):549-554.
[16]Hüttemann M,Helling S,Sanderson TH,et al.Regulation of mitochondrial respiration and apoptosis through cell signaling:cytochrome C oxidase and cytochrome C in ischemia/reperfusion injury and inflammation.Biochim Biophys Acta,2012,1817(4):598-609.
[17]Sesso A1,Marques MM,Monteiro MM,et al.Morphology of mitochondrialpermeability transition:morphometric volumetry in apoptotic cells.AnatRec A Discov MolCellEvolBiol,2004,281(2):1337-1351.
[18]武磊,刘晓华,王天辉.组蛋白去乙酰化酶抑制剂对大鼠应激性心肌损伤的保护作用.中国应用生理学杂志,2015,31(3):193-196.
[19]Chang Z1,Li Y,He W,et al.Selective inhibition of histone deacetylase 6 promotes survival in a rat model of hemorrhagic shock.J Trauma Acute Care Surg,2015,79(6):905-910.
[20]Li S,Tang Z,Yu H et al.Administration of naked plasmid encoding hepatic stimulator substance by hydrodynamic tail vein injection protects mice from hepatic failure by suppressing the mitochondrial permeability transition.J Pharmacol Exp Ther,2011,338(3):750-757.
(收稿:2017-03-20)
(本文编辑:陈从新)
Protective effect of histone deacetylase inhibitor ACY1215 on hepatocyte mitochondria in rats with acute hepatic failure
Chen Qian,Jiao Fangzhou,Zhang Haiyue,et al.Department of Infectious Disease,Renmin Hospital,Wuhan University,Wuhan 430060,Hubei Province,China
ObjectiveTo investigate the protective mechanism of histone deacetylase inhibitor ACY1215 on liver mitochondrial damage in rats with acute hepatic failure(AHF).Methods24 male SD rats were randomly divided into control group,model group and ACY1215-intervened group.Lipopolysaccharide (LPS) and D-galactosamine(D-Gal)were used to establish acute liver failure model in rats.The ACY1215 (10 mg·kg-1)was given 2 hours before the establishment of acute liver failure.Serum and liver samples of rats were obtained at end of 48 hours after AHF induction.The liver histological changes were observed by light and electron microscopy,and the mitochondria of hepatocytes were separated by gradient centrifugation.The relative fluorescence(RFU) of mitochondrialmembrane permeability transition porosity (MPTP) was tested by fluorescence spectrometry.The content of cytochrome C(Cytc)in mitochondria supernatants was determined by ELISA.The contents of serum ALT,AST and total bilirubin were detected by routine biochemical method.ResultsCompared with in the model group,the degree of liver histological damage was reduced in the ACY1215-intervened group,and the mitochondrial swelling of the hepatocytes was improved;serum ALT[(5114.1±252.6) U/L vs.(56.0±4.4)U/L],AST[(2909.8±31.7)U/L vs.(130.4±12.6) U/L]and total bilirubin levels[(97.6±1.4) μmol/L vs. (7.4±0.7) μmol/L]in the model group were significantly higher than those in the control group(P<0.05),while they[(799.4±11.2)U/L,(401.0±5.6)U/L and (28.0±1.2)μmol/L,respectively]in the ACY1215-intervened group significantly decreases as compared to those in the model group (P<0.05);the MPTP in acute liver failure model group was significantly higher than that in the normal control group[(968220.0±16733.1)RFU/mgprot vs.(156300.0±24043.3)RFU/mgprot,P<0.05)],and also higher than in the ACY1215-intervened group[(127150.0±12337.6) RFU/mgprot,P<0.05];the mitochondrial Cytc level in the model group was significantly lower than that in the control group [(0.17±0.03)ng/mgprot vs. (0.39±0.10)ng/mgprot,P<0.05],and also lower than that in the ACY1215-intervened group[(0.32 ±0.06) ng/mgprot,P<0.05].ConclusionACY1215 has a protective effect on liver mitochondria in rats with acute hepatic failure,and the mechanism might be the inhibition of opening of mitochondrial MPTP in the livers and reduction of translocation of Cytc into the cytoplasm.
Acute hepatic failure;Mitochondria;Histone deacetylase inhibitor ACY1215;Rats
10.3969/j.issn.1672-5069.2017.06.009
国家自然科学基金资助项目(编号:81371789)
430060武汉市 武汉大学人民医院感染病科
陈倩,女,22岁,硕士研究生。主要从事病毒性肝炎防治研究。E-mail:1252191988@qq.com
龚作炯,E-mail:zjgong@163.com
