乳腺良性叶状肿瘤复发相关危险因素及麦默通手术的可行性
2017-12-06朱大江范旭龙
朱 婧,朱大江,范旭龙,平 静
佛山市妇幼保健院1乳腺疾病防治中心,2病理科,广东 佛山 528000
乳腺良性叶状肿瘤复发相关危险因素及麦默通手术的可行性
朱 婧1,朱大江1,范旭龙1,平 静2
佛山市妇幼保健院1乳腺疾病防治中心,2病理科,广东 佛山 528000
目的探讨乳腺良性叶状肿瘤术后复发相关危险因素及麦默通手术的可行性。方法2007年1月~2016年5月,佛山市妇幼保健院收治乳腺良性叶状肿瘤113例,开放手术扩大切除58例,麦默通旋切手术活检55例,对患者临床及病理资料进行回顾性研究。结果开放手术治疗与麦默通微创旋切治疗组间复发率无统计学差异(P>0.05),发病年龄分别为38.8±8.1岁与34.9±8.1岁,肿瘤直径分别为3.6±1.3 cm与2.0±0.7 cm,差异均有统计学意义(P<0.05)。复发组与无复发组间肿瘤大小及核分裂有统计学意义(P<0.05)。但以肿瘤大小分组后, 肿瘤<2.5 cm组术式选择与复发无统计学意义(P=0.67)。结论乳腺良性叶状肿瘤患者术后复发与肿瘤病理特征有关,大小<2.5 cm的叶状肿瘤通过麦默通微创旋切治疗是安全可行的。
乳腺良性叶状肿瘤;临床特点;复发因素;麦默通
乳腺叶状肿瘤是一种具有潜在侵袭性的纤维上皮性肿瘤,临床上少见,约占乳腺肿瘤的0.3%~1%[1]。其生物学行为有复发甚至恶变倾向,目前临床对其局部复发的预测无精确有效的指标。有学者认为扩大切除可减少复发,也有学者认为复发与肿瘤间质增生、核分裂、细胞异形等增殖性质有关[2-4]。由于麦默通旋切手术的微创性,临床中越来越多将其应用于BI-RADS 3级肿瘤活检治疗。当术后病理结果提示为良性叶状肿瘤时,是否需要再次开放手术扩大切除,选择观察处理是否安全,这些问题让乳腺外科医生感到困惑。本研究收集了佛山市妇幼保健院乳腺科2007年1月~2016年5月共113例乳腺良性叶状肿瘤患者临床及病理资料,进行回顾性研究,探讨乳腺良性叶状肿瘤术后复发相关危险因素及麦默通微创旋治疗乳腺良性叶状肿瘤的安全性。
1 资料与方法
1.1 临床资料
收集佛山市妇幼保健院乳腺科2007年1月~2016年5月收治的手术治疗并经病理确诊乳腺良性叶状肿瘤病例共计113例。纳入标准:主诉为新发乳腺肿瘤,已行肿瘤切除(麦默通切除或开放手术切除),术后病理提示良性叶状肿瘤。排除标准:局部复发乳腺肿瘤,术后病理提示为交界性叶状肿瘤或恶性叶状肿瘤者。
患者均为女性,年龄20~59岁(36.9±8.3岁)。肿物大小直径0.8~6.5 cm,平均2.8±1.3 cm,多呈圆形、分叶状,边界清楚,质韧,活动度好。术前均行乳腺高频B超检查,BI-RADS分级3-4a类;39例患者年龄>35岁,加行乳腺钼靶检查。
1.2 治疗方法
全部病例采用手术治疗,24例患者B超报告BIRADS 4a类,手术前行肿瘤空芯针穿刺活检,病理提示乳腺纤维腺瘤9例,叶状肿瘤15例,诊断符合率62.5%。
肿瘤开放手术扩大切除54例,切除肿瘤、包膜及周围少许正常腺体。麦默通旋切术后再次行扩大切除者4例,按肿瘤开放手术患者统计,扩大切除标本均未见肿瘤残留。
单纯麦默通旋切治疗55例,超声引导下完全切除肿瘤,超声检查未见原病灶区低回声病变,最后切除标本肉眼检查为正常腺体。
手术标本均行病理检查,参照WHO分级法诊断为良性叶状肿瘤[5]。
1.3 统计学处理
采用SPSS 22.0软件进行分析,计量资料以均数±标准差表示,采用两独立样本t检验,计数资料采用卡方检验,P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况
按术式不同分组行常规项目及病理特征项目统计,行开放手术患者较微创手术患者年龄较大,肿瘤体积较大(P<0.05,表1)。
表1 患者一般情况(, n)
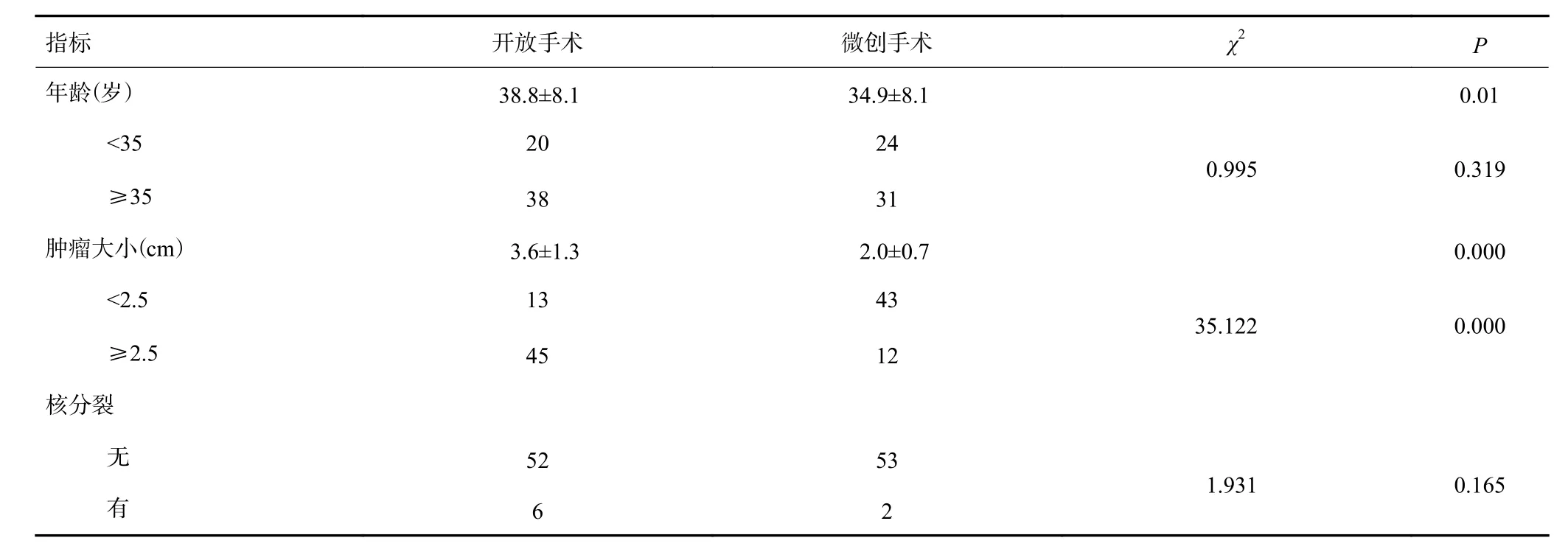
表1 患者一般情况(, n)
指标 开放手术 微创手术 χ2 P年龄(岁) 38.8±8.1 34.9±8.1 0.01<35 20 24 0.995 0.319≥35 38 31肿瘤大小(cm) 3.6±1.3 2.0±0.7 0.000<2.5 13 43 35.122 0.000≥2.5 45 12核分裂无52 53 1.931 0.165有6 2
2.2 随访结果
患者术后首2年内每3月复查,其后每6~12月门诊随访,随访时间13~113月,平均35.6±19.8月,复发17例,其中1例复发为交界性叶状肿瘤,余均为良性叶状肿瘤,复发率15%。最短复发间隔时间为术后7月,最长为术后63月,中位复发间隔时间为术后16月,平均20.3月。未复发与复发分组相比,肿瘤体积较小,核分裂少具有统计学意义;而组间患者年龄、手术方式等方面则差异无统计学意义(表2)。
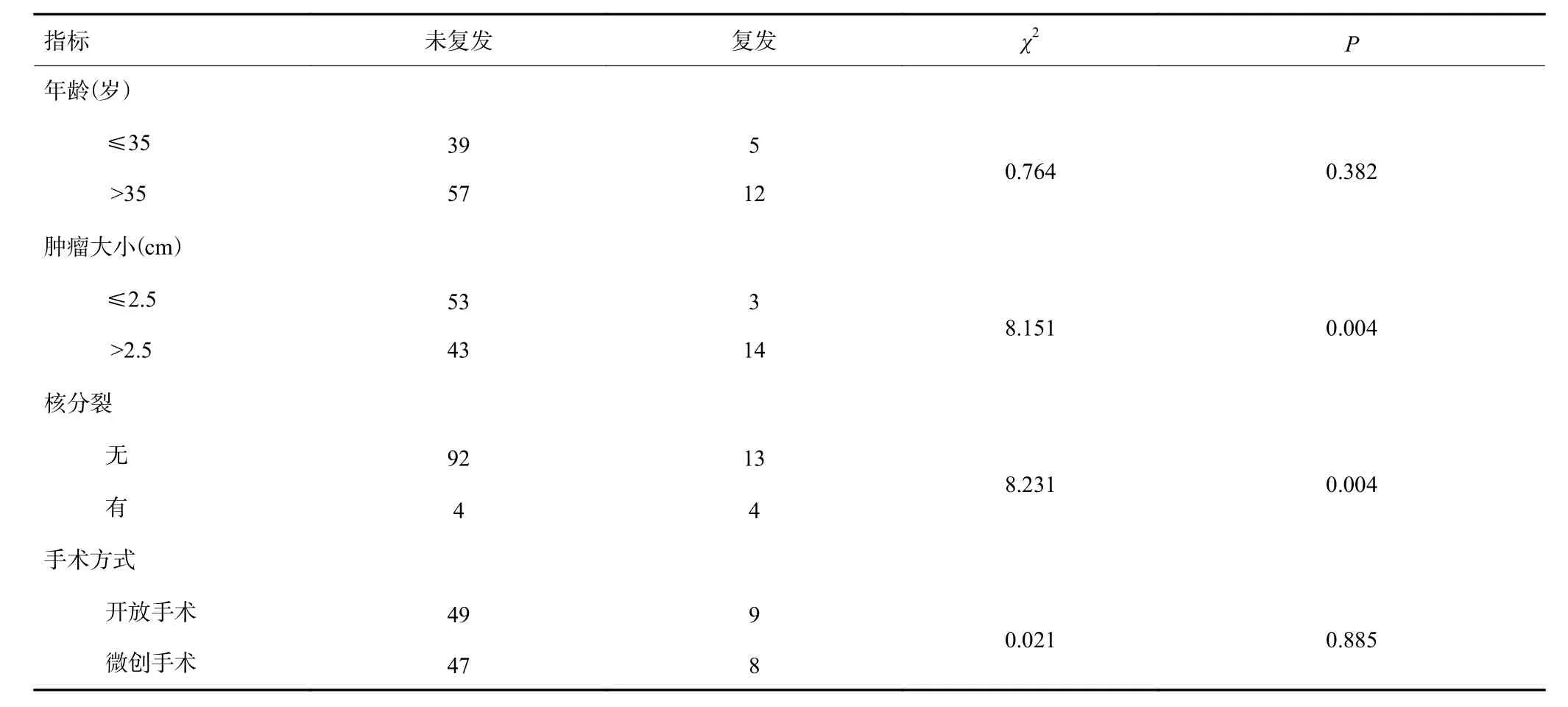
表2 复发分组情况(n)
2.3 肿瘤大小分组结果
因肿瘤大小在手术方式选择及复发风险分组中均有统计学意义,排除肿瘤大小因素,分组后再进行χ2检验,在肿瘤<2.5 cm时复发风险与手术方式无关(P=0.670),肿瘤≥2.5 cm后,复发风险在不同术式间差异有统计学意义(P=0.021,表3)。
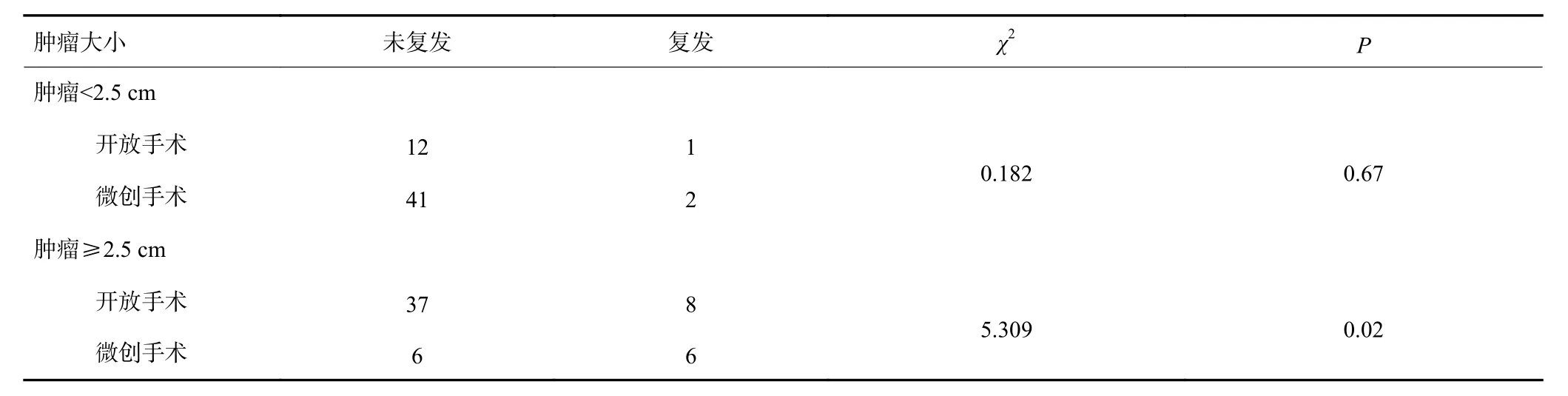
表3 大小肿瘤组术式与复发情况(n)
3 讨论
乳腺叶状肿瘤在1838年首先由Muller[6]命名为“叶状囊肉瘤”,描述该肿瘤大体切面标本呈鱼肉样、分叶状且有囊肿的外观。1982年WHO推荐更名为“分叶状肿瘤”,2003 年WHO统称其为乳腺叶状肿瘤[5]。其发病机制目前尚不清楚,叶状肿瘤临床上发病率较低,占所有乳腺肿瘤的0.3%~1%,占乳腺纤维上皮性肿瘤的2.5%[7]。发病年龄多数在40岁以后,病变多为单侧,大多数病程较长,肿瘤体积较大,可有肿瘤突然加速生长的病史,有术前诊断率低、术后易复发等特点。
区别叶状肿瘤良性、交界性和恶性的组织学指标包括:间质细胞丰富程度、间质细胞非典型性/多形性、间质细胞核分裂象数量、肿瘤边缘情况和间质过度生长[7]。良性叶状肿瘤的一般特征为间质细胞数量中等、间质细胞核轻度多形性和核分裂象少。肿瘤边界大多界限清晰,或呈推挤性。可出现小灶性浸润。无间质过度生长。可有异源性间质成分如脂肪、骨、软骨和骨骼肌等。常需要与富于细胞性纤维腺瘤鉴别。无论良性、交界性还是恶性叶状肿瘤,都有局部复发的倾向,随着复发次数增加,肿瘤恶性程度逐步增加[2-3]。
手术切除是叶状肿瘤的主要治疗方式,但由于其较高复发风险,国内外大量研究针对手术范围及肿瘤病理等研究,认为病变复发主要取决于切除范围、肿瘤大小以及肿瘤组织学类型[8-11]。有研究认为即使初次手术切缘阴性的良性乳腺叶状肿瘤也存在复发的可能,应定期随访[12]。另有研究分析118例良性及交界性叶状肿瘤却发现交界性肿瘤复发率高,肿瘤复发状态与切缘宽度无统计学差异,肿瘤广泛切除并不能预防其复发[13]。
乳房是女性重要的美学器官,手术治疗乳腺疾病时能更好保证其美学功能尤为重要[14]。1996年首先有文献报道Mammotome在乳腺活检中应用[15]。由于其较小的手术切口、较短的手术及住院时间、较少的手术出血、较轻微的术后疼痛等优越性,麦默通微创旋切术越来越多应用于乳腺疾病的临床治疗[16-18]。这其中不乏术后病理诊断为叶状肿瘤的患者,但是否所有患者都需要再次手术扩大切除?这明显违背了微创手术治疗的初衷。临床工作中也观察到并非所有患者都出现局部肿瘤复发。什么情况下扩大切除可降低复发风险,或者说哪些患者选择观察治疗是安全的,在叶状肿瘤复发原因不明的情况下,后续的治疗选择让乳腺外科医生困惑。
本研究中观察共113例病理确诊为良性叶状肿瘤患者,自主选择开刀扩大切除手术及麦默通微创手术。门诊随访结果经统计分析,发现肿瘤大小与有无核分裂是局部复发重要预测因素,这与既往研究结果较一致[19]。当本研究以肿瘤大小将患者分组后发现,在肿瘤<2.5 cm时,麦默通微创手术及开放扩大切除组间复发无统计学差异。肿瘤<2.5 cm共43例患者,复发2例,考虑其原因是麦默通刀槽大小2.3 cm×0.3 cm,由于腺体及瘤体组织具有一定变形性,到一般肿瘤<2.5 cm可以达到完全切除效果。有学者认为良性肿瘤<3.0 cm都可以通过麦默通微创手术治疗[20]。有研究[21]统计了2003年1月~2011年12月间5434例患者行真空辅助微创旋切手术,其中53例为乳腺良性叶状肿瘤,31例进行了>24月随访,对这31例患者进行回顾性分析,平均随访75.9月,只有1例复发。31例患者肿瘤大小平均1.6±0.88 cm,微创手术后复发仅1例,可能也与研究组肿瘤体积较小,切除病变较完全有关。
良性叶状肿瘤呈膨胀性生长,大体标本常有肉眼可见的边界。麦默通微创手术时,从标本观察到肿瘤边界时,再切除多1条正常组织,即可达到扩大切除约2~5 mm的手术效果。这可能是肿瘤较小时麦默通微创手术肿瘤复发率与开放手术无差异的原因。当肿瘤体积增大,切割次数多,容易造成瘤腔内积气,影响超声观察,增加肿瘤残留风险,亦增加了肿瘤复发风险。
综上所述,本研究发现良性叶状肿瘤的体积大小及有无核分裂是复发的预测因素。在肿瘤大小<2.5 cm时,不同手术方式选择间肿瘤复发风险无统计学差异,即麦默通微创活检发现的<2.5 cm良性叶状肿瘤手术患者,特别是病理提示无核分裂时,无需行扩大切除手术治疗。麦默通微创活检手术后病理提示良性叶状肿瘤患者,肿瘤平均复发时间20.3月,术后2年内每3月1次的密切随访检查对早期发现肿瘤复发有意义。
[1]Zhou ZR, Wang CC, Yang ZZ, et al. Phyllodes tumors of the breast: diagnosis, treatment and prognostic factors related to recurrence[J]. J Thorac Dis, 2016, 8(11): 3361-8.
[2]王 慧, 王 翔, 王成锋. 乳腺叶状肿瘤的临床预后分析[J]. 中华肿瘤杂志, 2015, 37(12): 923-7.
[3]张珊珊, 秦 云, 张轶华, 等. 复发性乳腺叶状肿瘤的临床病理特征分析[J]. 中国实用医药, 2017, 12(8): 90-1.
[4]贾 翠, 韩邦彩, 何 飞, 等. ER, PR, CD34, P16在乳腺叶状肿瘤中的表达及预后相关性分析[J]. 成都医学院学报, 2016, 11(6):652-61.
[5]Tavassoli F, Devilee P. World Health Organization classification of tumors:pathology & genetics of tumors of the breast and female genital organs[M]. lyon: IARC Press, 2003: 99-103.
[6]Muller J. Uber den feineran Ban and die Forman der Krankaften Geschwilste[M]. Berlin: G Reinmer, 1838: 54-7.
[7]龚西騟, 丁华野. 乳腺病理学[M]. 北京: 人民卫生出版社, 2009:451-3.
[8]Moffat CJ, Pinder SE, Dixon AR, et al. Phyllodes tumours of the breast: a clinicopathological review of thirty-two cases[J]. Histopathology, 1995, 27(3): 205-18.
[9]Guillot E, Couturaud B, Reyal F, et al. Management of phyllodes breast tumors[J]. Breast J, 2011, 17(2): 129-37.
[10]Jang JH, Choi MY, Lee SK, et al. Clinicopathologic risk factors for the local recurrence of phyllodes tumors of the breast[J]. Ann Surg Oncol, 2012, 19(8): 2612-7.
[11]秦悦农, 陈莉颖, 鲍以嘉. 叶状肿瘤的临床特点及复发因素分析[J]. 实用癌症杂志, 2015, 30(7): 1044-7.
[12]Sakurai K, Enomoto K, Amano S. Long-term results of surgical therapy for phyllodes tumor of the breast[J]. Gan Kagaku Ryoho,2010, 37(12): 2784-5.
[13]李晓平, 余绮荷, 黄 晖, 等. 良性与交界性叶状肿瘤局部复发风险的分析[J]. 岭南现代临床外科, 2017, 17(1): 24-6.
[14]骆成玉. 微创时代的乳腺外科-理想与现实的抉择[J]. 中国微创外科杂志, 2014, 14(2): 97-101.
[15]Burbank F, Parker SH, Fogarty TJ. Stereotactic breast biopsy:improved tissue harvesting with the Mammotome[J]. Am Surg,1996, 62(9): 738-44.
[16]李 鑫, 骆成玉, 李海连, 等. 真空辅助微创旋切系统治疗乳腺良性叶状肿瘤的临床研究[J]. 中华乳腺病杂志: 电子版, 2016, 10(5):291-4.
[17]王 健, 张丽娜, 顾 林. 麦默通在乳腺良性肿块治疗中的应用研究[J]. 天津医药, 2016, 44(4): 385-8.
[18]那将超, 狄长安, 殷咏梅. 麦默通微创旋切术与传统手术治疗乳腺肿块效果对比分析[J]. 临床和实验医学杂志, 2015, 14(6): 435-8 .
[19]贾 翠, 梅 放, 柳剑英, 等. 乳腺叶状肿瘤的分级指标及预后相关因素探讨[J]. 中华病理学杂志, 2017, 46(1): 14-9.
[20]马斌林, 耿中利, 单美慧, 等. B超引导下Mammotome微创旋切技术在乳腺良性肿块外科治疗应用研究[J]. 新疆医科大学学报, 2009, 32(7): 839-41.
[21]Park HL, Kwon SH, Chang SY, et al. Long-Term Follow-Up result of benign phyllodes tumor of the breast diagnosed and excised by Ultrasound-Guided Vacuum-Assisted breast biopsy[J]. J Breast Cancer, 2012, 15(2): 224-9.
Risk factors associated with recurrence of benign breast phyllodes tumors and the feasibility of Mammotome operation
ZHU Jing1, ZHU Dajiang1, FAN Xulong1, PING Jing2
1The Center of Breast Diseases,2Department of Pathology, Maternal and Children Healthcare Hospital of Foshan, Foshan 528000, China
ObjectiveTo explore the risk factors associated with recurrence of benign breast phyllodes tumors and the feasibility of Mammotome operation.MethodsThe clinic and pathological data were retrospectivly analyzed in 113 cases with benign PT who
surgery in the Maternal and Children Healthcare Hospital of Foshan from Jan 2007 to May 2016. There were 58 cases of open surgery and 55 cases of Mammotome surgery.ResultsThe recurrence rate in two groups were not significantly different. The differences of age and tumor size in 2 group were significant.The average age were 38.8±8.1 and 34.9±8.1 years. The average tumor diameter were 3.6±1.3 cm and 2.0±0.7 cm. The differences of tumor size and mitosis in recurrence group and no recurrence group were significant. However, difference of recurrence was not significant between different surgery choice in the small tumor group (P=0.67).ConclusionRecurrence of PT is related to pathological features.Mammotome treatment is safe and feasible when tumor size <2.5 cm.
benign breast phyllodes tumor; clinical characteristics; recurrence factors; Mammotome
2017-06-18
朱 婧,副主任医师,E-mail: zjsmalll@vip.sina.com
