榛苓颗粒质量标准研究
2017-12-06张蕊多王仁广贾艾玲
王 畅,张蕊多,王仁广,郭 静,贾艾玲*
榛苓颗粒质量标准研究
王 畅1,2,张蕊多1,王仁广1,郭 静1,2,贾艾玲1,2*
目的为榛苓颗粒建立质量标准。方法薄层色谱法对榛苓颗粒中的大黄、人参、陈皮、穿山甲四味药材进行定性分析;高效液相色谱法测定大黄中大黄素和大黄酚的含量。填充剂为十八烷基硅烷键合硅胶;流动相为甲醇-0.1%磷酸水溶液(85∶15);检测波长254 nm。理论塔板数按大黄素峰计算应高于3 000。流速:1 mL/min。结果大黄、人参、陈皮、穿山甲四味药的薄层色谱图斑点清楚可见,有很好的分离效果。当大黄素浓度在0.321 6~25.728 μg/mL范围内,大黄酚浓度在0.303 2~24.256 0 μg/mL范围内时,线性关系良好。精密度、稳定性、重现性试验的RSD<3%。大黄素的加样回收率为101.17%,RSD值为1.39%;大黄酚的加样回收率为101.39%,RSD值为1.30%。加样回收率良好。结论此方法简单可行,重现性好,针对性强,可以很好地控制榛苓颗粒的质量。
榛苓颗粒;质量标准;高效液相色谱法;薄层色谱法;大黄素
0 引言
榛苓颗粒由长春国家生物产业基地医药中试平台生产研究,经榛花、土茯苓、益母草、丹参、大黄、陈皮、蝉蜕、血竭粉、人参、穿山甲粉、枸杞子11味中药提取纯化而得,具有活血化瘀、通络止渴的功效,对糖尿病肾病有很好的治疗作用。该制剂为我校南征教授用于治疗糖尿病肾病的方剂,其剂型稳定、疗效可靠,在临床上卓有成效。现代药理研究证明,该制剂中君药榛花的水提液可以提高肝糖原含量,降低血糖,具有保护肝脏的功能。大黄的首要有效成分为蒽醌类化合物[1-4],临床上用于治疗慢性肾功能衰竭等病症。人参的主要化学成分为人参皂苷及多糖,具有止渴生津、调和营卫、补脾益肺、通络活血等作用[5-7]。为了更好地控制榛苓颗粒的成品质量,笔者用薄层色谱法对组方中的大黄、人参、陈皮、穿山甲四味药材进行定性分析,用高效液相色谱法对大黄中大黄素、大黄酚进行含量测定,为进一步开发新药奠定基础。
1 仪器与试药
1.1 仪器 LC-10AT型岛津高效液相色谱仪(日本岛津公司)、DZF-6050型真空干燥箱(上海一恒实验仪器总厂)、TP-150超声波清洗机(天鹏电子新技术有限公司)、BP211D电子分析天平(德国Sartorius公司)、EL-204电子天平[梅特勒-托利多仪器(上海)有限公司]。
1.2 试药 榛苓颗粒(长春国家生物产业基地医药中试平台提供,每袋含5 g,批号:20160701、20160702、20160703、20160715、20160716、20160717、20160801、20160802、20160803、20160804),大黄素(批号:110756-200110,质量分数≥98%)、大黄酚(批号:110796-201118,质量分数≥98%)、丹参酮ⅡA(批号:110766-200518,质量分数≥98%)、人参皂苷Rg1(批号:110703-201027,质量分数≥98%)、橙皮苷(批号:110721-201316,质量分数≥98%),以上对照品均由中国食品药品检定研究院提供。环己烷、冰醋酸、三氯甲烷、石油醚(30~60 ℃)(北京化工厂),乙醇、丙酮、甲醇(北京北化精细化学品有限公司)、色谱甲醇(美国Fisher公司)、薄层层析硅胶(青岛海洋化工有限公司)。
2 方法与结果
2.1 定性鉴别
2.1.1 大黄薄层鉴别[8]榛苓颗粒(批号:20160701)研成细粉(过六号筛),取1.0 g粉末置锥形瓶中,加20 mL甲醇后静置1 h,过滤,精密吸取5 mL续滤液置蒸发皿中,挥干溶剂后加入10 mL水溶解剩余残渣,水液置于锥形瓶中,加入1 mL盐酸加热回流30 min,待冷却后用40 mL乙醚液平均分2次萃取,合并乙醚层溶液后水浴挥干溶剂,加入1 mL甲醇溶解剩余残渣作为供试品溶液[9]。取除去大黄的其他10种药材制备的阴性对照品粉末(过六号筛)0.5 g,同样方法制备阴性对照品溶液。取0.1 g大黄药材制备大黄对照药材溶液。取大黄素及大黄酚对照品适量,加甲醇溶解制成1 mg/mL的混合标准品溶液。参照薄层色谱法(通则0502)试验,吸取2 μL标准品溶液、5 μL大黄对照药材溶液、10 μL供试品溶液、10 μL阴性对照品溶液,分别点于同一硅胶H薄层板上(羧甲基纤维素钠为黏合剂),展开剂为石油醚(30~60 ℃)∶甲酸∶甲酸乙酯(15∶1∶5)的上层溶液,置于展开缸内展开,取出晾干后置紫外灯(365 nm)下检视。从薄层色谱图可以看出,供试品与对照药材及标准品色谱图相对应位置,显相同颜色荧光斑点,且无阴性干扰。见图1。
2.1.2 人参薄层鉴别 榛苓颗粒(批号:20160701)研成细粉(过六号筛),取1.0 g粉末置于锥形瓶中,加入40 mL三氯甲烷,加热回流1 h,过滤弃去滤液,药渣挥干溶剂后加0.5 mL水搅拌,再加入10 mL水饱和正丁醇溶液超声提取30 min,精密吸取上层液体置于分液漏斗中,加入氨试液(3倍量)进行萃取,振摇均匀后放置,待分层后取上层溶液水浴挥干,加入1 mL甲醇溶解剩余残渣作为供试品溶液[9]。取除去人参的其他10种药材制备的阴性对照品粉末1 g,同样方法制备阴性对照品溶液。取1 g人参药材制备人参对照药材溶液。取人参皂苷Rg1标准品适量,加甲醇溶解制成2 mg/mL的标准品溶液。参照薄层色谱法(通则0502)试验,吸取2 μL标准品溶液、5 μL对照药材溶液、5 μL供试品溶液、5 μL阴性对照品溶液,分别点于同一硅胶G薄层板(羧甲基纤维素钠为黏合剂),取放置于10 ℃以下的三氯甲烷∶甲醇∶水∶乙酸乙酯(15∶22∶10∶40)混合液的下层溶液作为展开剂,放入展开缸内展开,取出薄层板晾干,10%硫酸乙醇溶液为显色剂,加热板(105 ℃)加热至斑点显色清晰,置紫外灯(365 nm)下检视。从薄层色谱图可以看出,供试品与对照药材及标准品色谱图所对应位置,都出现相同颜色荧光斑点,且无阴性干扰。见图2。
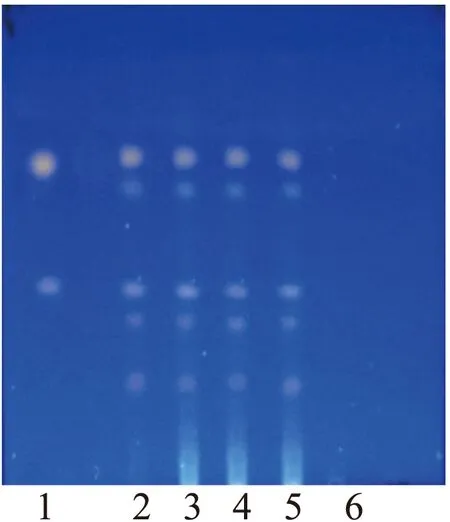
图1 大黄的TLC鉴别图谱注:1.大黄素、大黄酚对照品,2.大黄对照药材,3~5.供试 品,6.大黄阴性对照
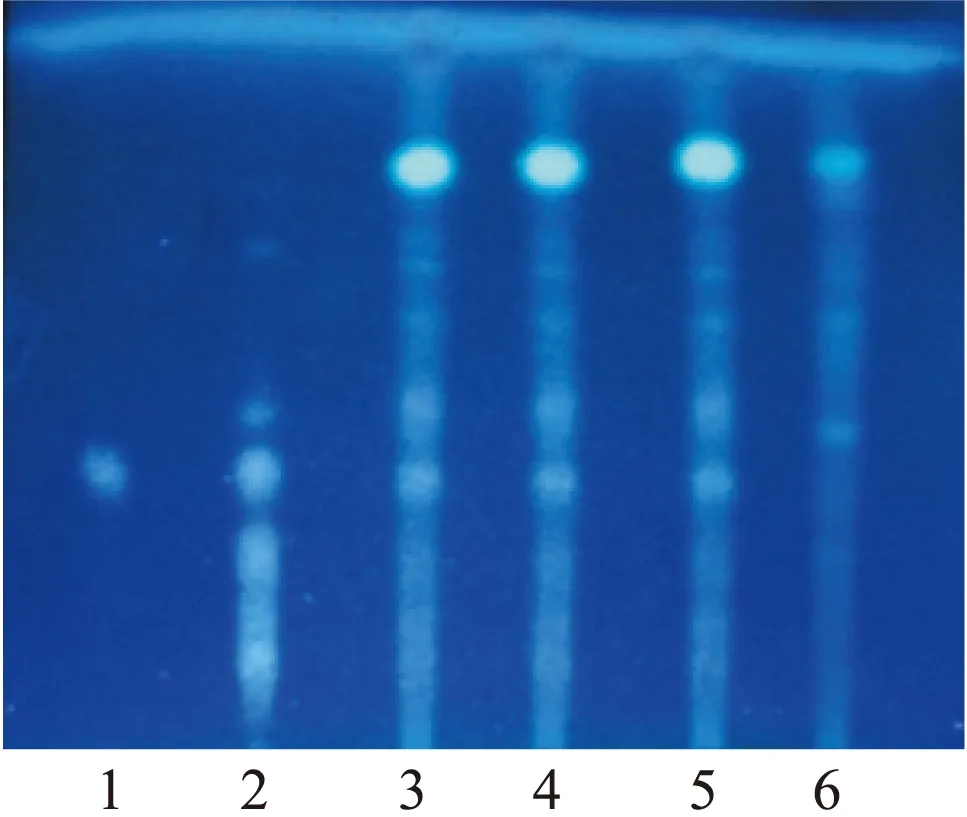
图2 人参的TLC鉴别图谱注:1.人参Rg1对照品,2.人参对照药材,3~5.供试品, 6.人参阴性对照
2.1.3 穿山甲薄层鉴别 榛苓颗粒(批号:20160701)研成细粉(过六号筛),取1.0 g粉末置于锥形瓶中,加60 mL三氯甲烷液加热回流4 h,过滤挥散滤液,加1 mL三氯甲烷溶解剩余残渣作为供试品溶液。取除去穿山甲的其他10种药材制成的阴性对照品粉末1 g,同样方法制成阴性对照品溶液[9]。取1 g穿山甲药材制备穿山甲对照药材溶液。参照薄层色谱法(通则0502)试验,吸取2 μL穿山甲对照药材溶液、2 μL阴性对照品溶液、2 μL供试品溶液,分别点于同一硅胶G薄层板(羧甲基纤维素钠为黏合剂),展开剂为丙酮∶甲苯(1∶20),置于展开缸内展开,取出薄层板晾干,喷以醋酐-硫酸(9∶1)的混合溶液,在80 ℃加热数分钟,置紫外灯(365 nm)下检视。从薄层色谱图可以看出供试品与对照药材相对应位置,显相同颜色荧光斑点,且无阴性干扰。见图3。

图3 穿山甲的TLC鉴别图谱注:1.穿山甲对照药材,2~4.供试品,5穿山甲阴性对照
2.1.4 陈皮薄层鉴别 榛苓颗粒(批号:20160701)研成细粉(过六号筛),取1.0 g粉末置于锥形瓶中,加入50 mL甲醇加热回流20 min,滤过,取滤液5 mL,浓缩至1 mL,作为供试品溶液。取除去陈皮的其他10种药材制备的阴性对照品粉末1 g,同样方法制备阴性对照品溶液[9]。取1 g陈皮药材制备陈皮对照药材溶液。另取橙皮苷标准品适量,加甲醇溶解制成标准品溶液。参照薄层色谱法(通则0502)试验,吸取2 μL橙皮苷标准品溶液、2 μL对照药材溶液、2 μL供试品溶液、2 μL阴性对照品溶液,分别点于同一硅胶G薄层板(5%氢氧化钠溶液制备),乙酸乙酯∶甲醇∶水(100∶l7∶13)为展开剂,展至约3 cm,取出,晾干,再以甲苯-乙酸乙酯-甲酸-水(20∶10∶1∶1)的上层溶液为展开剂,展至约8 cm,取出,晾干,三氯化铝试液为显色剂,置365 nm紫外灯下检视。从薄层色谱图可以看出,供试品与对照药材及标准品色谱图相对应位置,显相同颜色荧光斑点,且无阴性干扰。见图4。
2.2 大黄素、大黄酚含量测定
2.2.1 色谱条件 色谱柱:填充剂为十八烷基硅烷键合硅胶;流动相为甲醇-0.1%磷酸水溶液(85∶15);检测波长为254 nm。理论塔板数按大黄素峰计算应高于3 000。流速:1 mL/min,温度为30 ℃。

图4 陈皮的TLC鉴别图谱注:1.橙皮苷对照品,2.陈皮对照药材,3~5.供试品, 6.陈皮阴性对照
2.2.2 标准品溶液的制备 精密称取大黄素、大黄酚标准品适量,加甲醇溶解制成每毫升含大黄素16.08 μg、大黄酚15.16 μg的混合标准品溶液。
2.2.3 溶液的制备 供试品溶液的制备:榛苓颗粒(批号:20160701)研成细粉(过六号筛),精密称定0.6 g粉末置具塞锥形瓶中,精密加入25 mL甲醇后称定锥形瓶重量,加热回流1 h,待溶剂冷却后,再次称定锥形瓶重量,用甲醇补足损失的重量,振摇均匀后过滤,精密吸取5 mL续滤液置锥形瓶中。挥散溶剂后加入10 mL盐酸(8%)溶液,进行2 min超声提取,再加入10 mL三氯甲烷加热回流1 h,待溶液冷却后置于分液漏斗中。用少量三氯甲烷液冲洗容器,倒入分液漏斗,振摇均匀后静置分层。取三氯甲烷层溶液另器保存,剩余酸液用30 mL三氯甲烷平均分3次萃取,合并萃取液并减压回收三氯甲烷,加少量甲醇溶解剩余残渣转移到10 mL容量瓶中,加适量甲醇定容,振摇均匀后过滤,其续滤液用0.22 μm微孔滤膜滤过后得供试品溶液。阴性对照品溶液的制备:取除大黄以外的其他10种药材,按照处方比例及相应的制法制备阴性样品。与制备供试品溶液相同的方法制备阴性对照品溶液。
2.2.4 系统适用性试验 取大黄的标准品溶液、供试品溶液、溶剂及阴性对照品溶液各10 μL,按照“2.2.1”项下的色谱条件进行含量测定,结果如图5所示。
2.2.5 线性关系考察 精密称取大黄素、大黄酚标准品,加甲醇溶解制成每毫升含大黄素16.08 μg、大黄酚15.16 μg的混合标准品溶液,精密吸取0.1、0.5、1、2、5、8 mL的标准品溶液到5 mL容量瓶中,配制成不同浓度的标准品溶液,分别注入高效液相色谱仪测定,以浓度(μg/mL)为横坐标、峰面积为纵坐标得到大黄素标准曲线Y=30 690 X-1 281.9,r2=0.999 9,大黄酚标准曲线Y=41 247 X-923.82,r2=0.999 9。结果表明,大黄素浓度在0.321 6~25.728 μg/mL范围内,大黄酚浓度在0.303 2~24.256 0 μg/mL范围内时,具有良好的线性关系。

图5 大黄的薄层色谱图注:A.对照品溶液,B.供试品溶液,C.甲醇溶液,D.阴性对照 溶液;1.大黄素对照品,2.大黄酚对照品
2.2.6 精密度试验 取与上述浓度相同的大黄素(16.08 μg/mL)、大黄酚(15.16 μg/mL)混合标准品溶液,反复进样6次,测定大黄素和大黄酚的峰面积,结果RSD值为1.14%,符合要求,表明精密度良好。
2.2.7 稳定性试验 精密吸取榛苓颗粒供试品溶液和大黄素、大黄酚混合标准品溶液各10 μL,在制备后0、2、4、8、12、24 h进样,测定大黄素、大黄酚的峰面积值。标准品溶液在24 h内峰面积的RSD值为1.26%,供试品溶液在24 h内峰面积的RSD值为1.49%,表明稳定性很好。
2.2.8 重现性试验 精密称定同一批次(20160701)的6份样品,按“2.2.3”项下的方法制备供试品溶液,每份供试品精密吸取10 μL注入液相色谱仪中,测定样品中大黄素、大黄酚的峰面积并计算相应含量,结果大黄素的平均含量为0.470 5 mg/g,大黄酚的平均含量为0.457 6 mg/g,重现性试验结果表明,大黄素的RSD值为0.97%,大黄酚符合要求方法RSD值为1.37%,表明重现性良好。
2.2.9 加样回收率试验 取与重现性试验同批次的榛苓颗粒9份,每份约0.3 g,精密称定,分别精密加入样品中大黄素、大黄酚含量80%、100%、120%的标准品,按照“2.2.3”项下供试品溶液的制备方法进行操作,9份供试品注入液相色谱仪中测定峰面积,分别计算大黄素和大黄酚的加样回收率。结果大黄素的加样回收率为101.17%,RSD值为1.39%。大黄酚的加样回收率为101.39%,RSD值为1.30%。均符合药典要求,加样回收率良好。见表1、表2。
10批样品的含量测定:分别取10批次榛苓颗粒,按照上述方法制备供试品溶液。测定10批榛苓颗粒中大黄素和大黄酚的总含量,结果见表3。
结果表明,10批样品中大黄素和大黄酚总含量的平均含量为0.934 8 mg/g,在平均含量的基础上,总含量下浮20%制定本制剂含量限度,故制剂的含量限度规定为本品每克以大黄中大黄素、大黄酚总和计不得少于0.75 mg。
3 讨论
3.1 定性鉴别的确定 采用薄层色谱法对处方中的11味药进行定性分析,最终确定大黄、人参、陈皮、穿山甲4味药作为定性鉴别标准。本处方中的另外几味药,其中榛花为方中的君药,但药典中没有此药的相关记载,文献中对此药的报道也相对较少,总黄酮为其主要成分,所以用鉴别总黄酮的方法对其进行鉴别,在薄层色谱中,阴性与供试品、对照药材相应位置显相同颜色斑点,存在阴性干扰,故不列入质量标准。土茯苓为方中用量最多的药,也是臣药,但是在薄层色谱鉴别中,阴性与供试品、对照药材和落新妇苷相对应位置上,显相同颜色斑点,存在阴性干扰,故不列入质量标准。
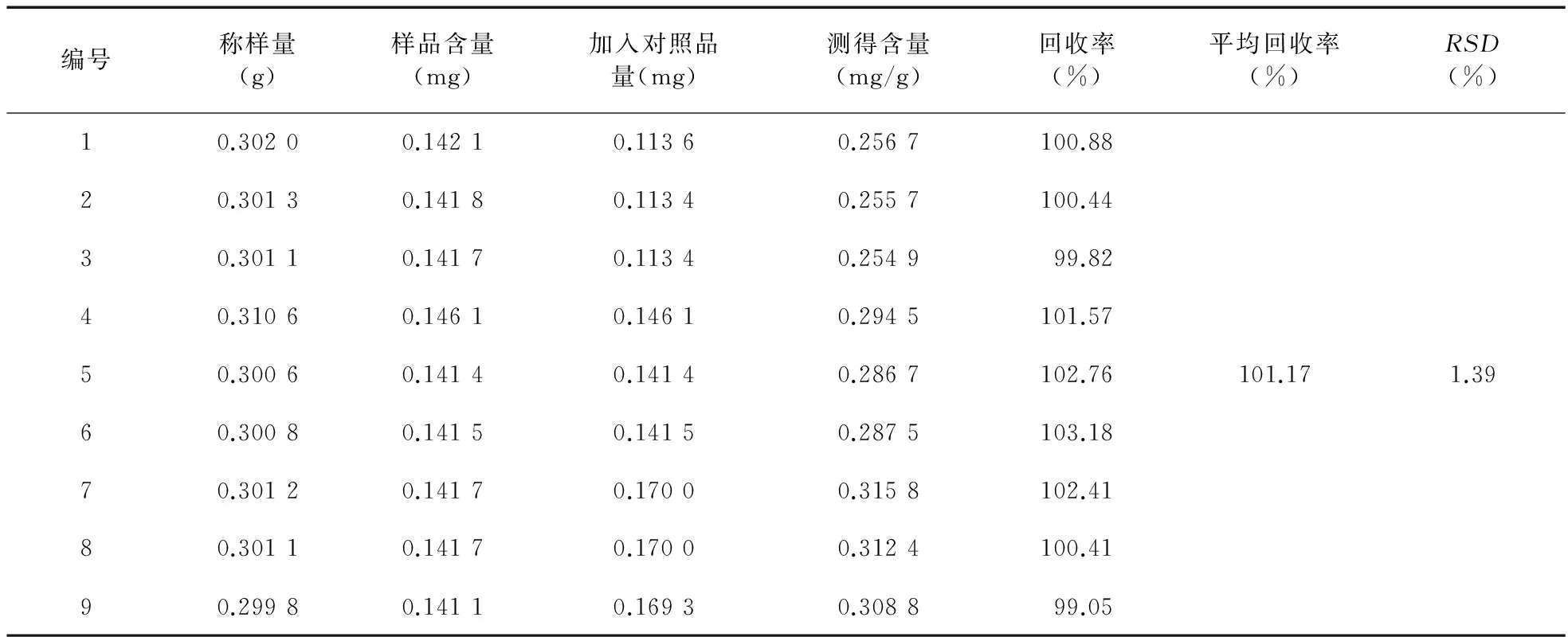
表1 大黄素加样回收率试验结果

表2 大黄酚加样回收率试验结果

表3 榛苓颗粒中大黄素、大黄酚的含量测定结果
3.2 质量控制指标成分的确定 本制剂处方中榛花为君药,榛花的主要成分为总黄酮[10],与方中其他药有阴性干扰,所以不能作为含量测定的跟踪指标。土茯苓在方中占比例最大,为方中臣药,但其主要成分落新妇苷也与方中其他药有阴性干扰,也不可作为含量测定的跟踪指标。大黄为臣药,实验结果显示,其主要成分中的芦荟大黄素、大黄酸在样品中与其他成分分离效果不好,大黄素甲醚的含量太少,其中大黄素、大黄酚的含量较高且分离度较好,不存在阴性干扰,保留时间合理。所以选择大黄素、大黄酚作为本制剂的质量控制成分。结果表明,选择大黄素及大黄酚为指标成分,可以很好地控制榛苓颗粒的质量,且结果稳定准确,重复性好。
[1] 徐震宇,王怡.大黄不同给药方式治疗慢性肾功能衰竭的研究概况[J].浙江中医杂志,2012,47(7):539-541.
[2] 李春雨,王平,王张,等.基于代谢组学技术的大黄治疗慢性肾功能衰竭的作用机制研究[J].中草药,2012,43(2):312-315.
[3] 谭文界,金姝娜,潘原虎,等.大黄中抑制慢性肾功能衰竭活性成分研究[J].湖北中医学院学报,2009,11(2):35-36.
[4] 薛小平,鹿燕敏,王倩,等.HPLC法测定清热解毒方芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚的含量[J].中国实验方剂学杂志,2009,15(7):6-8.
[5] 陈泠,李春艳,王政,等.HPLC法测定人参毛状根及不同人参样品中9种人参皂苷的含量[J].药学实践杂志,2016,34(4):313-317,353.
[6] 平华.HPLC法同时测定生脉散中4种人参皂背类成分的含量[J].中国药房,2016,27(12):1702-1704.
[7] 路放,杨世海,孟宪兰.人参药理作用研究新进展[J].人参研究,2013,25(1):46-52.
[8] 贾丽娜,汪祥,汪涛,等.温脾汤颗粒剂质量标准研究[J].安徽医药,2014,18(11):2058-2061.
[9] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:8-9,23-24,191,268-269.
[10]高国粉,南劲松,田晓乐,等.榛花总黄酮的提取及抗氧化活性的研究[J].中华中医药杂志,2007,22(8):547-549.
ResearchinthequalitystandardofZhenlinggranule
WANG Chang1,2,ZHANG Rui-duo1,WANG Ren-guang1,GUO Jing1,2,JIA Ai-ling1,2*
(1.Changchun University of Traditional Chinese Medicine,Changchun 130117,China;2.Changchun National Biological Industry Base Pharmaceutical Preparation Platform,Changchun 130117,China)
ObjectiveTo establish the quality standard of Zhenling granule.MethodsTLC was used for the qualitative identification of rheum rhubarb,ginseng,dried tangerine peel and pangolin.HPLC was used to determine the content of emodin and chrysophanol.The contents were measured in Phe-nomenex Luna C18column with methano-2% water-phosphoric acid(85∶15)as the mobile phase,and 254 nm detection wavelength and area-external standard method was used.According to Huang Sufeng calculation the number of theoretical plates should not be less than 3 000.Flow rate:1 mL/min.ResultsThe thin-layer chromatographic spots of rheum rhubarb,ginseng,dried tangerine peel,and pangolin were clear and well separated.Emodin showed good linearity in the range of 0.321 6~25.728 μg/mL.Chrysophanol showed good linearity in the range of 0.303 2~24.256 0 μg/mL.TheRSDvalues of precision,repeatability and stability tests were less than 3%.The average recovery of emodin and chrysophanol was 101.17% and 101.39%,and theRSDwas 1.39% and 1.30%,respectively.ConclusionThe method is simple with good reproducibility and strong specificity.The quality of Zhenling granules can be well controlled.
Zhenling granule;Quality standard;HPLC;TLC;Emodin
2017-03-26
1.长春中医药大学药学院,长春 130117;2.长春国家生物产业基地医药中试平台,长春 130117
吉林省中医药科技项目(2016164)
*
10.14053/j.cnki.ppcr.201711023
