响应面优化金线草主根多酚提取工艺及其抗氧化性
2017-12-06,,,,,*
,,,,,*
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025)
响应面优化金线草主根多酚提取工艺及其抗氧化性
方兰1,2,邱树毅1,2,周鸿翔1,2,曾海英1,2,王晓丹1,2,*
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025)
采用乙醇回流法从金线草主根中提取多酚类物质,利用响应面法建立多酚得率与温度、乙醇浓度、液料比、时间之间的数学模型。通过此模型确定金线草主根多酚的最适提取工艺参数,并通过体外抗氧化实验评价其抗氧化能力。结果表明:该多酚得率模型的拟合度很好,最佳工艺参数为温度83.7 ℃、乙醇浓度43%、液料比30 mL/g、时间149 min。在此条件下,经过第一次提取其多酚得率为90.065 mg/g,而提取两次时可高达93.380 mg/g。金线草主根多酚具有较强的DPPH·和羟基自由基清除能力,其半数抑制浓度分别为0.175 mg/mL和0.025 mg/mL。
金线草主根,多酚,响应曲面,抗氧化
金线草(AntenoronfiliformeRob. et Vaut.)为蓼科(Polygonaceae)蓼属(Polygonum)下的一个种,多年生草本,高50~100 cm,为民间草药,始载于《本草拾遗》[1],以毛蓼之名载于《植物名实图考》[2]。金线草具有祛风除湿;止痛、健脾燥湿、散瘀消肿、治霍乱、痈肿瘰疬;散瘀止血、解毒利气;收敛、治跌打损伤[3-6]等多种功效;通过经典的抗炎、镇痛实验也表明了金线草具有抗炎、镇痛及抗凝血的药理作用[7],具有较高的药用价值,这有可能和金线草多酚有关。多酚具有抗癌、抗菌、抗氧化和预防心脑血管疾病等多种生物活性[8-10],抗氧化活性是植物多酚的一个重要性质,其抗氧化能力与多酚类物质的含量和种类有关[11]。金线草分布范围广,主要分布贵州、山东、河南、山西、陕西、湖北、四川、云南、广西、广东、江西、浙江、江苏等地,资源较为丰富。若能充分利用这一资源,将能提高金线草的社会价值。
目前,植物多酚提取方法主要有经典的回流提取、超声波辅助提取、微波协同提取、酶法辅助提取等,回流提取法是用乙醇等易挥发的有机溶剂提取原料成分,将浸出液加热蒸馏,其中挥发性溶剂馏出后又被冷却,重复流回浸出容器中浸提原料,这样周而复始,直至有效成分回流提取完全的方法。此实验选用乙醇为提取剂,为了减少乙醇的挥发,选用回流提取金线草主根中的多酚。
近年来,有关金线草的研究报道中,樊宝娟等[1]用HPLC法测定金线草不同部位没食子酸的含量,赵友兴等[12]从金线草的乙醇提取物中共分离鉴定出11种化合物,曹望弟等[13]对金线草的质量标准进行了研究。但鲜有文献对其主根中多酚类物质进行研究,鉴于此,本文采用响应面设计对金线草主根多酚的提取工艺进行优化,并测定金线草主根多酚提取液对二苯代苦味酰基自由基(DPPH·)和羟基自由基的清除作用,研究金线草主根多酚的体外抗氧化能力,为后续开发利用金线草提供一定的理论依据。
1 材料与方法
1.1材料与仪器
金线草 贵州省六盘水市六枝特区,采摘时间:2017年4月1日,将金线草主根洗净,打碎,并过20目筛,于自封袋中(鲜样)保存于4 ℃的冰箱,及时使用;没食子酸标准品 贵州迪大生物科技有责任限公司,纯度≥99%;福林酚 北京索莱宝科技有限公司;无水碳酸钠 天津市永大化学试剂有限公司;无水乙醇 天津市富于精细化工有限公司;VE、VC北京奥博星生物技术有限责任公司;DPPH 梯希爱(上海)化成工业发展有限公司。
721可见分光光度计 上海菁华科技有限公司;FA2004N电子天平 上海菁海仪器有限公司;HH数显恒温水浴锅 江苏金坛市中大仪器厂;XTP-200型高速多功能粉碎机 永康市红太阳机电有限公司;SHZ-111型循环水真空泵 上海亚荣生化仪器厂。
1.2实验方法
1.2.1 金线草水分含量的测定 水分含量的测定采用GB5009.3-2016《食品中水分的测定方法》[14]。
1.2.2 金线草主根多酚的提取 金线草鲜样→抛去茎叶及须根→主根打碎→过筛→提取→真空抽滤→定容→稀释→计算含量
上述流程中,过筛是过20目的筛子;提取:准确称取3 g样品于平底烧瓶中,在一定的乙醇浓度、液料比和温度下进行乙醇回流提取一段时间;定容:滤液用提取溶剂定容到100 mL;稀释:取1 mL滤液用提取溶剂稀释10倍,待用。
1.2.3 没食子酸标准曲线的制作 采用福林酚法,根据黄欣欣[15]的方法并稍做修改,标准溶液的配制:准确称取0.0115 g没食子酸标准品,用蒸馏水溶解并定容于100 mL容量瓶中,得浓度为0.115 mg/mL的没食子酸标准溶液,待用。量取没食子酸标准溶液0、0.2、0.4、0.6、0.8、1.0 mL分别于25 mL容量瓶中,依次加蒸馏水至5 mL,然后再依次加入福林酚试剂0.5 mL,摇匀1 min,最后依次加20% Na2CO3溶液1.5 mL,用蒸馏水定容,摇匀,避光放置2 h;以溶剂作空白,蒸馏水作参比,在752 nm(通过扫描其溶液在752 nm下有最大吸收峰)下测吸光度,以没食子酸浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.4 金线草主根多酚得率的计算 取1 mL稀释液至25 mL容量瓶中,按1.2.3步骤进行并测定吸光度,由回归方程计算样品多酚的浓度,并按式(1)计算多酚得率(以干质量计)。
多酚得率(mg/g)=(C×Va×Vb×N)/(M-M×w)×v
式(1)
式中,C提取液多酚的浓度(mg/mL);Va是容量瓶量程(25 mL);Vb是提取液总体积(100 mL);N稀释倍数10;M样品质量3 g;w为水分含量57.89%;v为1 mL稀释液。
1.2.5 单因素实验
1.2.5.1 时间对多酚得率的影响 以70%乙醇为提取剂、液料比为30 mL/g、70 ℃恒温水浴,乙醇回流提取,提取1.0、1.5、2.0、2.5、3.0 h,考察时间对多酚提取的影响。
1.2.5.2 液料比对多酚得率的影响 以70%乙醇为提取剂、70 ℃恒温水浴、提取时间2.5 h,分别在液料比为15、20、25、30、35 mL/g下,考察液料比对多酚提取的影响。
1.2.5.3 乙醇浓度对多酚得率的影响 70 ℃恒温水浴、液料比为30 mL/g、提取时间2.5 h,在乙醇浓度为40%、50%、60%、70%、80%下,考察乙醇浓度对多酚提取的影响。
1.2.5.4 温度对多酚得率的影响 以50%乙醇为提取剂、液料比为30 mL/g、提取时间2.5 h,水浴温度为50、60、70、80、90、100 ℃下,考察温度对多酚提取的影响。
1.2.6 响应面优化实验设计 在单因素实验结果的基础上,根据响应面Box-Behnken的设计原理,以提取温度、乙醇浓度、料液比、时间为因子,以金线草主根多酚得率(mg/g)为响应值,设计4因素3水平的响应面实验,因素水平表见表1。
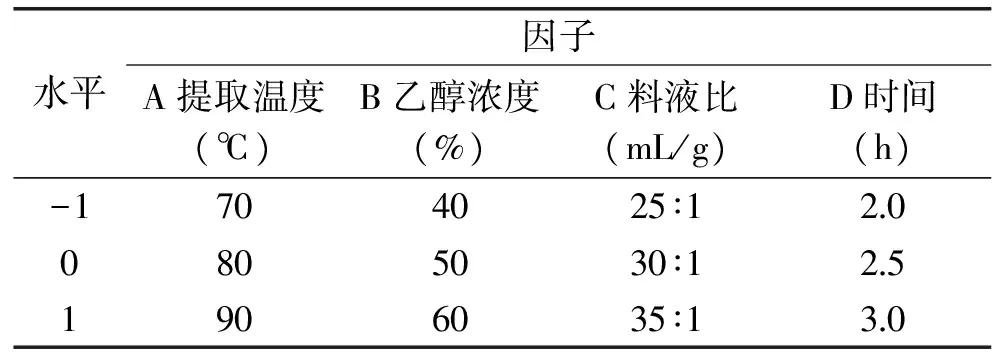
表1 响应面分析实验设计因素与水平
1.2.7 提取次数对多酚得率的影响 在乙醇回流提取的最佳工艺条件下,分别提取1、2、3、4次,研究最佳工艺条件下提取次数对多酚得率的影响。
1.2.8 抗氧化活性的测定
1.2.8.1 DPPH·清除率的测定 不同浓度提取液的配制:准确称取3.0 g样品,在最适工艺条件下进行提取,计算出多酚含量,并将提取液分别稀释成多酚浓度为0.025、0.050、0.075、0.100、0.125、0.150、0.175、0.200和0.250 mg/mL的溶液。配制浓度为0.025、0.050、0.075、0.100、0.125、0.150、0.175、0.200和0.250 mg/mL的VC和VE溶液。
参考李西柳等[16]、石恩慧等[17]和吴林秀等[18]的方法并稍作修改,分别取上述不同浓度的提取液、VC溶液和VE溶液2.0 mL于具塞试管中,再加入2.0 mL DPPH·无水乙醇溶液(0.2 mmol/L),摇匀避光放置30 min,用无水乙醇调零,测定517 nm波长处的吸光度(A1);同法,用等量的无水乙醇代替2.0 mL DPPH·溶液,测吸光度作为对照(A2);测2.0 mL DPPH·无水乙醇溶液与2.0 mL无水乙醇溶液的混合液作为空白(A3)。DPPH·清除率按式(2)计算。
式(2)
1.2.8.2 羟基自由基清除率的测定 采用水杨酸法[19],并稍作修改,分别取1.2.8.1中不同浓度提取液和VC溶液2 mL于具塞试管中,依次加入2 mL 6 mmol/L FeSO4、2 mL 6 mmol/L水杨酸-无水乙醇溶液、2 mL 6 mmol/L H2O2溶液,在37 ℃的鼓风干燥箱中反应30 min后,在波长510 nm处测定吸光度A1,未加入H2O2的溶液的吸光度A2,按相同方法测定未加入样品的溶液吸光度A3,均以蒸馏水为参比溶液。羟基自由基清除能力按式(3)计算。
式(3)
1.3数据处理
所有数据均为3次重复实验的平均值,验证实验为5次重复实验的平均值,并表示为平均值±标准差,单因素实验数据运用Origin 8.5软件绘制趋势图,响应面实验采用Design-Expert 8.06软件进行方差分析,并优化出最佳提取工艺参数。
2 结果与分析
2.1金线草主根水分含量的测定
按照GB5009.3-2016《食品中水分的测定方法》测得金线草主根的水分含量为57.89%±0.02%。
2.2标准曲线的建立
以没食子酸浓度为横坐标,吸光度值为纵坐标,绘制标注曲线。得到标准曲线的回归方程为:Y=95.652X+0.007,R2=0.9988,表明没食子酸浓度在0~0.0046 mg/mL范围内,没食子酸浓度与吸光度值线性关系良好。
2.3金线草主根多酚提取的单因素实验
2.3.1 提取时间对多酚得率的影响 如图1可见,随着提取时间的增加,多酚得率出现先增加后迅速减小的变化趋势,2.5 h为多酚提取的最佳时间。分析其原因,可能是在较短的时间内,多酚还没有完全提取出来,所以随着提取时间的延长,多酚的得率逐渐增加,但如果时间过长,在较高温度下,多酚被破坏,从而导致得率下降。
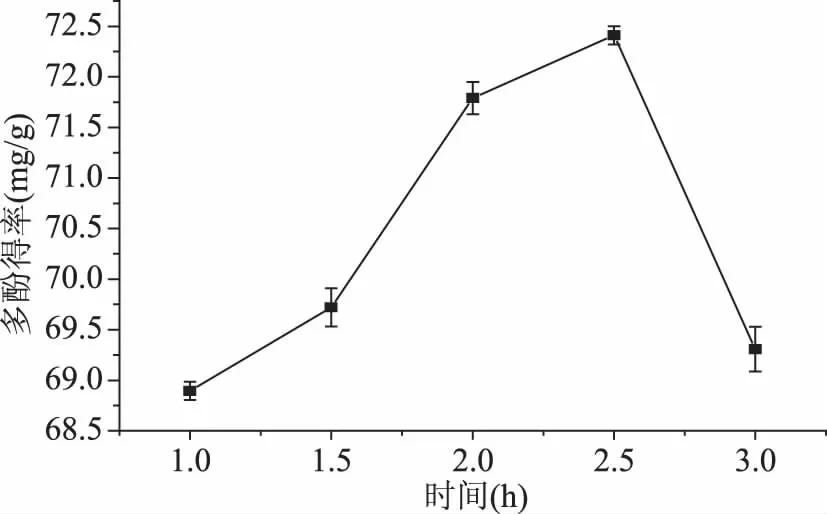
图1 提取时间对多酚得率的影响
2.3.2 液料比对多酚得率的影响 如图2可见,在液料比小于30 mL/g时,随着液料比的增加,多酚得率增加,在液料比为30 mL/g左右时,多酚得率达到最大,之后随着液料比的增加,多酚得率减少。这可能是因为,增大液料比,溶剂的量也就相应增多,样品在溶液中的分散程度增大,接触面积也增大,有利于多酚提取,但当液料比过大时,其中的杂质如可溶性的蛋白、多糖、果胶溶出,这些杂质可能吸附多酚或者和多酚结合,从而导致其多酚浸出率较少[20]。因此液料比为30 mL/g时,多酚得率达到最大。
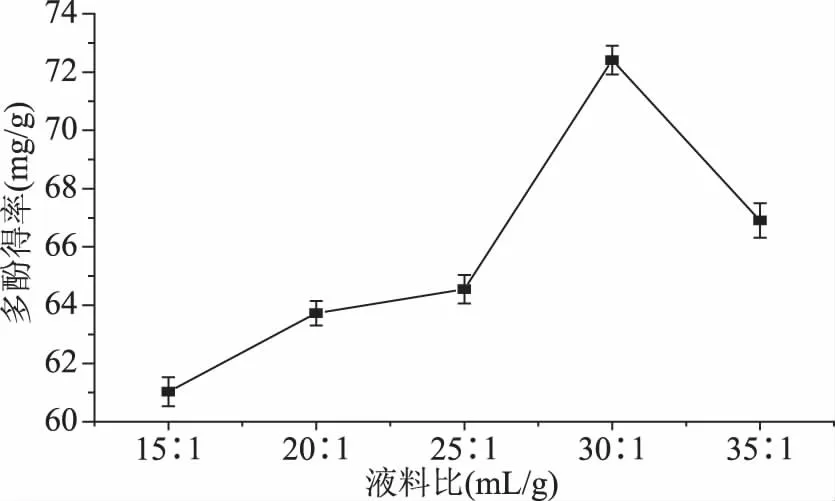
图2 液料比对多酚得率的影响
2.3.3 乙醇浓度对多酚得率的影响 如图3可见,在乙醇浓度小于50%时,随着乙醇浓度的增加,多酚得率增加,在乙醇浓度大于50%时,随着乙醇浓度的增加,多酚得率减少,这可能由于乙醇浓度过大,容易挥发,同时其他一些醇溶性物质和脂溶性杂质的溶出的增加,或可能是高浓度的乙醇使蛋白质变性,影响与之结合多酚的溶出[21],从而导致多酚得率的下降,当乙醇浓度为50%时,得率达到最大,这有可能是金线草主根多酚的极性与50%乙醇的极性相同[23]。

图3 乙醇浓度对多酚得率的影响
2.3.4 提取温度对多酚得率的影响 如图4可见,在80 ℃之前,随着提取温度的增加,多酚得率增加,在80 ℃以后,随着提取温度的增加,多酚的得率减少,80 ℃时多酚得率达到最大。这可能是因为高温有利于引起细胞膜结构的变化,加剧分子的运动,从而使多酚得率增加,但随着温度升高,由于温度过高,从而引起多酚类物质结构发生氧化,破坏了多酚类物质[23],使得多酚的得率又有所下降。

图4 提取温度对多酚得率的影响
2.4响应面优化实验
2.4.1 二次响应面回归模型的建立与分析 响应面的设计与结果见表2,本次实验中,共进行了5次中心实验,用于估计实验误差。

表2 响应面实验设计与结果

表3 回归方程系数显著性检验表
注:**表示差异极显著(p<0.01);*表示差异显著(p<0.05)。
应用Design-Expert 8.06软件进行分析,得到各因素与响应值的二次多项式方程模型:多酚得率Y=88.18+5.79A-4.16B+0.22C-1.59D-2.26AB-3.05AC+3.23AD-0.18BC+0.21BD-0.16CD-9.89A2-3.76B2-8.64C2-5.84D2。
由表3回归方程系数显著性检验表可知,该模型的p值小于0.0001,模型极显著,失拟误差p值等于0.708(p>0.05),失拟误差不显著,模型R2=0.9997,RAdj=0.9995,说明模型的误差较小,拟合度较高,能够较准确的反应实验因素对响应值的影响。
对回归模型的显著性检验可知,A、B、C、D、AB、AC、AD对多酚的提取有极显著影响,BD对多酚的提取有显著影响,BC、CD对多酚提取的影响不显著。各因素对多酚提取的影响依次为A(温度)>B(乙醇浓度)>D(时间)>C(液料比)。
2.4.2 两因子间交互作用分析 图5是由响应值和实验因素构成的立体曲面图,其图显示了提取温度、乙醇浓度、料液比、提取时间中任意两个变量取零水平时,其余两个变量对金线草主根多酚提取的影响。每个图的交互作用都呈现先增加后减小的趋势,从各图的变化幅度及等高线可以看出,图5a、图5b、图5c有极显著交互作用;图5e有显著交互作用;图5d、图5f的交互作用不显著。
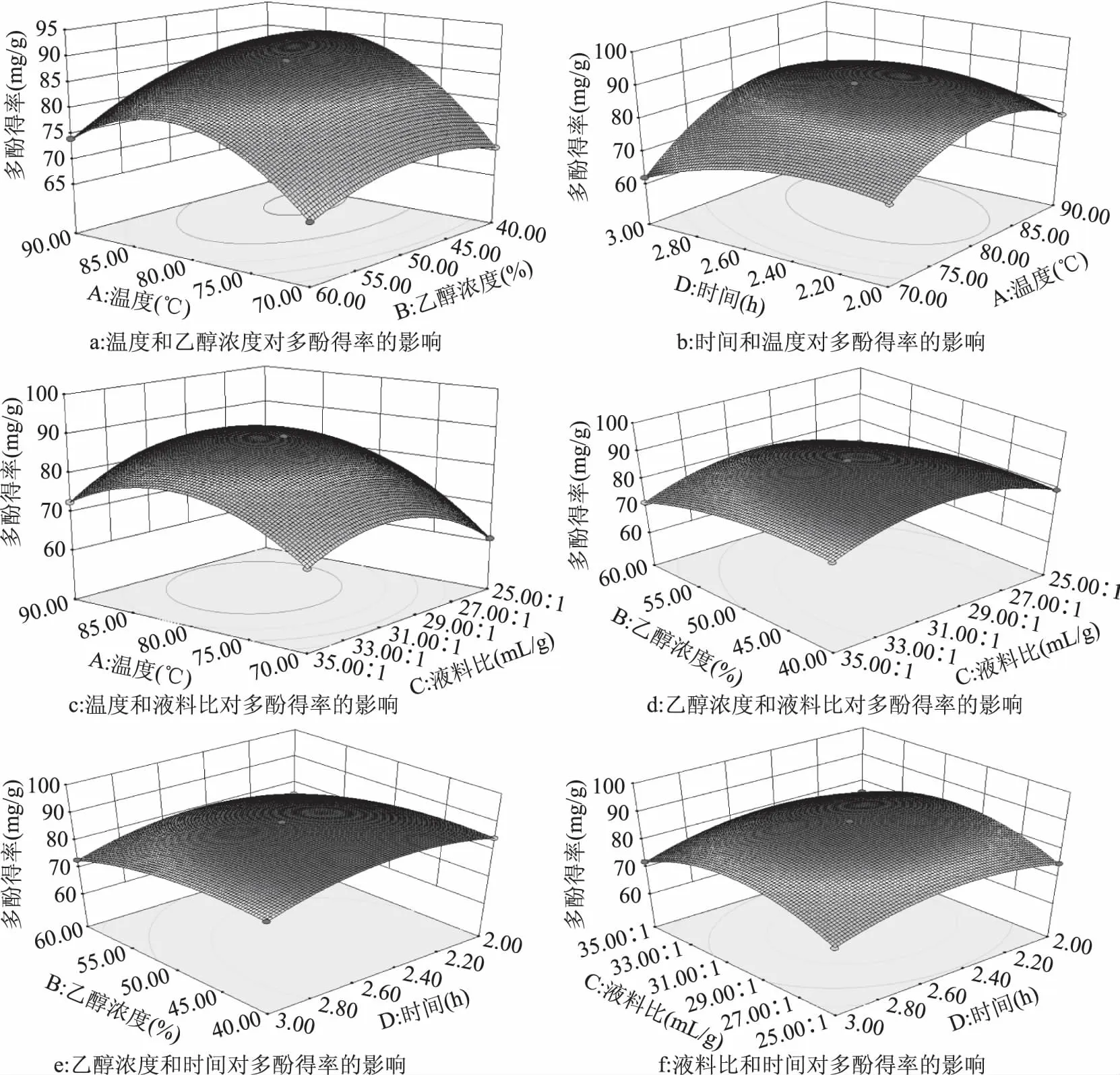
图5 任意两变量对总酚得率影响的响应曲面图
2.4.3 最佳工艺条件的预测及实验验证 通过Design-Expert 8.06软件进行分析,可以预测乙醇回流提取金线草主根多酚的最佳工艺条件为:温度83.68 ℃、乙醇浓度43.35%、液料比29.78∶1 mL/g、时间2.48 h,此时能够得到的多酚理论得率为90.663 mg/g。结合实际生产,将各影响因素调整为温度83.7 ℃、乙醇浓度43%、液料比30 mL/g、时间149 min。在此条件下,进行5次平行验证实验,金线草主根多酚的平均得率为(90.065±0.123) mg/g,与理论值90.663 mg/g相比误差仅为0.66%,验证了该模型是可行有效的。
2.4.4 提取次数的影响 在最佳提取工艺条件下,进行实验,研究提取次数对多酚得率的影响,结果如图6。由图6可以看出,提取一次时,得率为90.065 mg/g,提取量占4次总量的百分比最大,为95.79%,提取两次时,得率为93.380 mg/g,占到99.33%,基本已经把多酚类物质提取完全,考虑到成本问题,在最佳工艺条件下提取两次金线草主根多酚为最佳。
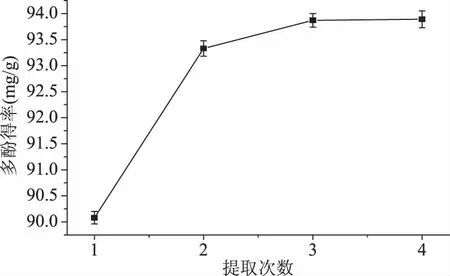
图6 提取次数对多酚得率的影响
2.5金线草主根多酚抗氧化活性的分析
2.5.1 金线草主根多酚提取液对DPPH·清除作用 由图7可知,随着金线草多酚提取液和VC浓度的增加,对DPPH·的清除率也在逐渐增大。对于多酚粗提物,当浓度达到0.175 mg/mL时,其对DPPH·的清除率达到50.27%,当浓度达到0.200 mg/mL以后,其对DPPH·清除率趋于稳定;对VC溶液,当浓度达到0.100 mg/mL时,对DPPH·的清除率达到50.11%,浓度达到0.150 mg/mL以后,对DPPH·清除率趋于稳定;VE溶液对DPPH·的清除率随着浓度的增加其清除率成线性增加,线性方程为y=130.61x-1.4933(R2=0.9847)。DPPH·的清除率的大小常用半清除率IC50表示,指当清除率达到50%时所需要的抗氧化剂的浓度,IC50越小表示其抗氧化能力越强。多酚提取液、VC、VE对DPPH·清除率的IC50分别为0.175、0.100和0.394 mg/mL,多酚提取液对DPPH·的清除率低于同浓度下的VC,高于VE,这可能与金线草主根中的多酚活性物质的种类有关,具体原因将有待进一步的研究和分析。

图7 金线草主根提取液对DPPH·的清除作用
2.5.2 金线草主根多酚提取液对羟自由基清除作用 由图8可知,随着金线草多酚提取液、VC浓度的增加,其对羟基自由基的清除率也在逐渐增大。对多酚粗提物,当浓度达到0.025 mg/mL时,其对羟基自由基的清除率达到49.62%,当浓度达到0.175 mg/mL以后,其对羟基自由基清除率趋于稳定;对VC溶液,当浓度达到0.200 mg/mL时,对羟基自由基的清除率达到50.86%,浓度达到0.350 mg/mL以后,对羟基自由基清除率趋于稳定;多酚提取液、VC对羟基自由基的清除率的IC50分别为0.025、0.200 mg/mL。多酚提取液对羟基自由基清除作用高于VC,表明金线草主根多酚提取物对羟基自由基具有较强清除作用,这可能与金线草多酚粗提物中主要活性物质的种类有关,具体原因将有待进一步的研究和分析。
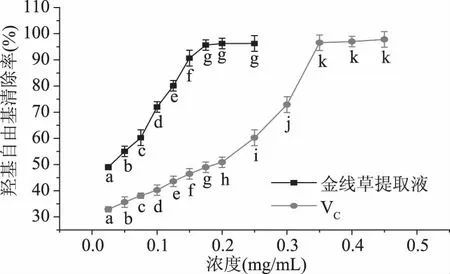
图8 金线草主根提取液对羟自由基清除作用
3 结论
采用乙醇回流提取法提取金线草主根中的多酚物质,在单因素实验基础上,通过响应面Box-Benhnken实验设计,建立金线草主根多酚得率的二次多项式数学模型。金线草主根多酚的最佳工艺条件为:温度83.7 ℃、乙醇浓度43%、液料比30 mL/g、时间149 min,在此条件下实际测定的多酚可达到(90.065±0.123) mg/g,所得值与模型预测值90.663 mg/g高度相符,误差仅为0.66%,验证该模型是可行有效的。金线草主根多酚提取液对DPPH·和羟基自由基具有较强清除作用,其IC50分别为0.175 mg/mL和0.025 mg/mL。
[1]樊宝娟,刘雪峰,曾爱国,等.HPLC法测定金线草不同部位没食子酸的含量[J].西北药学杂志,2014,29(6):573-575.
[2]南京中药大学.中药大辞典(上册)[M].第二版.上海:上海科学技术出版社,2006:1957,1981.
[3]中国科学院中国植物志编辑委员会.中国植物志[M]. 第25卷北京:科学出版社,1988;121.
[4]广西中药志(第一辑)即将出版[J].中国药学杂志,1959,12:654-666.
[5]张兴.《草木便方》“金线草”考[J].时珍国药研究,1996,7(3):7-8.
[6]鲁大军,曾红,赖林城,等.金线草的研究进展[J].中国医院用药评价与分析,2015,15(9):1269-1270.
[7]黄勇其,骆红梅,陈秀芬,等. 金线草药理作用初步研究[J].中成药,2004,26(11):918-921.
[8]GONZA LEZ-MONTELONGOR,LOBOGM,MNICAG. Antioxidant activity in banana peel extracts:testing extraction conditions and related bioactive compounds[J]. Food Chemistry,2010,119:1030-1039.
[9]LEEJH,PARKKH,LEEMH,et al. Identification,characterisation,and quantification of phenolic compounds in the antioxidant activity-containing fraction from the seeds of Korean perilla(Perillafrutescens)cultivars[J]. Food Chemistry,2013,136:843-852.
[10]柯春林,王娣,谢海伟,等.多酚化合物抗菌活性的最新进展[J].食品工业科技,2012,33(17):405-408.
[11]Petkovsek M M,Slatnar A,Stampar F,et al. The influence of organic/integrated production on the content of phenolic compounds in apple leaves and fruits in four different varieties over a 2-year period[J]. Journal of the Science of Food and Agriculture,2010,90(14):2366-2378.
[12]赵友兴,李红芳,马青云,等.金线草化学成分研究[J].中药材,2011,34(5):704-706.
[13]曹望弟,王翠萍.金线草质量标准研究[J].中国药业,2012,21(20):92-93.
[14]中华人民共和国国家标准.食品中水分的测定方法[S]. GB/T 5009.3-2016.
[15]黄欣欣.大果山楂黄酮类物质的提取及其抗氧化性和降血脂功能研究[D].南宁:广西大学,2015.
[16]李西柳,庞明,王俊儒,等.柿子渣中多酚的提取工艺及其抗氧化性研究[J].西北植物学报,2010,30(7):1475-1480.
[17]石恩慧,郭凯军,李红,等.板栗总苞多酚提取工艺优化及其抗氧化性研究[J].动物营养学报,2013,25(2):406-414.
[18]吴林秀,胡荣康,陈艺煊,等.竹荪中多酚提取工艺优化及其抗氧化活性研究[J].食品工业科技,2017,38(7):203-206,215.
[19]陈晨,胡文忠,田沛源,等.超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J].食品科学,2014(2):12-17.
[20]代燕丽,沈维治,廖森泰,等.响应面法优化超声波辅助提取桑叶多酚工艺[J].热带作物学报,2016,37(8):1588-1594.
[21]Yang Li,Jiang Jian-Guo,Li Wei-Feng,et al. Optimum extraction process of polyphenols from the bark ofPhyllanthusemblicaL. based on the response surface methodology[J]. Journal of Separation Science,2009,32:1437-1444.
[22]段宙位,窦志浩,何艾,等.青金桔皮中多酚的提取及其抗氧化性研究[J].食品工业科技,2015,36(10):244-248.
[23]CARRERAC,RUIZ-ROARGUEZ A,PALMA M,et al.Ultrasound assisted extraction of phenolic compounds from grapes[J]. Analytica Chimica Acta,2012,732:100-104.
OptimizationofextractiontechniqueofpolyphenolsfromAntenoronfiliformetaprootbyresponsesurfacemethodologyanditsantioxidantactivity
FANGLan1,2,QIUShu-yi1,2,ZHOUHong-xiang1,2,ZENGHai-ying1,2,WANGXiao-dan1,2,*
(1.Guizhou Provincial Key Laboratory of Fermentation Engineeringand Biological Pharmacy,Guizhou University,Guiyang 550025,China;2.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China)
The polyphenols in taproot ofAntenoronfiliformewas extracted by ethanol reflux extraction,and the mathematical model of the yield of polyphenol with temperature,ethanol concentration,liquid ratio and time was established by response surface methodology. Through this model,the optimum extraction process parameters of polyphenols were determined,and their antioxidant capacity was evaluated byinvitroantioxidant assay. The results showed that the polyphenol extraction rate model had a good reliability,the optimized extraction conditions were extraction temperature of 83.7 ℃,ethanol concentration of 43%,liquid to solid ratio of 30 mL/g and extraction time 149 min. Under these conditions,the polyphenol extraction rate was 90.065 mg/g for the first extraction,and two times extraction could be as high as 93.380 mg/g. Polyphenols inAntenoronfiliformetaproot had strong DPPH· and hydroxyl free radical scavenging activity,and their half inhibitory concentration(IC50)were 0.175 mg/mL and 0.025 mg/mL,respectively.
Antenoronfiliformetaproot;polyphenols;response surface;antioxidant activity
2017-05-11
方兰(1991-),女,硕士研究生,研究方向:生物活性物质的提取分离,E-mail:fl18786110476@163.com。
*
王晓丹(1980-),女,博士,高级实验师,研究方向:应用生物技术,E-mail:wangxiaodan0516@126.com。
贵州大学教育教学改革研究项目(JGYB201531);贵州大学品牌特色专业建设(培育)项目(PTPY201303);贵州大学“本科教学工程”建设项目(JG201641)。
TS201.2
B
1002-0306(2017)22-0150-07
10.13386/j.issn1002-0306.2017.22.030
