酶转化人参皂苷中25-OH-Rg2的纯化及结构鉴定
2017-12-06,,
,,
(大连工业大学生物工程学院,辽宁大连 116034)
酶转化人参皂苷中25-OH-Rg2的纯化及结构鉴定
王宇,刘春莹,鱼红闪*
(大连工业大学生物工程学院,辽宁大连 116034)
以分离纯化及结构鉴定人参皂苷Re酶转化产物中未知皂苷为目标,采用酶转化法制备产物,经硅胶柱层析、结晶和重结晶对未知皂苷进行分离纯化,并进行核磁共振结构鉴定。酶转化法制备的产物中,主要含有20(S,R)-Rg2、少量的Rg4和Rg6,以及HPLC检测为双峰的手性异构体未知皂苷,酶转化得率为65.5%(w/w)。采用硅胶柱层析和结晶重结晶方法,纯化得到了0.33 g纯度达99.7%的一种未知皂苷,经核磁共振技术检测确定该未知皂苷为20(R)-25-OH-Rg2,系统名称为3β,12β,20(R),25-tetrahydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside,以及另一种未知皂苷20(S)-25-OH-Rg2,系统名称为3β,12β,20(S),25-tetrahydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside。
人参皂苷Re,人参皂苷Rg2,20(R)-25-OH-Rg2,酶转化
人参(Panaxginseng)是五加科人参属多年生植物,其中含有的人参皂苷被认为是最主要的活性成分,在医药和健康方面具促进血液循环、平衡肌肤性质、保护心肌、降血脂、抗动脉硬化、抗肿瘤等诸多功效[1],受到人们的关注。目前已从人参属植物中分离并鉴定出182种[2]人参皂苷。人参皂苷的种类按照其苷元结构的不同可分为三种类型:达玛烷型(Dammarene type)四环三萜类皂苷的原人参二醇型皂苷(Protopanaxadiol type ginsenoside,PPD)和原人参三醇型皂苷(Protopanaxatriol type ginsenoside,PPT)[3],以及齐墩果烷型(Oleanolic acid type)五环三萜类皂苷Ro[4]。不同人参属植物中,总皂苷的含量和比例组成各不相同,一般在4%~10%(w/w)[5-6]。其中,PPT约占总皂苷含量的40%(w/w),PPT中含量较高且常见的皂苷有Re、Rg1、R1等[7]。而诸如Rh1、Rh4、Rg2、Rg4、Rg6、Rk3、F1等,在人参属植物中含量极低或无。
利用PPT中含量较高且常见的皂苷,如人参皂苷Re,催化转化制备稀有人参皂苷,如Rg2、Rh1、Rg4、Rg6等,通常采用酸碱催化法[8]和酶转化法[9]。酶转化法由于具有反应温和,有很强的底物专一性,副产物少,对环境没有污染等优势[10],在人参稀有皂苷的制备中有很好的应用,并受到人们越来越多的关注。在前期的研究中,以人参皂苷Re为底物的酶转化中,发现酶转化产物中除了主要含有人参皂苷Rg2以外,还有几种未知的人参皂苷。本论文以分离纯化和鉴定该未知人参皂苷为目标,进行人参皂苷Re为底物的酶转化,制备酶转化产物,并对其中未知人参皂苷进行分离纯化,采用核磁共振法进行结构鉴定。
1 材料与方法
1.1材料与仪器
犁头霉(Absidasp.G9g) 由大连工业大学生物工程学院菌种保藏所提供;麦麸皮 大连调味品厂;人参粉 吉林抚松第一参场人参制品厂;人参皂苷标准品Re、Rg2、Rg4、Rg6、Rh1 实验室自制,HPLC纯度在95%以上;Silica Gel 60-F254薄层层析板 德国Merck公司;硅胶 青岛海洋化工厂;甲醇、氯仿 天津市科密欧化学试剂有限公司;C18色谱柱 大连中汇达科学仪器有限公司。
Jasco N2000系列高效液相色谱仪 日本分光公司;Alltech 2000ES型蒸发光散射检测器 美国Alltech公司;AVANCE 400超导核磁共振波普仪 瑞士Bruke公司。
1.2实验方法
1.2.1 酶液的制备 称取人参粉10 g,麦麸皮30 g,装入500 mL三角瓶中,然后加入40 mL自来水,搅匀,在灭菌锅中0.1~0.5 MPa下高压灭菌20~30 min。上述灭菌后的固体培养基中,用接菌环接入10环Absidasp.G9g菌,30 ℃下发酵培养6~7 d。
固体发酵结束后,加入200 mL 0.02 mol/L pH5.0的HAc-NaAc缓冲液,浸泡2~3 h,用滤布过滤,5000 r/min下离心10 min除杂,将上清液用75%饱和硫酸铵2 h沉淀,12000 r/min下离心20 min取沉淀溶解于0.02 mol/L pH5.0的HAc-NaAc缓冲液中。该溶液转入透析袋中,每隔4 h换一次透析液,充分透析24~48 h后,在4 ℃,13000 r/min下离心20 min,取上清液用0.02 mol/L pH5.0的HAc-NaAc缓冲液定容至20 mL,即为酶液。
1.2.2 酶转化产物的制备 参照YU Hongshan等人的酶转化产物的制备方法[11],取20 g人参皂苷Re标准品充分溶解于500 mL、0.02 mol/L pH5.0的HAc-NaAc缓冲液中,加入500 mL上述制备好的酶液,于反应釜中40 ℃反应12 h。酶反应结束后,用两倍体积水饱和正丁醇进行萃取,取正丁醇层,浓缩蒸干成粉末状,即为酶转化产物混合品。
1.2.3 薄层层析法(TLC) 将人参皂苷溶于甲醇中,浓度为1 mg/mL,毛细管针取样于薄层层析板下沿0.8 cm处点样,将薄层层析板转入层析缸中,于V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5的展开剂中,展开至距离层析板顶部2 mm左右,喷洒10%硫酸溶液显色。
1.2.4 硅胶柱层析法 制备样品胶[12]:取5 g酶转化产物混合品,用50 mL甲醇溶解,加入12.5 g、80~100目硅胶,在50 ℃水浴锅上不断搅拌待其完全蒸干。
在玻璃柱最底部装入两层脱脂棉,防止硅胶漏出,取100 g、300~400目硅胶用漏斗缓慢装入玻璃柱内,并抽真空压实,使之均匀细密地分布在柱子内,再装入上述制备好的样品胶,最后在最上层放置多层脱脂棉,制备好硅胶柱层析装置。
洗脱[13]:用四倍柱体积(14.5 L)的纯氯仿通柱,然后按照V(氯仿):V(甲醇)=9.9∶0.1、9.8∶0.2、9.7∶0.3等梯度依次进行洗脱,洗脱剂的用量为:9.9∶0.1,1 L;9.8∶0.2,2 L;9.7∶0.3,2 L;9.5∶0.5,4 L;9.4∶0.6,7 L;9.3∶0.7,9 L;9.2∶0.8,44 L。每200 mL收集一瓶,并用TLC检测法跟踪检测。
1.2.5 结晶与重结晶 取2 g上述硅胶柱层析分离纯化后的人参皂苷,加入50%的甲醇溶液中充分溶解,使其尽量达到溶液的饱和状态,放入7 ℃冰箱中冷却结晶。2 d后,有无定形沉淀物析出,过滤收集沉淀物,用冷30 mL甲醇或冷水快速冲洗,冷冻干燥沉淀物。上述沉淀物,加入80%的甲醇溶液,加热搅拌使其充分溶解,冷却结晶。重复上述操作,重结晶三次。
1.2.6 高效液相色谱法 采用HPLC-ELSD[14]检测人参皂苷,通过对比保留时间来确定人参皂苷的种类。
色谱条件:C18色谱柱(4.6 mm×250 mm,5 μm);进样量:10 μL;柱温:35 ℃;流动相流量:1.0 mL/min;载气:氮气;气体流速:3.2 L/min;载气压力:0.1 MPa;ELSD的漂移管温度:110 ℃;撞击器:关。
梯度洗脱条件:乙腈(A)-水(B);0~20 min,20% A;20~31 min,20%~32% A;31~40 min,32%~43% A;40~70 min,43%~100% A。
1.2.7 核磁共振法(NMR) 利用超导核磁共振波谱仪对单体皂苷进行核磁共振检测。探头:5 mm BBO;溶剂:Pyridine-D5(氘代吡啶)。进行包括1H NMR,13C NMR,1H-1H COSY,DEPT45,DEPT90,DEPT135,HSQC,HMBC等检测。
1.3数据处理
酶转化得率(%,w/w)=酶转化产物混合品的质量/底物的质量×100
硅胶柱层析产物得率(%,w/w)=层析后产物质量/层析前样品质量×100
化合物纯度(%)=经HPLC检测的化合物的峰面积/总峰面积×100
HPLC数据处理采用高效液相色谱分析仪Waters 2695和ELSD检测器,Empower色谱工作站给出保留时间和峰积分面积等数据处理结果,进一步采用外标法进行定量分析。
2 结果与讨论
2.1酶转化产物的制备及分析
采用1.2.1方法,对Absidasp.G9g菌进行固体发酵并提取酶液,共制备酶液500 mL。共得到13.1 g酶转化产物混合品,酶转化得率为65.5%(w/w)。
酶转化产物混合品经HPLC检测结果如图1所示。与实验室现有标准品(包括人参皂苷Re、Rg2、Rg4、Rg6、Rh1等)作对照,发现酶转化产物中主要含有20(S,R)-Rg2和少量的Rg4和Rg6,另外还含有一种具有两个吸收峰的未知皂苷,初步判断为手性异构体皂苷,暂命名为化合物1和化合物2。该未知皂苷,还需进一步采用硅胶柱层析法、结晶及重结晶法进行纯化精制,并利用核磁共振技术对其结构进行鉴定。
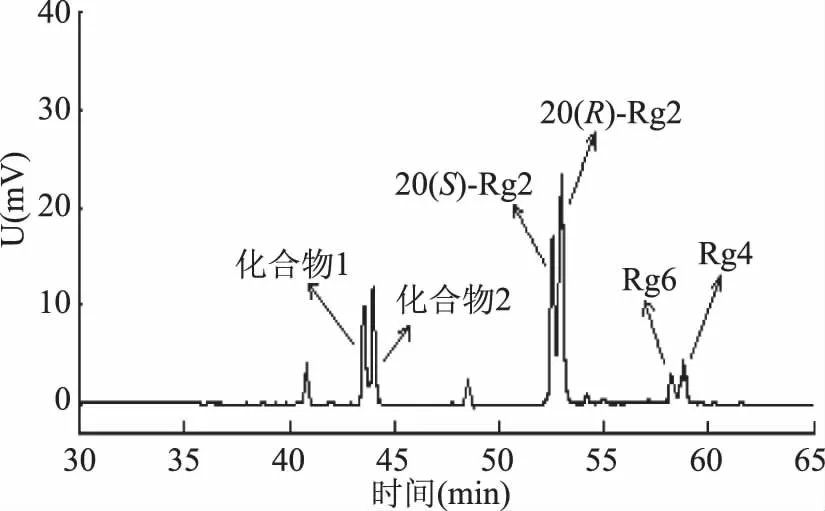
图1 人参皂苷Re酶转化产物的HPLC
2.2硅胶柱层析法分离纯化未知皂苷
按照1.2.4中的方法,用硅胶柱分离法分离该未知人参皂苷。对洗脱液进行收集,作TLC检测,结果如图2所示。

图2 酶转化产物混合品的硅胶柱层析跟踪监测
利用硅胶柱层析法分离纯化未知皂苷,根据TLC检测结果,分别收集较纯的各组分,合并洗脱液浓缩蒸干成粉末状,洗脱液的收集及各组分情况如表1所示。

表1 硅胶柱层析中洗脱液的合并收集
经过硅胶柱层析法的分离纯化,得到三组较纯的人参皂苷。经过与实验室现有皂苷及HPLC测定结果对比(由于手性化合物和顺反式化合物在薄层层析中无法达到良好的分离效果,需经HPLC检测鉴定,参见图1),确定这几种皂苷分别是Rg4和Rg6、20(S,R)-Rg2及未知皂苷。其中未知皂苷为1.58 g,得率是31.5%(w/w)。为了检测这三种皂苷是否完全分离,采用TLC法对表1中的各组分进行测定,结果如图3所示。
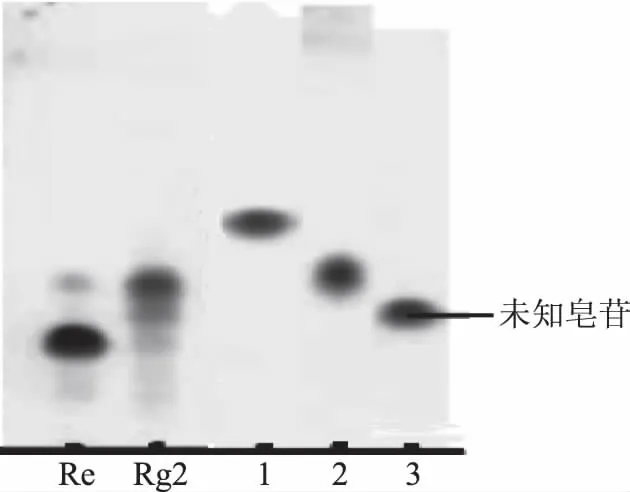
图3 硅胶柱层析分离纯化后各组分TLC
由图3可以看出,几种组分在TLC板中均为单点。为了进一步检测未知皂苷的纯度,采用HPLC法对其进行测定,结果如图4所示。
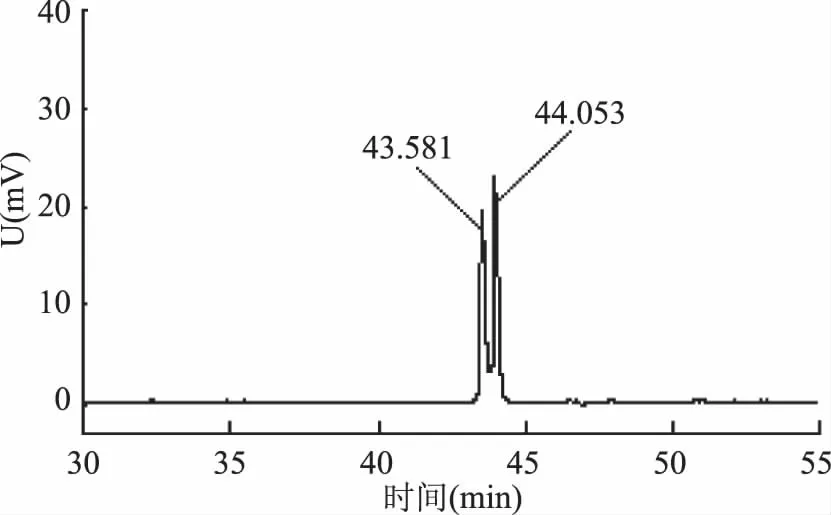
图4 分离纯化后未知皂苷的HPLC图
由图4可知,虽然未知皂苷在TLC上呈现单点,但是在HPLC图谱中显示出两个吸收峰,说明硅胶柱层析法不能将这两种化合物分离,需要对化合物1和化合物2进行进一步的精制。
2.3结晶法对化合物2进行纯化
经结晶和重结晶后,得到未知皂苷0.33 g,得率是22%(w/w)。HPLC检测(图5)发现,该未知皂苷的保留时间是44.061 min,与图4中两个峰的保留时间以及图1中标注的化合物1、2作对比,可以看出图5中44.061 min与图4中44.053 min极其相近,可以确认结晶析出的未知皂苷为化合物2,纯度达99.7%。
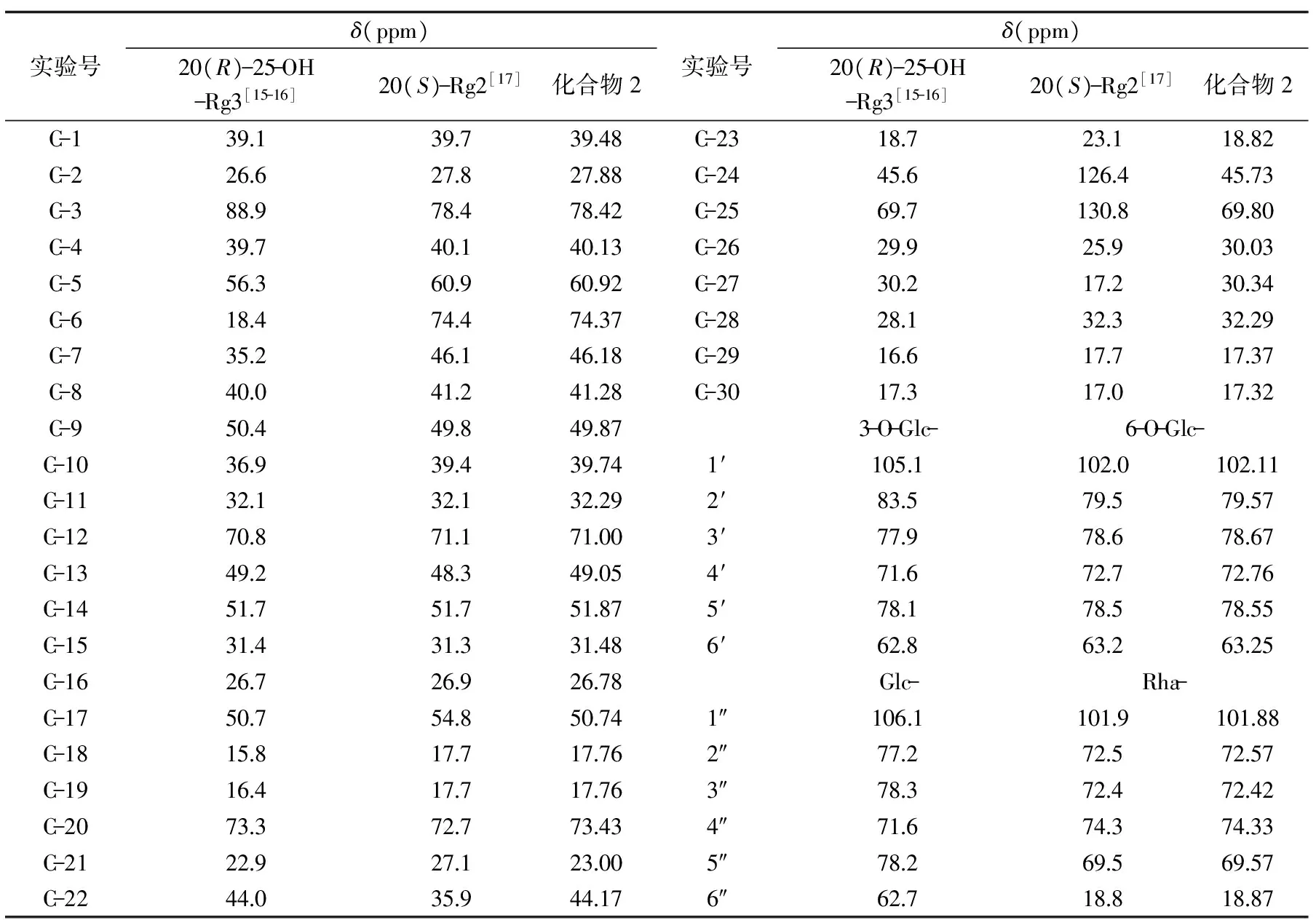
表2 化合物2的13C NMR化学位移
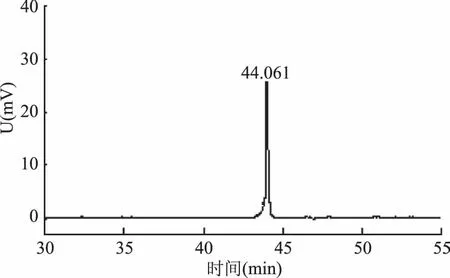
图5 结晶与重结晶后未知皂苷的HPLC
2.4核磁共振法测定化合物2的结构
为了确定化合物2的化学结构,采用核磁共振技术,分别对其进行1H NMR,13C NMR,1H-1H COSY,DEPT45,DEPT90,DEPT135,HSQC,HMBC等检测。其13C NMR数据如表2所示:
对化合物2的13C NMR数据,采用20(R)-25-OH-Rg3和20(S)-Rg2的13C NMR数据比较分析。三种化合物C-20的化学位移分别是73.3、72.7、73.43 ppm,化合物2的C-20化学位移与20(R)-25-OH-Rg3的C-20化学位移相似,说明化合物2是R型手性异构体。同理,三种化合物C-21、C-22、C-23、C-24、C-25、C-26、C-27的化学位移比较发现,化合物2与20(R)-25-OH-Rg3的化学位移相似,而与20(S)-Rg2的化学位移相差甚远,说明化合物2在C-22、C-23、C-24、C-25、C-26、C-27的β-侧链上具有与20(R)-25-OH-Rg3相同的结构,即C-24、C-25上的双键消失,C-25上连接有-OH。
综合核磁共振检测中的1H NMR,1H-1H COSY,DEPT45,DEPT90,DEPT135,HSQC,HMBC等数据,最后确定化合物2的结构式如图6所示,分子式为C42H74O14,相对分子质量为803.03。该物质的简称为20(R)-25-OH-Rg2,学名(英文):3β,12β,20(R),25-tetrahydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside。
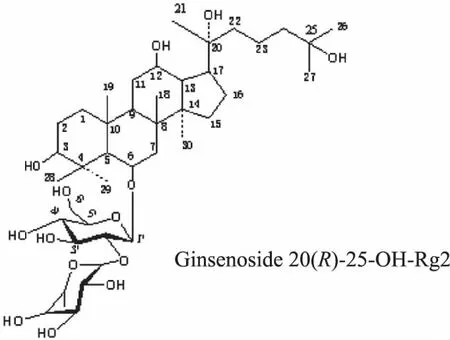
图6 人参皂苷20(R)-25-OH-Rg2的结构式
虽然对化合物1未进行核磁共振检测,但根据图4的HPLC结果分析,推测化合物1是化合物2相对应的手性异构体化合物,推测化合物1是S型的25-OH-Rg2,其系统名称是3β,12β,20(S),25-tetrahydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside,化学结构式如图7所示。
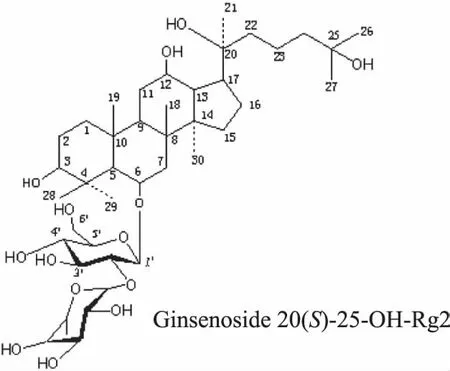
图7 人参皂苷20(S)-25-OH-Rg2的结构式
3 结论
本论文以人参中含量丰富的人参皂苷Re为底物,采用Absidasp.G9g菌固体发酵得到的酶液,进行酶转化产物的制备,发现酶转化产物中主要含有20(S,R)-Rg2、少量的Rg4和Rg6,以及人参皂苷20(S,R)-25-OH-Rg2,酶转化得率为65.5%(w/w)。酶转化产物经硅胶柱层析和结晶重结晶,纯化得到了0.33 g纯度达99.7%的20(R)-25-OH-Rg2,并对该化合物进行了核磁共振检测和分析,最终确定其化学结构,系统命名为3β,12β,20(R),25-trihydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside。
在以人参皂苷Re为底物的酶转化反应中,除了产生主要产物20(S,R)-Rg2外,还产生了一定量的Rg4、Rg6、20(S,R)-25-OH-Rg2。从这些化合物的化学结构分析推测,Rg4和Rg6是在催化反应中脱水反应产生的顺反异构体,而20(S,R)-25-OH-Rg2是在催化中水合反应产生的手性异构体,其催化反应产生的机制还有待进一步的研究验证。本论文提供了酶转化制备20(S,R)-25-OH-Rg2的方法,并鉴定出20(R)-25-OH-Rg2的化学结构,不仅丰富了人参皂苷的种类,还为其生物活性的研究提供了物质基础。
[1]傅晓晴,蔡宗苇,杨显荣. 人参延缓中枢神经系统衰老的生理调节治疗作用的研究[J]. 中药医学,2013,21(7):1044-1046.
[2]Qi L W,Wang C Z,Yuan C S. Ginsenosides from American ginseng:Chemical and pharmacological diversity[J]. Phytochemistry,2011,72(8):689.
[3]徐利云,杨志宏,孙晓波. 达玛烷型人参皂苷的药物代谢动力学研究概述简[J]. 中国实验方剂学杂志,2017(1):
220-227.
[4]赵寿经,侯春喜,徐立新,等. 抑制齐墩果烷型人参皂苷合成支路对达玛烷型人参皂苷生产能力的影响[J]. 吉林大学学报(工),2011,41(3):865-868.
[5]MARA C,ALESSANDRA A,MATTEO C,et al. The secrets of Oriental panacea:Panax ginseng[J]. Journal of Proteomics,2015,130:150-159.
[6]CHRISTENSEN L P. Ginsenosides chemistry,biosynthesis,analysis,and potential health effects.[J]. Adv Food Nutr Res,2009,55(55):1-99.
[7]LIU C Y,SONG J G,PENG F,et al. Ginsenoside contents in three different ginseng[J]. Journal of Dalian Polytechnic University,2011,30:79-82.
[8]SUNWOO H H,GUJRAL N,HUEBL A C,et al. Application of High Hydrostatic Pressure and Enzymatic Hydrolysis for the Extraction of Ginsenosides from Fresh Ginseng Root(Panaxginseng,C.A. Myer)[J]. Food and Bioprocess Technology,2014,7(5):1246-1254.
[9]Wan H,Li D. Highly efficient biotransformation of ginsenoside Rb1 and Rg3 usingβ-galactosidase fromAspergillussp. [J]. Rsc Advances,2015,5(96):78874-78879.
[10]杨金玲,高丽丽,朱平. 人参皂苷生物合成研究进展[J]. 药学学报,2013,48(2):170-178.
[11]YU Hongshan,GONG Jinmei,ZHANG Chunzhi,et al. Purification and Characterization of Ginsenoside-α-L-Rhamnosidase[J]. Chemical & Pharmaceutical Bulletin,2002,50(2):175.
[12]董微,郜玉钢,何忠梅,等. 人参中人参皂苷提取分离研究进展[J]. 食品工业科技,2014,17:366-369.
[13]李鹏飞,何丹,鱼红闪,等. 人参皂苷Rf 的分离提纯[J]. 大连工业大学学报,2011,30(3):180-182.
[14]孟霜,裴妙荣,李慧峰. HPLC-ELSD测定归芪洋参丸中人参皂苷Rb1的含量[J]. 山西中医学院学报,2012,13(1):31-33.
[15]Chen G T,Yang M,Song Y,et al. Microbial transformation of ginsenoside Rb1 by Acremonium strictum[J]. Applied Microbiology and Biotechnology,2008,77(6):1345-1350.
[16]Lee J H,Choi S H,Lee B H,et al. Modifications of aliphatic side chain of 20(S)-ginsenoside RG3 cause an enhancement or loss of brain Na+channel current inhibitions[J]. Biological & Pharmaceutical Bulletin,2008,31(3):480-486.
[17]李平亚. 人参皂苷NMR标准图谱[M]. 北京:化学工业出版社,2012:343.
Purificationandidentificationof25-OH-Rg2fromginsenosidesbyenzymatictransformation
WANGYu,LIUChun-ying,YUHong-shan*
(College of Bioengineering,Dalian Polytechnic University,Dalian 116034,China)
In order to isolation,purification and structural identifying unknown saponins of ginsenoside Re conversion products,the products were prepared by enzymatic conversion method,then separated and purified by silica gel column chromatography,crystallization and recrystallization,and identified by nuclear magnetic resonance(NMR)structure. The product of the enzyme preparation consisted of 20(S,R)-Rg2,a small amount of Rg4 and Rg6. And unknow chiral isomer saponin with a bimodal peaks of HPLC,which conversion rate was 65.5%(w/w). Using the silica gel column chromatography and the crystallization recrystallization method,obtained 0.33 g of unknown saponins with purity of 99.7%. The unknown saponins were identified as 20(R)-25-OH-Rg2 by nuclear magnetic resonanc NMR,and its systematic name was 3β,12β,20(R),25-tetrahydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside,and another unknown saponins were indentified as 20(S)-25-OH-Rg2,the systematic name was 3β,12β,20(S),25-tetrahydroxydammar-6-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside.
ginsenoside Re;ginsenoside Rg2;20(R)-25-OH-Rg2;enzymatic conversion
2017-04-28
王宇(1992-),女,硕士研究生,研究方向:天然产物生物转化,E-mail:13624985605@163.com。
*
鱼红闪(1968-),男,博士,教授,研究方向:天然产物生物转化,E-mail:hongshan@dlpu.edu.cn。
国家高端外国专家项目(GDT20152100019)。
TS255.1
A
1002-0306(2017)22-0026-05
10.13386/j.issn1002-0306.2017.22.006
