流式细胞学技术检测急性髓细胞白血病患者外周血淋巴细胞亚群的效果分析
2017-12-06汪宏梅张云宁
汪宏梅, 张云宁, 罗 云
(江苏省泰兴市人民医院 检验科, 江苏 泰兴, 225400)
流式细胞学技术检测急性髓细胞白血病患者外周血淋巴细胞亚群的效果分析
汪宏梅, 张云宁, 罗 云
(江苏省泰兴市人民医院 检验科, 江苏 泰兴, 225400)
目的分析流式细胞学技术检测急性髓细胞白血病患者外周血淋巴细胞亚群的变化的效果。方法选取108例急性髓细胞白血病患者为白血病组,另选取108例健康人员作为健康组,采用MultiSET免洗淋巴细胞亚群试剂盒,运用美国BD公司生产的流式细胞仪CD45/SSC设门检测10 000个细胞,采用FACS Diva软件对细胞免疫表型及表达强度进行分析。结果白血病组患者的CD3、CD4、CD4+/CD8+、CD16+/CD56+均显著低于健康组(P<0.05),CD8+、CD19+均显著高于健康组(P<0.05)。细胞CD33、CD38、Cyt-MPO抗原高表达数比例较高,分别占总数的72.5%、70.4%、67.5%; 其次为CD15、CD64,分别占总数的38.0%、32.5%。高表达CD33和CD64及Cyt-MPO表达均呈显著正相关(P<0.05),但是和CD15表达无相关性(P>0.05)。结论流式细胞学技术检测急性髓细胞白血病患者外周血淋巴细胞亚群,能够对其变化规律有一个清晰的了解。
流式细胞学技术; 急性髓细胞白血病; 外周血淋巴细胞亚群
急性髓细胞白血病又称急性非淋巴细胞白血病,是一种高度异质化的恶性血液病,发生机制为骨髓中集聚血细胞的髓性癌,正常血细胞的生成受到快速生长的异常白细胞的干扰,进而从骨髓向血液进入,取代正常血细胞[1-2]。目前,临床还未明确急性髓细胞白血病的具体病因,普遍认为其发病可能受到病毒感染、化学物质毒性等的影响,而癌细胞可能会在缺失机体细胞/体液免疫功能、较弱的免疫清除能力等的作用下无限增殖[3]。本研究分析流式细胞学技术检测急性髓细胞白血病患者外周血淋巴细胞亚群的变化的效果,现报告如下。
1 资料与方法
1.1 一般资料
选取本院2013年5月—2016年5月收治的急性髓细胞白血病患者108例为白血病组,所有患者均符合《血液病诊断及疗效标准》[4]中急性髓细胞白血病的诊断标准,均经血常规检查及骨髓穿刺检查确诊为急性髓细胞白血病,均知情同意。其中男58例,女50例,年龄16~54岁,平均(19.4±5.4)岁; 在FAB分型方面, 10例患者为M0, 15例患者为M1, 23例患者为M2, 20例患者为M3, 13例患者为M4, 14例患者为M5, 13例患者为M6。另选取同期来本院进行体检的108例健康人员作为健康组,其中男57例,女51例,平均(22.0±5.3)岁。2组患者的一般资料比较,差异无统计学意义(P>0.05), 具有可比性。
1.2 方法
采集2组患者的外周静脉全血2 mL, 在抗凝管中放置,振摇均匀后备用。分别将50 μL抗凝全血取出来,在FACS专用试管中放置,将20 μL CD3/CD4/CD8/CD45/CD19/CD45/CD1等标记的抗体分别加入其中,旋涡混匀,室温下进行15 min的避光放置,将450 μL溶血素加入其中,混匀后进行15 min的避光放置,采用MultiSET免洗淋巴细胞亚群试剂盒,运用美国BD公司生产的流式细胞仪CD45/SSC设门检测10 000个细胞,采用FACS Diva软件对细胞免疫表型及表达强度进行分析。
1.3 统计学分析

2 结 果
2.1 2组患者的外周血T、B淋巴细胞和NK细胞亚群检测结果比较
白血病组患者的CD3、CD4、CD4+/CD8+、CD16+/CD56+均显著低于健康组(P<0.05),CD8+、CD19+均显著高于健康组(P<0.05), 见表1。

表1 2组患者的外周血T、B淋巴细胞和NK细胞亚群 检测结果比较 %
与健康组比较, *P<0.05。
2.2 白血病组患者细胞CD抗原表达分布情况
分析
白血病组患者细胞CD33、CD38、Cyt-MPO抗原高表达数比例较高,分别占总数的72.5%、70.4%、67.5%; 其次为CD15、CD64, 分别占总数的38.0%、32.5%; 再次为CD7,占总数的13.0%; 最后为CD2、CD19, 均为0%, 见表2。
2.3 白血病组患者高表达CD33和CD15、CD64及
Cyt-MPO表达的相关性分析
白血病组患者高表达CD33和CD64及Cyt-MPO表达均呈显著正相关(P<0.05), 但是和CD15表达无相关性(P>0.05), 见表3。
3 讨 论
急性髓细胞白血病属于一种恶性肿瘤性疾病,诱发因素为造血干细胞异常增生,现阶段急性髓细胞白血病患者具有较低的5年生存率[5]。发生这一现象的主要原因为现阶段的治疗手段无法将致病细胞彻底清除掉,在一定程度上残留了致病细胞,从而造成白血病复发,最终造成白血病致死等。很多相关医学研究[6-8]表明,白血病的发病受到外周血淋巴细胞亚群异常的影响。
在免疫系统中,淋巴细胞占有极为重要的地位,依据细胞表面标志及功能,临床分淋巴细胞为很多不同群体,在免疫应答中进行分化及增值前经抗原活化,最终将功能表达出来对效应进行形式,对机体内稳定的环境进行有效维持。在肿瘤免疫中,T淋巴细胞发挥着中心调控的作用,其属于一群人胸腺中输出细胞,具有特殊标志,对细胞免疫功能及免疫调节功能进行执行,其中CD3+细胞代表T淋巴细胞总数; 在免疫应答过程中, CD4+细胞作为反应细胞占有极为重要的地位,能够促进其他免疫细胞功能的增强或将其扩大。如果其T淋巴细胞减少,则说明患者体内具有较低的细胞免疫功能; CD8+细胞一方面会对靶细胞产生细胞毒作用,另一方面还会调节性免疫抑制CD4+细胞。如果其T淋巴细胞相对增加,则能够为机体处于免疫抑制状态提供良好的前提条件,并促进白细胞对癌变细胞清除能力的减弱,使癌细胞残存,从而提升复发率; CD4+/CD8+的稳定比例对细胞免疫反应的平衡进行维持,其将抗肿瘤作用有效发挥出来的唯一条件为具有正常的水平[9]。

表2 白血病组患者细胞CD抗原表达分布情况分析[n(%)]
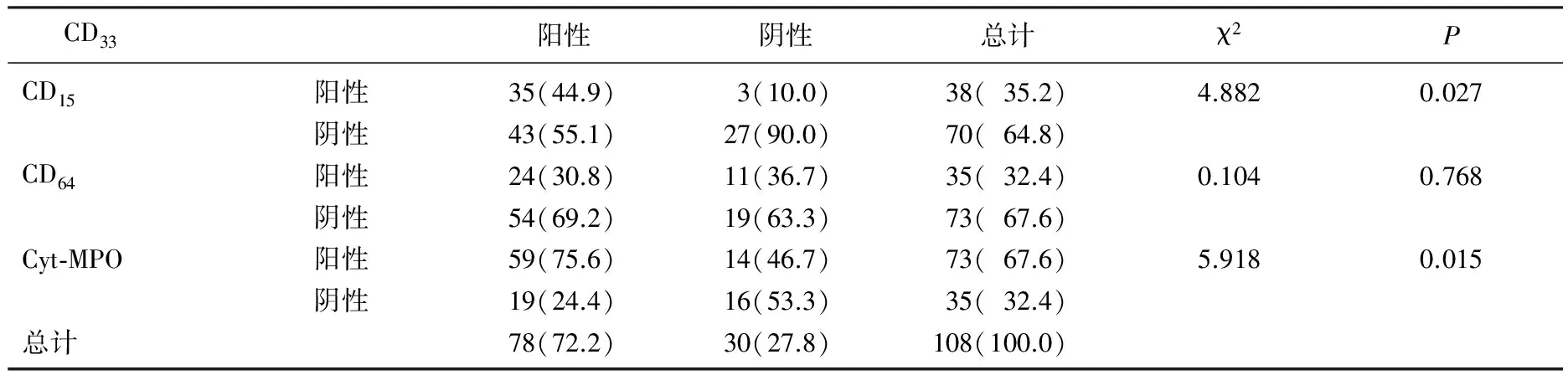
表3 白血病组患者高表达CD33和CD15、CD64及Cyt-MPO表达的相关性分析
Cyt-MPO属于一种过氧化物酶,产生主体为中性粒细胞嗜天青颗粒,能够将足够的自由基产生出来,途径为催化氯化物并氧化氧化氢,进而对NK细胞对肿瘤细胞的反应进行抑制,对机体免疫功能造成直接而深刻的影响; CD15属于一种碳水化合物抗原,在单核细胞及中性粒细胞细胞膜表面糖蛋白上存在,其一方面作为第二信使在细胞间的信号传导中参与,向细胞质及细胞核传导细胞外信息,另一方面还使肿瘤细胞易于在基膜上黏附,途径为通过细胞黏附作用,从而为癌症进展提供良好的前提条件; CD19是B细胞的一个标志,在一定程度上影响着B细胞的分化、增值等; CD45是一种白细胞表面共同抗原,能够将全部白细胞获取过来,这些白细胞没有杂细胞,途径为通过CD45/SSC设门; CD33分子属于一种跨膜受体,分布于髓系细胞细胞表现,临床普遍认为其标志着粒细胞特异性; CD64在白细胞表面分布,属于一种Fc受体,将体液调节和细胞免疫连接了起来[10]。
[1] 中华医学会血液学分会. 急性髓系白血病(复发难治性)中国诊疗指南(2011年版)[J]. 中华血液学杂志, 2011, 32(12): 887-888.
[2] 中华医学会血液学分会. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)[J]. 中华血液学杂志, 2011, 32(11): 804-807.
[3] 陈影. 流式细胞术检测急性髓细胞白血病免疫表型及其临床意义[D]. 安徽医科大学, 2014.
[4] 贾明峰, 席亚明, 石秀娥, 等. MPO、NQ01优基因多态性与急性白血病易感性的相关研究[J]. 中国实验血液学杂志, 2012, 20(6): 1336-1340.
[5] 张书芹, 王光平, 朱平, 等. 急性髓系白血病CD33+/CD34+细胞表面核酸适配体的筛选及结构分析[J]. 中国实验血液学杂志, 2011, 19(3): 561-565.
[6] 王贤, 夏永泉, 张葵. CD64和CD14单核细胞相关性急性髓系白血病诊断中的意义[J]. 国际检验医学杂志, 2013, 34(2): 158-159.
[7] 吕占武, 胡朝晖, 陈南风, 等. 糖原染色在急性淋巴细胞白血病亚型诊断中的应用[J]. 检验医学与临床, 2011, 8(2): 180-181.
[8] 王忠英, 林桢, 邓小燕, 等. 急性髓细胞白血病17号染色体短臂杂合性缺失的研究[J]. 检验医学与临床, 2011, 8(9): 1025-1026, 1029.
[9] Cogle Christopher R, Scott Bart L, Boyd Thomas, et al. Oral Azacitidine (CC-486) for the Treatment of Myelodysplastic Syndromes and Acute Myeloid Leukemia[J]. The Oncologist, 2015, 20 (12): 1404-1412.
[10] Chen Mo, Zhu Nan, Liu Xiaochuan, et al. JMJD1C is required for the survival of acute myeloid leukemia by functioning as a coactivator for key transcription factors[J]. Genes & Development, 2015, 29 (20): 2123-2139.
Effectofflowcytometryondetectionofperipheralbloodlymphocytesubsetsinpatientswithacutemyeloidleukemia
WANGHongmei,ZHANGYunning,LUOYun
(DepartmentofLaboratory,TaixingPeople′sHospital,Taixing,Jiangsu, 225400)
ObjectiveTo analyze the effect of flow cytometry on detection of peripheral blood lymphocyte subsets in patients with acute myeloid leukemia.MethodsA total of 108 patients with acute myeloid leukemia were selected as leukemia group, and 108 healthy people were selected as control group. MultiSE lymphocyte subsets regents and flow cytometer (CD45/SSC, America) were used to detect 10 000 cells, and FACS Diva software was used to analyze the cellular immunophenotype and expression intensity.ResultsIn the leukemia patients, the CD3, CD4, CD4+/CD8+, CD16+/CD56+were significantly lower than normal people, while CD8+, CD19+were significantly higher (P<0.05). Expression of antihelion of cell CD33, CD38and Cyt-MPO were high, respectively accounting for 72.5%, 70.4% and 67.5%, and followed by CD15, CD64, which accounting for 38% and 32.5% respectively. High expressions of CD33, CD64and Cyt-MPO all showed positive correlations (P<0.05), but was not related with expression of CD15(P>0.05).ConclusionFlow cytometric analysis of peripheral blood lymphocyte subsets in patients with acute myeloid leukemia can provide a clear understanding of the change of lymphocyte subsets.
flow cytometry; acute myeloid leukemia; peripheral blood lymphocyte subsets
R 733.71
A
1672-2353(2017)21-036-03
10.7619/jcmp.201721010
2017-06-05
