重症EV71型手足口病炎症因子的临床意义
2017-12-06谭艳芳魏婷婷欧阳文献李双杰
谭艳芳,魏婷婷,欧阳文献,姜 涛,李双杰
(湖南省儿童医院,湖南 长沙 410007)
·论著·
重症EV71型手足口病炎症因子的临床意义
谭艳芳,魏婷婷,欧阳文献,姜 涛,李双杰
(湖南省儿童医院,湖南 长沙 410007)
目的了解5种炎症因子MCP-1、IL-1β、IL-18、HMGB1、IL-10在重症EV71型手足口病(HFMD)中的临床意义。方法选取某院2014年3—8月确诊为重症EV71型HFMD的住院患儿为HFMD组,同期本院门诊体检的健康儿童为对照组,动态观察两组外周血MCP-1、IL-1β、IL-18、HMGB1、IL-10表达水平的变化,并收集HFMD组临床资料。结果HFMD组共102例患儿,平均年龄为(2.18±0.91)岁,其中主要以≤3岁为主,占80.39%;HFMD组患儿入院时为第2期77例,第3期16例,第4期9例。经过第2期共77例,第3期共52例,第4期共21例,第5期共88例。HFMD组第2、3、4期分别与对照组的5种炎症因子表达水平比较,差异均有统计学意义(均P<0.05);HFMD组第3期与第4期的IL-10表达水平比较,差异无统计学意义(P>0.05)。HFMD组第2、3期进展组HMGB1表达水平均高于痊愈组,差异均有统计学意义(均P<0.05)。死亡组与存活组在入院时5种炎症因子表达水平的比较,差异均有统计学意义(均P<0.05)。结论MCP-1、HMGB1、IL-1β、IL-10、IL-18的表达水平与HFMD病情轻重相关,对患儿预后的预测有一定临床意义。HMBG1在HFMD中对病情转归有一定预测价值。
手足口病; 人肠道病毒71型; MCP-1; HMGB1; IL-1β; IL-10; IL-18
典型的手足口病(hand-foot-and-mouth disease ,HFMD) 以手、足、臀周及口腔黏膜的疱疹为主要表现,伴有发热等非典型症状;重症病例常无典型皮疹,可能以严重的神经系统、呼吸系统、循环系统症状为首发表现,以神经源性肺水肿、循环衰竭为主要致死原因。重症HFMD以感染人肠道病毒71型(enterovirus 71,EV71)为主[1],在并发脑炎、肺水肿、肺出血患者中EV71检出率更高,但EV71在HFMD的具体致病机制尚不明确。单核细胞趋化蛋白-1(MCP-1)、白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)、高迁移率族蛋白1(HMGB1)是常见的炎症因子,其在肺炎、出血后的炎症反应、炎症性肠病、胰腺炎、皮炎以及众多其他炎症相关疾病的发生发展中起重要调节作用[2-6]。白细胞介素-10(IL-10)作为一种经典的抑炎因子,常常与IL-1β、IL-18等促炎因子相互协调而起到保护机体免受感染的作用。目前,上述炎症因子和白细胞介素在重症EV71型HFMD的发病过程中是否起作用尚不清楚,故选取某院确诊为重症EV71型HFMD的住院患儿,动态观察此病不同分期外周血中MCP-1、IL-1β、IL-18、HMGB1、IL-10表达水平的变化,探索此5种炎症因子在重症EV71型HFMD发病过程中的临床意义。
1 对象与方法
1.1 研究对象 选取某院2014年3—8月符合《手足口病诊疗指南(2010年版)》诊断标准,经实验室ELISA确诊病原仅为EV71的住院患儿,作为HFMD组;选取同期本院门诊体检,按性别、年龄匹配设置的健康儿童为对照组。参照卫生部颁布的《肠道病毒71型(EV71)感染重症病例临床救治专家共识(2011年版)》,将HFMD组患儿按照病情轻重分为神经系统受累期(第2期)、心肺功能衰竭前期(第3期)、心肺功能衰竭期(第4期)、恢复期(第5期)。进一步将HFMD组第2、3期患儿按照之后病情转归不同分为进展组与痊愈组;按照结局不同分为死亡组与存活组。
1.2 临床观察 参照《肠道病毒71型(EV71)感染重症病例临床救治专家共识(2011年版)》判断病情变化,动态观察HFMD组患儿发热、皮疹、精神反应、易惊、呕吐、心率、呼吸、末梢循环等情况,并于病情变化2 h内再次留取外周静脉血标本。所有HFMD组患儿均采集外周血进行血常规、血糖、C反应蛋白(CRP)、降钙素原(PCT)、血生化等参数检测,行胸片、头颅CT/MRI等影像学检查。
1.3 检测方法 留取HFMD组和对照组患儿入院2 h内静脉血标本2 mL,置于EDTA抗凝管中,以3 000 r/min的速度离心10 min,分离出血浆于冻存管,置于-70℃冰箱保存。采用双抗体夹心ELISA法测定外周血血浆MCP-1、IL-1β、IL-18、HMGB1、IL-10表达水平,按说明书进行操作;每个样本设3个复孔,酶标检测仪450 nm处读数。
1.4 统计分析 应用SPSS 19.0统计软件进行数据分析。计量资料采用均数±标准差,两样本比较采用独立样本T检验,多样本比较采用单因素方差分析,P≤0.05为差异有统计学意义。
2 结果
2.1 一般资料 HFMD组共102例患儿,其中男性57例,女性45例;年龄为3个月~7岁,平均年龄为(2.18±0.91)岁,其中主要以≤3岁为主,占80.39%(82/102);HFMD组患儿均以发热、皮疹、精神反应差、易惊为主要表现;第4期患儿年龄低于第2、3期,但入院时体温、白细胞数、血糖、CRP、PCT高于第2、3期。见表1。
2.2 病情转归 HFMD组患儿入院时为第2期有77例,第3期有16例,第4期有9例。HFMD患儿从第2期进展到第3、4期一般于病程的第2~4天。HFMD组患儿从第2期病情共转为第3期有36例,第4期有5例,第5期有73例,死亡1例;从第3期病情共转为第4期有7例,第5期有12例,死亡4例;从第4期病情共转为第5期有3例,死亡6例。见图1。
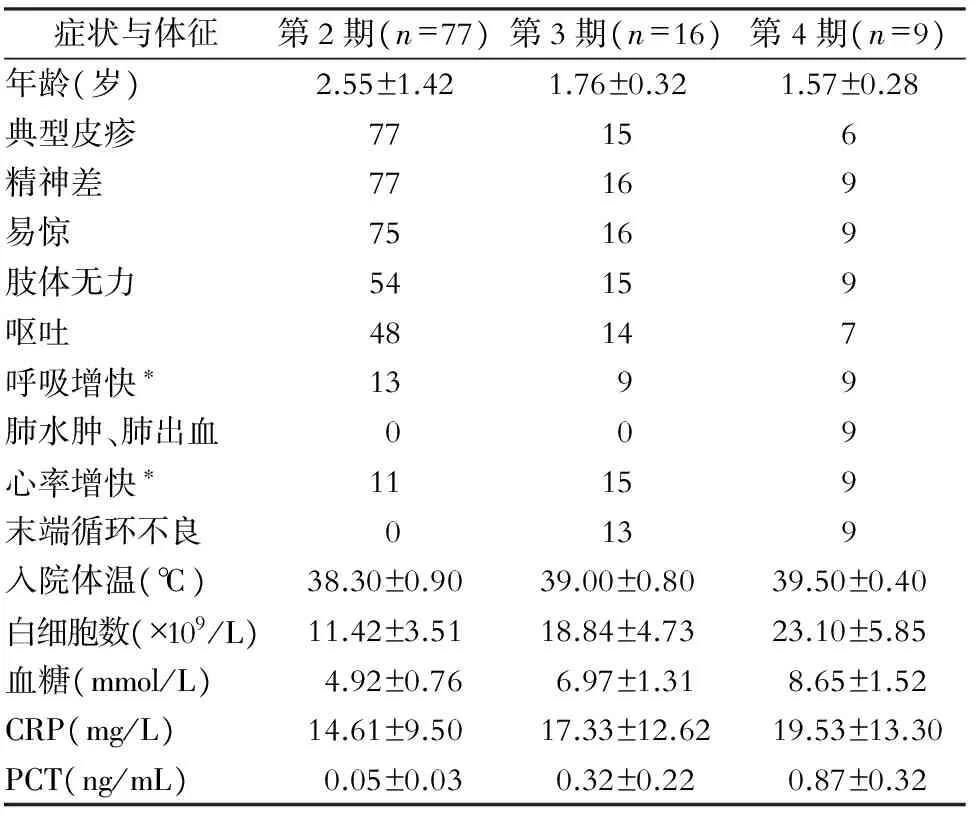
表1 HFMD组患儿一般资料
*:排除体温影响
2.3 HFMD组和对照组炎症因子表达水平 HFMD组患儿经过第2期共有77例,第3期共有52例,第4期共有21例,第5期共有88例。HFMD组第2、3、4期分别与对照组的5种炎症因子表达水平比较,差异均有统计学意义(均P<0.05)。
HFMD组第2期与第3期的5种炎症因子表达水平比较,差异均有统计学意义(均P<0.05);HFMD组第3期与第4期的MCP-1、IL-1β、IL-18、 HMGB1表达水平比较,差异均有统计学意义(均P<0.05);HFMD组第3期与第4期的IL-10表达水平比较,差异无统计学意义(P>0.05)。见表2。
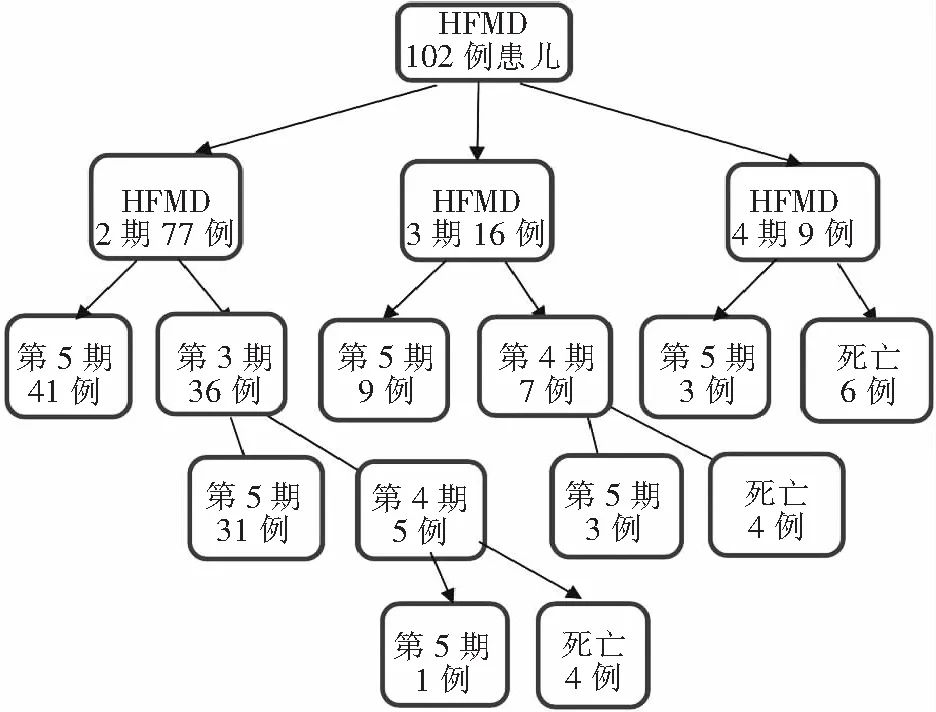
图1 102例HFMD患儿病情转归情况

组别例数MCP⁃1(pg/mL)IL⁃1β(pg/mL)IL⁃18(pg/mL)HMGB1(ng/mL)IL⁃10(pg/mL)HFMD组 第2期77468.72±266.431149.41±207.211363.83±268.0153.90±17.30638.10±89.82 第3期52711.90±397.85°1614.35±297.24°1535.01±239.94°75.52±14.93°918.72±166.45° 第4期211034.32±464.22#2351.72±434.83#2010.91±521.40#104.00±12.21#939.80±147.87 第5期88151.70±29.82260.72±49.10276.40±67.9429.52±9.76192.29±26.46对照组6832.05±13.34∗57.51±28.54∗64.80±24.72∗5.90±1.33∗24.94±9.88∗
*:分别与HFMD组第2、3、4期比较,P<0.05;°:与HFMD组第2期组比较P<0.05;#:与HFMD组第3期比较P<0.05
2.4 进展组和痊愈组炎症因子表达水平 HFMD组第2期进展组共36例,痊愈组共41例;HFMD第3期进展组共7例,痊愈组共9例。HFMD组第2期进展组与痊愈组的MCP-1、IL-1β、IL-18、IL-10表达水平比较,差异均无统计学差异(均P>0.05);HFMD组第3期进展组与痊愈组的MCP-1、IL-1β、IL-18、IL-10表达水平比较,差异均无统计学差异(均P>0.05)。HFMD组第2、3期进展组的HMGB1表达水平均高于痊愈组,差异均有统计学意义(均P<0.05)。见表3。
2.5 死亡组和存活组炎症因子表达水平 HFMD组中死亡组共14例,存活组共88例,两组在入院时5种炎症因子表达水平比较,差异均有统计学意义(均P<0.05)。见表4。
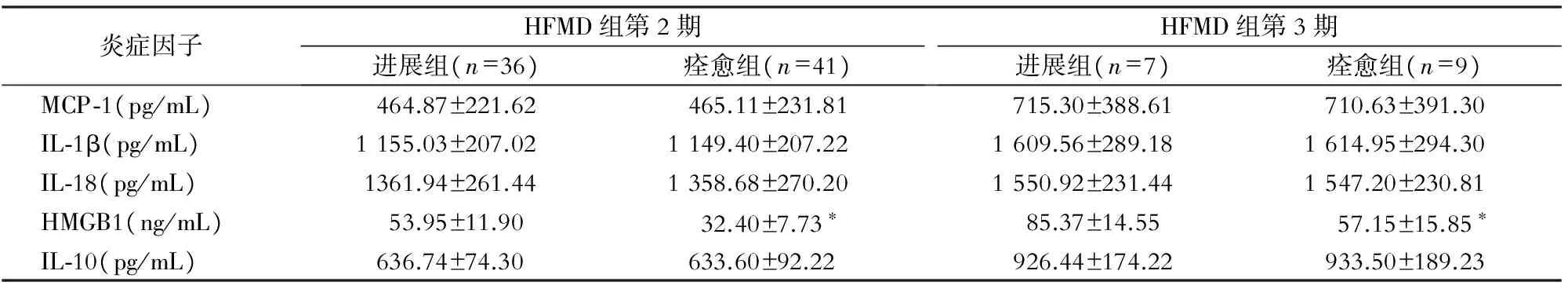
表3 HFMD组第2、3期进展组和痊愈组5种炎症因子表达水平
*:与进展组比较P<0.05

表4 HFMD死亡组和存活组5种炎症因子表达水平
*:与死亡组比较P<0.05
3 讨论
我国近年HFMD流行病学调查[7]显示,EV71为重症HFMD的主要病原体。重症病例主要有中枢神经系统症状、循环系统症状、呼吸系统症状等[8];重症EV71型HFMD发生发展有全身炎症反应参与[9]。正常情况下,促炎反应与抑炎反应维持动态平衡过程,以达到清除体内病原的目的,但当病情严重,如重症EV71感染时,平衡可能被打破,炎症因子大量释放,全身炎症反应剧烈,损伤多个脏器组织[10]。
MCP-1是趋化因子超家族中的CC亚族有代表性的一员,由炎性细胞及组织细胞共同分泌[11]。MCP-1通过趋化单核细胞,上调单核细胞黏附分子的表达,进而促进分泌IL-1、IL-6等多种细胞因子,促使嗜碱性粒细胞对组胺的释放,对炎症反应起调节作用。随着EV71感染越严重,MCP-1表达水平越高,对免疫细胞的趋化作用越强,进一步刺激下游炎症因子释放增多,加重全身炎症反应。IL-1β是一种早期炎症因子[12],在人体感染EV71后,体内炎症反应过程被启动,巨噬细胞等多种免疫相关细胞分泌IL-1β,之后通过与TLR家族成员结合来完成一系列下游反应,在反应过程中会激活转录因子NF-κB信号途径[13],NF-κB信号途径又对MCP-1起激活作用,即IL-1β对MCP-1参与炎症反应的过程起到调节作用,可以解释IL-1β与MCP-1在HFMD各个分期中表达水平趋势相同的原因。
IL-18是一种重要的前炎症细胞因子,主要表达于T淋巴细胞、巨噬细胞和树突状细胞等[14]。IL-18与受体IL-18Rα结合后,也可诱导转录因子NF-κB的活化以促进诸多其他反应的发生。本研究结果显示,IL-18的表达水平趋势与IL-1β、MCP-1一致,与IL-18在炎症反应过程中诱导NF-κB活化、激活JAK/STAT信号转导通路相关。IL-18在HFMD组各期外周血中的表达水平均高于对照组,随着第2、3、4期病情加重,IL-18表达水平逐渐增高,提示IL-18与病情的严重程度相关。第5期的IL-18表达水平低于第2期,同期外周血中IL-18表达水平不因病情转归不同而有差别。
HMGB1是细胞核内的一种典型的非组蛋白,是高迁移率族蛋白家族中的一员。当感染越严重,HMGB1的释放量越多,炎症反应越剧烈,病情的转归也将朝着进展方向发展;HMGB1释放过度,预后较差,全身炎症反应明显并可能导致死亡。本研究显示HMGB1在HFMD组各期外周血中的表达水平均也高于对照组,随着第2、3、4期病情加重,HMGB1表达水平逐渐增高,第5期的HMGB1表达水平低于第2期,提示HMGB1与病情的严重程度相关。HFMD组第2、3期进展组的HMGB1表达水平均高于痊愈组,提示HMBG1在HFMD中对病情转归有一定预测价值。
IL-10是一种强有力的抗炎因子[15],当患儿感染EV71后,启动全身炎症反应,此时体内的炎症反应既需要清除体内的感染源又不能反应过度造成自身组织损伤,于是IL-10作为监督员调控炎症反应过程[16]。研究发现,HFMD组第2、3期中IL-10的表达水平与MCP-1、HMGB1、IL-1β的表达水平趋势一致,表明在HFMD第3期之前,抑炎因子IL-10的表达与MCP-1、HMGB1、IL-1β的表达是相互作用以达到炎症反应平衡状态。当病情进展至第4期时,炎症平衡状态打破,抑炎因子IL-10的表达不再随着促炎因子的进一步表达而增高,此时,促炎反应作用强于抑炎反应,平衡失调,发生全身炎症反应,多脏器功能受损甚至衰竭,提示IL-10在重症HFMD中的表达水平仍与病情严重程度相关。
综上所述,5种炎症因子在HFMD各期的动态变化过程,提示MCP-1、IL-1β、IL-18、HMGB1、IL-10的表达水平均与HFMD病情轻重相关。5种炎症因子在死亡组表达水平均高于存活组,提示对患儿预后的预测有一定临床意义。
本研究局限于本院感染科住院部病例,样本量不大,其结果存在一定的局限性;若进一步加大样本量进行统计分析,有希望根据炎症指标制定出医学参考范围提示病情分期及严重程度。
[1] Gong M, Zhu H, Zhou J, et al. Cryo-electron microscopy study of insect cell-expressed enterovirus 71 and coxsackievirus a16 virus-like particles provides a structural basis for vaccine development[J]. J Virol, 2014, 88(11): 6444-6452.
[2] Kurata S, Osaki T, Yonezawa H, et al. Role of IL-17A and IL-10 in the antigen induced inflammation model byMycoplasmapneumoniae[J]. BMC Microbiol, 2014, 14: 156.
[3] Sun Q, Wu W, Hu YC, et al. Early release of high-mobility group box 1 (HMGB1) from neurons in experimental subarachnoid hemorrhage in vivo and in vitro[J]. J Neuroinflammation, 2014, 11: 106.
[4] Dinarello CA, Novick D, Kim S, et al. Interleukin-18 and IL-18 binding protein[J]. Front Immunol, 2013, 4: 289.
[5] Xu B, Bai B, Sha S, et al. Interleukin-1β induces autophagy by affecting calcium homeostasis and trypsinogen activation in pancreatic acinar cells[J]. Int J Clin Exp Pathol, 2014, 7(7): 3620-3631.
[6] Gogolinska A, Nowak W. Molecular basis of lateral force spectroscopy nano-diagnostics: computational unbinding of autism related chemokine MCP-1 from IgG antibody[J]. J Mol Model, 2013, 19(11): 4773-4780.
[7] Liu MY, Liu J, Lai W, et al. Characterization of enterovirus 71 infection and associated outbreak of hand, foot, and mouth disease in Shawo of China in 2012[J]. Sci Rep, 2016, 12(6): 38451.
[8] Lee KY. Enterovirus 71 infection and neurological complications[J]. Korean Pediatr, 2016, 59 (10): 395-401.
[9] 韦丹, 李坤雄, 陈娥.肠道病毒71型脑干脑炎二例尸检报道及文献复习[J].中华儿科杂志,2010, 48(3): 220-223.
[10] Feng M, Guo S, Fan S, et al. The preferential infection of astrocytes by enterovirus 71 plays a key role in the viral neurogenic pathogenesis[J]. Front Cell Infect Microbiol, 2016, 6: 192.
[11] Shin HS, Yoo IH, Kim YJ, et al. MKP1 regulates the induction of MCP1 byStreptococcuspneumoniaepneumolysin in human epithelial cells[J]. Mol Cells, 2010, 30(3): 263-270.
[12] Cui D, Zhong F, Lin J, et al. Changes of circulating Th22 cells in children with hand, foot, and mouth disease caused by enterovirus 71 infection[J]. Oncotarget, 2017, 8(17): 29370-29382.
[13] Lin CY, Lee CH, Chang YW, et al. Pheophytin a inhibits inflammation via suppression of LPS-induced nitric oxide synthase-2, prostaglandin E2, and interleukin-1β of macrophages[J]. Int J Mol Sci, 2014, 15(12): 22819-22834.
[14] Shi JH, Niu LD, Chen XY, et al. Investigation on the IL-18 -607A/C and -137C/G on the susceptibility of ischemic stroke[J]. Pak J Med Sci, 2015, 31(1): 198-202.
[15] Yang S, Gao L, Lu F, et al. Transcription factor myocyte enhancer factor 2D regulates interleukin-10 production in microglia to protect neuronal cells from inflammation-induced death[J]. Neuroinflammation, 2015, 12: 33.
[16] Yang J, Zhao N, Su NL. Association of interleukin 10 and interferon gamma gene polymorphisms with enterovirus 71 encephalitis in patients with hand, foot and mouth disease[J]. Scand J Infect Dis, 2012, 44(6): 465-469.
ClinicalsignificanceofinflammatoryfactorsinsevereEV71hand-foot-and-mouthdisease
TANYan-fang,WEITing-ting,OUYANGWen-xian,JIANGTao,LIShuang-jie
(HunanChildren’sHospital,Changsha410007,China)
ObjectiveTo investigate the clinical significance of 5 kinds of inflammatory factors (MCP-1, IL-1β, IL-18, HMGB1, and IL-10) in severe EV71 hand-foot-and-mouth disease (HFMD).MethodsHospitalized children who were diagnosed with severe EV71 HFMD in a hospital in March-August, 2014 were as HFMD group, healthy children who underwent physical examination in outpatient department of the same hospital during the same period were as control group, changes in expression levels of peripheral blood MCP-1, IL-1β, IL-18, HMGB1, and IL-10 of both groups were dynamically observed, clinical data of HFMD group were collected.ResultsThere were 102 children in HFMD group, the average age was (2.18±0.91) years old, 80.39% of whom were ≤3 years old; there were 77, 16, and 9 cases in HFMD group at stage 2, 3, and 4 respectively at admission. 77, 52, 21, and 88 cases went through stage 2, 3, 4, and 5 respectively. Expression levels of 5 kinds of inflammatory factors at stage 2, 3, and 4 in HFMD group were compared respectively with control group, differences were all statistically significant(allP<0.05); expression levels of IL-10 at stage 3 and 4 in HFMD group were not significantly different (P>0.05). In HFMD group,the expression levels of HMGB1 of stage 2, 3 progression groups were both higher than recovery group(bothP<0.05). The expression levels of 5 kinds of inflammatory factors in the death group and survival group at admission were all significantly different (allP<0.05).ConclusionThe expression levels of MCP-1, HMGB1, IL-1β, IL-10, and IL-18 are closely related to the severity of HFMD, and has certain clinical significance for the prognosis of children. HMBG1 has certain predictive value in the prognosis of HFMD.
hand-foot-and-mouth disease; human enterovirus 71; MCP-1; HMGB1; IL-1β; IL-10; IL-18
[Chin J Infect Control,2017,16(12):1156-1160]
2017-01-03
湖南省中医药管理局(2013128)
谭艳芳(1981-),女(汉族),湖南省涟源市人,主治医师,主要从事儿童感染性疾病与肝胆相关性疾病研究。
李双杰 E-mail:lesjie62@vip.sina.com
10.3969/j.issn.1671-9638.2017.12.011
R512.5
A
1671-9638(2017)12-1156-05
刘思娣、左双燕)
