蓝氏贾第鞭毛虫α-4贾第素诱饵蛋白质粒构建
2017-12-05刘绍伟田喜凤
刘绍伟 王 洋 田喜凤
华北理工大学基础医学院病原生物学学科 河北唐山 063000
蓝氏贾第鞭毛虫α-4贾第素诱饵蛋白质粒构建
刘绍伟 王 洋 田喜凤
华北理工大学基础医学院病原生物学学科 河北唐山 063000
①目的 构建α-4 贾第素诱饵蛋白质粒,为贾第素功能的研究奠定基础。②方法 从α-4贾第素克隆载体pGM-T-α-4中双酶切获得α-4贾第素编码序列,与酵母表达质粒pGBKT7在DNA连接酶的作用下进行重组,重组载体通过热休克法转化大肠杆菌感受态细胞,大肠杆菌经过培养、筛选,碱裂解法提取质粒酶切鉴定获得pGBKT7-α-4诱饵载体。并对诱饵载体进行自激活验证,利用Western blot鉴定诱饵蛋白的表达情况。③结果 经酶切和测序鉴定,获得了pGBKT7-α-4诱饵载体。转化子Y187酵母细胞在SD/-Trp平板上能够生长;而在SD/-Trp/-His和SD/-Trp/-Ade平板上不能生长。说明pGBKT7-α-4质粒无自我激活作用。Western blot鉴定结果显示,pGBKT7-α-4转化酵母菌在52KD 水平位置可检测到α-4 融合C-Myc蛋白的表达。④结论 构建α-4贾第素诱饵蛋白质粒。诱饵蛋白质粒无自我激活作用,在酵母菌株中表达良好,为贾第素功能的研究奠定了基础。
α-4贾第素 构建诱饵蛋白质粒 酵母双杂交
蓝氏贾第鞭毛虫是一种原始的单细胞真核生物,常引起贾第虫病[1]。贾第虫病通过粪口途径传播,患者通过饮用含有贾第虫包囊的水感染,贾第虫病具有传染性强,发病率高的特点,在医疗卫生条件较差的国家和地区常呈爆发性流行。鞭毛、腹吸盘等与贾第虫感染过程密切相关,主要由细胞骨架构成。而贾第素是贾第虫特有的骨架蛋白[2,3],在致病过程中起着重要的作用,可分成α、β、γ、δ四大类[4~6],其中最大的一族是α贾第素。目前,大部分贾第素的定位已经清楚,但每种α贾第素的具体功能尚未明晰[7]。
在生物体内,任何一种细胞骨架蛋白需要与其他蛋白接触联合发挥作用。蛋白质相互作用的研究可以对生命活动有更好的认识。酵母双杂交技术是近年来研究蛋白质的一种重要方法[8]。
本研究利用酵母双杂交技术,构建α-4 贾第素诱饵蛋白质粒,为α-4贾第素功能的研究提供分子基础。
1 材料与方法
1.1材料 菌株和质粒;pGBKT7质粒购自Clontech公司,大肠杆菌菌株XL1-Blue储存于本实验室;Mate & PlateTM文库构建试剂盒购自Clontech公司;DNA片段凝胶回收试剂盒和质粒小量快速提取试剂盒购自百泰克公司; EcoRⅠ、T4 DNA连接酶,限制型内切酶 NdeⅠ购自NEB公司;琼脂糖凝胶购自BIOWEST公司;蛋白酶抑制剂cocktail、细胞裂解液、PMSF购自生工生物公司;HRP标记羊抗鼠IgG抗体、低背景化学发光检测试剂盒、小鼠抗c-Myc标签单克隆抗体购自康为世纪公司;酵母提取物、胰化蛋白胨购自Oxoid公司;卡那霉素购自Sigma公司;氯化钙、无水乙醇等均购于天津北科天津北科化学有限责任公司。自配试剂:LB培养基、PBS缓冲液、50×TAE电泳缓冲液、5×Tris-甘氨酸电泳缓冲液、4×SDS凝胶加样缓冲液、4×转移缓冲液。
1.2仪器 倒置显微镜CKX31、超净工作台ZHJH-C1112B、台式低温高速离心机3K30、台式低温高速离心机Heraeus X1R、恒温水浴箱HH-W、CO2孵箱2406、低温循环水浴、超微量核酸蛋白测定仪Scandrop2000、PCR扩增仪T100、稳压稳流电泳仪DYY-6C、凝胶成像系统92-1292、高压蒸汽灭菌锅SQ510C、气浴振荡摇床ZHWY-100D。
1.3实验方法
1.3.1α-4贾第素诱饵蛋白质粒的构建 α-4克隆质粒PGM-T-α-4和pGBKT7 载体经EcoRⅠ和NdeⅠ酶切作用,酶切产物利用1%的琼脂糖凝胶电泳进行分离,利用DNA片段胶回收试剂盒,回收pGBKT7 载体和α-4 贾第素基因。α-4 贾第素基因与pGBKT7 载体在DNA连接酶作用下进行重组。重组载体转化XL1-blue感受态大肠杆菌。大肠杆菌经过培养,碱裂解法小量提取质粒。
1.3.2重组质粒的酶切鉴定 重组质粒经EcoRⅠ和NdeⅠ酶切,1%琼脂糖凝胶电泳分离酶切产物。获得的质粒进行测序。正确重组质粒命名为pGBKT7-α-4,其对应的菌液继续增菌培养,利用质粒小量提取试剂盒提取质粒并纯化、备用。
1.3.3α-4贾第素自激活实验 pGBKT7-α-4质粒重新转化感受态的酵母细胞中,获得转化子,将转化子分成3份涂于不同平板上,1/3 涂在SD/-His/-Leu/-Trp,1/3 涂在SD/-Ade/-His/-Leu/-Trp,最后1/3 涂在SD/-Leu/-Trp上。30℃培养3~5天,观察菌落生长情况。缺陷性平板筛选转化子。
1.3.4Western Blot 验证诱饵蛋白的表达 pGBKT7-α-4质粒转化感受态酵母,经培养后,裂解转化酵母细胞,收集裂解产物,其中包含裂解蛋白质。Western blot检测诱饵蛋白的表达。
2 结果
2.1α-4贾第素诱饵蛋白质粒的构建 从α-4贾第素克隆载体pGM-T-α-4经NdeⅠ和EcoRⅠ双酶切下来的α-4贾第素全长基因与pGBKT7载体连接产物转化大肠杆菌,质粒经双酶切作用。电泳结果显示,克隆1、2分别在约900bp出现了目的基因片段,在约7.3kb出现了pGBKT7载体片段,提示构建成功。经测序,证实连入的确实为α-4贾第素基因,见图1。
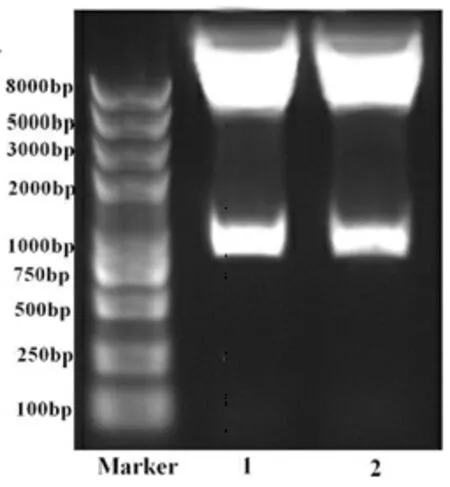
注:Marker:DNA分子量标准;1:克隆1;2:克隆2
图1重组质粒经EcoRⅠ和NdeⅠ酶切后,1%琼脂糖凝胶电泳分离结果
2.2自激活实验结果 将对照质粒和重组质粒小量转化Y187,转化子铺板,3天后观察。阳性对照pCL1 在缺陷培养基上转化酵母菌能够生长,见图2。阳性对照 (pGBKT7-53和pGADT7-T),在缺陷培养基上转化酵母菌均有克隆生长,见图3。阴性对照(pGBKT7)转化酵母菌在SD/-Trp平板上生长;但在缺乏组氨酸(His)或腺嘌呤(Ade)平板上,基本上不生长,见图4。实验组 pGBKT7-α-4转化酵母菌在SD/-Trp平板上生长;但在缺乏组氨酸(His)或腺嘌呤(Ade)平板上,基本上不生长。说明pGBKT7-α-4质粒无自我激活作用,见图5。

注:A:SD/-Leu;B:SD/-Leu/-His;C:SD/-Leu/-Ade
图2在缺陷培养基上pCL1质粒转化酵母菌的成长情况

注:A:SD/-Trp/-Leu/-His/-Ade;B:SD/-Trp/-Leu
图3阳性对照(pGBKT7-53和pGADT7-T)共转化酵母菌在缺陷培养基上的生长情况

注:A:SD/-Trp;B:SD/-Trp/-His;C:SD/-Trp/-Ade
图4缺陷培养基上pGBKT7转化酵母菌的生长情况

注:A:SD/-Trp;B:SD/-Trp/-His;C:SD/-Trp/-Ade
图5重组载体pGBKT7-α-4的自激活实验结果
2.3重组载体pGBKT7-α-4的表达情况鉴定 采用western blot鉴定pGBKT7-α-4在酵母菌中的表达情况。结果显示,实验组在 52 KD 水平可检测到α-4X融合C-Myc蛋白的表达。空载体对照组可在20KD左右处检测到C-Myc-Tag蛋白的表达,见图6,证明重组载体表达良好。

图6 Western blot鉴定pGBKT7-α-4在Y187酵母菌中的表达
3 讨论
贾第素是贾第虫特有的骨架成分[2,3],与贾第虫的致病性关系密切[9~12]。贾第素蛋白成员众多,其中α贾第素家族是其中最大的一族,共有21个成员,其大部分成员的具体功能未知[7]。本研究主要探索α-4 贾第素的功能,以便了解贾第虫的致病机理。
酵母双杂交技术是应用较为广泛的研究方法,在研究中具有很多的优势[13,14],所以,在蛋白质的研究[15~17]、基因的研究[18~20]、蛋白连锁图的建立[21,22]、药物及其作用位点[23]、抗原抗体反应[24]、病毒[25~27]、寄生虫[28]等的研究中被广泛应用。利用酵母双杂交技术进行α-4 贾第素诱饵蛋白质粒构建和自激活功能的研究,为最终通过贾第素相互作用蛋白以证实贾第素功能的研究奠定基础。
若要构建α-4 贾第素诱饵蛋白质粒,首先需要获得α-4 贾第素基因与pGBKT7 载体。本研究利用α-4克隆质粒PGM-T-α-4和pGBKT7 质粒在双酶切作用下分别获得α-4 贾第素基因和 pGBKT7 载体编码序列,并对其进行回收。重组后,转化XL1-blue 感受态大肠杆菌中。经过培养、筛选、提取,获得重组质粒,重组质粒构建完成后,其正确性仍需进行验证。重组质粒经酶切后电泳分离,从研究结果来看,质粒经双酶切电泳显示,克隆1、2分别在约900bp出现了目的基因片段,在约7.3kb出现了pGBKT7载体片段,提示本次α-4 贾第素诱饵蛋白质粒构建成功。为更进一步精确验证重组质粒的正确性,本研究还采用基因测序的方法,再次对质粒进行测序验证。经测序证实连入的确实为α-4贾第素基因。含有pGBKT7-α-4质粒的大肠杆菌继续增菌培养,最后经菌体破坏、收集、提取、纯化获得pGBKT7-α-4质粒。
α-4 贾第素诱饵蛋白质粒是否能满足实验要求,除质粒构建成功外,需进行自激活能力的验证,以排除自激活带来的假阳性的发生[29]。除此之外,成功转化的酵母菌株诱饵蛋白能够正常表达。这两个条件缺一不可。将对照质粒和重组质粒小量转化酵母菌株Y187,转化子转种在缺陷培养基上培养3天,观察菌落生长情况。
从培养结果可以看出,pCL1质粒由于含有编码亮氨酸(Leu)和野生型 GAL4的基因,因此不需要外界提供Leu、组氨酸(His)或腺嘌呤(Ade),在相应的缺陷培养基上转化菌可以生长。因此,在SD/-Leu,SD/-Leu/-His,SD/-Leu/-Ade 平板上,转化酵母菌均有生长,和预期一致。
在酵母细胞内,pGBKT7-53可表达GAL4 BD domain和鼠p53的融合蛋白,pGADT7-T表达GAL4 AD domain和large T-antigen的融合蛋白,两融合蛋白通过BD-AD相互结合,p53和SV40 large T-antigen发挥激活活性,报告基因表达组氨酸(His)或腺嘌呤(Ade),接种到缺陷培养基,转化菌可以生长。从培养结果可以看出,在缺陷培养基上pGBKT7-53和pGADT7-T转化酵母菌均能生长,和预期一致。
pGBKT7 质粒能够表达色氨酸(Trp),不能表达组氨酸(His)或腺嘌呤(Ade)。因此,不需要外界提供Trp,将转化菌接种到缺Trp培养平板上,可以生长。转化菌接种到缺乏His或Ade的培养平板上,不能生长。从培养结果可以看出,转化酵母菌在SD/-Trp平板上生长;但在缺乏组氨酸(His)或腺嘌呤(Ade)平板上,基本不生长,和预期一致。
实验组pGBKT7-α-4质粒由于含有编码色氨酸(Trp)的基因,不需要外界提供Trp,将转化菌接种到缺乏Trp的培养平板上,可以生长。若pGBKT7-α-4质粒无自激活作用,则报告基因不会激活,也就不能表达组氨酸(His)或腺嘌呤(Ade),在相应缺陷培养基上转化菌则不能生长。因此,在SD/-Trp平板上,转化酵母菌有生长;而在SD/-Trp/-His和SD/-Trp/-Ade平板上,转化菌不能生长。说明pGBKT7-α-4质粒无自我激活作用。
将α-4 贾第素诱饵蛋白质粒重新转化到感受态的酵母菌株中,经过培养后,进行裂解,收集裂解产物。检测诱饵蛋白的表达。经证实实验组和对照组分别在52KD 、20KD水平检测到α-4 融合 C-Myc蛋白和C-Myc-Tag蛋白的表达,证明重组载体表达良好。
通过本次研究,利用酶切作用对α-4克隆质粒PGM-T-α-4和pGBKT7 质粒进行酶切获得α-4 贾第素基因和 pGBKT7 载体片段,并利用DNA连接酶进行基因重组,经过大肠杆菌转化、培养、质粒提取,最终成功构建α-4 贾第素诱饵蛋白质粒。α-4 贾第素诱饵蛋白质粒无自我激活作用;在酵母菌株中表达良好。为贾第素功能的研究奠定了基础。
[1] Gardner TB,Hill DR.Treatment of giardiasis[J].Clin Microbiol Rev,2001,14(1):114-128
[2] Crossley R,Holberton DV.Characterization of proteins from the cytoskeleton of Giardia lamblia[J].J Cell Sci,1983,59:81-103
[3] Holberton DV,Ward AP.Isolation of the cytoskelet on from Giardia.Tubulin and a low-molecular-weight protein associated with microribbon structures[J].J Cell Sci,1981,47:139-166
[4] Kim J,Goo SY,Chung H J,et al.Interaction of beta-giardin with the Bop1 protein in Giardia lamblia[J].Parasitol Res,2006,98(2):138-144
[5] Nohria A,Alonso RA,Peattie DA.Identification and characterization of gamma-giardin and the gamma-giardin gene from Giardia lamblia[J].Mol Biochem Parasitol,1992,56: 27-37
[6] Jenkins MC,O'Brien CN,Murphy C,et al.Antibodies to the ventral disc protein delta-giardin prevent in vitro binding of Giardia lamblia trophozoites[J].J Parasitol,2009,95(4):895-899
[7] 王 洋,余 源,王卫亮,等.蓝氏贾第鞭毛虫α-4贾第素的原核表达及纯化[J].中国人兽共患病学报,2011,27(6):465-469
[8] 吴 娟,钱 凯,杨泽峰.酵母双杂交系统的研究进展[J].安庆师范学院学报(自然科版),2005,11(2):59-63
[9] Campanati L,Holloschi A,Troster H,et al.Video-microscopy observations of fast dynamic processes in the protozoon Giardia lamblia[J].Cell Motil Cytoskeleton,2002,51(4):213-224
[10] Cruz A,Sousa MI,Azeredo Z,et al.Isolation,excystation and axenization of Giardia lamblia isolates: invitrosusceptibility to metronidazole and albendazole[J].J Antimicrob Chemother,2003,51(4):1017-1020[11] Cruz A,Isaura SM,Azeredo Z,et al.Comparison between two common methods for measuring Giardia lamblia susceptibility to antiparasitic drugs invitro[J].Acta Trop,2003,88(2):131-135
[12] Campanati L,Monteiro-Leal LH.The effects of the antiprotozoal drugs metronidazole and furazolidone on trophozoites of Giardia lamblia (P1 strain)[J].Parasitol Res,2002,88(2):80-85
[13] 刘 骥,张秀娟,翻建平,等.酵母双杂交技术的应用及进展[J].安徽农业科学,2008,36(19):8021-8022
[14] 郑立双,李向楠,孙城涛,等.酵母双杂交技术及应用的研究进展[J].中国畜牧兽医,2013,40(9):105-108
[15] 高向伟,许正平.血管生成素相互作用蛋白质的筛选及鉴定[J].中国生物化学与分子生物学学报, 2015,31(12):1289-1293
[16] 沈君豪,方 娟,郭兴荣.酵母双杂交技术筛选宫颈癌HeLa细胞cDNA文库中FAM92A1-289关联蛋白[J].山东医药,2016,56(19):1-4
[17] 刘 超,刘乙蒙,栾治东,等.酵母双杂交技术筛选与蛋白激酶Weel相互作用的蛋白[J].中国生化药物杂志,2016,36(3):23-26
[18] 王 鑫,石 达,董 慧,等.ST细胞酵母双杂交cDNA文库的构建及鉴定[J].中国畜牧兽医,2017,44(3):667-672
[19] 卢 恒,谢芝勋,谢丽基,等.禽呼肠孤病毒σA基因酵母双杂交诱饵载体的构建及鉴定[J].中国畜牧兽医, 2017, 44(3): 847-853
[20] 程冰花,路云建,刁有祥,等.鸭胚成纤维细胞酵母双杂交cDNA文库的构建及鉴定[J].中国兽医学报, 2016,36(9):1507-1510
[21] 黄欣媛,范红波.酵母双杂交及其衍生系统[J].生物技术通报,2014,(1):75-82
[22] 王 婷,葛怀娜,郭 宏.酵母双杂交技术的应用进展[J].生物技术进展,2015,5(5):392-396
[23] 刘 潇.基于膜上的酵母双杂交系统及其在药物开发中的应用[J].生命科学研究, 2006,10(4):20-24
[24] 郑美云,李妙君,沈国婴,等.用酵母双杂交系统筛选抗人P53单链抗体[J].细胞与分子免疫学杂志, 2016,32(1):112-117
[25] 张 丹,翟永贞,冯国和.丙型肝炎病毒核心蛋白酵母双杂交诱饵载体的构建及鉴定研究[J].临床和实验医学杂志,2014,13(16):1329-1331
[26] 于洪敏,金 新,张欢欢,等.酵母双杂交筛选与人巨细胞病毒US28相互作用的蛋白[J].中国热带医学,2016,16(1):6-9
[27] 陈泽良,高 婷,张部昌,等.应用酵母双杂交技术筛选与埃博拉病毒VP24、VP35、VP40蛋白相互作用的宿主蛋白[J].生物技术通讯,2016,27(3):308-313
[28] 董 亮,张守发,许天应,等.瑟氏泰勒虫感染的牛外周血单个核细胞酵母双杂交cDNA文库构建及鉴定[J].畜牧与兽医,2014,47(9):65-68
[29] Suter B,Kittanakom S,Stagljar I.Two-hybrid technologies in proteomics research[J].Current Opinon Biotechnology,2008,19(4):316-323
(2017-09-16 收稿)(库雪飞 编辑)
Constructionofα-4giardindecoyproteinparticles
LIUShaowei,WANGYang,TIANXifeng
(PathogenicBiology,CollegeofElementaryMedicine,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
ObjectiveConstruction ofα-4 giardin decoy protein particles.In order to study the function of giardin.MethodsThe α-4 giardin encoding sequence was obtained by double enzyme digestion from the α-4 giardin cloning vector pGM-T-α-4. Under the action of DNA ligase, the α-4 giardin coding sequence was combined with the yeast expression plasmid pGBKT7. The recombinant plasmid transformed the competent cells of escherichia coli by heat shock. Coli was cultured and screened.Finally,the plasmid was extracted by alkaline lysis and identified by enzyme digestion.The pGBKT7-α-4 decoy vector was obtained.In addition, the self activation capability of bait vector was verified,and the expression of bait protein was identified by wstern blot.ResultsThe pGBKT7-alpha-4 decoy vector was obtained by restriction enzyme digestion and sequencing.Transformants Y187 yeast cells could grow on SD/-Trp plates, but not on SD/-Trp/-His and SD/-Trp/-Ade plates. Therefore, there was no self activation of pGBKT7-α-4 plasmid.Western blot identification showed that the expression ofα-4 fusion C-Myc protein could be detected at the level of 52KD in pGBKT7-α-4 transformed yeast.ConclusionSuccessful construction of α-4 giardin decoy protein particles.The bait protein granules show no self activation and are well expressed in yeast strains.It lays a foundation for the study of giardin function.
α-4 giardin.Construction of bait protein particles.Yeast two hybrid
R 37
A
2095-2694(2017)06-421-05
国家自然科学基金(编号:31471954)。
刘绍伟(1987- ),男,硕士研究生。研究方向:蓝氏贾第鞭毛虫α-4贾第素功能研究。
田喜凤。
