托珠单抗治疗全身型幼年特发性关节炎的疗效分析
2017-12-04郑雯洁叶晓华陈敏广杨康康林瑞霞庄捷秋杨青
郑雯洁 叶晓华 陈敏广 杨康康 林瑞霞 庄捷秋 杨青
●论 著
托珠单抗治疗全身型幼年特发性关节炎的疗效分析
郑雯洁 叶晓华 陈敏广 杨康康 林瑞霞 庄捷秋 杨青
目的 评价托珠单抗治疗全身型幼年特发性关节炎(SoJIA)的有效性与安全性。方法 选择难治性或有巨噬细胞活化综合征特征的SoJIA 7例,2016年1月1日之前收住的4例患儿均予每4周静脉滴注1次托珠单抗;2016年1月1日之后收住的3例患儿均予每2周静脉滴注1次托珠单抗,持续6次后若疾病维持非活动状态,减量为每4周静脉滴注1次托珠单抗。观察治疗前、治疗后4、8周的肿胀关节数、压痛关节数、活动受限关节数、ESR、C反应蛋白(CRP)、铁蛋白、Hb、激素使用剂量等指标,记录随访期间所有不良事件。结果 治疗后8周肿胀关节数、压痛关节数、活动受限关节数均较治疗前明显减少,ESR、CRP均较治疗前明显下降,Hb较治疗前上升,差异均有统计学意义(均P<0.05)。治疗后12周平均激素剂量减少57.94%。7例患儿共输注101次托珠单抗,发生可能与药物相关的不良事件8次,发生率为7.9%。7例累积托珠单抗使用时间为6.76年,共出现27次感染,年发生率为3.99次/年,均为轻度或中度感染,最常见为上呼吸道感染。7例患者中,5例处于疾病非活动状态,完全缓解6个月以上4例。结论 托珠单抗联合抗风湿药物治疗SoJIA临床起效快,持续缓解率高,安全性良好。
全身型幼年特发性关节炎 托珠单抗 疗效
全身型幼年特发性关节炎(systemic onset juvenile idiopathic arthritis,SoJIA)是儿童时期严重的全身炎症性疾病。约20%~50%的SoJIA可能出现关节畸形、破坏,是JIA中致残、致死的主要亚型[1]。临床上多采用糖皮质激素、非甾体类抗炎药和甲氨喋呤等联合治疗。糖皮质激素能迅速减轻临床症状,但长期应用所产生的不良反应危害很大,尤其是对难治性及反复发作的患儿。IL-6是一种重要的促炎性细胞因子,在SoJIA患儿的血液中高表达,在免疫系统活化、关节和软骨破坏及全身症状中发挥重要作用。托珠单抗为重组人源化抗IL-6受体单克隆抗体,特异性地与可溶性及膜性IL-6受体结合阻断信号传导,从而抑制IL-6活性。由于该药2013年才在我国上市,国内鲜有儿童使用的报道[2],本研究旨在评价托珠单抗在SoJIA患儿中的疗效与安全性,现报道如下。
1 对象和方法
1.1 对象 选择2014年3月至2016年10月在本院住院的难治性或有巨噬细胞活化综合征(MAS)特征的SoJIA患儿7例,其中男5例,女2例;年龄4.35~10.25(7.87±2.56)岁;病程 0.50~89.47(40.40±30.56)个月。2016年1月1日之前收住3例,之后收住4例。难治性6例,MAS特征1例。治疗前存在发热5例,皮疹6例,关节痛7例,ESR、C反应蛋白(CRP)升高7例,WBC升高6例,Hb下降5例。激素使用剂量(泼尼松或等同泼尼松剂量)≥1mg/(kg·d)的4例,0.5~<1mg/(kg·d)的1例,<0.5mg/(kg·d)的2例(包括1例去激素化治疗)。入组前使用环孢素2例,使用TNF-α拮抗剂(依那西普)4例,使用来氟米特1例,使用环磷酰胺1例。所有患儿诊断均符合2001年欧洲抗风湿病联盟修订的SoJIA分类标准[3]。难治性标准定义为病程≥6个月,对非甾体类抗炎药和激素疗效不佳或激素依赖[4]。MAS特征参照2013年美国风湿病学会建议标准[5]。排除标准:活动性感染包括活动性结核、肝炎病毒感染活动期、细菌感染等。
1.2 方法 2016年1月1日之前收住患儿均予每4周静脉滴注1次托珠单抗(瑞士罗氏制药,80mg/4ml)(<30kg:10~12mg/kg,≥30kg:8mg/kg);2016 年 1 月 1 日之后收住患儿均予每2周静脉滴注1次托珠单抗,持续6次后若疾病维持非活动状态(依据标准参照文献[6]),减量为每4周静脉滴注1次托珠单抗。治疗期间,若ALT或AST升高>正常上限的3倍,托珠单抗减少原剂量的一半;若连续2次ALT或AST升高>3倍或单次升高>5倍正常上限,则停用托珠单抗。允许口服糖皮质激素、非甾体类抗炎药和甲氨喋呤。使用托珠单抗前均停用其他抗风湿药物和生物制剂2周以上。
1.3 观察指标 治疗前、治疗后4、8周的肿胀关节数、压痛关节数、活动受限关节数、ESR、CRP、铁蛋白、Hb、激素使用剂量等指标,随访期间继续记录上述指标。
1.4 安全性评价 随访时间125~1 082d,记录随访期间所有不良事件,记录给药后出现的任何不适症状及异常实验室检查结果。
1.5 统计学处理 采用SPSS 21.0统计软件。计量资料以表示,治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 托珠单抗治疗SoJIA的近期疗效评价 使用托珠单抗治疗后2周,所有发热患儿体温均降至正常;6例有皮疹患儿,2周内消退5例,4周内消退1例。CRP降至正常时间为 1~30(11.43±9.36)d,ESR 降至正常时间为7~84(23.00±27.92)d,Hb 恢复正常的时间为 28~112(56.00±34.29)d。托珠单抗治疗后8周Hb平均升高14.14g/L,且基线时Hb<参考值下限的5例患儿,在第8周时平均Hb增加值为17.20g/L;而基线时Hb≥参考值下限的2例患儿,在第8周时平均Hb增加值为12.00g/L。治疗后8周肿胀关节数、压痛关节数、活动受限关节数均较治疗前明显减少,Hb较治疗前上升,差异均有统计学意义(均P<0.05)。治疗8周后ESR、CRP均较治疗前明显下降,差异均有统计学意义(均P<0.01),其中5例降至正常水平。托珠单抗治疗8周后,铁蛋白水平与治疗前比较差异无统计学意义(P>0.05),见表1。使用托珠单抗治疗12周后,平均激素剂量减少57.94%。
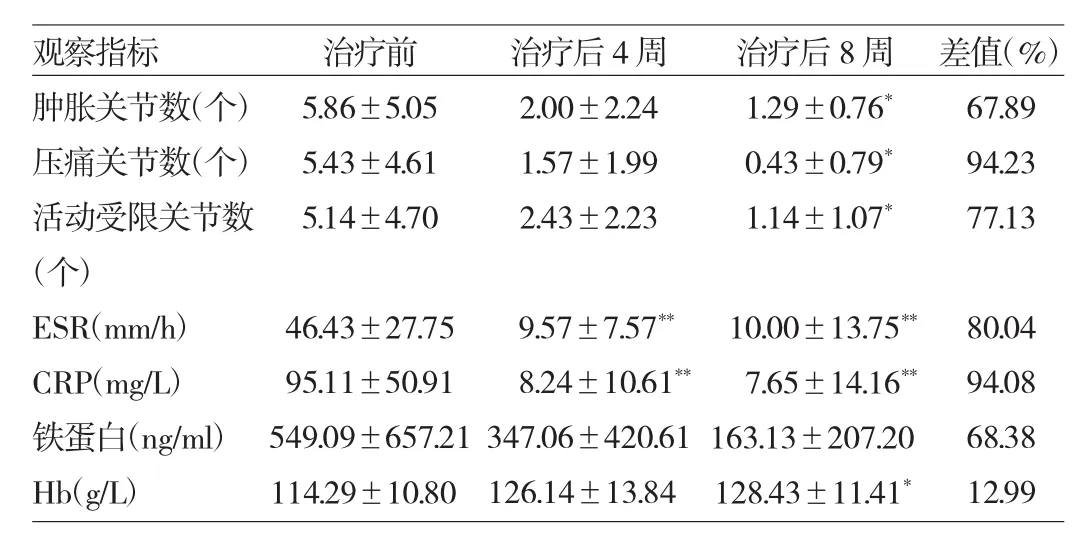
表1 托珠单抗治疗SoJIA的近期疗效评价
2.2 安全性评价 7例患儿共输注101次托珠单抗,发生可能与药物机制相关的不良事件8次,发生率为7.9%,分别是心律不齐1次,肌酸肌酶升高2次,肝酶升高3次,TC升高1次,TG升高1次。8次不良事件发生在4例患儿中,其中87.5%(7/8)发生在治疗后12周内,1例同时出现心律不齐和肌酸肌酶升高,1例同时出现肝酶升高和TC升高,1例先后出现肝酶升高和TG升高,1例先后出现肝酶升高和肌酸肌酶升高。本组肝酶升高表现为ALT和AST均升高,均在正常值高限3倍以下。本组所有不良事件予一般对症处理后很快恢复正常,再次输注时无同类不良反应出现。7例患儿累积托珠单抗使用时间为6.76年,共出现27次感染,年发生率为3.99次/年(27/6.76),均为轻度或中度感染,其中从高到低依次为:上呼吸道感染3.40次/年(23/6.76),胃肠炎 0.30 次/年(2/6.76),肺炎 0.15 次/年(1/6.76),腮腺炎0.15次/年(1/6.76)。无一例出现过敏反应、粒细胞减少、淋巴细胞减少、血小板减少、活动性结核和乙肝感染。
2.3 随访结果 托珠单抗使用时间为90~1 082(352.57±351.54)d,1例使用3个月病情未缓解停药;1例病情完全缓解持续10个月,激素减量至0.17mg/(kg·d)时复发停药;其余5例均处于疾病非活动状态。这5例中完全缓解6个月以上4例,其中1例为去激素化治疗;2例停用激素,分别在使用托珠单抗治疗后472和809d停用。4例曾经使用TNF-α抑制剂疗效欠佳,使用托珠单抗后处于完全缓解的有3例,有效率达到75.0%。
3 讨论
IL-6是一种促炎性细胞因子,可由单核-巨噬细胞、内皮细胞、间充质细胞如成纤维细胞及滑膜细胞等多种细胞产生。研究表明IL-6不仅与关节受损及骨质疏松有关,还可能是致SoJIA患儿发热、血小板增多、贫血及生长迟缓等的关键因素[7-8]。同时IL-6的基因多态性、启动子区域单核苷酸多态性与SoJIA发病相关[9]。而IL-6只有通过与其受体形成IL-6/IL-6R/gpl30六聚复合物才能进行信号传导,发挥生物学活性,因此调节IL-6受体水平来控制IL-6表达已成为一种治疗手段[7]。托珠单抗是一种免疫球蛋白G亚类的重组人源化抗人IL-6受体单克隆抗体,日本、欧盟、美国等多项研究显示托珠单抗在SoJIA的应用效果良好,很大程度上改善了SoJIA患儿的生存质量和预后[4,10-11]。
本研究结果显示使用托珠单抗联合甲氨喋呤治疗可明显改善SoJIA患儿的症状与体征。临床起效快,治疗后2周体温很快降至正常,5例皮疹完全消退,同时可有效控制关节炎,与Benedetti等[4]的一项多中心研究结果一致。同时高达70%以上患儿在治疗后8周内炎性指标降至正常,并持续处于平稳的低水平,激素得以顺利减量。其中4例曾经使用TNF-α抑制剂疗效欠佳,使用托珠单抗后有效率达到75.0%,与国外研究一致[10]。本组多为难治性病例,应用时间最长的2例先后停用激素,现分别处于疾病非活动状态达16和33个月之久。
研究表明贫血的纠正可以减轻全身炎症反应[12]。IL-6可刺激铁调素生成,铁调素通过影响消化道铁吸收、巨噬细胞释放铁从而影响体内铁含量,最终抑制Hb生成。因此,通过阻断IL-6受体信号转导可降低铁调素水平,从而增加Hb生成[12]。本研究显示托珠单抗治疗后SoJIA患儿的贫血减轻,其中基线时Hb<参考值下限的患儿Hb改善更明显,而基线时Hb≥参考值下限的患儿也出现了不同程度的升高,但未观察到Hb过度升高,未发现血栓形成。
药物安全性是使用生物制剂重点关注的问题。本研究患儿最高的不良事件为感染,平均3.99次/年,最常见的是上呼吸道感染,均为轻度或中度感染,与国外报道一致[4]。部分患儿出现ALT、AST升高,但很快降至正常,且大部分发生在治疗后12周内。血脂水平相对基线有所升高,但未发现随治疗时间延长而持续升高的趋势。赵岩等[13]报道接受托珠单抗治疗的类风湿关节炎患者血脂水平的平均绝对值升高,且这种升高与CRP水平的大幅下降同时出现,本研究因患儿例数较少,未作相关统计。Benedetti等[4]研究显示托珠单抗的输液反应发生率为6.9%,多为轻至中度的高血压、头痛及皮肤反应,导致停止治疗的严重输液反应发生率为0.3%。本研究暂未发现输液反应,赵岩等[13]报道输液反应率为1.5%,低于Benedetti等[4]报道,是否存在种族差异有待进一步扩大样本量及长期随访。
此外,关于托珠单抗的疗程和减停药问题目前尚无统一指南。俄罗斯近期报道了在低疾病活动度的SoJIA患儿中药物逐渐减量方案[14]。如何制定科学可行的减停药方案,以达到最佳的经济效益比,有待临床的进一步探索。
综上所述,托珠单抗联合抗风湿药物治疗SoJIA临床起效快,持续缓解率高,安全性良好。
[1] Manners P J,Bower C.Worldwide prevalence of juvenile arthritis:whydoes itvaryso much?[J].J Rheumatol,2002,29(7):1520-1530.
[2] 梁芳芳,彭程,罗书立,等.托珠单抗和肿瘤坏死因子α抑制剂及改善病情抗风湿药物治疗全身型幼年特发性关节炎的临床效果[J].中国医药,2016,11(9):1338-1342.doi:10.3760/cma.j.issn.1673-4777.2016.09.019.
[3] Petty R S,Southwood T R,Manners P,et al.International League of Associations for Rheumatology classification of juvenile idiopathic arthritis:second revision,Edmonton,2001[J].The Journal of Rheumatology,2004,31(2):390-392.
[4] Benedetti F D,Brunner H I,Ruperto N,et al.Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis[J].N Engl J Med,2012,367(25):2385-2395.doi:10.1056/NEJMoa1112802.
[5] Ringold S,Weiss P F,Beukelman T,et al.2013 update of the 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis:recommendations for the medical therapy of children with systemic juvenile idiopathic arthritis and tuberculosis screening among children receiving biologic medications[J].Arthritis Rheum,2013,65(10):2499-2512.doi:10.1002/art.38092.
[6] 中国全身型幼年特发性关节炎多中心研究协作组.中国557例全身型幼年特发性关节炎临床特征和预后分析的多中心研究[J].中华风湿病学杂志,2013,17(3):173-178.doi:10.3760/cma.j.issn.1007-7480.2013.03.008.
[7] Fonseca J E,Santos M J,Canhao H,et al.Interleukin-6 as a key player in systemic inflammation and joint destruction[J].Autoimmun Rev,2009,8(7):538-542.doi:10.1016/j.autrev.2009.01.012.
[8] 王颖,郭莉,卢美萍.全身型幼年特发性关节炎与川崎病炎症指标的比较[J].浙江医学,2016,38(9):630-632.
[9] Ogilvie E M,Fife M S,Thompson S D,et al.The-174G allele of the interleukin-6 gene confers susceptibility to systemic arthritis in children:a multicenter study using simplex and multiplex juvenile idiopathic arthritis families[J].Arthritis Rheum,2003,48(11):3202-3206.doi:10.1002/art.11300.
[10] Yokota S,Itoh Y,Morio T,et al.Tocilizumab in systemic juvenile idiopathic arthritis in a real-world clinical setting:results from 1year of postmarketing surveillance follow-up of 417 patients in Japan[J].Ann Rheum Dis,2016,75(9):1654-1660.doi:10.1136/annrheumdis-2015-207818.
[11] Yokota S,Imagawa T,Mori M,et al.Longterm safety and effectiveness of the anti-interleukin 6 receptor monoclonal antibody tocilizumab in patients with systemic juvenile idiopathic arthritis in Japan[J].J Rheumatol,2014,41(4):759-767.doi:10.3899/jrheum.130690.
[12] Andrews N C.Anemia of inflammation:the cytokine-hepcidin link[J].J Clin Invest,2004,113(9):1251-1253.doi:10.1172/JCI21441.
[13] 赵岩,史群,鲍春德,等.托珠单抗联合改善病情抗风湿药治疗类风湿关节炎的多中心、随机、双盲、安慰剂对照临床研究[J].中华内科杂志,2013,52(4):323-329.doi:10.3760/cma.j.issn.0578-1426.2013.04.015.
[14] Kostik M M,Dubko M F,Masalova V V,et al.Successful treatment with tocilizumab every 4 weeks of a low disease activity group who achieve a drug-free remission in patients with systemic-onset juvenile idiopathic arthritis[J].Pediatric Rheumatology 2015,13(4):1-9.doi:10.1186/1546-0096-13-4.eCollection 2015.
(本文由浙江省医学会风湿病学分会推荐)
Efficacy and safety of tocilizumab in treatment of systemic juvenile idiopathic arthritis
ZHENG Wenjie,YE Xiaohua,CHEN Minguang,et al.
Department of Pediatric Rheumatology,the Second Affiliated Hospital and Yuying Children's Hospital, Wenzhou Medical University,Wenzhou 325027,China
Objective To assess the efficacy and safety of tocilizumab(TCZ)in treatment of systemic juvenile idiopathic arthritis(SoJIA). Methods Seven patients with refractory SoJIA or with SoJIA of macrophage activation syndrome(MAS)were enrolled.TCZ was initiated intravenously every 4 weeks in 4 patients who were admitted before January 2016,and every 2 weeks in 3 patients who were admitted after January 2016.If patients maintained inactive disease after 6 injections,the TCZ were administrated every 4 weeks.The number of swollen joints,tender joints,joints with limited range of motion were documented,and the levels of ESR,C-reactive protein(CRP),ferritin,hemoglobin were measured before treatment,4 and 8 weeks after treatment.The adverse events were recorded during follow-up period. Results At 8 weeks after treatment the number of swollen joints,tender joints,joints with limited range of motion were significantly reduced,the levels of ESR,CRP were significantly decreased and the level of hemoglobin was significantly increased(all P<0.05).At 12 weeks after treatment the mean dose of glucocorticoid decreased by 57.94%.There were 8 adverse events probably associated with TCZ among 101 injections with an incidence rate of 7.9%.Cumulative usage time of TCZ in 7 patients was 6.76 years,and 27 infections occurred,most of which were mild to moderate,and upper respiratory infection was the most common one.Among 7 patients,5 cases achieved inactive condition and 4 cases achieved disease remission. Conclusion Tocilizumab combined with DMARDs is safe and effective in treatment of children with SoJIA.
Systemic onset juvenile idiopathic arthritis Tocilizumab Effect
10.12056/j.issn.1006-2785.2017.39.21.2017-1594
325027 温州医科大学附属第二医院、育英儿童医院儿童风湿科
郑雯洁,E-mail:wzwjzheng@sina.com
2017-07-07)
陈丽)
